2024-2025学年高二化学苏教版(2019)上学期期末教学质量模拟检测(三)(含解析)
文档属性
| 名称 | 2024-2025学年高二化学苏教版(2019)上学期期末教学质量模拟检测(三)(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-15 18:55:11 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024-2025学年高二化学苏教版(2019)上学期期末教学质量模拟检测(三)(含解析)
注意事项:
1.答题前,考生先将自己的姓名准考证号码填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、异皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.研究发现,在牙膏中添加氟化物能起到预防龋齿的作用,这是因为能与牙齿表面的釉质层(主要成分是羟基磷灰石发生反应生成氟磷灰石:。下列说法错误的是( )
A.食物在口腔中分解产生的有机酸会破坏的溶解平衡
B.高氟地区人群以及6岁以下的儿童不宜使用含氟牙膏
C.相比羟基磷灰石,氟磷灰石能够抵抗有机酸对牙齿的侵蚀
D.常温下,氟磷灰石的比羟基磷灰石的大
2.已知:25℃时,。下列说法正确的是( )
A.将溶液稀释后,溶液中各粒子浓度减小
B.冰醋酸中逐滴加水,醋酸的电离程度先增大后减小
C.向溶液中加入一定量的盐酸,的电离常数减小
D.向溶液中加入少量的粉末,增大
3.25℃时,水的电离达到平衡,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,减小,减小
B.向水中加入少量气体平衡逆向移动,减小,减小
C.将水加热,增大,变大
D.向水中分别通入适量气体或加入一小块Na,都能促进水的电离
4.室温下,溶液滴定20.00 mL 溶液时,、各含磷元素微粒的和pH的关系如图。下列说法中正确的是( )
A.①为的与pH的关系
B.b点时,溶液中
C.的
D.d点时,溶液中存在着
5.如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为
B.P点时恰好完全中和,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
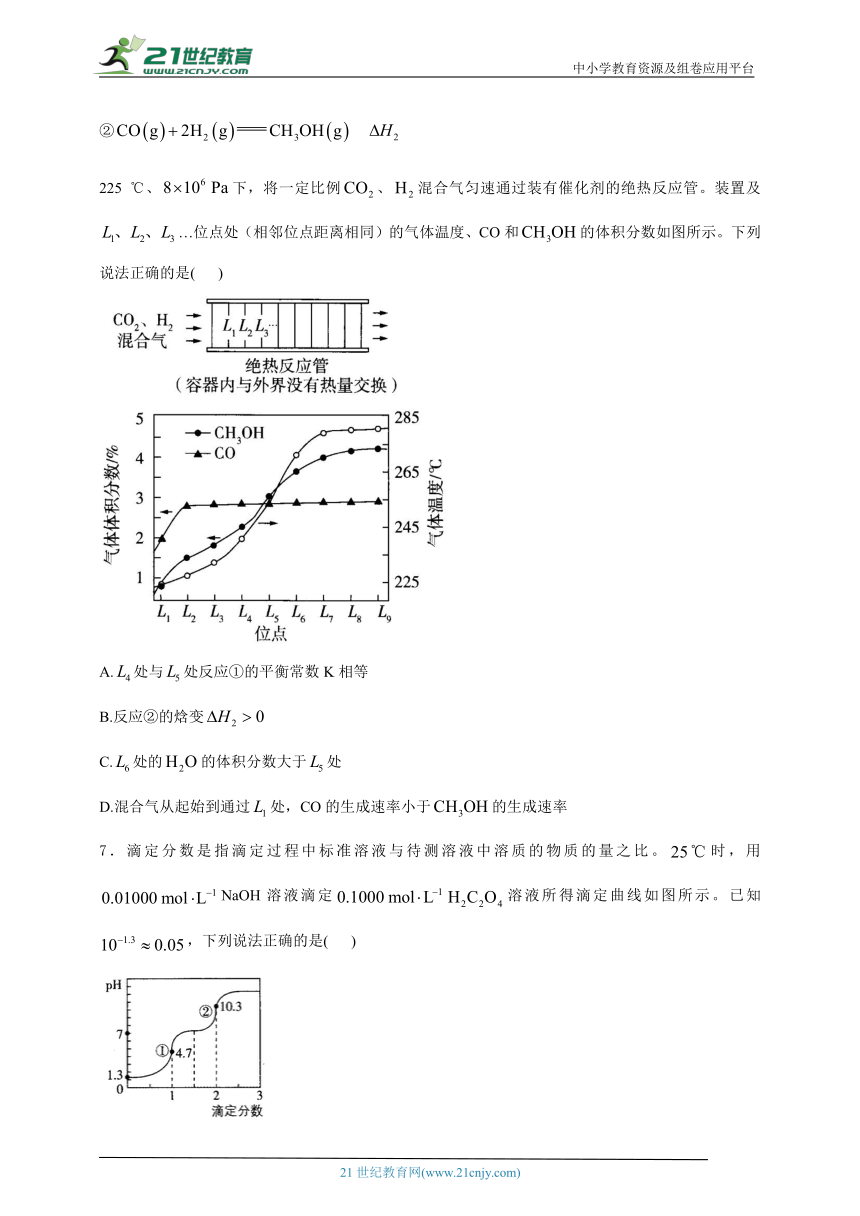
6.二氧化碳加氢制甲醇的过程中的主要反应(忽略其他副反应)为:
①
②
225 ℃、下,将一定比例、混合气匀速通过装有催化剂的绝热反应管。装置及…位点处(相邻位点距离相同)的气体温度、CO和的体积分数如图所示。下列说法正确的是( )
A.处与处反应①的平衡常数K相等
B.反应②的焓变
C.处的的体积分数大于处
D.混合气从起始到通过处,CO的生成速率小于的生成速率
7.滴定分数是指滴定过程中标准溶液与待测溶液中溶质的物质的量之比。时,用NaOH溶液滴定溶液所得滴定曲线如图所示。已知,下列说法正确的是( )
A.从①点到②点水的电离程度逐渐增大
B.②点所示溶液中:
C.①点所示溶液中:
D.时的电离常数:
8.常温下,下列溶液呈中性的是( )
A.稀盐酸 B.硫酸钠溶液 C.澄清石灰水 D.氢氧化钾溶液
9.物质a和物质b在图甲装置中发生反应,一段时间后,U形管内红墨水的液面高度如图乙所示,则物质a和物质b可能是( )
选项 物质a 物质b
A 水 生石灰
B 稀盐酸 固体
C 稀硫酸 锌粉
D 稀盐酸 小苏打
A.A B.B C.C D.D
10.在时,对10.0 mL浓度均为盐酸和醋酸的混合溶液进行如下操作。下列说法正确的是( )
A.加入少量固体,溶液中将减小
B.加入10.0 mL相同浓度的NaOH溶液,所得溶液
C.加入15.0 mL NaOH溶液,若所得溶液,则水电离的
D.加入20.0 mL相同浓度的NaOH溶液,若忽略混合时的体积变化,此时溶液中:
11.亚砷酸可用于治疗白血病,亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示。
下列说法中不正确的是( )
A.人体血液的pH约为7.35-7.45,血液中所含+3价砷元素的主要微粒是
B.向溶液中滴加KOH溶液至pH=11的过程中,主要反应的离子方程式为:
C.该温度下,的电离平衡常数约为
D.向溶液中滴加KOH溶液至pH=13时,溶液中存在关系:
12.已知A转化为C和D分步进行:①;②,其反应过程能量如图所示,下列说法正确的是( )
A.1mol的能量低于1mol的能量
B.
C.断裂1mol化学键吸收的热量小于形成1mol和3mol化学键所放出的热量
D.反应过程中,由于<,反应②速率大于反应①,气体B很难大量积累
13.常温下,往溶液中滴入溶液,溶液pH与滴入NaOH溶液体积的关系如图所示。下列说法正确的是( )
已知:。
A.a点溶液中,
B.b点溶液中,
C.c点溶液中,
D.a→c的滴定过程中,可能存在
14.工业废水中常含有氮、氯元素,可用电解原理对含有高浓度氯离子的工业废水中的氮进行脱除。用和NaCl分别模拟工业废水中的氮和氯,电化学处理装置如图1所示;电解过程中,模拟工业废水中的浓度随时间变化的曲线如图2所示。
下列说法错误的是( )
A.该方法能脱除,无法脱除
B.a电极接电源的正极,b电极接电源的负极
C.b电极的反应式为
D.电解过程中,a电极附近溶液pH降低
二、非选择题:本题共4小题,共58分。
15.可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以形式存在,还含有等物质。以独居石为原料制备的工艺流程如图:
回答下列问题:
(1)“焙烧”时产生的酸性废气中含有的酸为________________ (写化学式)。
(2)滤渣Ⅲ的主要成分是,已知,一般认为杂质离子浓度小于mol/L时可认为已经除干净,加MgO调pH时,pH应大于______;此时溶液中______;加入絮凝剂的目的是____________。
(3)“沉铈”过程中,生成的离子方程式为____________。
(4)滤渣Ⅱ的主要成分是,在高温条件下,、葡萄糖()和可制备电极材料,同时生成CO和,该反应的化学方程式为____________。
16.科学家研究发现热裂解时主要发生如下反应:
反应ⅰ:
反应ⅱ:
反应ⅲ:
反应ⅳ:
回答下列问题:
(1)反应________。
(2)在密闭刚性容器中投料,若只发生反应,平衡总压强为,温度对平衡体系中乙烯、丙烯和丁烯物质的量分数的影响如图甲所示。
①随温度升高,物质的量分数先增大后减小的原因是__________。
②转化率________(填“>”“<”或“=”);715K时,反应ⅰ平衡常数________MPa(列计算式)。
(3)反应ⅳ的相关信息如表:
H—H键能 I—I键能 H—I键能 正反应活化能
①________,反应ⅳ逆反应的活化能=________。
②研究反应ⅳ发现:,,其中为常数。在某温度下,向刚性密闭容器中充入一定量的,碘化氢的物质的量分数与反应时间t的关系如图乙所示。
,反应的平均速率______(用单位时间内物质的量分数的变化表示)。该温度下,反应ⅳ的______(列计算式)。
17.I.如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。
(1)“O”点为什么不导电_____。
(2)a、b、c三点的氢离子浓度由小到大的顺序为_____。
(3)a、b、c三点中,醋酸的电离程度最大的一点是_____。
(4)若使c点溶液中的提高,在如下措施中,可选择_____。
A.加热 B.加水 C.加粒 D.加少量浓盐酸
II.已知25℃时,某些酸的电离平衡常数如下:
化学式
电离平衡常数 1.8×10-5 4.3×10-7 4.9×10-10
电离平衡常数 —— 5.6×10-11 ——
(5)完成的电离方程式为_____。
(6)向溶液中加入适量晶体以后,溶液中的_____(填“增大”“减小”或“不变”)
(7)在相同条件下,有物质的量浓度相同、体积相等的溶液、溶液和溶液。
①溶液中,氢离子浓度最大的是_____(用化学式表示)。
②同时加入足量的锌,则开始反应时,_____速率最慢(用化学式表示)。
(8)则以下反应不能发生的是_____。
A.
B.
C.
D.
18.和催化重整制合成气(、)有利于实现碳中和,涉及反应如下:
Ⅰ:
Ⅱ:
Ⅲ:
Ⅳ:
回答下列问题:
(1)已知、的燃烧热分别为,,则=__________,__________0(填“>”“<”或“=”)。
(2)将一定体积和投入密闭容器中,反应Ⅰ在不同条件下达到平衡(反应Ⅱ、Ⅲ、Ⅳ可忽略)。设体系中甲烷的物质的量分数为,在T=610℃下的、在下的如图甲所示。图中对应等温过程的曲线是________,处于相同化学平衡状态的点是________。
(3)在恒压p=100kPa、初始投料的条件下,、发生上述反应达平衡时气体物质的量随温度的变化如图乙所示。
①曲线a表示的物质是________(填化学式),625℃时积碳物质的量为________kmol,反应Ⅲ的压强平衡常数=________。
②下列说法正确的是________。
A.平衡后,移除部分积碳,Ⅲ和Ⅳ均向右移
B.保持其他条件不变,升温积碳量逐渐减小
C.温度一定时,增大投料比,有利于减少积碳
D.温度一定时,增大投料比,则将增大
参考答案
1.答案:D
解析:A.食物在口腔中分解产生的有机酸电离出与电离的发生反应,破坏电离的平衡,故A正确;
B.6岁以下的儿童吞咽功能不全,洗漱时牙缝易残留较多含氟牙膏,高氟地区的人群不宜使用含氟牙膏,容易产生氟斑牙,故B正确;
C.相比羟基磷灰石,的溶解度更小,质地更坚固,能有效抵抗有机酸对牙齿的侵蚀,更能防龋齿,故C正确;
D.牙齿表面釉质层的主要成分是,可将其自发转化为,从而保护牙齿,说明溶解度更小,性质更稳定,则,故D错误;
故选:D。
2.答案:D
解析:
3.答案:C
解析:A.向水中加入稀氨水,氨水是弱碱,会抑制水的电离,使平衡逆向移动,增大,减小,故A错误;
B.向水中加入少量气体,会抑制水的电离,平衡逆向移动,增大,减小,故B错误;
C.水的电离是吸热的,将水加热,水的电离平衡正向移动,增大,变大,故C正确;
D.通入适量气体,与反应生成,会抑制水的电离;加入一小块Na与水电离出的氢离子反应生成氢气,促进了水的电离,故D错误。
答案选C。
4.答案:B
解析:随着NaOH溶液的不断滴入,逐渐减小、逐渐增大,和都是先增大后减小,且pH较小时,所以①②③④分别表示的与pH的关系,A错误;由要点图解可知b点溶液的5.00,溶质是,所以的电离程度大于水解程度,则,B正确;a点时,溶液中,同理,c点时,,,C错误;由d点时溶液呈碱性可知,而溶液中存在电荷守恒:,所以,D错误。
5.答案:B
解析:当盐酸的物质的量浓度为时,pH应该等于0,A项错误;
由图可知,盐酸与氢氧化钠溶液的浓度相等,都是,P点时盐酸与氢氧化钠溶液的体积相等,恰好完全中和,溶液呈中性,B项正确;
曲线a对应的溶液起点的pH等于1,故曲线a是氢氧化钠溶液滴定盐酸的滴定曲线,C项错误;
强酸和强碱的中和滴定,达到终点时溶液为中性,指示剂选择酚酞或甲基橙都可以,D项错误。
6.答案:C
解析:图中白圈标记的曲线代表气体温度,处与处对应的温度不同,平衡常数只与温度有关,故处与处的平衡常数不同,A错误;
由图可知,随着气体在绝热反应管中前进,气体温度不断升高,说明有热量放出,而反应①,故反应②,B错误;
从到,甲醇的体积分数逐渐增加,说明反应②在向右进行,反应②消耗CO,而CO体积分数没有明显变化,说明反应①也在向右进行,反应①为气体分子数不变的反应,其向右进行时,增大,反应②为气体分子数减小的反应,且没有的消耗与生成,故减小而增加,即的体积分数会增大,故处的的体积分数大于处,C正确;
处,CO的体积分数大于,说明生成的CO的物质的量大于,两者反应时间相同,说明CO的生成速率大于的生成速率,D错误。
7.答案:A
解析:由图可知,是二元弱酸,①点→②点发生的反应为,抑制水的电离,促进水的电离,故从①点到②点,水的电离程度逐渐增大,A正确;②点处溶质为,根据电荷守恒可知:,B错误;①点为第一个滴定终点,溶质为,此时溶液显酸性,说明电离程度大于其水解程度,则,故浓度大小顺序为,C错误;的电离常数,根据起始时pH为1.3,则,D错误。
8.答案:B
解析:溶液的酸碱性是根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断的;当溶液中氢离子浓度大于氢氧根离子浓度时,溶液呈酸性;当氢离子浓度和氢氧根离子浓度相等时,溶液呈中性;当溶液中氢氧根离子浓度大于氢离子浓度时,溶液呈碱性,据此判断。
A.稀盐酸溶液中氢离子浓度大于氢氧根离子浓度,溶液呈酸性,故A错误;
B.硫酸钠溶液中,硫酸根离子水解,溶液呈中性,故B正确;
C.澄清石灰水溶液中氢氧根离子浓度大于氢离子浓度,溶液呈碱性,故C错误;
D.氢氧化钾溶液中氢氧根离子浓度大于氢离子浓度,溶液呈碱性,故D错误;
故选B
9.答案:D
解析:A.生石灰和水反应生成氢氧化钙,属于放热反应,故A不选;
B.稀盐酸和氢氧化钠的反应生成氯化钠和水,属于放热反应,故B不选;
C.锌粉与稀硫酸的反应生成氢气和硫酸锌,属于放热反应,故C不选;
D.稀盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,属于吸热反应,故D选;
故选D。
10.答案:C
解析:向盐酸和醋酸的混合溶液中加入少量固体,则变大,醋酸的电离平衡逆向移动,减小,不变,故增大,A错误;加入10.0 mL相同浓度的NaOH溶液,溶液中的溶质为氯化钠和醋酸,溶液显酸性,所得溶液,B错误;加入15.0 mL NaOH溶液,若所得溶液,说明溶液显酸性,即酸有剩余,酸对水的电离有抑制作用,故水电离的,C正确;加入20.0 mL相同浓度的NaOH溶液,根据物料守恒得,D错误。
11.答案:D
解析:A.据图可知当pH在7.35-7.45之间时,As元素主要存在形式为,故A正确;
B.向溶液中滴加KOH溶液至pH=11的过程中,As元素主要存在形式为、,反应的离子方程式为:,故B正确;
C.由图中数据可知,pH=9.2时,,故的电离常数,的电离平衡常数约为,故C正确;
D.由电荷守恒可知,,故D错误;
故选D。
12.答案:D
解析:A.从图中可知1molA(g)的能量低于1molB(g)和2molD(g)的总能量,不能比较1molA(g)的能量和1molB(g)的能量大小,A错误;
B.从图中反应前后能量变化可知,反应物总能量低于生成物总能量,为吸热反应,,故,B错误;
C.从图中可知,A转化为C和D为吸热反应,断裂1molA(g)化学键吸收的热量应大于形成1molC(g)和3molD(g)化学键所放出的热量,C错误;
D.从反应过程的图像中可知,<,活化能越低,反应速率越快,故反应②速率大于反应①,气体B很难大量积累,D正确。
故选D。
13.答案:C
解析:A.a点溶液是,则有元素质量守恒:和电荷守恒,则,故A错误;
B.b点溶液是中,存在和,则有,故B错误;
C.c点溶液是,存在电荷守恒,则有,从而得,故C正确;
D.a→c的滴定过程中,一直存在电荷守恒,不可能存在,故D错误;
故选C。
14.答案:A
解析:图2曲线显示0~30 min内浓度增长极为缓慢,可推测这段时间内阳极生成的将氧化,消耗了,可知大部分在0~30 min内被脱除,A错误;a电极上,Cl元素化合价升高,a电极为阳极,则b电极为阴极,a电极接电源的正极,b电极接电源的负极,B正确;b电极为阴极,得到电子,发生还原反应,C正确;a电极为阳极,阳极反应为,电解过程中消耗,a电极附近溶液pH降低,D正确。
15.答案:(1)HF
(2) 4.7;4.5;为了促进胶体聚沉,便于分离
(3)
(4)
解析:
(1)根据以上分析可知“焙烧”时产生的酸性废气中含有的酸为HF;
(2)氢氧化铁的溶度积常数大于氢氧化铝的,当氢氧化铝沉淀完全时铁离子已经完全沉淀,则此时溶液中氢氧根浓度是,氢离子浓度是mol/L,所以pH应大于4.7;此时溶液中mol/L =104.5mol/L;为了促进胶体聚沉,便于分离,需要加入絮凝剂;
(3)用碳酸氢铵“沉铈”,则结合原子守恒、电荷守恒可知生成的离子方程式为;
(4)由在高温条件下,、葡萄糖()和可制备电极,同时生成CO和可知,该反应中Fe价态降低,C价态升高,结合得失电子守恒、原子守恒可知该反应的化学方程式为。
16.答案:(1)+66.3(或66.3)
(2)①反应为吸热反应,温度升高,反应1平衡向正向移动,乙烯浓度增大,使得反应ⅱ平正向移动;反应ⅱ为放热反应,温度升高,反应ⅱ平衡向逆向移动;低于800K,乙烯浓度对反应ⅱ的影响占主导,高于800 K,温度对反应ⅱ的影响占主导。因此,丙烯的物质的量分数先增大后减小
②<;(或)
(4)①299;162.1
②0.00375;
解析:由可得,结合盖斯定律可得。
(2)②由于B处的温度高于A处的温度,反应ⅰ是吸热反应,温度越高,反应物的平衡转化率就越高,所以;由题图可知,715 K,平衡时,设平衡时,则,,则由I原子守恒可知,由C元素守恒可知①1mol,的物质的量分数为,可得②,由①②联立得,平衡时,的平衡分压为,的平衡分压为,则。
(3)①,解得;反应ⅳ逆反应的活化能。
②由题图乙可知,40min时,HI的物质的量分数是,说明HI发生转化的物质的量分数为,则;,,由题图乙可知,100 min后HI物质的量分数不再改变,反应达到平衡状态,平衡时,该温度下平衡时,反应ⅳ的,后HI的物质的量分数为,和的物质的量分数为,则。
17.答案:(1)因为冰醋酸未电离,无离子
(2)c(3)c
(4)AC
(5)
(6)减小
(7);
(8)B
解析:冰醋酸为纯醋酸,醋酸未电离,无离子,故O点不导电,随着水的加入,醋酸电离,溶液中离子浓度先增大,溶液导电性增强,b点时离子浓度最大,溶液导电性最强,继续加水,离子浓度降低,溶液导电性减弱。
(1)根据分析,O点不导电:因为冰醋酸未电离,无离子;
(2)醋酸电离产生氢离子和醋酸根,溶液中离子浓度大时溶液导电能力强,导电性强弱c(3)溶液越稀,醋酸电离程度越大,故a、b、c三点中,醋酸的电离程度最大的一点是c;
(4)A.加热能促进醋酸电离,故增大,A正确;
B.加水促进醋酸电离,最终结果减小,B错误;
C.加Zn粒,消耗氢离子,促进醋酸电离,故增大,C正确;
D._加少量浓盐酸,氢离子浓度增大,抑制醋酸电离,减小,D错误;
故选AC;
(5)醋酸为弱酸,电离方程式为:;
(6)向溶液中加入适量晶体以后,醋酸根浓度增大,醋酸电离平衡逆向移动,溶液中的减小;
(7)弱酸的电离平衡常数越大,酸性越强,故酸性:。在相同条件下,有物质的量浓度相同、体积相等的溶液、溶液和溶液,氢离子浓度由大到小顺序为:溶液、溶液和溶液。
①溶液中,氢离子浓度最大的是;
②同时加入足量的锌,氢离子浓度小的反应速率满,故则开始反应时,速率最慢;
(8)A.酸性,故能发生,A不符合题意;
B.由表格可知酸性:,故不能发生,B符合题意;
C.由表格可知酸性:,故能发生,C不符合题意;
D.由表格可知酸性,能发生,D不符合题意;
故选B。
18.答案:(1)+41.2;>
(2);AC
(3);0.8;0.056;BC
解析:(1)已知、的燃烧热分别为,,①,②,③,由盖斯定律可知①-②+③得到反应II,则反应热=(-285.8kJ/mol)-(-283.0kJ/mol)+(+44kJ/mol)=+41.2kJ/mol,由盖斯定律可知,反应IV-反应III得到反应I,。
(2)反应|为气体体积增大的反应温度一定时,增大压强,平衡向逆反应方向移动,甲烷的物质的量分数增大,则等温下,甲烷的物质的量分数,随压强的变化曲线是,则为等压下甲烷的物质的量分数随温度的变化曲线,根据以上分析AC点处于相同的化学平衡状态。
(3)由(1)可知反应I、Ⅱ、Ⅳ都是吸热反应,升高温度,平衡正向移动,和CO的物质的量增大,由C和H元素守恒可知,的物质的量比CO大,则a表示的物质是,初始投料,625℃时,由C元素守恒可知积碳物质的量为2kmol-1mol-0.2mol=0.8mol,由H元素守恒可知==1.1mol,反应Ⅲ的压强平衡常数==0.056kPa 1;
A.积碳是固体,平衡后,移除部分积碳,不改变平衡状态,故A错误;
B.保持其他条件不变,升高温度,反应Ⅲ逆向移动,积碳量逐渐减小,故B正确;
C.温度一定时,增大投料比,相当于增大的物质的量,反应Ⅲ逆向移动,积碳量逐渐减小,故C正确;
D.温度一定时,增大投料比,相当于增大的物质的量或减少的物质的量,由反应Ⅲ的平衡常数和反应Ⅳ的平衡常数K=不变可知,将减小,将增大,则将减小,故D错误;
故选BC。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2024-2025学年高二化学苏教版(2019)上学期期末教学质量模拟检测(三)(含解析)
注意事项:
1.答题前,考生先将自己的姓名准考证号码填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、异皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项符合题目要求。
1.研究发现,在牙膏中添加氟化物能起到预防龋齿的作用,这是因为能与牙齿表面的釉质层(主要成分是羟基磷灰石发生反应生成氟磷灰石:。下列说法错误的是( )
A.食物在口腔中分解产生的有机酸会破坏的溶解平衡
B.高氟地区人群以及6岁以下的儿童不宜使用含氟牙膏
C.相比羟基磷灰石,氟磷灰石能够抵抗有机酸对牙齿的侵蚀
D.常温下,氟磷灰石的比羟基磷灰石的大
2.已知:25℃时,。下列说法正确的是( )
A.将溶液稀释后,溶液中各粒子浓度减小
B.冰醋酸中逐滴加水,醋酸的电离程度先增大后减小
C.向溶液中加入一定量的盐酸,的电离常数减小
D.向溶液中加入少量的粉末,增大
3.25℃时,水的电离达到平衡,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,减小,减小
B.向水中加入少量气体平衡逆向移动,减小,减小
C.将水加热,增大,变大
D.向水中分别通入适量气体或加入一小块Na,都能促进水的电离
4.室温下,溶液滴定20.00 mL 溶液时,、各含磷元素微粒的和pH的关系如图。下列说法中正确的是( )
A.①为的与pH的关系
B.b点时,溶液中
C.的
D.d点时,溶液中存在着
5.如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为
B.P点时恰好完全中和,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
6.二氧化碳加氢制甲醇的过程中的主要反应(忽略其他副反应)为:
①
②
225 ℃、下,将一定比例、混合气匀速通过装有催化剂的绝热反应管。装置及…位点处(相邻位点距离相同)的气体温度、CO和的体积分数如图所示。下列说法正确的是( )
A.处与处反应①的平衡常数K相等
B.反应②的焓变
C.处的的体积分数大于处
D.混合气从起始到通过处,CO的生成速率小于的生成速率
7.滴定分数是指滴定过程中标准溶液与待测溶液中溶质的物质的量之比。时,用NaOH溶液滴定溶液所得滴定曲线如图所示。已知,下列说法正确的是( )
A.从①点到②点水的电离程度逐渐增大
B.②点所示溶液中:
C.①点所示溶液中:
D.时的电离常数:
8.常温下,下列溶液呈中性的是( )
A.稀盐酸 B.硫酸钠溶液 C.澄清石灰水 D.氢氧化钾溶液
9.物质a和物质b在图甲装置中发生反应,一段时间后,U形管内红墨水的液面高度如图乙所示,则物质a和物质b可能是( )
选项 物质a 物质b
A 水 生石灰
B 稀盐酸 固体
C 稀硫酸 锌粉
D 稀盐酸 小苏打
A.A B.B C.C D.D
10.在时,对10.0 mL浓度均为盐酸和醋酸的混合溶液进行如下操作。下列说法正确的是( )
A.加入少量固体,溶液中将减小
B.加入10.0 mL相同浓度的NaOH溶液,所得溶液
C.加入15.0 mL NaOH溶液,若所得溶液,则水电离的
D.加入20.0 mL相同浓度的NaOH溶液,若忽略混合时的体积变化,此时溶液中:
11.亚砷酸可用于治疗白血病,亚砷酸在溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH的关系如图所示。
下列说法中不正确的是( )
A.人体血液的pH约为7.35-7.45,血液中所含+3价砷元素的主要微粒是
B.向溶液中滴加KOH溶液至pH=11的过程中,主要反应的离子方程式为:
C.该温度下,的电离平衡常数约为
D.向溶液中滴加KOH溶液至pH=13时,溶液中存在关系:
12.已知A转化为C和D分步进行:①;②,其反应过程能量如图所示,下列说法正确的是( )
A.1mol的能量低于1mol的能量
B.
C.断裂1mol化学键吸收的热量小于形成1mol和3mol化学键所放出的热量
D.反应过程中,由于<,反应②速率大于反应①,气体B很难大量积累
13.常温下,往溶液中滴入溶液,溶液pH与滴入NaOH溶液体积的关系如图所示。下列说法正确的是( )
已知:。
A.a点溶液中,
B.b点溶液中,
C.c点溶液中,
D.a→c的滴定过程中,可能存在
14.工业废水中常含有氮、氯元素,可用电解原理对含有高浓度氯离子的工业废水中的氮进行脱除。用和NaCl分别模拟工业废水中的氮和氯,电化学处理装置如图1所示;电解过程中,模拟工业废水中的浓度随时间变化的曲线如图2所示。
下列说法错误的是( )
A.该方法能脱除,无法脱除
B.a电极接电源的正极,b电极接电源的负极
C.b电极的反应式为
D.电解过程中,a电极附近溶液pH降低
二、非选择题:本题共4小题,共58分。
15.可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以形式存在,还含有等物质。以独居石为原料制备的工艺流程如图:
回答下列问题:
(1)“焙烧”时产生的酸性废气中含有的酸为________________ (写化学式)。
(2)滤渣Ⅲ的主要成分是,已知,一般认为杂质离子浓度小于mol/L时可认为已经除干净,加MgO调pH时,pH应大于______;此时溶液中______;加入絮凝剂的目的是____________。
(3)“沉铈”过程中,生成的离子方程式为____________。
(4)滤渣Ⅱ的主要成分是,在高温条件下,、葡萄糖()和可制备电极材料,同时生成CO和,该反应的化学方程式为____________。
16.科学家研究发现热裂解时主要发生如下反应:
反应ⅰ:
反应ⅱ:
反应ⅲ:
反应ⅳ:
回答下列问题:
(1)反应________。
(2)在密闭刚性容器中投料,若只发生反应,平衡总压强为,温度对平衡体系中乙烯、丙烯和丁烯物质的量分数的影响如图甲所示。
①随温度升高,物质的量分数先增大后减小的原因是__________。
②转化率________(填“>”“<”或“=”);715K时,反应ⅰ平衡常数________MPa(列计算式)。
(3)反应ⅳ的相关信息如表:
H—H键能 I—I键能 H—I键能 正反应活化能
①________,反应ⅳ逆反应的活化能=________。
②研究反应ⅳ发现:,,其中为常数。在某温度下,向刚性密闭容器中充入一定量的,碘化氢的物质的量分数与反应时间t的关系如图乙所示。
,反应的平均速率______(用单位时间内物质的量分数的变化表示)。该温度下,反应ⅳ的______(列计算式)。
17.I.如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。
(1)“O”点为什么不导电_____。
(2)a、b、c三点的氢离子浓度由小到大的顺序为_____。
(3)a、b、c三点中,醋酸的电离程度最大的一点是_____。
(4)若使c点溶液中的提高,在如下措施中,可选择_____。
A.加热 B.加水 C.加粒 D.加少量浓盐酸
II.已知25℃时,某些酸的电离平衡常数如下:
化学式
电离平衡常数 1.8×10-5 4.3×10-7 4.9×10-10
电离平衡常数 —— 5.6×10-11 ——
(5)完成的电离方程式为_____。
(6)向溶液中加入适量晶体以后,溶液中的_____(填“增大”“减小”或“不变”)
(7)在相同条件下,有物质的量浓度相同、体积相等的溶液、溶液和溶液。
①溶液中,氢离子浓度最大的是_____(用化学式表示)。
②同时加入足量的锌,则开始反应时,_____速率最慢(用化学式表示)。
(8)则以下反应不能发生的是_____。
A.
B.
C.
D.
18.和催化重整制合成气(、)有利于实现碳中和,涉及反应如下:
Ⅰ:
Ⅱ:
Ⅲ:
Ⅳ:
回答下列问题:
(1)已知、的燃烧热分别为,,则=__________,__________0(填“>”“<”或“=”)。
(2)将一定体积和投入密闭容器中,反应Ⅰ在不同条件下达到平衡(反应Ⅱ、Ⅲ、Ⅳ可忽略)。设体系中甲烷的物质的量分数为,在T=610℃下的、在下的如图甲所示。图中对应等温过程的曲线是________,处于相同化学平衡状态的点是________。
(3)在恒压p=100kPa、初始投料的条件下,、发生上述反应达平衡时气体物质的量随温度的变化如图乙所示。
①曲线a表示的物质是________(填化学式),625℃时积碳物质的量为________kmol,反应Ⅲ的压强平衡常数=________。
②下列说法正确的是________。
A.平衡后,移除部分积碳,Ⅲ和Ⅳ均向右移
B.保持其他条件不变,升温积碳量逐渐减小
C.温度一定时,增大投料比,有利于减少积碳
D.温度一定时,增大投料比,则将增大
参考答案
1.答案:D
解析:A.食物在口腔中分解产生的有机酸电离出与电离的发生反应,破坏电离的平衡,故A正确;
B.6岁以下的儿童吞咽功能不全,洗漱时牙缝易残留较多含氟牙膏,高氟地区的人群不宜使用含氟牙膏,容易产生氟斑牙,故B正确;
C.相比羟基磷灰石,的溶解度更小,质地更坚固,能有效抵抗有机酸对牙齿的侵蚀,更能防龋齿,故C正确;
D.牙齿表面釉质层的主要成分是,可将其自发转化为,从而保护牙齿,说明溶解度更小,性质更稳定,则,故D错误;
故选:D。
2.答案:D
解析:
3.答案:C
解析:A.向水中加入稀氨水,氨水是弱碱,会抑制水的电离,使平衡逆向移动,增大,减小,故A错误;
B.向水中加入少量气体,会抑制水的电离,平衡逆向移动,增大,减小,故B错误;
C.水的电离是吸热的,将水加热,水的电离平衡正向移动,增大,变大,故C正确;
D.通入适量气体,与反应生成,会抑制水的电离;加入一小块Na与水电离出的氢离子反应生成氢气,促进了水的电离,故D错误。
答案选C。
4.答案:B
解析:随着NaOH溶液的不断滴入,逐渐减小、逐渐增大,和都是先增大后减小,且pH较小时,所以①②③④分别表示的与pH的关系,A错误;由要点图解可知b点溶液的5.00,溶质是,所以的电离程度大于水解程度,则,B正确;a点时,溶液中,同理,c点时,,,C错误;由d点时溶液呈碱性可知,而溶液中存在电荷守恒:,所以,D错误。
5.答案:B
解析:当盐酸的物质的量浓度为时,pH应该等于0,A项错误;
由图可知,盐酸与氢氧化钠溶液的浓度相等,都是,P点时盐酸与氢氧化钠溶液的体积相等,恰好完全中和,溶液呈中性,B项正确;
曲线a对应的溶液起点的pH等于1,故曲线a是氢氧化钠溶液滴定盐酸的滴定曲线,C项错误;
强酸和强碱的中和滴定,达到终点时溶液为中性,指示剂选择酚酞或甲基橙都可以,D项错误。
6.答案:C
解析:图中白圈标记的曲线代表气体温度,处与处对应的温度不同,平衡常数只与温度有关,故处与处的平衡常数不同,A错误;
由图可知,随着气体在绝热反应管中前进,气体温度不断升高,说明有热量放出,而反应①,故反应②,B错误;
从到,甲醇的体积分数逐渐增加,说明反应②在向右进行,反应②消耗CO,而CO体积分数没有明显变化,说明反应①也在向右进行,反应①为气体分子数不变的反应,其向右进行时,增大,反应②为气体分子数减小的反应,且没有的消耗与生成,故减小而增加,即的体积分数会增大,故处的的体积分数大于处,C正确;
处,CO的体积分数大于,说明生成的CO的物质的量大于,两者反应时间相同,说明CO的生成速率大于的生成速率,D错误。
7.答案:A
解析:由图可知,是二元弱酸,①点→②点发生的反应为,抑制水的电离,促进水的电离,故从①点到②点,水的电离程度逐渐增大,A正确;②点处溶质为,根据电荷守恒可知:,B错误;①点为第一个滴定终点,溶质为,此时溶液显酸性,说明电离程度大于其水解程度,则,故浓度大小顺序为,C错误;的电离常数,根据起始时pH为1.3,则,D错误。
8.答案:B
解析:溶液的酸碱性是根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断的;当溶液中氢离子浓度大于氢氧根离子浓度时,溶液呈酸性;当氢离子浓度和氢氧根离子浓度相等时,溶液呈中性;当溶液中氢氧根离子浓度大于氢离子浓度时,溶液呈碱性,据此判断。
A.稀盐酸溶液中氢离子浓度大于氢氧根离子浓度,溶液呈酸性,故A错误;
B.硫酸钠溶液中,硫酸根离子水解,溶液呈中性,故B正确;
C.澄清石灰水溶液中氢氧根离子浓度大于氢离子浓度,溶液呈碱性,故C错误;
D.氢氧化钾溶液中氢氧根离子浓度大于氢离子浓度,溶液呈碱性,故D错误;
故选B
9.答案:D
解析:A.生石灰和水反应生成氢氧化钙,属于放热反应,故A不选;
B.稀盐酸和氢氧化钠的反应生成氯化钠和水,属于放热反应,故B不选;
C.锌粉与稀硫酸的反应生成氢气和硫酸锌,属于放热反应,故C不选;
D.稀盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,属于吸热反应,故D选;
故选D。
10.答案:C
解析:向盐酸和醋酸的混合溶液中加入少量固体,则变大,醋酸的电离平衡逆向移动,减小,不变,故增大,A错误;加入10.0 mL相同浓度的NaOH溶液,溶液中的溶质为氯化钠和醋酸,溶液显酸性,所得溶液,B错误;加入15.0 mL NaOH溶液,若所得溶液,说明溶液显酸性,即酸有剩余,酸对水的电离有抑制作用,故水电离的,C正确;加入20.0 mL相同浓度的NaOH溶液,根据物料守恒得,D错误。
11.答案:D
解析:A.据图可知当pH在7.35-7.45之间时,As元素主要存在形式为,故A正确;
B.向溶液中滴加KOH溶液至pH=11的过程中,As元素主要存在形式为、,反应的离子方程式为:,故B正确;
C.由图中数据可知,pH=9.2时,,故的电离常数,的电离平衡常数约为,故C正确;
D.由电荷守恒可知,,故D错误;
故选D。
12.答案:D
解析:A.从图中可知1molA(g)的能量低于1molB(g)和2molD(g)的总能量,不能比较1molA(g)的能量和1molB(g)的能量大小,A错误;
B.从图中反应前后能量变化可知,反应物总能量低于生成物总能量,为吸热反应,,故,B错误;
C.从图中可知,A转化为C和D为吸热反应,断裂1molA(g)化学键吸收的热量应大于形成1molC(g)和3molD(g)化学键所放出的热量,C错误;
D.从反应过程的图像中可知,<,活化能越低,反应速率越快,故反应②速率大于反应①,气体B很难大量积累,D正确。
故选D。
13.答案:C
解析:A.a点溶液是,则有元素质量守恒:和电荷守恒,则,故A错误;
B.b点溶液是中,存在和,则有,故B错误;
C.c点溶液是,存在电荷守恒,则有,从而得,故C正确;
D.a→c的滴定过程中,一直存在电荷守恒,不可能存在,故D错误;
故选C。
14.答案:A
解析:图2曲线显示0~30 min内浓度增长极为缓慢,可推测这段时间内阳极生成的将氧化,消耗了,可知大部分在0~30 min内被脱除,A错误;a电极上,Cl元素化合价升高,a电极为阳极,则b电极为阴极,a电极接电源的正极,b电极接电源的负极,B正确;b电极为阴极,得到电子,发生还原反应,C正确;a电极为阳极,阳极反应为,电解过程中消耗,a电极附近溶液pH降低,D正确。
15.答案:(1)HF
(2) 4.7;4.5;为了促进胶体聚沉,便于分离
(3)
(4)
解析:
(1)根据以上分析可知“焙烧”时产生的酸性废气中含有的酸为HF;
(2)氢氧化铁的溶度积常数大于氢氧化铝的,当氢氧化铝沉淀完全时铁离子已经完全沉淀,则此时溶液中氢氧根浓度是,氢离子浓度是mol/L,所以pH应大于4.7;此时溶液中mol/L =104.5mol/L;为了促进胶体聚沉,便于分离,需要加入絮凝剂;
(3)用碳酸氢铵“沉铈”,则结合原子守恒、电荷守恒可知生成的离子方程式为;
(4)由在高温条件下,、葡萄糖()和可制备电极,同时生成CO和可知,该反应中Fe价态降低,C价态升高,结合得失电子守恒、原子守恒可知该反应的化学方程式为。
16.答案:(1)+66.3(或66.3)
(2)①反应为吸热反应,温度升高,反应1平衡向正向移动,乙烯浓度增大,使得反应ⅱ平正向移动;反应ⅱ为放热反应,温度升高,反应ⅱ平衡向逆向移动;低于800K,乙烯浓度对反应ⅱ的影响占主导,高于800 K,温度对反应ⅱ的影响占主导。因此,丙烯的物质的量分数先增大后减小
②<;(或)
(4)①299;162.1
②0.00375;
解析:由可得,结合盖斯定律可得。
(2)②由于B处的温度高于A处的温度,反应ⅰ是吸热反应,温度越高,反应物的平衡转化率就越高,所以;由题图可知,715 K,平衡时,设平衡时,则,,则由I原子守恒可知,由C元素守恒可知①1mol,的物质的量分数为,可得②,由①②联立得,平衡时,的平衡分压为,的平衡分压为,则。
(3)①,解得;反应ⅳ逆反应的活化能。
②由题图乙可知,40min时,HI的物质的量分数是,说明HI发生转化的物质的量分数为,则;,,由题图乙可知,100 min后HI物质的量分数不再改变,反应达到平衡状态,平衡时,该温度下平衡时,反应ⅳ的,后HI的物质的量分数为,和的物质的量分数为,则。
17.答案:(1)因为冰醋酸未电离,无离子
(2)c
(4)AC
(5)
(6)减小
(7);
(8)B
解析:冰醋酸为纯醋酸,醋酸未电离,无离子,故O点不导电,随着水的加入,醋酸电离,溶液中离子浓度先增大,溶液导电性增强,b点时离子浓度最大,溶液导电性最强,继续加水,离子浓度降低,溶液导电性减弱。
(1)根据分析,O点不导电:因为冰醋酸未电离,无离子;
(2)醋酸电离产生氢离子和醋酸根,溶液中离子浓度大时溶液导电能力强,导电性强弱c
(4)A.加热能促进醋酸电离,故增大,A正确;
B.加水促进醋酸电离,最终结果减小,B错误;
C.加Zn粒,消耗氢离子,促进醋酸电离,故增大,C正确;
D._加少量浓盐酸,氢离子浓度增大,抑制醋酸电离,减小,D错误;
故选AC;
(5)醋酸为弱酸,电离方程式为:;
(6)向溶液中加入适量晶体以后,醋酸根浓度增大,醋酸电离平衡逆向移动,溶液中的减小;
(7)弱酸的电离平衡常数越大,酸性越强,故酸性:。在相同条件下,有物质的量浓度相同、体积相等的溶液、溶液和溶液,氢离子浓度由大到小顺序为:溶液、溶液和溶液。
①溶液中,氢离子浓度最大的是;
②同时加入足量的锌,氢离子浓度小的反应速率满,故则开始反应时,速率最慢;
(8)A.酸性,故能发生,A不符合题意;
B.由表格可知酸性:,故不能发生,B符合题意;
C.由表格可知酸性:,故能发生,C不符合题意;
D.由表格可知酸性,能发生,D不符合题意;
故选B。
18.答案:(1)+41.2;>
(2);AC
(3);0.8;0.056;BC
解析:(1)已知、的燃烧热分别为,,①,②,③,由盖斯定律可知①-②+③得到反应II,则反应热=(-285.8kJ/mol)-(-283.0kJ/mol)+(+44kJ/mol)=+41.2kJ/mol,由盖斯定律可知,反应IV-反应III得到反应I,。
(2)反应|为气体体积增大的反应温度一定时,增大压强,平衡向逆反应方向移动,甲烷的物质的量分数增大,则等温下,甲烷的物质的量分数,随压强的变化曲线是,则为等压下甲烷的物质的量分数随温度的变化曲线,根据以上分析AC点处于相同的化学平衡状态。
(3)由(1)可知反应I、Ⅱ、Ⅳ都是吸热反应,升高温度,平衡正向移动,和CO的物质的量增大,由C和H元素守恒可知,的物质的量比CO大,则a表示的物质是,初始投料,625℃时,由C元素守恒可知积碳物质的量为2kmol-1mol-0.2mol=0.8mol,由H元素守恒可知==1.1mol,反应Ⅲ的压强平衡常数==0.056kPa 1;
A.积碳是固体,平衡后,移除部分积碳,不改变平衡状态,故A错误;
B.保持其他条件不变,升高温度,反应Ⅲ逆向移动,积碳量逐渐减小,故B正确;
C.温度一定时,增大投料比,相当于增大的物质的量,反应Ⅲ逆向移动,积碳量逐渐减小,故C正确;
D.温度一定时,增大投料比,相当于增大的物质的量或减少的物质的量,由反应Ⅲ的平衡常数和反应Ⅳ的平衡常数K=不变可知,将减小,将增大,则将减小,故D错误;
故选BC。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
