小卷抢分 选择题专练(三)(含解析)-2025高考化学二轮复习 抢分练
文档属性
| 名称 | 小卷抢分 选择题专练(三)(含解析)-2025高考化学二轮复习 抢分练 |  | |
| 格式 | doc | ||
| 文件大小 | 342.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-15 19:39:44 | ||
图片预览


文档简介
选择题专练(三)
1 [2025南通如东期初T1]材料在生产、生活中起着重要作用。下列属于新型无机非金属材料的是( )
A. 钢化玻璃
B. 醋酸纤维
C. 氮化硅陶瓷
D. 聚四氟乙烯
2 [2025苏州期初T2]草酸易被NaClO氧化:H2C2O4+NaClO===NaCl+2CO2↑+H2O。下列说法不正确的是( )
A. CO2的空间结构为直线形
B. NaClO属于离子化合物
C. H2O的电子式为H+[]2-H+
D. Cl的结构示意图为
3 [2024淮安洪泽中学等七校联考T4]木炭与浓硫酸可发生反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。实验室利用下列装置进行实验并检验混合气体的成分。下列不能达到实验目的的是( )
甲 乙 丙 丁
A. 用装置甲发生木炭与浓硫酸的反应
B. 用装置乙检验气体产物中含水蒸气
C. 用装置丙检验气体产物中含SO2
D. 用装置丁检验气体产物中含CO2
4 [2024南京、盐城一模T4]十二烷基磺酸钠(C12H25SO3Na)常用作轻纺工业的乳化剂。下列说法正确的是( )
A. C12H25SO3Na为离子化合物
B. 离子半径:r(O2-)C. 电离能:I1(C)D. 热稳定性:H2O阅读下列材料,完成5~7题:
甲醇是易燃液体,能与水、乙醇、丙酮等混溶。甲醇的燃烧热为726.51 kJ/mol。工业使用原料气CO、H2气相法合成甲醇的主反应:CO(g)+2H2(g)===CH3OH(g) ΔH=-90.8 kJ/mol。有少量CO2存在时,会发生副反应:CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41.3 kJ/mol。甲醇是一种重要的工业原料,可用于制备二甲醚(CH3OCH3)、甲醛、甲酸等有机物。
5 [2024南通海安调研T5]下列说法正确的是( )
A. CO、H2、CO2都属于非极性分子
B. 用分液法分离甲醇和丙酮的混合物
C. 甲醇和二甲醚互为同分异构体
D. 甲醇和二氧化碳分子中碳原子杂化方式不同
6 [2024南通海安调研T6]下列化学反应或转化过程表示正确的是( )
A. CH3OH燃烧热的热化学方程式:CH3OH(l)+O2(g)===CO2(g)+2H2O(g) ΔH=-726.51 kJ/mol
B. 气相法合成甲醇的副反应:CO2(g)+H2(g)===CO(g)+H2O(g) ΔS=0
C. 实验室由甲醇制备二甲醚的反应:2CH3OHCH3OCH3+H2O
D. 甲醇转化为甲酸:CH3OHHCHOHCOOH
7 [2024南通海安调研T7]下列物质结构与性质或物质性质与用途具有对应关系的是( )
A. 甲醇分子间能形成氢键,可与水任意比例互溶
B. CO具有氧化性,可用于冶金工业
C. 干冰能溶于水,可用作制冷剂
D. 二甲醚具有可燃性,可用作燃料
8 [2025海安中学、淮阴中学联考T10]下列物质的制备与工业生产实际相符合的是( )
A. 海带提碘:海带含I-滤液I2(aq)I2
B. 海水提镁:海水Mg(OH)2MgOMg
C. 制纯碱:NaHCO3(s)Na2CO3(s)
D. 制漂白粉: NaCl(aq)Cl2(g)漂白粉(s)
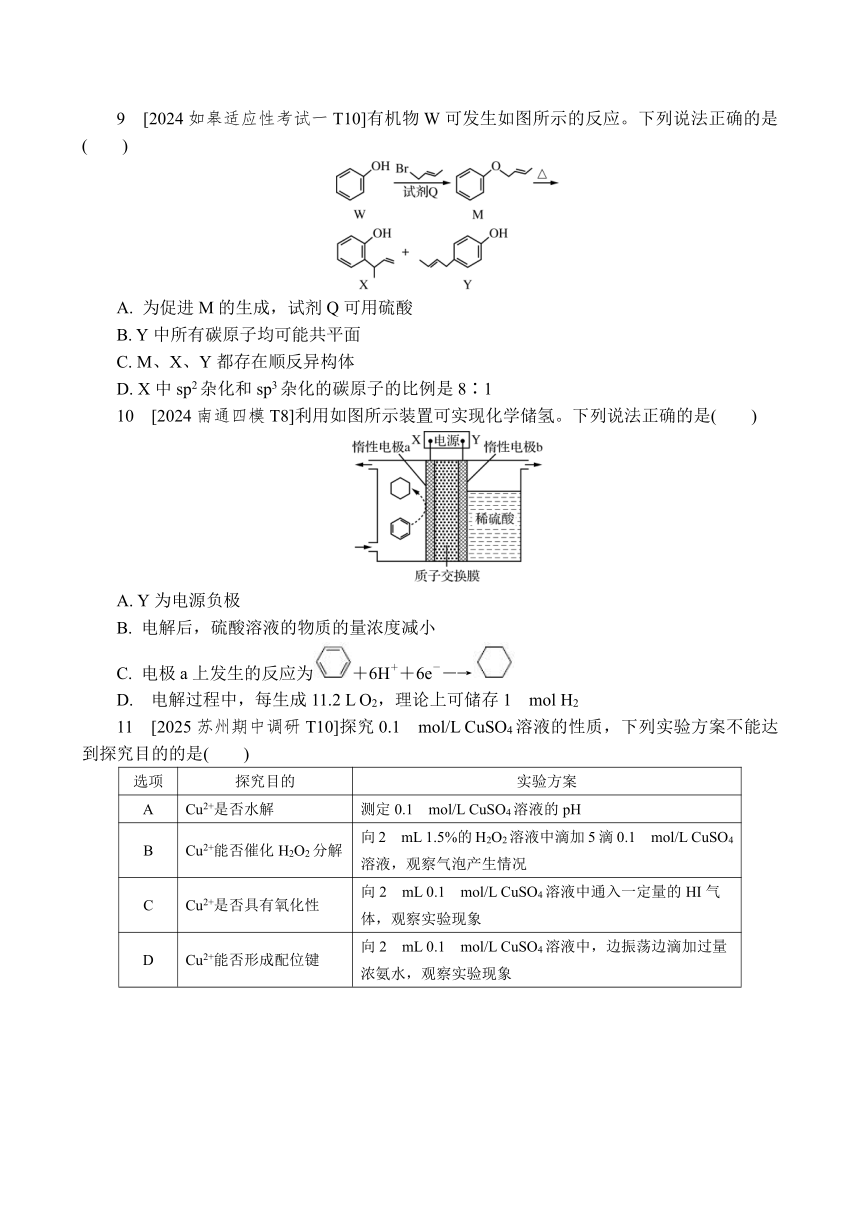
9 [2024如皋适应性考试一T10]有机物W可发生如图所示的反应。下列说法正确的是( )
A. 为促进M的生成,试剂Q可用硫酸
B. Y中所有碳原子均可能共平面
C. M、X、Y都存在顺反异构体
D. X中sp2杂化和sp3杂化的碳原子的比例是8∶1
10 [2024南通四模T8]利用如图所示装置可实现化学储氢。下列说法正确的是( )
A. Y为电源负极
B. 电解后,硫酸溶液的物质的量浓度减小
C. 电极a上发生的反应为+6H++6e-―→
D. 电解过程中,每生成11.2 L O2,理论上可储存1 mol H2
11 [2025苏州期中调研T10]探究0.1 mol/L CuSO4溶液的性质,下列实验方案不能达到探究目的的是( )
选项 探究目的 实验方案
A Cu2+是否水解 测定0.1 mol/L CuSO4溶液的pH
B Cu2+能否催化H2O2分解 向2 mL 1.5%的H2O2溶液中滴加5滴0.1 mol/L CuSO4溶液,观察气泡产生情况
C Cu2+是否具有氧化性 向2 mL 0.1 mol/L CuSO4溶液中通入一定量的HI气体,观察实验现象
D Cu2+能否形成配位键 向2 mL 0.1 mol/L CuSO4溶液中,边振荡边滴加过量浓氨水,观察实验现象
12 [2024扬州考前模拟T12]CuCl为难溶于水的白色固体。室温下,以CuO为原料制备CuCl的过程如图所示。下列说法正确的是( )
A. 0.1 mol/L Na2SO3溶液中:c(OH-)=c(HSO)+c(H2SO3)+c(H+)
B. “还原”发生反应的离子方程式:2Cu2++SO+2Cl-+H2O===2CuCl+SO+2H+
C. “还原”后的溶液中:2c(Cu2+)+c(H+)=c(OH-)+2c(SO)+c(Cl-)
D. “过滤”后得到的滤液中:c(Cu+)>
13 [2025镇江调研T13]工业上采用RuO2催化氧化处理HCl废气实现氯资源循环利用:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH。不同温度下,HCl的转化率(α)与HCl和O2的起始流速变化关系如图所示(较低流速下转化率可近似为平衡转化率)。下列说法不正确的是( )
A. ΔH<0,ΔS<0
B. 增大n(O2)∶n(HCl)的比值,可提高M点HCl转化率
C. 较高流速时α(HCl)低的原因是在较短时间内达到了平衡状态
D. N点为平衡状态,用平衡物质的量分数代替平衡浓度计算,该温度下反应的平衡常数K=36
选择题专练(三)
1 C 钢化玻璃与普通玻璃的成分相同,是传统无机非金属材料,A错误;醋酸纤维是有机高分子材料,B错误;氮化硅陶瓷是新型无机非金属材料,C正确;聚四氟乙烯是有机高分子材料,D错误。
2 C CO2的中心原子C为sp杂化,空间结构为直线形,A正确;NaClO由Na+和ClO-构成,属于离子化合物, B正确;H2O是共价化合物,其电子式为,C错误;Cl原子核外有17个电子,其结构示意图为 ,D正确。
3 D SO2也能使澄清石灰水变浑浊,需要先除去SO2再检验CO2,D错误。
4 A 电子层数相同时,核电荷数越大,离子半径越小,离子半径r(O2-)>r(Na+),B错误;同周期主族元素从左到右,元素的第一电离能总体呈增大趋势,但ⅡA、ⅤA族元素的第一电离能反常地大,故电离能I1(C)<I1(O)<I1(N),C错误;元素的非金属性越强,简单气态氢化物越稳定,非金属性O>S,故热稳定性H2O>H2S,D错误。
5 D CO为极性分子,A错误;甲醇与丙酮混溶,无法分液,可以用蒸馏法分离,B错误;二甲醚的分子式为C2H6O,与CH3OH不互为同分异构体,C错误;甲醇中碳原子为sp3杂化,CO2分子中碳原子为sp杂化,D正确。
6 C 燃烧热的热化学方程式中,应该生成液态水,A错误;副反应的ΔH=+41.3 kJ/mol,为吸热反应,能发生反应,需满足ΔS>0,B错误;甲醇与新制氢氧化铜不反应,D错误。
7 D 甲醇与水能形成分子间氢键,与水互溶,A错误;CO具有还原性,可用于冶炼金属,B错误;干冰可用作制冷剂,是因为升华时从环境吸热,与能溶于水无关,C错误。
8 C 海带晒干灼烧后再用水浸取,工业上从碘溶液中获得粗碘,采用结晶、过滤的方法,A错误;用石灰乳沉淀Mg2+,工业获得镁应电解熔融的MgCl2,B错误;工业制漂白粉的原料是Cl2与石灰乳,D错误。
9 B W―→M的副产物是HBr,为促进M的生成,需要除去反应生成的HBr,故试剂Q是碱性物质,不可能是硫酸,A错误;苯环平面与碳碳双键平面通过单键相连,单键可以旋转,故Y中所有碳原子均可能共平面,B正确;X中碳碳双键一端的碳原子连有2个H原子,故X不存在顺反异构体,C错误;X中只有2个饱和碳原子采取sp3杂化,其余碳原子均采取sp2杂化,故X中sp2杂化和sp3杂化的碳原子的比例是4∶1,D错误。
10 C 电极a上发生的反应为+6e-+6H+―→,为还原反应,电极a为阴极,电极b为阳极,Y为电源正极,A错误;电极b上发生的反应为2H2O-4e-===4H++O2↑,H+透过质子交换膜从阳极区移向阴极区,阳极区本质是电解水,硫酸浓度增大,B错误;气体所处状况未知,无法计算O2的物质的量,D错误。
11 B CuSO4是强酸弱碱盐,Cu2+发生水解反应,溶液显酸性,溶液pH<7,A正确;无法排除SO的干扰,B错误;向CuSO4溶液中通入一定量的HI气体,二者反应生成CuI沉淀,Cu元素的化合价降低,得到电子被还原,Cu2+具有氧化性,C正确;向CuSO4溶液中边振荡边滴加过量浓氨水,先生成蓝色Cu(OH)2沉淀,后沉淀溶解,溶解时生成硫酸四氨合铜,则Cu2+能形成配位键,D正确。
12 B 质子守恒式为c(OH-)=c(HSO)+2c(H2SO3)+c(H+),A错误;SO将Cu2+还原,生成CuCl和SO,B正确;还原后溶液中还有Na+,C错误;过滤后得到的滤液为CuCl饱和溶液,c(Cu+)=,D错误。
13 C 正反应的气体分子数减少,故ΔS<0,升高温度,HCl的平衡转化率降低,则正反应为放热反应,故ΔH<0,A正确;增大n(O2)∶n(HCl)的比值,即相对增大氧气的投料量,可提高M点HCl转化率,B正确;较高流速时α(HCl)低的原因是流速太快导致HCl反应不充分,C错误;该温度下HCl转化率最大时达到了反应限度,即平衡状态,n(O2)∶n(HCl)=4∶4,HCl的转化率为80%,设起始物质的量为4 mol,可列出三段式:
4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)
起始(mol) 4 4 0 0
转化(mol) 3.2 0.8 1.6 1.6
平衡(mol) 0.8 3.2 1.6 1.6
气体总物质的量为7.2 mol,HCl、O2、Cl2、H2O的物质的量分数分别为、、、,K==36,D正确。
1 [2025南通如东期初T1]材料在生产、生活中起着重要作用。下列属于新型无机非金属材料的是( )
A. 钢化玻璃
B. 醋酸纤维
C. 氮化硅陶瓷
D. 聚四氟乙烯
2 [2025苏州期初T2]草酸易被NaClO氧化:H2C2O4+NaClO===NaCl+2CO2↑+H2O。下列说法不正确的是( )
A. CO2的空间结构为直线形
B. NaClO属于离子化合物
C. H2O的电子式为H+[]2-H+
D. Cl的结构示意图为
3 [2024淮安洪泽中学等七校联考T4]木炭与浓硫酸可发生反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。实验室利用下列装置进行实验并检验混合气体的成分。下列不能达到实验目的的是( )
甲 乙 丙 丁
A. 用装置甲发生木炭与浓硫酸的反应
B. 用装置乙检验气体产物中含水蒸气
C. 用装置丙检验气体产物中含SO2
D. 用装置丁检验气体产物中含CO2
4 [2024南京、盐城一模T4]十二烷基磺酸钠(C12H25SO3Na)常用作轻纺工业的乳化剂。下列说法正确的是( )
A. C12H25SO3Na为离子化合物
B. 离子半径:r(O2-)
甲醇是易燃液体,能与水、乙醇、丙酮等混溶。甲醇的燃烧热为726.51 kJ/mol。工业使用原料气CO、H2气相法合成甲醇的主反应:CO(g)+2H2(g)===CH3OH(g) ΔH=-90.8 kJ/mol。有少量CO2存在时,会发生副反应:CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41.3 kJ/mol。甲醇是一种重要的工业原料,可用于制备二甲醚(CH3OCH3)、甲醛、甲酸等有机物。
5 [2024南通海安调研T5]下列说法正确的是( )
A. CO、H2、CO2都属于非极性分子
B. 用分液法分离甲醇和丙酮的混合物
C. 甲醇和二甲醚互为同分异构体
D. 甲醇和二氧化碳分子中碳原子杂化方式不同
6 [2024南通海安调研T6]下列化学反应或转化过程表示正确的是( )
A. CH3OH燃烧热的热化学方程式:CH3OH(l)+O2(g)===CO2(g)+2H2O(g) ΔH=-726.51 kJ/mol
B. 气相法合成甲醇的副反应:CO2(g)+H2(g)===CO(g)+H2O(g) ΔS=0
C. 实验室由甲醇制备二甲醚的反应:2CH3OHCH3OCH3+H2O
D. 甲醇转化为甲酸:CH3OHHCHOHCOOH
7 [2024南通海安调研T7]下列物质结构与性质或物质性质与用途具有对应关系的是( )
A. 甲醇分子间能形成氢键,可与水任意比例互溶
B. CO具有氧化性,可用于冶金工业
C. 干冰能溶于水,可用作制冷剂
D. 二甲醚具有可燃性,可用作燃料
8 [2025海安中学、淮阴中学联考T10]下列物质的制备与工业生产实际相符合的是( )
A. 海带提碘:海带含I-滤液I2(aq)I2
B. 海水提镁:海水Mg(OH)2MgOMg
C. 制纯碱:NaHCO3(s)Na2CO3(s)
D. 制漂白粉: NaCl(aq)Cl2(g)漂白粉(s)
9 [2024如皋适应性考试一T10]有机物W可发生如图所示的反应。下列说法正确的是( )
A. 为促进M的生成,试剂Q可用硫酸
B. Y中所有碳原子均可能共平面
C. M、X、Y都存在顺反异构体
D. X中sp2杂化和sp3杂化的碳原子的比例是8∶1
10 [2024南通四模T8]利用如图所示装置可实现化学储氢。下列说法正确的是( )
A. Y为电源负极
B. 电解后,硫酸溶液的物质的量浓度减小
C. 电极a上发生的反应为+6H++6e-―→
D. 电解过程中,每生成11.2 L O2,理论上可储存1 mol H2
11 [2025苏州期中调研T10]探究0.1 mol/L CuSO4溶液的性质,下列实验方案不能达到探究目的的是( )
选项 探究目的 实验方案
A Cu2+是否水解 测定0.1 mol/L CuSO4溶液的pH
B Cu2+能否催化H2O2分解 向2 mL 1.5%的H2O2溶液中滴加5滴0.1 mol/L CuSO4溶液,观察气泡产生情况
C Cu2+是否具有氧化性 向2 mL 0.1 mol/L CuSO4溶液中通入一定量的HI气体,观察实验现象
D Cu2+能否形成配位键 向2 mL 0.1 mol/L CuSO4溶液中,边振荡边滴加过量浓氨水,观察实验现象
12 [2024扬州考前模拟T12]CuCl为难溶于水的白色固体。室温下,以CuO为原料制备CuCl的过程如图所示。下列说法正确的是( )
A. 0.1 mol/L Na2SO3溶液中:c(OH-)=c(HSO)+c(H2SO3)+c(H+)
B. “还原”发生反应的离子方程式:2Cu2++SO+2Cl-+H2O===2CuCl+SO+2H+
C. “还原”后的溶液中:2c(Cu2+)+c(H+)=c(OH-)+2c(SO)+c(Cl-)
D. “过滤”后得到的滤液中:c(Cu+)>
13 [2025镇江调研T13]工业上采用RuO2催化氧化处理HCl废气实现氯资源循环利用:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH。不同温度下,HCl的转化率(α)与HCl和O2的起始流速变化关系如图所示(较低流速下转化率可近似为平衡转化率)。下列说法不正确的是( )
A. ΔH<0,ΔS<0
B. 增大n(O2)∶n(HCl)的比值,可提高M点HCl转化率
C. 较高流速时α(HCl)低的原因是在较短时间内达到了平衡状态
D. N点为平衡状态,用平衡物质的量分数代替平衡浓度计算,该温度下反应的平衡常数K=36
选择题专练(三)
1 C 钢化玻璃与普通玻璃的成分相同,是传统无机非金属材料,A错误;醋酸纤维是有机高分子材料,B错误;氮化硅陶瓷是新型无机非金属材料,C正确;聚四氟乙烯是有机高分子材料,D错误。
2 C CO2的中心原子C为sp杂化,空间结构为直线形,A正确;NaClO由Na+和ClO-构成,属于离子化合物, B正确;H2O是共价化合物,其电子式为,C错误;Cl原子核外有17个电子,其结构示意图为 ,D正确。
3 D SO2也能使澄清石灰水变浑浊,需要先除去SO2再检验CO2,D错误。
4 A 电子层数相同时,核电荷数越大,离子半径越小,离子半径r(O2-)>r(Na+),B错误;同周期主族元素从左到右,元素的第一电离能总体呈增大趋势,但ⅡA、ⅤA族元素的第一电离能反常地大,故电离能I1(C)<I1(O)<I1(N),C错误;元素的非金属性越强,简单气态氢化物越稳定,非金属性O>S,故热稳定性H2O>H2S,D错误。
5 D CO为极性分子,A错误;甲醇与丙酮混溶,无法分液,可以用蒸馏法分离,B错误;二甲醚的分子式为C2H6O,与CH3OH不互为同分异构体,C错误;甲醇中碳原子为sp3杂化,CO2分子中碳原子为sp杂化,D正确。
6 C 燃烧热的热化学方程式中,应该生成液态水,A错误;副反应的ΔH=+41.3 kJ/mol,为吸热反应,能发生反应,需满足ΔS>0,B错误;甲醇与新制氢氧化铜不反应,D错误。
7 D 甲醇与水能形成分子间氢键,与水互溶,A错误;CO具有还原性,可用于冶炼金属,B错误;干冰可用作制冷剂,是因为升华时从环境吸热,与能溶于水无关,C错误。
8 C 海带晒干灼烧后再用水浸取,工业上从碘溶液中获得粗碘,采用结晶、过滤的方法,A错误;用石灰乳沉淀Mg2+,工业获得镁应电解熔融的MgCl2,B错误;工业制漂白粉的原料是Cl2与石灰乳,D错误。
9 B W―→M的副产物是HBr,为促进M的生成,需要除去反应生成的HBr,故试剂Q是碱性物质,不可能是硫酸,A错误;苯环平面与碳碳双键平面通过单键相连,单键可以旋转,故Y中所有碳原子均可能共平面,B正确;X中碳碳双键一端的碳原子连有2个H原子,故X不存在顺反异构体,C错误;X中只有2个饱和碳原子采取sp3杂化,其余碳原子均采取sp2杂化,故X中sp2杂化和sp3杂化的碳原子的比例是4∶1,D错误。
10 C 电极a上发生的反应为+6e-+6H+―→,为还原反应,电极a为阴极,电极b为阳极,Y为电源正极,A错误;电极b上发生的反应为2H2O-4e-===4H++O2↑,H+透过质子交换膜从阳极区移向阴极区,阳极区本质是电解水,硫酸浓度增大,B错误;气体所处状况未知,无法计算O2的物质的量,D错误。
11 B CuSO4是强酸弱碱盐,Cu2+发生水解反应,溶液显酸性,溶液pH<7,A正确;无法排除SO的干扰,B错误;向CuSO4溶液中通入一定量的HI气体,二者反应生成CuI沉淀,Cu元素的化合价降低,得到电子被还原,Cu2+具有氧化性,C正确;向CuSO4溶液中边振荡边滴加过量浓氨水,先生成蓝色Cu(OH)2沉淀,后沉淀溶解,溶解时生成硫酸四氨合铜,则Cu2+能形成配位键,D正确。
12 B 质子守恒式为c(OH-)=c(HSO)+2c(H2SO3)+c(H+),A错误;SO将Cu2+还原,生成CuCl和SO,B正确;还原后溶液中还有Na+,C错误;过滤后得到的滤液为CuCl饱和溶液,c(Cu+)=,D错误。
13 C 正反应的气体分子数减少,故ΔS<0,升高温度,HCl的平衡转化率降低,则正反应为放热反应,故ΔH<0,A正确;增大n(O2)∶n(HCl)的比值,即相对增大氧气的投料量,可提高M点HCl转化率,B正确;较高流速时α(HCl)低的原因是流速太快导致HCl反应不充分,C错误;该温度下HCl转化率最大时达到了反应限度,即平衡状态,n(O2)∶n(HCl)=4∶4,HCl的转化率为80%,设起始物质的量为4 mol,可列出三段式:
4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)
起始(mol) 4 4 0 0
转化(mol) 3.2 0.8 1.6 1.6
平衡(mol) 0.8 3.2 1.6 1.6
气体总物质的量为7.2 mol,HCl、O2、Cl2、H2O的物质的量分数分别为、、、,K==36,D正确。
同课章节目录
