小卷抢分 选择题专练(五)(含解析)-2025高考化学二轮复习 抢分练
文档属性
| 名称 | 小卷抢分 选择题专练(五)(含解析)-2025高考化学二轮复习 抢分练 |  | |
| 格式 | doc | ||
| 文件大小 | 294.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-15 19:41:52 | ||
图片预览


文档简介
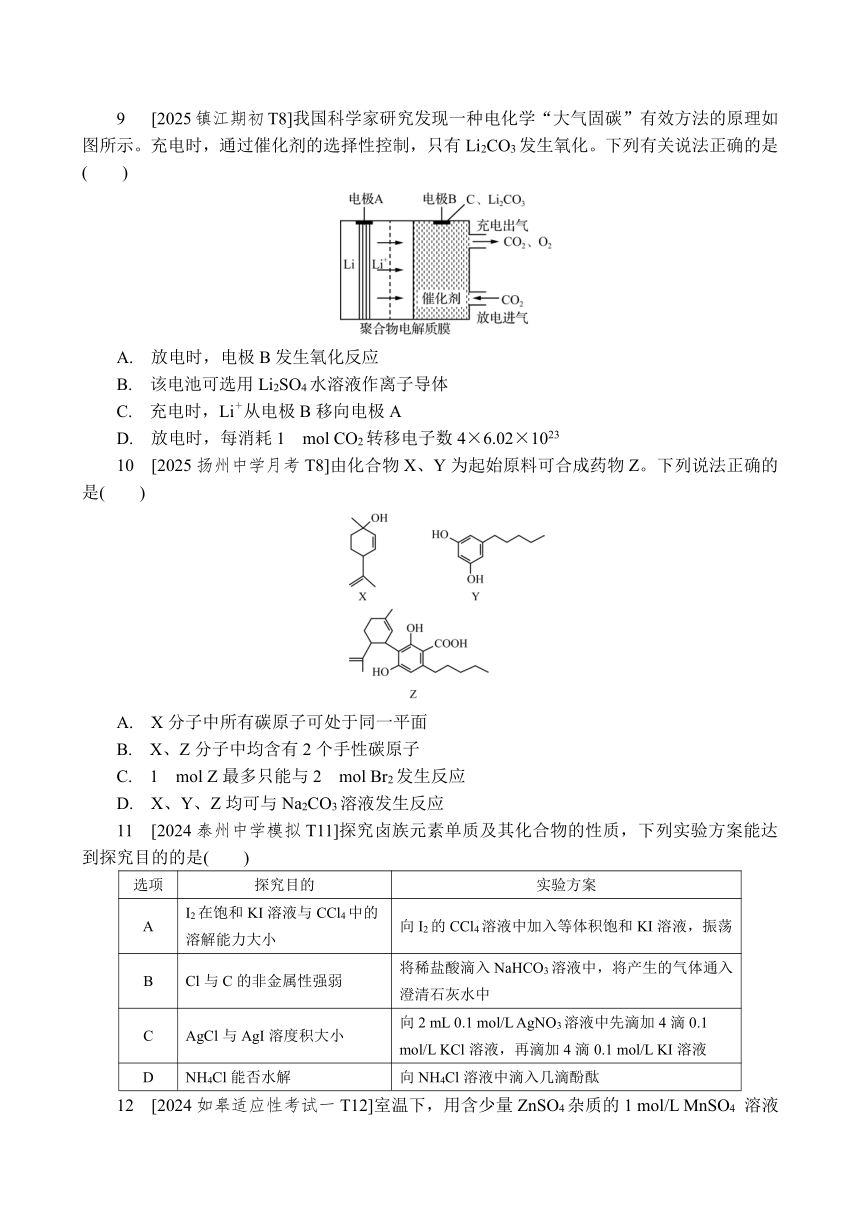
选择题专练(五)
1 [2024如皋适应性三T1]物质转化和合成需要选择合适的原料。以油脂为原料适合制取或合成下列物质中的( )
A. 聚乙烯 B. 晶体硅
C. 氨基酸 D. 甘油
2 [2025如东调研T2][Cu(NH3)4]SO4·H2O(硫酸四氨合铜晶体)常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分。下列叙述正确的是( )
A. NH3的电子式为
B. [Cu(NH3)4]2+中存在离子键、配位键和极性共价键
C. NH3分子中H—N—H的键角小于H2O分子中H—O—H的键角
D. NH3和H2O与Cu2+的配位能力:NH3>H2O
3 [2024南京外国语、金陵中学、海安中学联考T3]实验室制取乙烯并验证其化学性质。下列装置不正确的是( )
A. 制备乙烯 B. 除去杂质 C. 验证加成反应 D. 收集乙烯
4 [2024南京二模T4]丁二酮肟与Ni2+反应生成鲜红色的二丁二酮肟合镍沉淀,其结构如图所示。该反应可鉴定Ni2+的存在。下列说法不正确的是( )
A. 沸点:CH4B. 原子半径:r(O)C. 电离能:I1(C)D. Ni2+提供空轨道,N原子提供孤电子对
阅读下列材料,完成5~7题:
氧、硫及其化合物应用广泛。O2可用作燃料电池的氧化剂。单质硫有多种同素异形体,其中S8在液态SO2中被AsF5氧化成S,化学方程式为S8+3AsF5S8(AsF6)2+AsF3。氧能形成H2O、H2O2、Na2O2、SO2、V2O5等重要氧化物。SO2是一种重要的工业原料,可通过煅烧黄铁矿或加热无水硫酸钙、焦炭及二氧化硅的混合物(CaSO4+C+SiO2SO2↑+CO↑+CaSiO3)等方法来制取。SO2在V2O5催化作用下与O2反应生成SO3。
5 [2024南通、泰州等八市三调T6]下列说法正确的是( )
A. O、O、O互为同素异形体
B. SO2的中心原子杂化轨道类型为sp3
C. Na2O2晶体中阴、阳离子数目之比为1∶2
D. 1 mol SiO2晶体中含有2 mol Si—O σ键
6 [2024南通、泰州等八市三调T7]下列关于反应2SO2(g)+O2(g)2SO3(g) ΔH<0 的说法正确的是( )
A. 基态V原子核外电子排布为3d34s2
B. 反应达到平衡状态时,v逆(SO3)=2v正(O2)
C. 使用V2O5的目的是增大SO2的平衡转化率
D. 其他条件相同,增大压强,平衡常数增大
7 [2024南通、泰州等八市三调T8]下列关于化学反应的表示或说法正确的是( )
A. 碱性氢氧燃料电池的正极反应:O2+4e-+4H+===2H2O
B. Na2O2与SO2反应:2Na2O2+2SO2===2Na2SO4+O2
C. S8与AsF5反应中,n(氧化剂)∶n(还原剂)=3∶1
D. 温度越高,ΔS越大,硫酸钙制取SO2的反应正向进行程度越大
8 [2025淮安期初T8]在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. N2(g)NH3(g)NaHCO3(s)
B. S(s)SO2(g)H2SO4(aq)
C. NaCl(aq)Cl2(g)FeCl2(s)
D. SiO2(s)H2SiO3(s)Na2SiO3(aq)
9 [2025镇江期初T8]我国科学家研究发现一种电化学“大气固碳”有效方法的原理如图所示。充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化。下列有关说法正确的是( )
A. 放电时,电极B发生氧化反应
B. 该电池可选用Li2SO4水溶液作离子导体
C. 充电时,Li+从电极B移向电极A
D. 放电时,每消耗1 mol CO2转移电子数4×6.02×1023
10 [2025扬州中学月考T8]由化合物X、Y为起始原料可合成药物Z。下列说法正确的是( )
A. X分子中所有碳原子可处于同一平面
B. X、Z分子中均含有2个手性碳原子
C. 1 mol Z最多只能与2 mol Br2发生反应
D. X、Y、Z均可与Na2CO3溶液发生反应
11 [2024泰州中学模拟T11]探究卤族元素单质及其化合物的性质,下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A I2在饱和KI溶液与CCl4中的溶解能力大小 向I2的CCl4溶液中加入等体积饱和KI溶液,振荡
B Cl与C的非金属性强弱 将稀盐酸滴入NaHCO3溶液中,将产生的气体通入澄清石灰水中
C AgCl与AgI溶度积大小 向2 mL 0.1 mol/L AgNO3溶液中先滴加4滴0.1 mol/L KCl溶液,再滴加4滴0.1 mol/L KI溶液
D NH4Cl能否水解 向NH4Cl溶液中滴入几滴酚酞
12 [2024如皋适应性考试一T12]室温下,用含少量ZnSO4杂质的1 mol/L MnSO4 溶液制备MnCO3的过程如下图所示。下列说法正确的是( )
已知:Ksp(MnS)=2×10-10、Ksp(ZnS)=2×10-24、Kb(NH3·H2O)=2×10-5、Ka1(H2CO3)=4×10-7、
Ka2(H2CO3)=5×10-11。
A. “除锌” 后所得上层清液中,c(Zn2+)一定小于1×10-5 mol/L
B. 0.1 mol/L NH4HCO3溶液中存在:c(H+)+c(H2CO3)=c(OH-)+c(CO)
C. 氨水、NH4HCO3溶液中存在:c(NH)<2c(CO)+c(HCO)
D. “沉锰”后的滤液中存在:c(NH)+c(NH3·H2O)=2c(SO )
13 [2024扬州期末T13]为研究反应2NO+O2 2NO2在不同条件下NO的转化率,向恒压反应器中通入含一定浓度NO与O2的气体,在无催化剂和有催化剂存在时,分别测得不同温度下反应器出口处NO的转化率如图中曲线a、b所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A. 反应的ΔH>0
B. 曲线a中NO转化率随温度升高而增大,是由于催化剂的活性增强
C. 曲线b中从M点到N点,NO转化率随温度升高而减小,是由于反应速率减慢
D. 催化剂存在时,其他条件不变,增大气体中c(O2),NO转化率随温度的变化为曲线c
选择题专练(五)
1 D 由于油脂水解可生成甘油,故以油脂为原料适合制取甘油,D符合题意。
2 D NH3的电子式为,A错误; [Cu(NH3)4]2+中存在配位键和极性共价键,不存在离子键,B错误;H2O中O原子有两个孤电子对,NH3分子中N原子有一个孤电子对,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致NH3分子中H—N—H键角比H2O分子中H—O—H键角大,C错误;N的电负性小于O,NH3中N原子上的孤电子对更容易贡献出来,NH3的配位能力强于H2O,结合实验,硫酸铜溶液中加入过量氨水后生成了[Cu(NH3)4]2+,也能说明NH3和H2O与Cu2+的配位能力:NH3>H2O,D正确。
3 D 空气的平均相对分子质量为29,乙烯的相对分子质量为28,二者的相对分子质量比较接近,不宜用排空气法收集,可改用排水法收集,D错误。
4 C NH3、H2O都能形成分子间氢键,常温下水呈液态,故沸点CH4<NH3<H2O,A正确;同周期主族元素从左到右,原子半径依次减小,半径r(O)<r(N)<r(C),B正确;ⅡA、ⅤA族元素原子的第一电离能比同周期左右相邻元素原子的第一电离能都大,第一电离能O<N,C错误;配合物二丁二酮肟合镍中,Ni2+为中心离子,提供空轨道,N原子为配位原子,提供孤电子对,D正确。
5 C 同素异形体的研究对象是同种元素组成的不同单质,同种元素的不同原子互为同位素,故O、O、O互为同位素,A错误;SO2的中心原子S采取sp2杂化,B错误;Na2O2由Na+和O构成,阴、阳离子数目之比为1∶2,C正确;SiO2晶体中,每个Si原子连接4个O原子,每个O原子连接2个Si原子,根据均摊法知,1 mol SiO2中含有4 mol Si—O σ键,D错误。
6 B 基态V原子核外电子排布式为[Ar]3d34s2,A错误;V2O5是该反应的催化剂,可加快反应速率,但不能增大SO2的平衡转化率,C错误;温度不变,平衡常数不变,故增大压强,平衡常数不变,D错误。
7 D 碱性条件下,没有外加H+参与反应时,正极反应式中不能出现H+,A错误;O原子不守恒,且反应中无O2生成,B错误;反应S8+3AsF5S8(AsF6)2+AsF3中,S8在液态SO2中被AsF5氧化成S,S8为还原剂,AsF5为氧化剂,只有的AsF5发生还原反应,故n(氧化剂)∶n(还原剂)=1∶1,C错误;CaSO4+C+SiO2SO2↑+CO↑+CaSiO3为熵增反应,且在高温下才能发生,说明反应的ΔH>0,故温度越高,CaSO4制取SO2的反应正向进行程度越大,D正确。
8 A SO2气体与水反应只能生成H2SO3(aq),不能生成H2SO4(aq),B错误;Cl2与Fe反应生成FeCl3,C错误;SiO2(s)难溶于水,与水不发生化学反应,不能生成H2SiO3,D错误。
9 C 放电时,A为负极,电极反应为Li-e-===Li+,B为正极,电极反应为3CO2+4e-+4Li+===2Li2CO3+C,充电时,A为阴极,电极反应式为Li++e-===Li,B为阳极,电极反应为2Li2CO3+C-4e-===3CO2↑+4Li+或2CO-4e-===2CO2↑+O2↑。放电时,B为正极,发生还原反应,A错误;放电时,电极A为负极,电极材料为Li,会与水反应,因此该电池只可选用无水电解液,B错误;充电时,阳离子移向阴极,则Li+的移动方向是从电极B移向电极A,C正确;放电时,根据电极反应3CO2+4e-+4Li+===2Li2CO3+C,每消耗1 mol CO2转移电子数×6.02×1023,D错误。
10 B X分子中的环不是苯环,根据甲烷的正四面体结构知,X分子中所有碳原子不可能处于同一平面,A错误;X()、Z()分子中均含有2个手性碳原子,B正确;1 mol Z()最多能与3 mol Br2发生反应,C错误;X分子中只含有碳碳双键和醇羟基两种官能团,不能与Na2CO3溶液发生反应,D错误。
11 A 比较最高价氧化物的水化物的酸性,可以得出非金属性强弱,即应比较HClO4与H2CO3的酸性,B错误;Ag+过量,无法比较AgCl和AgI的溶度积大小,C错误;NH4Cl若水解,则溶液呈酸性,用酚酞无法判断,D错误。
12 A “除锌”反应为Zn2++MnS Mn2++ZnS,K====1014>105,说明该反应比较彻底,留在溶液中的c(Zn2+)<10-5mol/L,A正确;NH4HCO3溶液中的质子守恒式为c(H+)+c(H2CO3)=c(OH-)+c(CO)+c(NH3·H2O),B错误;氨水、NH4HCO3溶液中的电荷守恒式为 c(NH)+c(H+)=2c(CO)+c(HCO )+c(OH-),由Kb(NH3·H2O)=2×10-5,Ka2(H2CO3)=5×10-11知,HCO的水解程度大于NH 的水解程度,NH4HCO3溶液显碱性,则氨水、NH4HCO3溶液显碱性,c(H+)13 C 由图中虚线(平衡转化率)可知,随着温度的升高,NO的转化率降低,即升高温度,平衡逆向移动,故正反应为放热反应,A错误;加入催化剂后反应速率加快,相同时间内NO的转化率增大,由图可知,曲线a所示转化率为没有加催化剂的情况,B错误;反应速率减慢,转化率会减小,由图像看出,b曲线上的M、N点都未达到平衡,NO转化率随温度升高而减小,原因可能是随着温度的升高,催化剂的活性降低,反应速率减慢,C正确;其他条件不变,增大气体中c(O2),达到平衡时,NO的平衡转化率应该比原平衡要大,D错误。
1 [2024如皋适应性三T1]物质转化和合成需要选择合适的原料。以油脂为原料适合制取或合成下列物质中的( )
A. 聚乙烯 B. 晶体硅
C. 氨基酸 D. 甘油
2 [2025如东调研T2][Cu(NH3)4]SO4·H2O(硫酸四氨合铜晶体)常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分。下列叙述正确的是( )
A. NH3的电子式为
B. [Cu(NH3)4]2+中存在离子键、配位键和极性共价键
C. NH3分子中H—N—H的键角小于H2O分子中H—O—H的键角
D. NH3和H2O与Cu2+的配位能力:NH3>H2O
3 [2024南京外国语、金陵中学、海安中学联考T3]实验室制取乙烯并验证其化学性质。下列装置不正确的是( )
A. 制备乙烯 B. 除去杂质 C. 验证加成反应 D. 收集乙烯
4 [2024南京二模T4]丁二酮肟与Ni2+反应生成鲜红色的二丁二酮肟合镍沉淀,其结构如图所示。该反应可鉴定Ni2+的存在。下列说法不正确的是( )
A. 沸点:CH4
阅读下列材料,完成5~7题:
氧、硫及其化合物应用广泛。O2可用作燃料电池的氧化剂。单质硫有多种同素异形体,其中S8在液态SO2中被AsF5氧化成S,化学方程式为S8+3AsF5S8(AsF6)2+AsF3。氧能形成H2O、H2O2、Na2O2、SO2、V2O5等重要氧化物。SO2是一种重要的工业原料,可通过煅烧黄铁矿或加热无水硫酸钙、焦炭及二氧化硅的混合物(CaSO4+C+SiO2SO2↑+CO↑+CaSiO3)等方法来制取。SO2在V2O5催化作用下与O2反应生成SO3。
5 [2024南通、泰州等八市三调T6]下列说法正确的是( )
A. O、O、O互为同素异形体
B. SO2的中心原子杂化轨道类型为sp3
C. Na2O2晶体中阴、阳离子数目之比为1∶2
D. 1 mol SiO2晶体中含有2 mol Si—O σ键
6 [2024南通、泰州等八市三调T7]下列关于反应2SO2(g)+O2(g)2SO3(g) ΔH<0 的说法正确的是( )
A. 基态V原子核外电子排布为3d34s2
B. 反应达到平衡状态时,v逆(SO3)=2v正(O2)
C. 使用V2O5的目的是增大SO2的平衡转化率
D. 其他条件相同,增大压强,平衡常数增大
7 [2024南通、泰州等八市三调T8]下列关于化学反应的表示或说法正确的是( )
A. 碱性氢氧燃料电池的正极反应:O2+4e-+4H+===2H2O
B. Na2O2与SO2反应:2Na2O2+2SO2===2Na2SO4+O2
C. S8与AsF5反应中,n(氧化剂)∶n(还原剂)=3∶1
D. 温度越高,ΔS越大,硫酸钙制取SO2的反应正向进行程度越大
8 [2025淮安期初T8]在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. N2(g)NH3(g)NaHCO3(s)
B. S(s)SO2(g)H2SO4(aq)
C. NaCl(aq)Cl2(g)FeCl2(s)
D. SiO2(s)H2SiO3(s)Na2SiO3(aq)
9 [2025镇江期初T8]我国科学家研究发现一种电化学“大气固碳”有效方法的原理如图所示。充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化。下列有关说法正确的是( )
A. 放电时,电极B发生氧化反应
B. 该电池可选用Li2SO4水溶液作离子导体
C. 充电时,Li+从电极B移向电极A
D. 放电时,每消耗1 mol CO2转移电子数4×6.02×1023
10 [2025扬州中学月考T8]由化合物X、Y为起始原料可合成药物Z。下列说法正确的是( )
A. X分子中所有碳原子可处于同一平面
B. X、Z分子中均含有2个手性碳原子
C. 1 mol Z最多只能与2 mol Br2发生反应
D. X、Y、Z均可与Na2CO3溶液发生反应
11 [2024泰州中学模拟T11]探究卤族元素单质及其化合物的性质,下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A I2在饱和KI溶液与CCl4中的溶解能力大小 向I2的CCl4溶液中加入等体积饱和KI溶液,振荡
B Cl与C的非金属性强弱 将稀盐酸滴入NaHCO3溶液中,将产生的气体通入澄清石灰水中
C AgCl与AgI溶度积大小 向2 mL 0.1 mol/L AgNO3溶液中先滴加4滴0.1 mol/L KCl溶液,再滴加4滴0.1 mol/L KI溶液
D NH4Cl能否水解 向NH4Cl溶液中滴入几滴酚酞
12 [2024如皋适应性考试一T12]室温下,用含少量ZnSO4杂质的1 mol/L MnSO4 溶液制备MnCO3的过程如下图所示。下列说法正确的是( )
已知:Ksp(MnS)=2×10-10、Ksp(ZnS)=2×10-24、Kb(NH3·H2O)=2×10-5、Ka1(H2CO3)=4×10-7、
Ka2(H2CO3)=5×10-11。
A. “除锌” 后所得上层清液中,c(Zn2+)一定小于1×10-5 mol/L
B. 0.1 mol/L NH4HCO3溶液中存在:c(H+)+c(H2CO3)=c(OH-)+c(CO)
C. 氨水、NH4HCO3溶液中存在:c(NH)<2c(CO)+c(HCO)
D. “沉锰”后的滤液中存在:c(NH)+c(NH3·H2O)=2c(SO )
13 [2024扬州期末T13]为研究反应2NO+O2 2NO2在不同条件下NO的转化率,向恒压反应器中通入含一定浓度NO与O2的气体,在无催化剂和有催化剂存在时,分别测得不同温度下反应器出口处NO的转化率如图中曲线a、b所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A. 反应的ΔH>0
B. 曲线a中NO转化率随温度升高而增大,是由于催化剂的活性增强
C. 曲线b中从M点到N点,NO转化率随温度升高而减小,是由于反应速率减慢
D. 催化剂存在时,其他条件不变,增大气体中c(O2),NO转化率随温度的变化为曲线c
选择题专练(五)
1 D 由于油脂水解可生成甘油,故以油脂为原料适合制取甘油,D符合题意。
2 D NH3的电子式为,A错误; [Cu(NH3)4]2+中存在配位键和极性共价键,不存在离子键,B错误;H2O中O原子有两个孤电子对,NH3分子中N原子有一个孤电子对,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致NH3分子中H—N—H键角比H2O分子中H—O—H键角大,C错误;N的电负性小于O,NH3中N原子上的孤电子对更容易贡献出来,NH3的配位能力强于H2O,结合实验,硫酸铜溶液中加入过量氨水后生成了[Cu(NH3)4]2+,也能说明NH3和H2O与Cu2+的配位能力:NH3>H2O,D正确。
3 D 空气的平均相对分子质量为29,乙烯的相对分子质量为28,二者的相对分子质量比较接近,不宜用排空气法收集,可改用排水法收集,D错误。
4 C NH3、H2O都能形成分子间氢键,常温下水呈液态,故沸点CH4<NH3<H2O,A正确;同周期主族元素从左到右,原子半径依次减小,半径r(O)<r(N)<r(C),B正确;ⅡA、ⅤA族元素原子的第一电离能比同周期左右相邻元素原子的第一电离能都大,第一电离能O<N,C错误;配合物二丁二酮肟合镍中,Ni2+为中心离子,提供空轨道,N原子为配位原子,提供孤电子对,D正确。
5 C 同素异形体的研究对象是同种元素组成的不同单质,同种元素的不同原子互为同位素,故O、O、O互为同位素,A错误;SO2的中心原子S采取sp2杂化,B错误;Na2O2由Na+和O构成,阴、阳离子数目之比为1∶2,C正确;SiO2晶体中,每个Si原子连接4个O原子,每个O原子连接2个Si原子,根据均摊法知,1 mol SiO2中含有4 mol Si—O σ键,D错误。
6 B 基态V原子核外电子排布式为[Ar]3d34s2,A错误;V2O5是该反应的催化剂,可加快反应速率,但不能增大SO2的平衡转化率,C错误;温度不变,平衡常数不变,故增大压强,平衡常数不变,D错误。
7 D 碱性条件下,没有外加H+参与反应时,正极反应式中不能出现H+,A错误;O原子不守恒,且反应中无O2生成,B错误;反应S8+3AsF5S8(AsF6)2+AsF3中,S8在液态SO2中被AsF5氧化成S,S8为还原剂,AsF5为氧化剂,只有的AsF5发生还原反应,故n(氧化剂)∶n(还原剂)=1∶1,C错误;CaSO4+C+SiO2SO2↑+CO↑+CaSiO3为熵增反应,且在高温下才能发生,说明反应的ΔH>0,故温度越高,CaSO4制取SO2的反应正向进行程度越大,D正确。
8 A SO2气体与水反应只能生成H2SO3(aq),不能生成H2SO4(aq),B错误;Cl2与Fe反应生成FeCl3,C错误;SiO2(s)难溶于水,与水不发生化学反应,不能生成H2SiO3,D错误。
9 C 放电时,A为负极,电极反应为Li-e-===Li+,B为正极,电极反应为3CO2+4e-+4Li+===2Li2CO3+C,充电时,A为阴极,电极反应式为Li++e-===Li,B为阳极,电极反应为2Li2CO3+C-4e-===3CO2↑+4Li+或2CO-4e-===2CO2↑+O2↑。放电时,B为正极,发生还原反应,A错误;放电时,电极A为负极,电极材料为Li,会与水反应,因此该电池只可选用无水电解液,B错误;充电时,阳离子移向阴极,则Li+的移动方向是从电极B移向电极A,C正确;放电时,根据电极反应3CO2+4e-+4Li+===2Li2CO3+C,每消耗1 mol CO2转移电子数×6.02×1023,D错误。
10 B X分子中的环不是苯环,根据甲烷的正四面体结构知,X分子中所有碳原子不可能处于同一平面,A错误;X()、Z()分子中均含有2个手性碳原子,B正确;1 mol Z()最多能与3 mol Br2发生反应,C错误;X分子中只含有碳碳双键和醇羟基两种官能团,不能与Na2CO3溶液发生反应,D错误。
11 A 比较最高价氧化物的水化物的酸性,可以得出非金属性强弱,即应比较HClO4与H2CO3的酸性,B错误;Ag+过量,无法比较AgCl和AgI的溶度积大小,C错误;NH4Cl若水解,则溶液呈酸性,用酚酞无法判断,D错误。
12 A “除锌”反应为Zn2++MnS Mn2++ZnS,K====1014>105,说明该反应比较彻底,留在溶液中的c(Zn2+)<10-5mol/L,A正确;NH4HCO3溶液中的质子守恒式为c(H+)+c(H2CO3)=c(OH-)+c(CO)+c(NH3·H2O),B错误;氨水、NH4HCO3溶液中的电荷守恒式为 c(NH)+c(H+)=2c(CO)+c(HCO )+c(OH-),由Kb(NH3·H2O)=2×10-5,Ka2(H2CO3)=5×10-11知,HCO的水解程度大于NH 的水解程度,NH4HCO3溶液显碱性,则氨水、NH4HCO3溶液显碱性,c(H+)
同课章节目录
