小卷抢分 选择题专练(一) (含解析)-2025高考化学二轮复习 抢分练
文档属性
| 名称 | 小卷抢分 选择题专练(一) (含解析)-2025高考化学二轮复习 抢分练 |
|
|
| 格式 | doc | ||
| 文件大小 | 400.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-15 00:00:00 | ||
图片预览


文档简介
抢分练 小卷抢分
选择题专练(一)
1 [2024南京外国语、金陵中学、海安中学联考T1]天宫空间站是我国建成的国家级太空实验室。下列有关天宫空间站的说法不正确的是( )
A. 太阳能电池中的单晶硅属于半导体材料
B. 外表面的碳化硅陶瓷属于硅酸盐材料
C. 外层的热控保温材料石墨烯属于无机非金属材料
D. 外壳的涂层材料之一酚醛树脂属于有机高分子材料
2 [2024南京、盐城期末T2]工业合成尿素的反应原理为CO2+2NH3CO(NH2)2+H2O。下列说法正确的是( )
A. 氧原子(8O)基态核外电子排布式为1s22s22p4
B. NH3的电子式为
C. CO(NH2)2中N元素的化合价为+3
D. H2O的空间结构为直线形
3 [2024扬州考前模拟T3]实验室制取少量C2H4的原理及装置均正确的是( )
A. 制取C2H4 B. 干燥C2H4 C. 收集C2H4 D. 吸收C2H4
4 [2024苏州期末T4]太阳能电池可由Si、GaP、GaAs等半导体材料构成。有关元素在元素周期表中的位置如图所示,下列说法正确的是( )
A. 原子半径:r(Ga)B. 第一电离能:I1(Si)C. 热稳定性:AsH3>PH3
D. Ga的周期序数与族序数相等
阅读下列资料,完成5~7题:
铁及其化合物用途广泛。日常生活用品和生命体中,有许多含有铁元素的物质。家用铁锅中含有铁和碳;补血剂中含有FeCO3,血红蛋白的活性物质血红素(结构简式如图)中含有铁元素;激光打印机中含有四氧化三铁;由铁及其化合物可制得FeSO4·7H2O、Fe3O4、FeCl3、K2FeO4等化工产品。
5 [2025海安中学、淮阴中学联考T5]下列关于铁及其化合物的说法正确的是( )
A. 家用铁锅的熔点高于铁单质的熔点
B. 向碳酸钠溶液中滴加FeSO4溶液可制得纯净的FeCO3
C. Fe3O4是由FeO与Fe2O3混合组成
D. 血红素分子中由N原子提供孤电子对形成4个配位键
6 [2025海安中学、淮阴中学联考T6]利用废旧镀锌铁皮制备Fe3O4胶体粒子的流程如图。已知:Zn溶于强碱时生成 [Zn(OH)4]2-。下列有关说法正确的是( )
A. “碱洗”的离子方程式:Zn+4OH- === [Zn(OH)4]2-
B. “酸溶”的离子方程式:Fe(OH)3+3H+===Fe3++3H2O
C. “氧化”后溶液中含有的主要离子:H+、Fe3+、SO
D. N2的作用是防止O2氧化Fe2+而降低Fe3O4产率
7 [2025海安中学、淮阴中学联考T7]下列关于铁及其化合物的性质与用途不具有对应关系的是( )
A. FeCl3溶液呈酸性,可用于蚀刻电路板
B. K2FeO4具有强氧化性,可用于水的消毒
C. 常温下,铁遇浓硝酸发生钝化,可用铁制容器贮运浓硝酸
D. FeSO4·7H2O具有还原性,可用作食品包装中的抗氧化剂
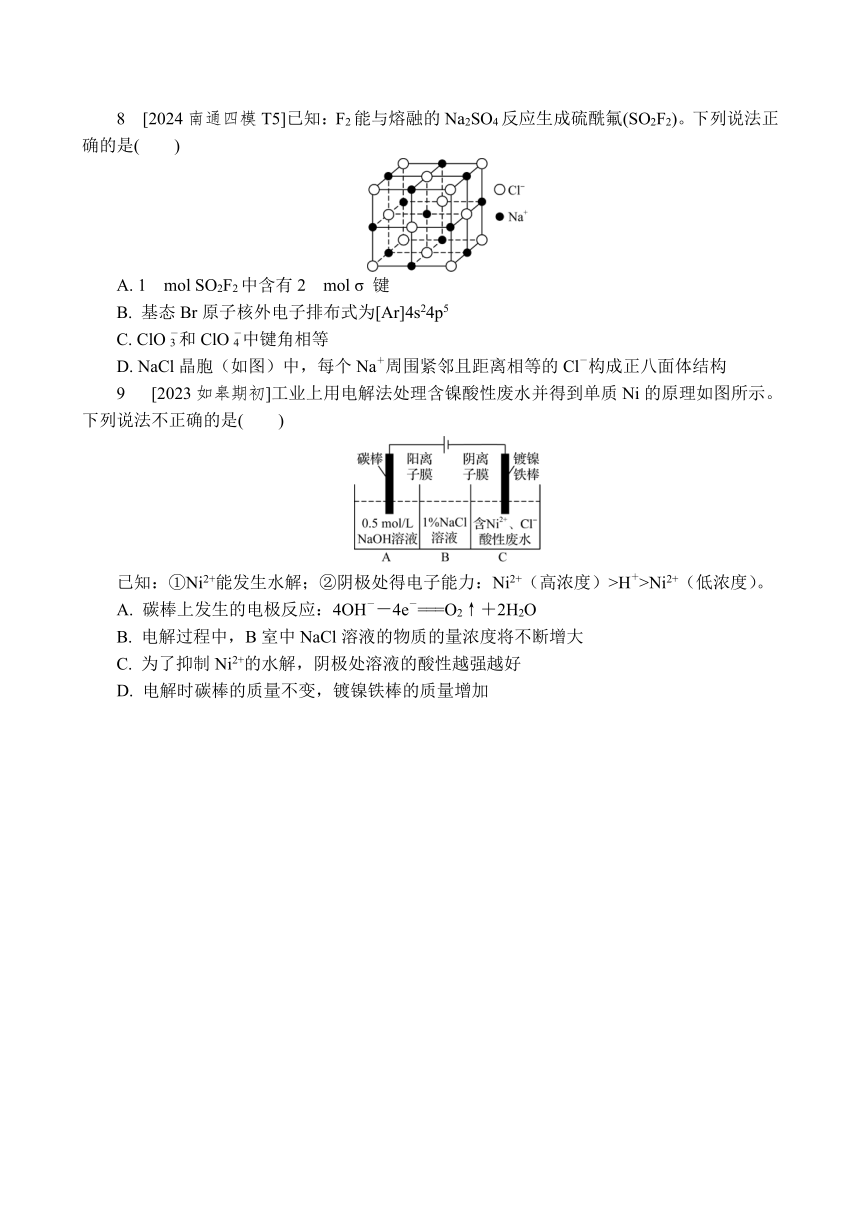
8 [2024南通四模T5]已知:F2能与熔融的Na2SO4反应生成硫酰氟(SO2F2)。下列说法正确的是( )
A. 1 mol SO2F2中含有2 mol σ 键
B. 基态Br原子核外电子排布式为[Ar]4s24p5
C. ClO和ClO中键角相等
D. NaCl晶胞(如图)中,每个Na+周围紧邻且距离相等的Cl-构成正八面体结构
9 [2023如皋期初]工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是( )
已知:①Ni2+能发生水解;②阴极处得电子能力:Ni2+(高浓度)>H+>Ni2+(低浓度)。
A. 碳棒上发生的电极反应:4OH--4e-===O2↑+2H2O
B. 电解过程中,B室中NaCl溶液的物质的量浓度将不断增大
C. 为了抑制Ni2+的水解,阴极处溶液的酸性越强越好
D. 电解时碳棒的质量不变,镀镍铁棒的质量增加
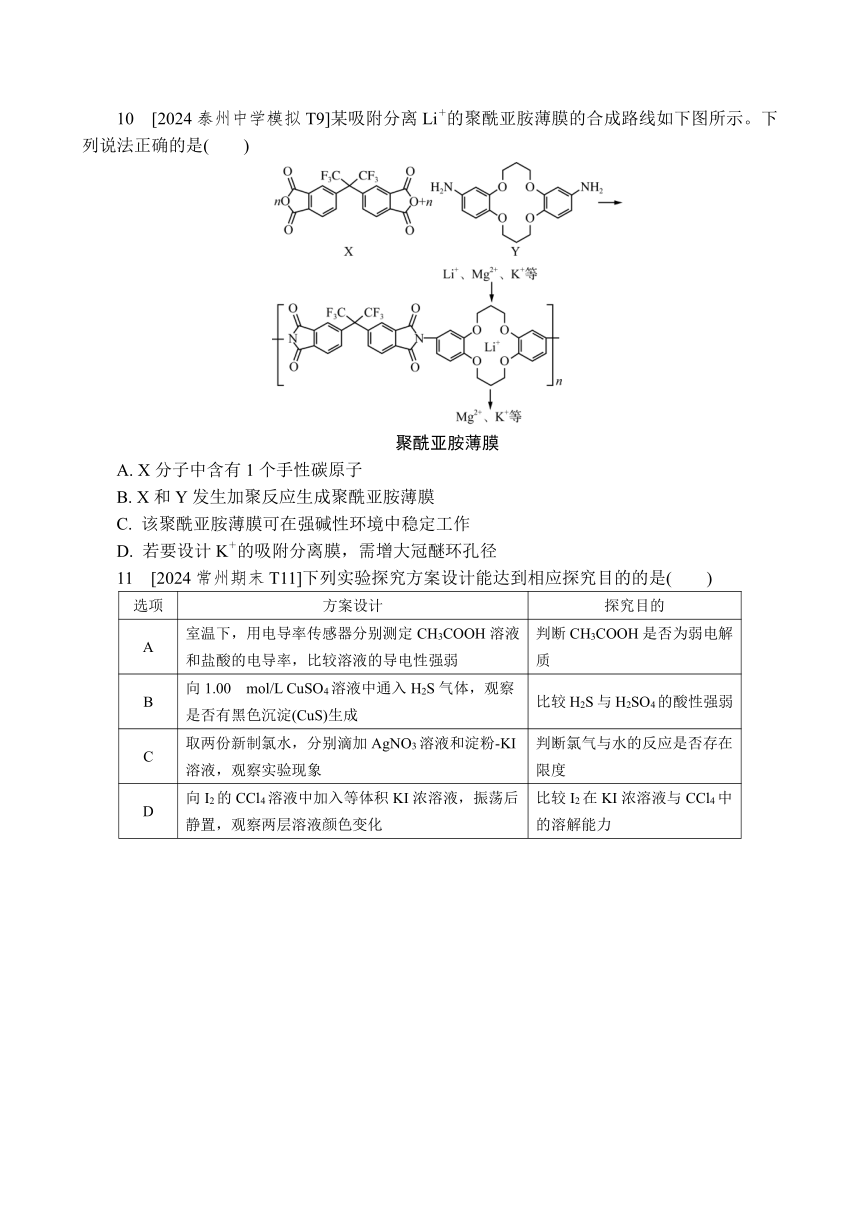
10 [2024泰州中学模拟T9]某吸附分离Li+的聚酰亚胺薄膜的合成路线如下图所示。下列说法正确的是( )
聚酰亚胺薄膜
A. X分子中含有1个手性碳原子
B. X和Y发生加聚反应生成聚酰亚胺薄膜
C. 该聚酰亚胺薄膜可在强碱性环境中稳定工作
D. 若要设计K+的吸附分离膜,需增大冠醚环孔径
11 [2024常州期末T11]下列实验探究方案设计能达到相应探究目的的是( )
选项 方案设计 探究目的
A 室温下,用电导率传感器分别测定CH3COOH溶液和盐酸的电导率,比较溶液的导电性强弱 判断CH3COOH是否为弱电解质
B 向1.00 mol/L CuSO4溶液中通入H2S气体,观察是否有黑色沉淀(CuS)生成 比较H2S与H2SO4的酸性强弱
C 取两份新制氯水,分别滴加AgNO3溶液和淀粉 KI溶液,观察实验现象 判断氯气与水的反应是否存在限度
D 向I2的CCl4溶液中加入等体积KI浓溶液,振荡后静置,观察两层溶液颜色变化 比较I2在KI浓溶液与CCl4中的溶解能力
12 [2024连云港调研T12]室温下,用含少量 Co2+和Ni2+的 FeSO4溶液制备FeC2O4·2H2O的过程如下:
已知:Ksp(CoS)=1.8×10-22,Ksp(NiS)=3.0×10-21;
Ka1(H2S)=1.1×10-7,Ka2(H2S)=1.3×10-13。
下列说法正确的是( )
A. 0.01 mol/L Na2S溶液中:c(HS-)>c(S2-)
B. “除钴镍”后得到的上层清液中:c(Ni2+)=1.0×10-6 mol/L,则c(Co2+)为6.0×10-2 mol/L
C. 0.1 mol/L NaHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)+c(C2O)
D. “沉铁”后的滤液中:c(Na+)+c(H+)=c(OH-)+c(HC2O)+2c(C2O)
13 [2024常州学业水平监测T13]二氧化碳催化合成燃料甲醇过程中的主要反应如下:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49.4 kJ/mol
CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41.1 kJ/mol
CO(g)+2H2(g)===CH3OH(g) ΔH=-90.5 kJ/mol
将一定比例CO2和H2的混合气体以一定流速通过装有催化剂的反应管,CO2的转化率、CH3OH的选择性与温度的关系如图所示。下列说法不正确的是( )
A. CH3OH的平衡选择性随温度的升高而减小
B. 其他条件不变,在210~290 ℃范围,随温度的升高,出口处CH3OH的量不断减小
C. 该条件下CO2催化合成CH3OH的最佳反应温度应控制在240~250 ℃
D. 为提高CH3OH产率,需研发低温下CO2转化率高和CH3OH选择性高的催化剂
选择题专练(一)
1 B 碳化硅(SiC)陶瓷属于新型无机非金属材料,B错误。
2 A NH3的电子式为,B错误;氨基是NH3的H被取代的产物,其中N元素保持-3价,C错误;H2O的空间结构为V形,D错误。
3 B 乙醇在浓硫酸催化、170 ℃下脱水生成乙烯,A错误;C2H4不与碱石灰反应,可以用碱石灰干燥C2H4,B正确;C2H4的密度与空气接近,不宜用排空法收集(收集到C2H4不纯),C错误;C2H4不溶于水,不能用水吸收,D错误。
4 B 原子半径r(Ga)>r(As),A错误;同周期主族元素从左到右,元素的第一电离能总体呈增大趋势,但ⅡA、ⅤA族元素的第一电离能反常地大,故第一电离能I1(Si)5 D 铁锅的材质是合金,合金的熔点低于成分金属,A错误;Na2CO3溶液的碱性较强,将FeSO4溶液滴入碳酸钠溶液中,除生成FeCO3外,还可生成Fe(OH)2,B错误;Fe3O4是纯净物,C错误。
6 D “碱洗”时,Zn和OH-反应生成[Zn(OH)4] 2-和H2:Zn+2H2O+2OH-===[Zn(OH)4] 2-+H2↑,A错误;“酸溶”时Fe与稀硫酸发生反应,B错误;由于最终生成Fe3O4,故加适量H2O2,溶液中有Fe3+和Fe2+,又由于稀硫酸过量,故“氧化”后溶液中含有的主要离子有Fe3+、Fe2+、H+、SO,C错误;向溶液中通入气体可起到搅拌作用,不通空气,改通N2,目的是防止空气中的O2氧化Fe2+而降低Fe3O4产率,D正确。
7 A FeCl3溶液蚀刻电路板的反应为2Fe3++Cu===2Fe2++Cu2+,FeCl3表现氧化性,A错误。
8 D SO2F2的结构式可表示为或,故SO2F2分子中含有4个σ 键,A错误;基态溴原子核外电子排布式为[Ar]3d104s24p5,B错误;ClO和ClO中的Cl原子均为sp3杂化,前者有1个孤电子对,孤电子对对成键电子对的斥力大于成键电子对之间的斥力,所以前者键角较小,C错误;NaCl晶胞中,每个Na+周围紧邻且距离相等的Cl-有6个(上下、左右、前后),构成正八面体,D正确。
9 C 碳棒与电源正极相连,为阳极,电极反应式为4OH--4e-===O2↑+2H2O,A正确;电解过程中阳极室中的Na+穿过阳离子膜移向B室,阴极室中Ni2+放电,Cl-穿过阴离子膜移向B室,故B室中NaCl溶液的浓度增大,B正确;阴极室主要目的是处理Ni2+,即Ni2++2e-===Ni,为了抑制Ni2+的水解,通常加入适量盐酸,若过多增加盐酸,导致H+浓度大于Ni2+浓度,则H+会优先放电,C错误;电解时阳极碳棒的质量不变,镀镍铁棒上析出固体Ni,质量增加,D正确。
10 D X分子中无手性碳原子,A错误;生成聚酰亚胺薄膜过程中有小分子水生成,为缩聚反应,B错误;该聚酰亚胺薄膜中有酰胺基,在强碱性条件下水解,不能稳定工作,C错误。
11 D 两种酸的浓度未知,故无法依据导电性强弱判断CH3COOH是否为弱电解质,A错误;该反应之所以能发生,是因为CuS难溶于H2SO4,不是因为强酸制弱酸,故无法比较H2S与H2SO4的酸性强弱,B错误;HClO也能将KI氧化为I2,不能说明新制氯水中一定含有Cl2,无法判断Cl2与水的反应是否存在限度,C错误。
12 A Kh(S2-)==≈7.7×10-2,Kh(HS-)==≈9.1×10-8,0.01 mol/L Na2S溶液中,以S2-的第一步水解为主,设发生水解的S2-为x mol/L,
S2-+H2O HS-+OH-
c(初始)/(mol/L) 0.01 0 0
c(转化)/(mol/L) x x x
c(平衡)/(mol/L) 0.01-x x x
则Kh(S2-)=≈7.7×10-2,解得x=0.008 9 mol/L>(0.01-0.008 9) mol/L,故c(HS-)>c(S2-),A正确;=,则c(Co2+)=×c(Ni2+)==6.0×10-8(mol/L),B错误;NaHC2O4溶液中的质子守恒式为c(OH-)+c(C2O)=c(H+)+c(H2C2O4),C错误; “沉铁”后的滤液中还含有硫酸盐和硫化物,电荷守恒式中离子种类不全,D错误。
13 B 生成CH3OH的两个反应都是放热反应,升高温度,平衡逆向移动,故CH3OH的平衡选择性随温度的升高而减小,A正确;其他条件不变,由图可知,在230~240 ℃范围,CH3OH选择性基本不变,但CO2转化率上升幅度较大,该温度范围内,出口处CH3OH的量随温度升高而增大,故在210~290 ℃范围,随温度的升高,出口处CH3OH的量并不是一直不断减小,B错误;由图可知,240~250 ℃时,CO2的转化率和甲醇的选择性都比较大,C正确;合成甲醇的反应为放热反应,降低温度,平衡正向移动,但温度低时,反应速率较慢,故应研发低温下CO2转化率高和CH3OH选择性高的催化剂,D正确。
选择题专练(一)
1 [2024南京外国语、金陵中学、海安中学联考T1]天宫空间站是我国建成的国家级太空实验室。下列有关天宫空间站的说法不正确的是( )
A. 太阳能电池中的单晶硅属于半导体材料
B. 外表面的碳化硅陶瓷属于硅酸盐材料
C. 外层的热控保温材料石墨烯属于无机非金属材料
D. 外壳的涂层材料之一酚醛树脂属于有机高分子材料
2 [2024南京、盐城期末T2]工业合成尿素的反应原理为CO2+2NH3CO(NH2)2+H2O。下列说法正确的是( )
A. 氧原子(8O)基态核外电子排布式为1s22s22p4
B. NH3的电子式为
C. CO(NH2)2中N元素的化合价为+3
D. H2O的空间结构为直线形
3 [2024扬州考前模拟T3]实验室制取少量C2H4的原理及装置均正确的是( )
A. 制取C2H4 B. 干燥C2H4 C. 收集C2H4 D. 吸收C2H4
4 [2024苏州期末T4]太阳能电池可由Si、GaP、GaAs等半导体材料构成。有关元素在元素周期表中的位置如图所示,下列说法正确的是( )
A. 原子半径:r(Ga)
D. Ga的周期序数与族序数相等
阅读下列资料,完成5~7题:
铁及其化合物用途广泛。日常生活用品和生命体中,有许多含有铁元素的物质。家用铁锅中含有铁和碳;补血剂中含有FeCO3,血红蛋白的活性物质血红素(结构简式如图)中含有铁元素;激光打印机中含有四氧化三铁;由铁及其化合物可制得FeSO4·7H2O、Fe3O4、FeCl3、K2FeO4等化工产品。
5 [2025海安中学、淮阴中学联考T5]下列关于铁及其化合物的说法正确的是( )
A. 家用铁锅的熔点高于铁单质的熔点
B. 向碳酸钠溶液中滴加FeSO4溶液可制得纯净的FeCO3
C. Fe3O4是由FeO与Fe2O3混合组成
D. 血红素分子中由N原子提供孤电子对形成4个配位键
6 [2025海安中学、淮阴中学联考T6]利用废旧镀锌铁皮制备Fe3O4胶体粒子的流程如图。已知:Zn溶于强碱时生成 [Zn(OH)4]2-。下列有关说法正确的是( )
A. “碱洗”的离子方程式:Zn+4OH- === [Zn(OH)4]2-
B. “酸溶”的离子方程式:Fe(OH)3+3H+===Fe3++3H2O
C. “氧化”后溶液中含有的主要离子:H+、Fe3+、SO
D. N2的作用是防止O2氧化Fe2+而降低Fe3O4产率
7 [2025海安中学、淮阴中学联考T7]下列关于铁及其化合物的性质与用途不具有对应关系的是( )
A. FeCl3溶液呈酸性,可用于蚀刻电路板
B. K2FeO4具有强氧化性,可用于水的消毒
C. 常温下,铁遇浓硝酸发生钝化,可用铁制容器贮运浓硝酸
D. FeSO4·7H2O具有还原性,可用作食品包装中的抗氧化剂
8 [2024南通四模T5]已知:F2能与熔融的Na2SO4反应生成硫酰氟(SO2F2)。下列说法正确的是( )
A. 1 mol SO2F2中含有2 mol σ 键
B. 基态Br原子核外电子排布式为[Ar]4s24p5
C. ClO和ClO中键角相等
D. NaCl晶胞(如图)中,每个Na+周围紧邻且距离相等的Cl-构成正八面体结构
9 [2023如皋期初]工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是( )
已知:①Ni2+能发生水解;②阴极处得电子能力:Ni2+(高浓度)>H+>Ni2+(低浓度)。
A. 碳棒上发生的电极反应:4OH--4e-===O2↑+2H2O
B. 电解过程中,B室中NaCl溶液的物质的量浓度将不断增大
C. 为了抑制Ni2+的水解,阴极处溶液的酸性越强越好
D. 电解时碳棒的质量不变,镀镍铁棒的质量增加
10 [2024泰州中学模拟T9]某吸附分离Li+的聚酰亚胺薄膜的合成路线如下图所示。下列说法正确的是( )
聚酰亚胺薄膜
A. X分子中含有1个手性碳原子
B. X和Y发生加聚反应生成聚酰亚胺薄膜
C. 该聚酰亚胺薄膜可在强碱性环境中稳定工作
D. 若要设计K+的吸附分离膜,需增大冠醚环孔径
11 [2024常州期末T11]下列实验探究方案设计能达到相应探究目的的是( )
选项 方案设计 探究目的
A 室温下,用电导率传感器分别测定CH3COOH溶液和盐酸的电导率,比较溶液的导电性强弱 判断CH3COOH是否为弱电解质
B 向1.00 mol/L CuSO4溶液中通入H2S气体,观察是否有黑色沉淀(CuS)生成 比较H2S与H2SO4的酸性强弱
C 取两份新制氯水,分别滴加AgNO3溶液和淀粉 KI溶液,观察实验现象 判断氯气与水的反应是否存在限度
D 向I2的CCl4溶液中加入等体积KI浓溶液,振荡后静置,观察两层溶液颜色变化 比较I2在KI浓溶液与CCl4中的溶解能力
12 [2024连云港调研T12]室温下,用含少量 Co2+和Ni2+的 FeSO4溶液制备FeC2O4·2H2O的过程如下:
已知:Ksp(CoS)=1.8×10-22,Ksp(NiS)=3.0×10-21;
Ka1(H2S)=1.1×10-7,Ka2(H2S)=1.3×10-13。
下列说法正确的是( )
A. 0.01 mol/L Na2S溶液中:c(HS-)>c(S2-)
B. “除钴镍”后得到的上层清液中:c(Ni2+)=1.0×10-6 mol/L,则c(Co2+)为6.0×10-2 mol/L
C. 0.1 mol/L NaHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)+c(C2O)
D. “沉铁”后的滤液中:c(Na+)+c(H+)=c(OH-)+c(HC2O)+2c(C2O)
13 [2024常州学业水平监测T13]二氧化碳催化合成燃料甲醇过程中的主要反应如下:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-49.4 kJ/mol
CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41.1 kJ/mol
CO(g)+2H2(g)===CH3OH(g) ΔH=-90.5 kJ/mol
将一定比例CO2和H2的混合气体以一定流速通过装有催化剂的反应管,CO2的转化率、CH3OH的选择性与温度的关系如图所示。下列说法不正确的是( )
A. CH3OH的平衡选择性随温度的升高而减小
B. 其他条件不变,在210~290 ℃范围,随温度的升高,出口处CH3OH的量不断减小
C. 该条件下CO2催化合成CH3OH的最佳反应温度应控制在240~250 ℃
D. 为提高CH3OH产率,需研发低温下CO2转化率高和CH3OH选择性高的催化剂
选择题专练(一)
1 B 碳化硅(SiC)陶瓷属于新型无机非金属材料,B错误。
2 A NH3的电子式为,B错误;氨基是NH3的H被取代的产物,其中N元素保持-3价,C错误;H2O的空间结构为V形,D错误。
3 B 乙醇在浓硫酸催化、170 ℃下脱水生成乙烯,A错误;C2H4不与碱石灰反应,可以用碱石灰干燥C2H4,B正确;C2H4的密度与空气接近,不宜用排空法收集(收集到C2H4不纯),C错误;C2H4不溶于水,不能用水吸收,D错误。
4 B 原子半径r(Ga)>r(As),A错误;同周期主族元素从左到右,元素的第一电离能总体呈增大趋势,但ⅡA、ⅤA族元素的第一电离能反常地大,故第一电离能I1(Si)
6 D “碱洗”时,Zn和OH-反应生成[Zn(OH)4] 2-和H2:Zn+2H2O+2OH-===[Zn(OH)4] 2-+H2↑,A错误;“酸溶”时Fe与稀硫酸发生反应,B错误;由于最终生成Fe3O4,故加适量H2O2,溶液中有Fe3+和Fe2+,又由于稀硫酸过量,故“氧化”后溶液中含有的主要离子有Fe3+、Fe2+、H+、SO,C错误;向溶液中通入气体可起到搅拌作用,不通空气,改通N2,目的是防止空气中的O2氧化Fe2+而降低Fe3O4产率,D正确。
7 A FeCl3溶液蚀刻电路板的反应为2Fe3++Cu===2Fe2++Cu2+,FeCl3表现氧化性,A错误。
8 D SO2F2的结构式可表示为或,故SO2F2分子中含有4个σ 键,A错误;基态溴原子核外电子排布式为[Ar]3d104s24p5,B错误;ClO和ClO中的Cl原子均为sp3杂化,前者有1个孤电子对,孤电子对对成键电子对的斥力大于成键电子对之间的斥力,所以前者键角较小,C错误;NaCl晶胞中,每个Na+周围紧邻且距离相等的Cl-有6个(上下、左右、前后),构成正八面体,D正确。
9 C 碳棒与电源正极相连,为阳极,电极反应式为4OH--4e-===O2↑+2H2O,A正确;电解过程中阳极室中的Na+穿过阳离子膜移向B室,阴极室中Ni2+放电,Cl-穿过阴离子膜移向B室,故B室中NaCl溶液的浓度增大,B正确;阴极室主要目的是处理Ni2+,即Ni2++2e-===Ni,为了抑制Ni2+的水解,通常加入适量盐酸,若过多增加盐酸,导致H+浓度大于Ni2+浓度,则H+会优先放电,C错误;电解时阳极碳棒的质量不变,镀镍铁棒上析出固体Ni,质量增加,D正确。
10 D X分子中无手性碳原子,A错误;生成聚酰亚胺薄膜过程中有小分子水生成,为缩聚反应,B错误;该聚酰亚胺薄膜中有酰胺基,在强碱性条件下水解,不能稳定工作,C错误。
11 D 两种酸的浓度未知,故无法依据导电性强弱判断CH3COOH是否为弱电解质,A错误;该反应之所以能发生,是因为CuS难溶于H2SO4,不是因为强酸制弱酸,故无法比较H2S与H2SO4的酸性强弱,B错误;HClO也能将KI氧化为I2,不能说明新制氯水中一定含有Cl2,无法判断Cl2与水的反应是否存在限度,C错误。
12 A Kh(S2-)==≈7.7×10-2,Kh(HS-)==≈9.1×10-8,0.01 mol/L Na2S溶液中,以S2-的第一步水解为主,设发生水解的S2-为x mol/L,
S2-+H2O HS-+OH-
c(初始)/(mol/L) 0.01 0 0
c(转化)/(mol/L) x x x
c(平衡)/(mol/L) 0.01-x x x
则Kh(S2-)=≈7.7×10-2,解得x=0.008 9 mol/L>(0.01-0.008 9) mol/L,故c(HS-)>c(S2-),A正确;=,则c(Co2+)=×c(Ni2+)==6.0×10-8(mol/L),B错误;NaHC2O4溶液中的质子守恒式为c(OH-)+c(C2O)=c(H+)+c(H2C2O4),C错误; “沉铁”后的滤液中还含有硫酸盐和硫化物,电荷守恒式中离子种类不全,D错误。
13 B 生成CH3OH的两个反应都是放热反应,升高温度,平衡逆向移动,故CH3OH的平衡选择性随温度的升高而减小,A正确;其他条件不变,由图可知,在230~240 ℃范围,CH3OH选择性基本不变,但CO2转化率上升幅度较大,该温度范围内,出口处CH3OH的量随温度升高而增大,故在210~290 ℃范围,随温度的升高,出口处CH3OH的量并不是一直不断减小,B错误;由图可知,240~250 ℃时,CO2的转化率和甲醇的选择性都比较大,C正确;合成甲醇的反应为放热反应,降低温度,平衡正向移动,但温度低时,反应速率较慢,故应研发低温下CO2转化率高和CH3OH选择性高的催化剂,D正确。
同课章节目录
