小卷抢分 选择题专练(六)(含解析)2024-2025学年高考化学二轮复习 抢分练
文档属性
| 名称 | 小卷抢分 选择题专练(六)(含解析)2024-2025学年高考化学二轮复习 抢分练 |  | |
| 格式 | doc | ||
| 文件大小 | 333.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-15 20:10:59 | ||
图片预览


文档简介
选择题专练(六)
1 [2024盐城期中T1]水是生命之源,寻找火星水冰是“祝融”号火星车的任务之一。下列关于水的说法正确的是( )
A. 属于两性氧化物
B. 既有氧化性又有还原性
C. 与H2O2互为同素异形体
D. 不属于电解质
2 [2025镇江期初T2]反应2K4[Fe(CN)6]+Cl2===2K3[Fe(CN)6]+2KCl可制备媒染剂铁氰化钾。下列说法正确的是( )
A. CN-的电子式为[C N]-
B. K4[Fe(CN)6]中铁元素化合价为+3
C. Cl-的结构示意图为
D. K3[Fe(CN)6]中既含离子键又含非极性共价键
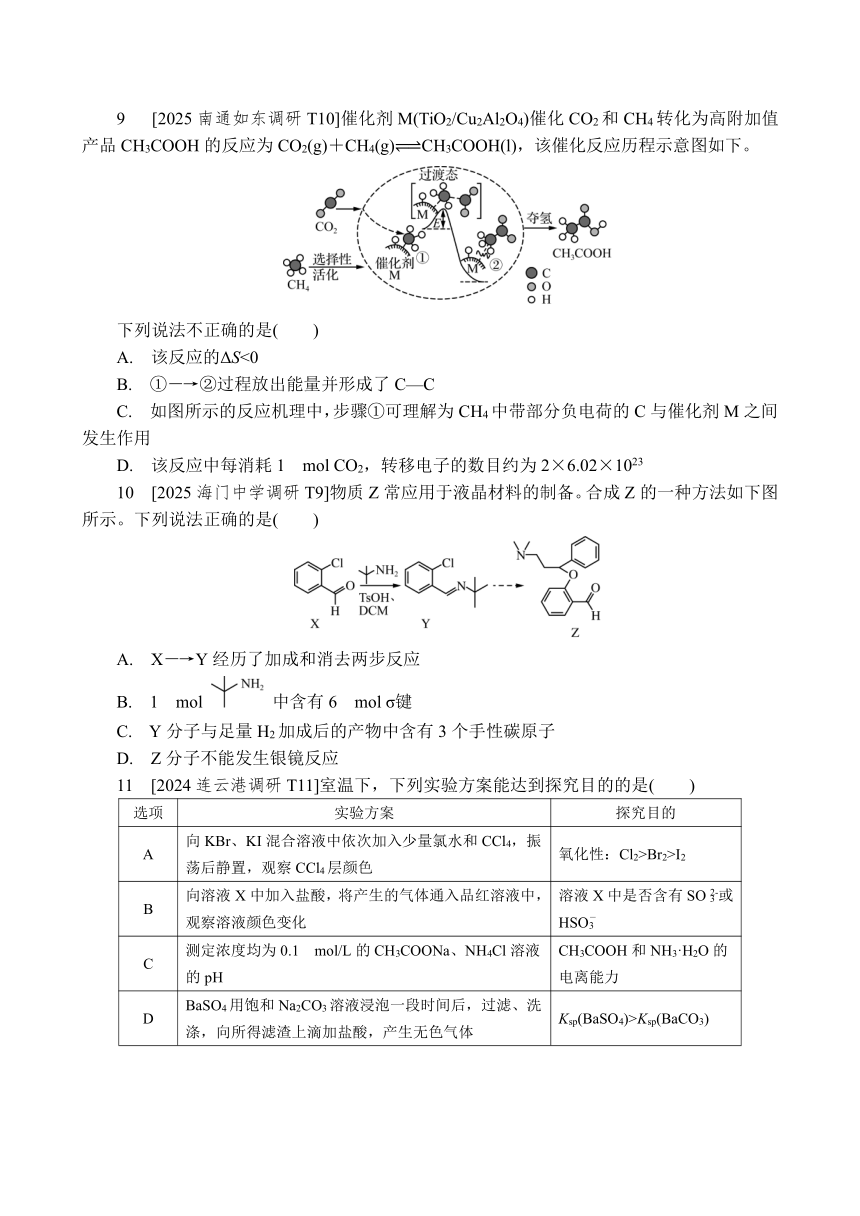
3 [2024海安中学期初T3]以菱镁矿(主要成分是MgCO3,含少量FeCO3)为原料制取高纯氧化镁需要经历酸浸、调pH、过滤、灼烧等操作。下列实验装置和原理能达到实验目的的是( )
甲 乙 丙 丁
A. 用装置甲配制稀硫酸
B. 用装置乙测溶液的pH
C. 用装置丙过滤悬浊液
D. 用装置丁灼烧Mg(OH)2固体
4 [2024常州期中T5]铁系超导材料Fe Sm As F O中基态Sm原子的价电子排布为4f26s2。下列说法正确的是( )
A. Sm位于元素周期表中的f区
B. Fe成为阳离子时先失去3d轨道电子
C. 氢化物的稳定性:AsH3>H2O
D. 电离能:I1(F)阅读下列材料,完成5~7题:
Cu、Ag位于元素周期表ⅠB族。Ag与空气中微量H2S接触发生反应生成黑色Ag2S。Cu可以形成CuCl2、CuSO4、Cu2O、Cu2S等化合物。有研究表明,无水CuCl2为长链状结构,其片段如图: 。
5 [2024扬州考前模拟T5]下列说法正确的是( )
A. CuCl2属于离子化合物
B. CO的空间结构为三角锥形
C. SO中的键角比SO中的小
D. NO中心原子的轨道杂化类型为sp2
6 [2024扬州考前模拟T6]下列化学反应表示正确的是( )
A. Ag与空气中H2S的反应:4Ag+2H2S+O2===2Ag2S+2H2O
B. 加热CuCl2·2H2O:CuCl2·2H2OCuCl2+2H2O
C. 用惰性电极电解CuSO4溶液的阴极反应:2H2O-4e-===4H++O2↑
D. Cu2S与热的浓硝酸反应:Cu2S+6H++2NO2Cu2++H2S↑+2NO2↑+2H2O
7 [2024扬州考前模拟T7]下列物质结构与性质或物质性质与用途不具有对应关系的是( )
A. H2O中的O存在孤电子对,Cu2+能与H2O形成[Cu(H2O)4]2+
B. H2SO4中H元素呈+1价,浓硫酸具有强氧化性
C. CuSO4具有杀菌能力,可用于游泳池的水处理
D. 无水CuSO4吸水后显现蓝色,可用于检验乙醇所含的微量水分
8 [2024南通、泰州等六市一调T8]氮及其化合物的转化具有重要应用。下列说法不正确的是( )
A. 常温下可以用铁制容器来盛装浓硝酸
B. 工业制硝酸过程中的物质转化:NH3NOHNO3
C. 氮气、铵盐、亚硝酸盐、硝酸盐之间的转化构成了自然界“氮循环”的一部分
D. 实验室用浓氨水、生石灰制备少量氨气:NH3·H2O+CaO===Ca(OH)2+NH3↑
9 [2025南通如东调研T10]催化剂M(TiO2/Cu2Al2O4)催化CO2和CH4转化为高附加值产品CH3COOH的反应为CO2(g)+CH4(g) CH3COOH(l),该催化反应历程示意图如下。
下列说法不正确的是( )
A. 该反应的ΔS<0
B. ①―→②过程放出能量并形成了C—C
C. 如图所示的反应机理中,步骤①可理解为CH4中带部分负电荷的C与催化剂M之间发生作用
D. 该反应中每消耗1 mol CO2,转移电子的数目约为2×6.02×1023
10 [2025海门中学调研T9]物质Z常应用于液晶材料的制备。合成Z的一种方法如下图所示。下列说法正确的是( )
A. X―→Y经历了加成和消去两步反应
B. 1 mol 中含有6 mol σ键
C. Y分子与足量H2加成后的产物中含有3个手性碳原子
D. Z分子不能发生银镜反应
11 [2024连云港调研T11]室温下,下列实验方案能达到探究目的的是( )
选项 实验方案 探究目的
A 向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡后静置,观察CCl4层颜色 氧化性:Cl2>Br2>I2
B 向溶液X中加入盐酸,将产生的气体通入品红溶液中,观察溶液颜色变化 溶液X中是否含有SO或HSO
C 测定浓度均为0.1 mol/L的CH3COONa、NH4Cl溶液的pH CH3COOH和NH3·H2O的电离能力
D BaSO4用饱和Na2CO3溶液浸泡一段时间后,过滤、洗涤,向所得滤渣上滴加盐酸,产生无色气体 Ksp(BaSO4)>Ksp(BaCO3)
12 [2024苏州三模T12]以磷石膏(主要成分CaSO4,杂质SiO2、Al2O3等)和氨水为原料可实现CO2矿物封存同时制备轻质CaCO3,转化部分流程如图。
Ksp(CaSO4)=5.0×10-5,Ksp(CaCO3)=3.0×10-9,
Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.61×10-11。
下列说法正确的是( )
A. 氨水中存在:c(NH)>c(H+)+c(NH3·H2O)
B. “转化”步骤,通入CO2后清液中始终存在: eq \f(c(SO),c(CO))>×104
C. “转化”步骤,若通入CO2至溶液pH为6.5,此时溶液中:c(HCO)>c(CO)
D. “滤液”中存在:c(H+)+2c(Ca2+)=c(OH-)+2c(CO)+c(HCO)+2c(SO)
13 [2024苏锡常镇二调T13]利用H2可实现对石膏中S元素的脱除,涉及的主要反应如下:
①CaSO4(s)+H2(g) CaO(s)+SO2(g)+H2O(g) ΔH1=+261.4 kJ/mol K1
②CaSO4(s)+4H2(g) CaS(s)+4H2O(g) ΔH2=-5.3 kJ/mol K2
在1.0×105 Pa、n始(H2)和n始(CaSO4)均为1 mol时,若仅考虑上述反应,平衡时各固体物质的物质的量随温度的变化关系如图所示。石膏中S元素的脱除效果可用脱硫率[×100%]表示。下列说法不正确的是( )
A. 反应3CaSO4(s)+CaS(s) 4CaO(s)+4SO2(g)的平衡常数K=K·K
B. 图中曲线X表示平衡时CaSO4固体的物质的量随温度的变化
C. 一定温度下,加入NaOH固体或增大体系压强,均可提高平衡时的脱硫率
D. 其他条件不变,1 000 ℃下,n始(H2)<1 mol时,n始(H2)越多,平衡时的脱硫率越高
选择题专练(六)
1 B 两性氧化物指的是既能与酸反应又能与碱反应的氧化物,A错误;水电解生成氢气和氧气的反应中,水既作氧化剂,也作还原剂,B正确;同素异形体为由同种元素组成的不同单质,水及双氧水为化合物,C错误;水为弱电解质,D错误。
2 A K4[Fe(CN)6]中Fe为+2价,B错误;Cl-的结构示意图为 ,C错误;K3[Fe(CN)6]中有离子键、极性共价键和配位键,D错误。
3 C 容量瓶不能稀释溶液,A错误;pH试纸伸入溶液中会污染溶液,应用玻璃棒蘸取溶液点在干燥的pH试纸上,B错误;加热固体时,试管口应略向下倾斜,D错误。
4 A 基态Sm原子的价电子排布为4f26s2,4f轨道未充满,位于元素周期表中的f区,A正确;Fe的价层电子排布式为3d64s2,Fe成为阳离子时首先失去4s轨道上2个电子,再失去3d轨道上的电子,B错误;非金属性O>P>As,故稳定性AsH3I1(O),D错误。
5 D 由“无水CuCl2为长链状结构”可知,CuCl2不为离子化合物,A错误;CO中碳原子价层电子对数为3,为平面三角形结构,B错误;SO和SO中S原子价层电子对数均为4(均为sp3杂化),后者有1个孤电子对,孤电子对对成键电子对的斥力强于成键电子对之间斥力,后者键角小,C错误;NO中N原子价层电子对数为3,为sp2杂化,D正确。
6 A 加热CuCl2·2H2O时,Cu2+会水解,得不到CuCl2固体,B错误;阴极上,溶液中的Cu2+放电:Cu2++2e-===Cu,C错误;浓硝酸具有强氧化性,将Cu2S氧化为Cu2+、SO,自身被还原为NO2,D错误。
7 B 浓硫酸具有强氧化性是因为其中的S元素呈+6价,与H元素的化合价无关,B错误。
酸在溶液中因能电离出H+,H+表现出氧化性,称为酸的氧化性,如稀硫酸、稀盐酸。浓硫酸、浓硝酸是因为+6价S、+5价的N表现出强氧化性。
8 B NO和水不反应,B错误。
9 D 该步反应的正反应是气体体积减小的反应,所以该反应的ΔS<0,A正确;①―→②过程是放热反应,放出能量,并在CH4和CO2之间形成了C—C,B正确;由反应机理可知,CH4中C显负价,H显正价,步骤①可理解为CH4中带部分负电荷的C与催化剂M之间发生作用,C正确;该反应中每消耗1 mol CO2,转移电子的数目约为4×6.02×1023,D错误。
10 A X―→Y经历了醛基的加成反应和羟基的消去反应,中间产物为 ,A正确; 分子的结构简式为,单键为σ键,则1 mol 分子中含有15 mol σ键,B错误;Y与足量H2加成后的产物分子的结构简式为 ,含有2个手性碳原子,C错误;Z分子中含有醛基,能发生银镜反应,D错误。
11 C 该实验可证明氧化性Cl2>I2,无法证明氧化性Cl2>Br2>I2,A错误;Cl2等具有强氧化性气体也可以使品红溶液褪色,不能判断溶液X中是否含有SO或HSO,B错误;相同条件下,依据盐类“越弱越水解”,可判断弱酸或弱碱的“电离能力”,C正确;BaSO4和BaCO3的溶度积常数相差不大,在浓度较大的Na2CO3溶液中,溶度积小的BaSO4沉淀也可以转化为溶度积大的BaCO3沉淀,依据此实验不能判断Ksp(BaSO4)>Ksp(BaCO3),D错误。
12 C 氨水中NH3·H2O电离使氨水呈碱性:NH3·H2O NH+OH-,因NH3·H2O的电离是微弱的,有c(NH3·H2O)>c(NH),A错误;转化时CaSO4转化为CaCO3,转化后的清液中,CaCO3一定达到沉淀溶解平衡,CaSO4不一定达到沉淀溶解平衡,则 eq \f(Ksp(CaCO3),c(CO))=c(Ca2+)≤ eq \f(Ksp(CaSO4),c(SO)), eq \f(c(SO),c(CO))≤×104, B错误;溶液pH为6.5,Ka2= eq \f(c(H+)·c(CO),c(HCO)),得 eq \f(c(CO),c(HCO))= =<1,C正确;滤液中还存在NH,有c(H+)+2c(Ca2+)+c(NH)=c(OH-)+2c(CO)+c(HCO)+2c(SO),D错误。
13 C ①×4-②可得目标化学方程式,化学方程式扩大n倍,平衡常数变为原来的n次方,化学方程式相减,平衡常数相除,故目标化学方程式的平衡常数K=K·K,A正确;随着温度的升高,反应①平衡正向移动,反应②平衡逆向移动,CaO的量逐渐增大,故曲线Z表示平衡时CaO固体的物质的量随温度的变化,CaSO4、CaS的量逐渐减小,起始投入H2量为1 mol,按反应②计算,最多可生成0.25 mol CaS,故曲线Y表示平衡时CaS固体的物质的量随温度的变化,曲线X表示平衡时CaSO4固体的物质的量随温度的变化,B正确;脱硫反应是反应①,一定温度下,增大体系压强,促使反应①逆向移动,SO2的量减小,不能提高平衡时的脱硫率,C错误;由图可知,1 000 ℃下,反应①已发生,其他条件不变,n始(H2)<1 mol 时,n始(H2)越多,反应①平衡正向移动程度越大,脱硫率增大,D正确。
1 [2024盐城期中T1]水是生命之源,寻找火星水冰是“祝融”号火星车的任务之一。下列关于水的说法正确的是( )
A. 属于两性氧化物
B. 既有氧化性又有还原性
C. 与H2O2互为同素异形体
D. 不属于电解质
2 [2025镇江期初T2]反应2K4[Fe(CN)6]+Cl2===2K3[Fe(CN)6]+2KCl可制备媒染剂铁氰化钾。下列说法正确的是( )
A. CN-的电子式为[C N]-
B. K4[Fe(CN)6]中铁元素化合价为+3
C. Cl-的结构示意图为
D. K3[Fe(CN)6]中既含离子键又含非极性共价键
3 [2024海安中学期初T3]以菱镁矿(主要成分是MgCO3,含少量FeCO3)为原料制取高纯氧化镁需要经历酸浸、调pH、过滤、灼烧等操作。下列实验装置和原理能达到实验目的的是( )
甲 乙 丙 丁
A. 用装置甲配制稀硫酸
B. 用装置乙测溶液的pH
C. 用装置丙过滤悬浊液
D. 用装置丁灼烧Mg(OH)2固体
4 [2024常州期中T5]铁系超导材料Fe Sm As F O中基态Sm原子的价电子排布为4f26s2。下列说法正确的是( )
A. Sm位于元素周期表中的f区
B. Fe成为阳离子时先失去3d轨道电子
C. 氢化物的稳定性:AsH3>H2O
D. 电离能:I1(F)
Cu、Ag位于元素周期表ⅠB族。Ag与空气中微量H2S接触发生反应生成黑色Ag2S。Cu可以形成CuCl2、CuSO4、Cu2O、Cu2S等化合物。有研究表明,无水CuCl2为长链状结构,其片段如图: 。
5 [2024扬州考前模拟T5]下列说法正确的是( )
A. CuCl2属于离子化合物
B. CO的空间结构为三角锥形
C. SO中的键角比SO中的小
D. NO中心原子的轨道杂化类型为sp2
6 [2024扬州考前模拟T6]下列化学反应表示正确的是( )
A. Ag与空气中H2S的反应:4Ag+2H2S+O2===2Ag2S+2H2O
B. 加热CuCl2·2H2O:CuCl2·2H2OCuCl2+2H2O
C. 用惰性电极电解CuSO4溶液的阴极反应:2H2O-4e-===4H++O2↑
D. Cu2S与热的浓硝酸反应:Cu2S+6H++2NO2Cu2++H2S↑+2NO2↑+2H2O
7 [2024扬州考前模拟T7]下列物质结构与性质或物质性质与用途不具有对应关系的是( )
A. H2O中的O存在孤电子对,Cu2+能与H2O形成[Cu(H2O)4]2+
B. H2SO4中H元素呈+1价,浓硫酸具有强氧化性
C. CuSO4具有杀菌能力,可用于游泳池的水处理
D. 无水CuSO4吸水后显现蓝色,可用于检验乙醇所含的微量水分
8 [2024南通、泰州等六市一调T8]氮及其化合物的转化具有重要应用。下列说法不正确的是( )
A. 常温下可以用铁制容器来盛装浓硝酸
B. 工业制硝酸过程中的物质转化:NH3NOHNO3
C. 氮气、铵盐、亚硝酸盐、硝酸盐之间的转化构成了自然界“氮循环”的一部分
D. 实验室用浓氨水、生石灰制备少量氨气:NH3·H2O+CaO===Ca(OH)2+NH3↑
9 [2025南通如东调研T10]催化剂M(TiO2/Cu2Al2O4)催化CO2和CH4转化为高附加值产品CH3COOH的反应为CO2(g)+CH4(g) CH3COOH(l),该催化反应历程示意图如下。
下列说法不正确的是( )
A. 该反应的ΔS<0
B. ①―→②过程放出能量并形成了C—C
C. 如图所示的反应机理中,步骤①可理解为CH4中带部分负电荷的C与催化剂M之间发生作用
D. 该反应中每消耗1 mol CO2,转移电子的数目约为2×6.02×1023
10 [2025海门中学调研T9]物质Z常应用于液晶材料的制备。合成Z的一种方法如下图所示。下列说法正确的是( )
A. X―→Y经历了加成和消去两步反应
B. 1 mol 中含有6 mol σ键
C. Y分子与足量H2加成后的产物中含有3个手性碳原子
D. Z分子不能发生银镜反应
11 [2024连云港调研T11]室温下,下列实验方案能达到探究目的的是( )
选项 实验方案 探究目的
A 向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡后静置,观察CCl4层颜色 氧化性:Cl2>Br2>I2
B 向溶液X中加入盐酸,将产生的气体通入品红溶液中,观察溶液颜色变化 溶液X中是否含有SO或HSO
C 测定浓度均为0.1 mol/L的CH3COONa、NH4Cl溶液的pH CH3COOH和NH3·H2O的电离能力
D BaSO4用饱和Na2CO3溶液浸泡一段时间后,过滤、洗涤,向所得滤渣上滴加盐酸,产生无色气体 Ksp(BaSO4)>Ksp(BaCO3)
12 [2024苏州三模T12]以磷石膏(主要成分CaSO4,杂质SiO2、Al2O3等)和氨水为原料可实现CO2矿物封存同时制备轻质CaCO3,转化部分流程如图。
Ksp(CaSO4)=5.0×10-5,Ksp(CaCO3)=3.0×10-9,
Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.61×10-11。
下列说法正确的是( )
A. 氨水中存在:c(NH)>c(H+)+c(NH3·H2O)
B. “转化”步骤,通入CO2后清液中始终存在: eq \f(c(SO),c(CO))>×104
C. “转化”步骤,若通入CO2至溶液pH为6.5,此时溶液中:c(HCO)>c(CO)
D. “滤液”中存在:c(H+)+2c(Ca2+)=c(OH-)+2c(CO)+c(HCO)+2c(SO)
13 [2024苏锡常镇二调T13]利用H2可实现对石膏中S元素的脱除,涉及的主要反应如下:
①CaSO4(s)+H2(g) CaO(s)+SO2(g)+H2O(g) ΔH1=+261.4 kJ/mol K1
②CaSO4(s)+4H2(g) CaS(s)+4H2O(g) ΔH2=-5.3 kJ/mol K2
在1.0×105 Pa、n始(H2)和n始(CaSO4)均为1 mol时,若仅考虑上述反应,平衡时各固体物质的物质的量随温度的变化关系如图所示。石膏中S元素的脱除效果可用脱硫率[×100%]表示。下列说法不正确的是( )
A. 反应3CaSO4(s)+CaS(s) 4CaO(s)+4SO2(g)的平衡常数K=K·K
B. 图中曲线X表示平衡时CaSO4固体的物质的量随温度的变化
C. 一定温度下,加入NaOH固体或增大体系压强,均可提高平衡时的脱硫率
D. 其他条件不变,1 000 ℃下,n始(H2)<1 mol时,n始(H2)越多,平衡时的脱硫率越高
选择题专练(六)
1 B 两性氧化物指的是既能与酸反应又能与碱反应的氧化物,A错误;水电解生成氢气和氧气的反应中,水既作氧化剂,也作还原剂,B正确;同素异形体为由同种元素组成的不同单质,水及双氧水为化合物,C错误;水为弱电解质,D错误。
2 A K4[Fe(CN)6]中Fe为+2价,B错误;Cl-的结构示意图为 ,C错误;K3[Fe(CN)6]中有离子键、极性共价键和配位键,D错误。
3 C 容量瓶不能稀释溶液,A错误;pH试纸伸入溶液中会污染溶液,应用玻璃棒蘸取溶液点在干燥的pH试纸上,B错误;加热固体时,试管口应略向下倾斜,D错误。
4 A 基态Sm原子的价电子排布为4f26s2,4f轨道未充满,位于元素周期表中的f区,A正确;Fe的价层电子排布式为3d64s2,Fe成为阳离子时首先失去4s轨道上2个电子,再失去3d轨道上的电子,B错误;非金属性O>P>As,故稳定性AsH3
5 D 由“无水CuCl2为长链状结构”可知,CuCl2不为离子化合物,A错误;CO中碳原子价层电子对数为3,为平面三角形结构,B错误;SO和SO中S原子价层电子对数均为4(均为sp3杂化),后者有1个孤电子对,孤电子对对成键电子对的斥力强于成键电子对之间斥力,后者键角小,C错误;NO中N原子价层电子对数为3,为sp2杂化,D正确。
6 A 加热CuCl2·2H2O时,Cu2+会水解,得不到CuCl2固体,B错误;阴极上,溶液中的Cu2+放电:Cu2++2e-===Cu,C错误;浓硝酸具有强氧化性,将Cu2S氧化为Cu2+、SO,自身被还原为NO2,D错误。
7 B 浓硫酸具有强氧化性是因为其中的S元素呈+6价,与H元素的化合价无关,B错误。
酸在溶液中因能电离出H+,H+表现出氧化性,称为酸的氧化性,如稀硫酸、稀盐酸。浓硫酸、浓硝酸是因为+6价S、+5价的N表现出强氧化性。
8 B NO和水不反应,B错误。
9 D 该步反应的正反应是气体体积减小的反应,所以该反应的ΔS<0,A正确;①―→②过程是放热反应,放出能量,并在CH4和CO2之间形成了C—C,B正确;由反应机理可知,CH4中C显负价,H显正价,步骤①可理解为CH4中带部分负电荷的C与催化剂M之间发生作用,C正确;该反应中每消耗1 mol CO2,转移电子的数目约为4×6.02×1023,D错误。
10 A X―→Y经历了醛基的加成反应和羟基的消去反应,中间产物为 ,A正确; 分子的结构简式为,单键为σ键,则1 mol 分子中含有15 mol σ键,B错误;Y与足量H2加成后的产物分子的结构简式为 ,含有2个手性碳原子,C错误;Z分子中含有醛基,能发生银镜反应,D错误。
11 C 该实验可证明氧化性Cl2>I2,无法证明氧化性Cl2>Br2>I2,A错误;Cl2等具有强氧化性气体也可以使品红溶液褪色,不能判断溶液X中是否含有SO或HSO,B错误;相同条件下,依据盐类“越弱越水解”,可判断弱酸或弱碱的“电离能力”,C正确;BaSO4和BaCO3的溶度积常数相差不大,在浓度较大的Na2CO3溶液中,溶度积小的BaSO4沉淀也可以转化为溶度积大的BaCO3沉淀,依据此实验不能判断Ksp(BaSO4)>Ksp(BaCO3),D错误。
12 C 氨水中NH3·H2O电离使氨水呈碱性:NH3·H2O NH+OH-,因NH3·H2O的电离是微弱的,有c(NH3·H2O)>c(NH),A错误;转化时CaSO4转化为CaCO3,转化后的清液中,CaCO3一定达到沉淀溶解平衡,CaSO4不一定达到沉淀溶解平衡,则 eq \f(Ksp(CaCO3),c(CO))=c(Ca2+)≤ eq \f(Ksp(CaSO4),c(SO)), eq \f(c(SO),c(CO))≤×104, B错误;溶液pH为6.5,Ka2= eq \f(c(H+)·c(CO),c(HCO)),得 eq \f(c(CO),c(HCO))= =<1,C正确;滤液中还存在NH,有c(H+)+2c(Ca2+)+c(NH)=c(OH-)+2c(CO)+c(HCO)+2c(SO),D错误。
13 C ①×4-②可得目标化学方程式,化学方程式扩大n倍,平衡常数变为原来的n次方,化学方程式相减,平衡常数相除,故目标化学方程式的平衡常数K=K·K,A正确;随着温度的升高,反应①平衡正向移动,反应②平衡逆向移动,CaO的量逐渐增大,故曲线Z表示平衡时CaO固体的物质的量随温度的变化,CaSO4、CaS的量逐渐减小,起始投入H2量为1 mol,按反应②计算,最多可生成0.25 mol CaS,故曲线Y表示平衡时CaS固体的物质的量随温度的变化,曲线X表示平衡时CaSO4固体的物质的量随温度的变化,B正确;脱硫反应是反应①,一定温度下,增大体系压强,促使反应①逆向移动,SO2的量减小,不能提高平衡时的脱硫率,C错误;由图可知,1 000 ℃下,反应①已发生,其他条件不变,n始(H2)<1 mol 时,n始(H2)越多,反应①平衡正向移动程度越大,脱硫率增大,D正确。
同课章节目录
