“10道选择+2道大题”综合小卷(八)(含解析)2024-2025学年高考化学二轮复习 抢分练
文档属性
| 名称 | “10道选择+2道大题”综合小卷(八)(含解析)2024-2025学年高考化学二轮复习 抢分练 |  | |
| 格式 | doc | ||
| 文件大小 | 543.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-15 20:13:34 | ||
图片预览



文档简介
“10+2”综合小卷(八)
一、 选择题:每题只有一个选项符合题意。
1 [2023苏锡常镇二调]嫦娥石属于陨磷钠镁钙石族,其纯晶体成分为Ca8YFe(PO4)7。下列说法正确的是( )
A. 电离能:I1(Na)>I1(Mg)
B. 碱性:Ca(OH)2>Mg(OH)2
C. 离子半径:r(Ca2+)>r(P3-)
D. 电负性:χ(P)>χ(O)
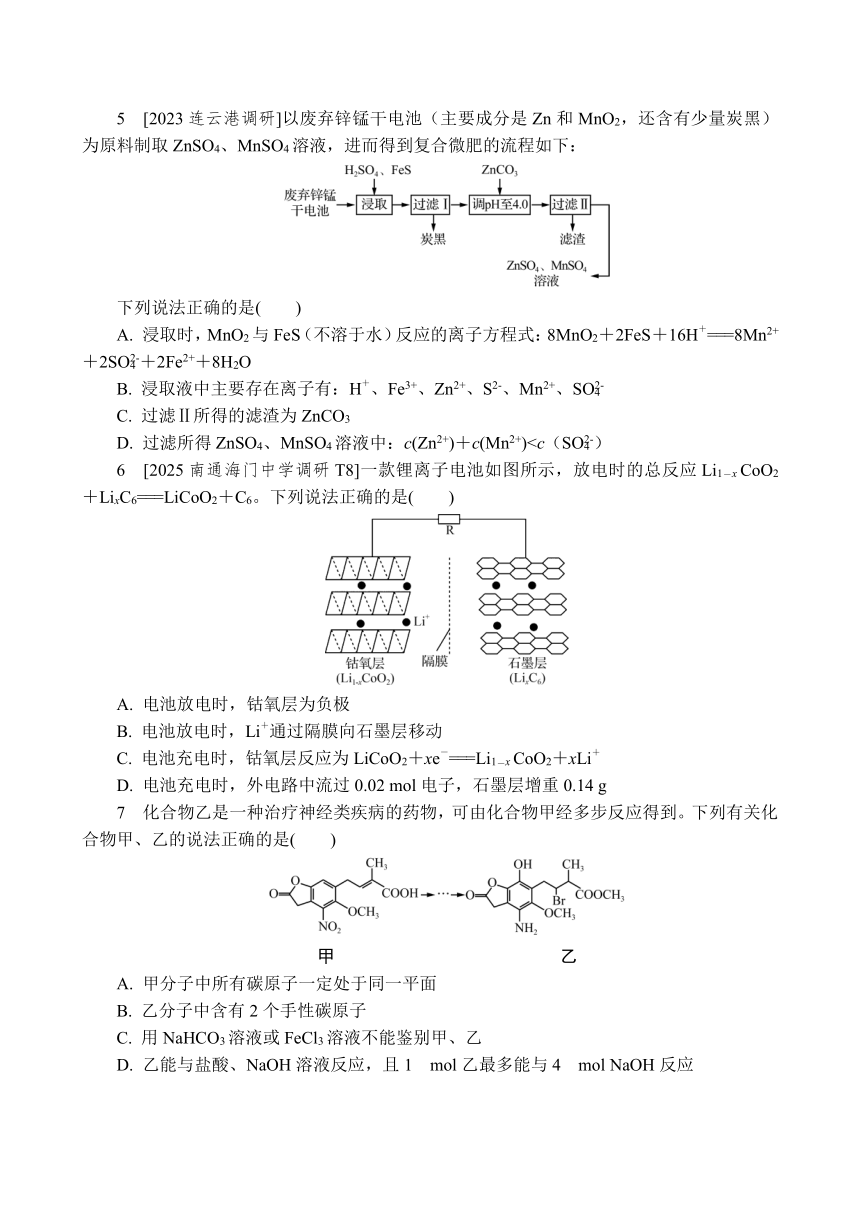
2 [2025苏州期中调研T3]氨是重要的化工原料,能与CaCl2结合生成CaCl2·8NH3,加热条件下NH3能将CuO还原成Cu,实验室制取少量NH3并探究其性质。下列装置不能达到实验目的的是( )
甲 乙 丙 丁
A. 用装置甲制取NH3
B. 用装置乙干燥NH3
C. 用装置丙检验NH3水溶液呈碱性
D. 用装置丁探究的NH3还原性
3 [2024南通四模T7]下列物质结构与性质或物质性质与用途不具有对应关系的是( )
A. HClO呈弱酸性,可用于漂白纸张
B. ClO2具有强氧化性,可用于自来水杀菌消毒
C. Cl-有孤电子对,可与Cu2+形成[CuCl4]2-
D. HF分子间存在氢键,HF沸点较高
4 [2023南通如皋期末]碱式碳酸氧钒铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O]是制备多种含钒产品的原料。下列有关说法不正确的是( )
A. NH的空间结构为正四面体形
B. 基态V4+的核外电子排布式为[Ar]3d1
C. CO中C的轨道杂化类型为sp2杂化
D. H2O是非极性分子
5 [2023连云港调研]以废弃锌锰干电池(主要成分是Zn和MnO2,还含有少量炭黑)为原料制取ZnSO4、MnSO4溶液,进而得到复合微肥的流程如下:
下列说法正确的是( )
A. 浸取时,MnO2与FeS(不溶于水)反应的离子方程式:8MnO2+2FeS+16H+===8Mn2++2SO+2Fe2++8H2O
B. 浸取液中主要存在离子有:H+、Fe3+、Zn2+、S2-、Mn2+、SO
C. 过滤Ⅱ所得的滤渣为ZnCO3
D. 过滤所得ZnSO4、MnSO4溶液中:c(Zn2+)+c(Mn2+)6 [2025南通海门中学调研T8]一款锂离子电池如图所示,放电时的总反应Li1-x CoO2+LixC6===LiCoO2+C6。下列说法正确的是( )
A. 电池放电时,钴氧层为负极
B. 电池放电时,Li+通过隔膜向石墨层移动
C. 电池充电时,钴氧层反应为LiCoO2+xe-===Li1-x CoO2+xLi+
D. 电池充电时,外电路中流过0.02 mol电子,石墨层增重0.14 g
7 化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关化合物甲、乙的说法正确的是( )
甲 乙
A. 甲分子中所有碳原子一定处于同一平面
B. 乙分子中含有2个手性碳原子
C. 用NaHCO3溶液或FeCl3溶液不能鉴别甲、乙
D. 乙能与盐酸、NaOH溶液反应,且1 mol乙最多能与4 mol NaOH反应
8 [2024扬州考前模拟T11]室温下,下列实验探究方案能达到探究目的的是( )
选项 探究方案 探究目的
A 向NaCl、NaI混合溶液中滴加少量AgNO3溶液,观察沉淀的颜色 Ksp(AgCl)>Ksp(AgI)
B 将少量SO2气体通入0.1 mol/L Ba(NO3)2溶液中,观察实验现象 BaSO3难溶于水
C 向0.1 mol/L H2O2溶液中滴加0.1 mol/L KMnO4溶液,观察溶液颜色变化 H2O2具有氧化性
D 向FeCl3溶液中滴加少量KI溶液,再滴加少量淀粉溶液,观察溶液颜色变化 Fe3+的氧化性比I2强
9 Na2S是染料工业中的重要原料,室温下,0.1 mol/L Na2S溶液的pH≈13,H2S的电离平衡常数Ka1=1.3×10-7,Ka2=7.1×10-15,现对0.1 mol/L Na2S溶液的性质进行探究,下列结论正确的是( )
A. 该溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
B. 该溶液中:c(Na+)>c(OH-)>c(HS-)>c(S2-)
C. 向0.1 mol/L Na2S溶液中通入过量Cl2,无淡黄色沉淀生成,说明S2-未被氧化
D. 向10 mL 0.1 mol/L Na2S溶液中滴入几滴0.1 mol/L ZnCl2溶液产生白色沉淀,再滴入几滴0.1 mol/L CuCl2溶液出现黑色沉淀,证明Ksp(ZnS)>Ksp(CuS)
10 [2024苏州三模T13]CO2催化加氢制甲醇主要反应如下:
反应Ⅰ:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-49.4 kJ/mol
反应Ⅱ:CO2(g)+ H2(g)===CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
压强分别为p1、p2时,将=1∶3的混合气体置于密闭容器中反应,不同温度下体系中CH3OH或CO的平衡选择性如图所示。CH3OH (或CO)的平衡选择性=。下列说法正确的是( )
A. 曲线①②表示的是CH3OH平衡选择性
B. 曲线①②表示的压强:p1C. 随温度升高,CO2的平衡转化率受压强影响减小
D. 相同温度下,压强分别为p1、p2时,反应Ⅰ的平衡常数K(p1)>K(p2)
二、 非选择题
11 [2024南通海安中学学情检测T16]由铁铬合金(主要成分Cr、Fe,含少量Co、Ni等)可以制取Cr2O3、FeC2O4·2H2O和LiFePO4。实验流程如下:
(1) “酸溶”时应先向反应器中加入硫酸,再分批加入铬铁合金粉末,同时需保持强制通风。
①分批加入铬铁合金粉末并保持强制通风的原因是______________________
________________________________________________________________________ 。
②其他条件相同,实验测得相同时间内铬铁转化率[
×100%]、析出硫酸盐晶体的质量随硫酸浓度变化情况如图所示。当硫酸的浓度为9~11 mol/L时,铬铁转化率下降的原因:_________________________________
________________________________________________________________________ (已知:硫酸浓度大于12 mol/L时,铁才会钝化)。
(2) 向酸溶所得溶液中加入0.5 mol/L Na2S溶液,使Co2+和Ni2+转化为CoS和NiS沉淀。当上层清液中c(Ni2+)=1.0×10-5 mol/L时,c(Co2+)= [已知:Ksp(CoS)=1.8×10-22,Ksp(NiS)=3.0×10-21]。
(3) 在N2氛围中将FeC2O4·2H2O与LiH2PO4按物质的量之比1∶1混合,360 ℃条件下反应可获得LiFePO4,同时有CO和CO2生成。写出该反应的化学方程式:_______________________________________________________________
______________________________________________________________________。
(4) 设计由沉铁后的滤液(含Cr3+和少量Fe2+)制备Cr2O3的实验方案:______
____________________________________________________________________________________________________________________________________________,
过滤、洗涤、干燥、500 ℃煅烧[实验中须选用试剂:P507萃取剂、H2O2、NaOH溶液]。
已知:①P507萃取剂密度小于水,萃取Fe3+时萃取率与溶液pH的关系如图所示。
②该实验中Cr3+在pH=6.0时开始沉淀,pH=8.0时沉淀完全。pH=12时Cr(OH)3开始溶解。
12 [2024扬州考前模拟T17]CO2资源利用具有重要意义。
(1) 燃煤烟气中CO2的捕集可通过如下所示的物质转化实现。
吸收剂X能吸收CO2的原因是________________________________________
____________________________________;“解吸”的条件是 。
(2) CO2与环氧化合物反应可以转化为有价值的有机物。转化过程如图1所示。Y为五元环状化合物,Y的结构简式为 ;N原子上的孤电子对主要进攻甲基环氧乙烷中“CH2”上的碳原子,而不是“CH”上的碳原子,原因是____________
____________________________________________________________________________________________________________________________________________。
图1
(3) 高活性CO2催化剂的主要成分为Cu2O。该催化剂中铜的氧化物晶胞投影如图2所示(沿x轴,y轴和z轴的投影都相同)。请在相应位置补全该晶胞图,晶胞内部距离最近的原子之间请用虚线相连接。
图2
(4) CO2通过电催化还原可转化为有机物。以0.1 mol/L的KHCO3溶液为电解质溶液,将CO2通入Cu基催化剂的电极材料上(Cu是催化剂的活性位点),相同条件下,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图3所示。
FE%=×100%
图3
①当电压为U1时,生成H2的电极反应式为_____________________________
。
②为了降低H2的法拉第效率,可以采取的措施为________________________
______________________________________________________________________。
③生成的中间产物CO中C原子与Cu之间存在强烈的相互作用,该作用力为 。
④电压从U2 V增大到U3 V时,电流减小的可能原因是___________________
____________________________________________________________________________________________________________________________________________。
“10+2”综合小卷(八)
1 B Mg的价电子排布式是3s2,全充满,较稳定,第一电离能:I1(Na)2 B NH3能与CaCl2结合生成CaCl2·8NH3,会损耗氨气,不能用装置乙干燥NH3,B符合题意。
3 A HClO因有强氧化性,可用于漂白,A错误;ClO2具有强氧化性,可用于自来水杀菌消毒,B正确;Cl-有孤电子对,Cu2+有空轨道,两者通过配位键形成[CuCl4]2-,C正确;HF分子间存在氢键,使沸点升高,D正确。
4 D H2O中O原子价层电子对数=2+=4,采用sp3杂化,是V形结构,正、负电荷中心不重合,是极性分子,D错误。
5 D 浸取时,发生反应的离子方程式为9MnO2+2FeS+20H+===9Mn2++2SO+2Fe3++10H2O,A错误;浸取液中主要存在离子有H+、Fe3+、Zn2+、Mn2+、SO,B错误;过滤Ⅱ所得的滤渣为Fe(OH)3沉淀,C错误;溶液中存在电荷守恒:c(H+)+2c(Zn2+)+2c(Mn2+)=2c(SO)+c(OH-),又调节pH=4,溶液呈酸性,c(H+)>c(OH-),故2c(Zn2+)+2c(Mn2+)<2c(SO),即c(Zn2+)+c(Mn2+)6 D 放电时的总反应Li1-xCoO2+LixC6===LiCoO2+C6,正极反应式为Li1-xCoO2+xLi++xe-===LiCoO2,负极反应式为LixC6-xe-===xLi++ C6。电池放电时,钴元素价态降低,被还原,钴氧层是正极,A错误;钴氧层是正极,石墨层是负极,电池放电时,阳离子移向正极,则Li+通过隔膜向钴氧层移动,B错误;放电时,正极反应式为Li1-xCoO2+xLi++xe-===LiCoO2,电池充电时,与电源正极相连的为阳极,钴氧层为阳极,电极反应式为LiCoO2-xe-===Li1-x CoO2+xLi+,C错误;电池充电时,阴极反应式为xLi++ C6+xe-=== LixC6,外电路中流过0.02 mol电子,石墨层增加0.02 mol Li+,增加的质量=0.02 mol×7 g/mol=0.14 g,D正确。
7 B 单键可以旋转,使得甲氧基上的碳原子不一定在苯环的平面上,A错误;乙中有2个手性碳原子:,B正确;甲中有羧基,与NaHCO3溶液反应生成CO2气体,乙中有酚羟基,遇FeCl3溶液会显色,可以鉴别甲和乙,C错误;乙中有—NH2,显碱性,能与盐酸反应,乙中的酚酯基、酯基、酚羟基、溴原子均能与NaOH溶液反应,1 mol乙最多能消耗5 mol NaOH,D错误。
8 D 没有等浓度,无法判断溶度积大小,A错误;酸性条件下,NO将SO2氧化为SO,生成BaSO4沉淀,B错误;KMnO4溶液褪色,体现H2O2还原性,C错误;加入淀粉溶液,颜色变蓝,说明有I2生成,发生反应2Fe3++2I-===2Fe2++I2,氧化剂的氧化性强于氧化产物的氧化性,D正确。
9 B 1 mol/L Na2S溶液中存在质子守恒:c(OH-)=c(H+)+c(HS-)+2c(H2S),A错误;该溶液中S2-水解,且分步水解,溶液显碱性,已知室温下0.1 mol/L Na2S溶液pH≈13,这说明溶液中c(OH-)=0.1 mol/L,则该溶液中:c(Na+)>c(OH-)>c(HS-)>c(S2-),B正确;向0.1 mol/L Na2S溶液中通入过量Cl2,无淡黄色沉淀生成,应该是S2-被氧化为更高价态的可溶的酸根离子,并不是S2-未被氧化,C错误;Na2S过量,不涉及沉淀的转化,不能证明Ksp(ZnS)>Ksp(CuS),D错误。
10 C 反应Ⅰ是放热反应,反应Ⅱ是吸热反应,随温度升高,反应Ⅰ逆向移动,反应Ⅱ正向移动,CO的选择性上升,曲线表示的是CO的平衡选择性,A错误;压强增大,反应Ⅰ正向移动,CH3OH选择性增大,则CO的选择性减小,相同温度下,曲线①的选择性小,故p1>p2,B错误;随温度升高,CO的选择性接近100%,以反应Ⅱ为主,平衡受压强的影响减小,C正确;一个给定反应,温度不变,平衡常数不变,D错误。
11 (1) ①防止产生的大量气体使反应液溢出;及时排出产生的H2,避免发生爆炸 ②析出的硫酸盐晶体覆盖在铬铁表面,减小了反应的速率 (2) 6.0×10-7 mol/L (3) FeC2O4·2H2O+LiH2PO4LiFePO4+CO↑+CO2↑+3H2O↑
(4) 边搅拌边向滤液中滴加稍过量的H2O2,充分反应后继续向其中滴加NaOH溶液,至pH约2.5时停止滴加,加入P507萃取剂,充分振荡、静置、分液,向水层中边搅拌边滴加NaOH溶液至pH为8~12时停止滴加
解析:(1) ①金属单质在与硫酸反应时会产生大量H2,分批加入铬铁合金粉末并保持强制通风可以防止产生的大量气体使反应液溢出;及时排出产生的H2,避免发生爆炸。②硫酸浓度较大后,生成的硫酸盐的量增多,析出的硫酸盐晶体覆盖在铬铁表面,减小了反应的速率。(2) 当上层清液中c(Ni2+)=1.0×10-5 mol/L时,c(S2-)===3.0×10-16(mol/L),c(Co2+)===6.0×10-7(mol/L)。(3) FeC2O4·2H2O与LiH2PO4按物质的量之比1∶1混合,360 ℃条件下反应可获得LiFePO4,同时有CO和CO2生成,说明该过程中草酸发生歧化,根据得失电子守恒、元素守恒可得化学方程式。(4) 根据题目所给信息可知,P507萃取剂可以萃取Fe3+,所以需先加入H2O2将Fe2+氧化为Fe3+,然后加入NaOH溶液调节pH至2.5左右,再加入P507萃取剂萃取,分液后向水层中加入NaOH溶液得到Cr(OH)3沉淀,具体操作见答案。
12 (1) HOCH2CH2NH2具有碱性 高温、低压 (2)
O的电负性比C大,与O直接相连的碳带部分正电荷,由于甲基是推电子基团,“CH”中碳带正电荷略少,因此孤电子对更容易进攻“CH2”中的碳原子 (3)
(4) ①2H2O+2e-+2CO2===H2↑+2HCO或2HCO+2e-=== H2↑+2CO ②适当调高电压,适当增大CO2的流速 ③配位键(或共价键) ④生成的CO与催化剂Cu的活性位点结合,生成的配合物覆盖在催化剂表面,导电能力减弱
解析:(1) X+CO2―→HOCH2CH2NHCOO-,X的结构简式为HOCH2CH2NH2,—NH2具有碱性。解吸反应为HOCH2CH2NHCOO-―→X+CO2,加热使其分解,或减压使反应正向进行。(2) CO2的结构式为O===C===O,发生加成反应,带正电荷的碳原子连接带负电荷氧原子,带负电荷的氧原子连带正电荷的碳原子,构成五元环。与氧原子相连,“CH”和“CH2”中的碳原子均带有正电荷,“CH”连接甲基,甲基是推电子基团,“CH”中碳原子带正电荷少于“CH2”,“CH2”更易受负电性的N原子进攻。(3) 由投影式可知,体心有1个黑球,晶胞中黑球数为8×+1=2,沿x轴,y轴和z轴的投影都相同,由投影可知,晶胞中至少有4个白球,由Cu2O化学式可知,内部有4个白球。将晶胞分成8个小立方体,不相邻的4个小立方体的体心有1个白球。(4) ①铜基电极为阴极,电压为U1 V时,水中的H+放电生成H2,同时有OH-生成,OH-吸收铜基电极上的CO2生成HCO。或者OH-可以继续和溶液中的HCO反应生成CO。②由图示知,提高电压,H2的法拉第效率下降,有机物的法拉第效率上升。因为是CO2与水中H+的竞争反应,所以可以增大CO2的流速。③CO可以作配体与金属离子形成配位键,CO作配体时,配位原子是C原子。④电压从U2 V增大到U3 V时,由图可知,CO、HCOO-的法拉第效率减小,由③可知,CO可与催化剂Cu的活性位点结合形成配合物,生成的配合物覆盖在催化剂表面,导电能力减弱。电压继续增大,CO继续被还原,配合物转化为催化剂Cu,活性位点增多,电流增大。
一、 选择题:每题只有一个选项符合题意。
1 [2023苏锡常镇二调]嫦娥石属于陨磷钠镁钙石族,其纯晶体成分为Ca8YFe(PO4)7。下列说法正确的是( )
A. 电离能:I1(Na)>I1(Mg)
B. 碱性:Ca(OH)2>Mg(OH)2
C. 离子半径:r(Ca2+)>r(P3-)
D. 电负性:χ(P)>χ(O)
2 [2025苏州期中调研T3]氨是重要的化工原料,能与CaCl2结合生成CaCl2·8NH3,加热条件下NH3能将CuO还原成Cu,实验室制取少量NH3并探究其性质。下列装置不能达到实验目的的是( )
甲 乙 丙 丁
A. 用装置甲制取NH3
B. 用装置乙干燥NH3
C. 用装置丙检验NH3水溶液呈碱性
D. 用装置丁探究的NH3还原性
3 [2024南通四模T7]下列物质结构与性质或物质性质与用途不具有对应关系的是( )
A. HClO呈弱酸性,可用于漂白纸张
B. ClO2具有强氧化性,可用于自来水杀菌消毒
C. Cl-有孤电子对,可与Cu2+形成[CuCl4]2-
D. HF分子间存在氢键,HF沸点较高
4 [2023南通如皋期末]碱式碳酸氧钒铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O]是制备多种含钒产品的原料。下列有关说法不正确的是( )
A. NH的空间结构为正四面体形
B. 基态V4+的核外电子排布式为[Ar]3d1
C. CO中C的轨道杂化类型为sp2杂化
D. H2O是非极性分子
5 [2023连云港调研]以废弃锌锰干电池(主要成分是Zn和MnO2,还含有少量炭黑)为原料制取ZnSO4、MnSO4溶液,进而得到复合微肥的流程如下:
下列说法正确的是( )
A. 浸取时,MnO2与FeS(不溶于水)反应的离子方程式:8MnO2+2FeS+16H+===8Mn2++2SO+2Fe2++8H2O
B. 浸取液中主要存在离子有:H+、Fe3+、Zn2+、S2-、Mn2+、SO
C. 过滤Ⅱ所得的滤渣为ZnCO3
D. 过滤所得ZnSO4、MnSO4溶液中:c(Zn2+)+c(Mn2+)
A. 电池放电时,钴氧层为负极
B. 电池放电时,Li+通过隔膜向石墨层移动
C. 电池充电时,钴氧层反应为LiCoO2+xe-===Li1-x CoO2+xLi+
D. 电池充电时,外电路中流过0.02 mol电子,石墨层增重0.14 g
7 化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关化合物甲、乙的说法正确的是( )
甲 乙
A. 甲分子中所有碳原子一定处于同一平面
B. 乙分子中含有2个手性碳原子
C. 用NaHCO3溶液或FeCl3溶液不能鉴别甲、乙
D. 乙能与盐酸、NaOH溶液反应,且1 mol乙最多能与4 mol NaOH反应
8 [2024扬州考前模拟T11]室温下,下列实验探究方案能达到探究目的的是( )
选项 探究方案 探究目的
A 向NaCl、NaI混合溶液中滴加少量AgNO3溶液,观察沉淀的颜色 Ksp(AgCl)>Ksp(AgI)
B 将少量SO2气体通入0.1 mol/L Ba(NO3)2溶液中,观察实验现象 BaSO3难溶于水
C 向0.1 mol/L H2O2溶液中滴加0.1 mol/L KMnO4溶液,观察溶液颜色变化 H2O2具有氧化性
D 向FeCl3溶液中滴加少量KI溶液,再滴加少量淀粉溶液,观察溶液颜色变化 Fe3+的氧化性比I2强
9 Na2S是染料工业中的重要原料,室温下,0.1 mol/L Na2S溶液的pH≈13,H2S的电离平衡常数Ka1=1.3×10-7,Ka2=7.1×10-15,现对0.1 mol/L Na2S溶液的性质进行探究,下列结论正确的是( )
A. 该溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
B. 该溶液中:c(Na+)>c(OH-)>c(HS-)>c(S2-)
C. 向0.1 mol/L Na2S溶液中通入过量Cl2,无淡黄色沉淀生成,说明S2-未被氧化
D. 向10 mL 0.1 mol/L Na2S溶液中滴入几滴0.1 mol/L ZnCl2溶液产生白色沉淀,再滴入几滴0.1 mol/L CuCl2溶液出现黑色沉淀,证明Ksp(ZnS)>Ksp(CuS)
10 [2024苏州三模T13]CO2催化加氢制甲醇主要反应如下:
反应Ⅰ:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-49.4 kJ/mol
反应Ⅱ:CO2(g)+ H2(g)===CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
压强分别为p1、p2时,将=1∶3的混合气体置于密闭容器中反应,不同温度下体系中CH3OH或CO的平衡选择性如图所示。CH3OH (或CO)的平衡选择性=。下列说法正确的是( )
A. 曲线①②表示的是CH3OH平衡选择性
B. 曲线①②表示的压强:p1
D. 相同温度下,压强分别为p1、p2时,反应Ⅰ的平衡常数K(p1)>K(p2)
二、 非选择题
11 [2024南通海安中学学情检测T16]由铁铬合金(主要成分Cr、Fe,含少量Co、Ni等)可以制取Cr2O3、FeC2O4·2H2O和LiFePO4。实验流程如下:
(1) “酸溶”时应先向反应器中加入硫酸,再分批加入铬铁合金粉末,同时需保持强制通风。
①分批加入铬铁合金粉末并保持强制通风的原因是______________________
________________________________________________________________________ 。
②其他条件相同,实验测得相同时间内铬铁转化率[
×100%]、析出硫酸盐晶体的质量随硫酸浓度变化情况如图所示。当硫酸的浓度为9~11 mol/L时,铬铁转化率下降的原因:_________________________________
________________________________________________________________________ (已知:硫酸浓度大于12 mol/L时,铁才会钝化)。
(2) 向酸溶所得溶液中加入0.5 mol/L Na2S溶液,使Co2+和Ni2+转化为CoS和NiS沉淀。当上层清液中c(Ni2+)=1.0×10-5 mol/L时,c(Co2+)= [已知:Ksp(CoS)=1.8×10-22,Ksp(NiS)=3.0×10-21]。
(3) 在N2氛围中将FeC2O4·2H2O与LiH2PO4按物质的量之比1∶1混合,360 ℃条件下反应可获得LiFePO4,同时有CO和CO2生成。写出该反应的化学方程式:_______________________________________________________________
______________________________________________________________________。
(4) 设计由沉铁后的滤液(含Cr3+和少量Fe2+)制备Cr2O3的实验方案:______
____________________________________________________________________________________________________________________________________________,
过滤、洗涤、干燥、500 ℃煅烧[实验中须选用试剂:P507萃取剂、H2O2、NaOH溶液]。
已知:①P507萃取剂密度小于水,萃取Fe3+时萃取率与溶液pH的关系如图所示。
②该实验中Cr3+在pH=6.0时开始沉淀,pH=8.0时沉淀完全。pH=12时Cr(OH)3开始溶解。
12 [2024扬州考前模拟T17]CO2资源利用具有重要意义。
(1) 燃煤烟气中CO2的捕集可通过如下所示的物质转化实现。
吸收剂X能吸收CO2的原因是________________________________________
____________________________________;“解吸”的条件是 。
(2) CO2与环氧化合物反应可以转化为有价值的有机物。转化过程如图1所示。Y为五元环状化合物,Y的结构简式为 ;N原子上的孤电子对主要进攻甲基环氧乙烷中“CH2”上的碳原子,而不是“CH”上的碳原子,原因是____________
____________________________________________________________________________________________________________________________________________。
图1
(3) 高活性CO2催化剂的主要成分为Cu2O。该催化剂中铜的氧化物晶胞投影如图2所示(沿x轴,y轴和z轴的投影都相同)。请在相应位置补全该晶胞图,晶胞内部距离最近的原子之间请用虚线相连接。
图2
(4) CO2通过电催化还原可转化为有机物。以0.1 mol/L的KHCO3溶液为电解质溶液,将CO2通入Cu基催化剂的电极材料上(Cu是催化剂的活性位点),相同条件下,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图3所示。
FE%=×100%
图3
①当电压为U1时,生成H2的电极反应式为_____________________________
。
②为了降低H2的法拉第效率,可以采取的措施为________________________
______________________________________________________________________。
③生成的中间产物CO中C原子与Cu之间存在强烈的相互作用,该作用力为 。
④电压从U2 V增大到U3 V时,电流减小的可能原因是___________________
____________________________________________________________________________________________________________________________________________。
“10+2”综合小卷(八)
1 B Mg的价电子排布式是3s2,全充满,较稳定,第一电离能:I1(Na)
3 A HClO因有强氧化性,可用于漂白,A错误;ClO2具有强氧化性,可用于自来水杀菌消毒,B正确;Cl-有孤电子对,Cu2+有空轨道,两者通过配位键形成[CuCl4]2-,C正确;HF分子间存在氢键,使沸点升高,D正确。
4 D H2O中O原子价层电子对数=2+=4,采用sp3杂化,是V形结构,正、负电荷中心不重合,是极性分子,D错误。
5 D 浸取时,发生反应的离子方程式为9MnO2+2FeS+20H+===9Mn2++2SO+2Fe3++10H2O,A错误;浸取液中主要存在离子有H+、Fe3+、Zn2+、Mn2+、SO,B错误;过滤Ⅱ所得的滤渣为Fe(OH)3沉淀,C错误;溶液中存在电荷守恒:c(H+)+2c(Zn2+)+2c(Mn2+)=2c(SO)+c(OH-),又调节pH=4,溶液呈酸性,c(H+)>c(OH-),故2c(Zn2+)+2c(Mn2+)<2c(SO),即c(Zn2+)+c(Mn2+)
7 B 单键可以旋转,使得甲氧基上的碳原子不一定在苯环的平面上,A错误;乙中有2个手性碳原子:,B正确;甲中有羧基,与NaHCO3溶液反应生成CO2气体,乙中有酚羟基,遇FeCl3溶液会显色,可以鉴别甲和乙,C错误;乙中有—NH2,显碱性,能与盐酸反应,乙中的酚酯基、酯基、酚羟基、溴原子均能与NaOH溶液反应,1 mol乙最多能消耗5 mol NaOH,D错误。
8 D 没有等浓度,无法判断溶度积大小,A错误;酸性条件下,NO将SO2氧化为SO,生成BaSO4沉淀,B错误;KMnO4溶液褪色,体现H2O2还原性,C错误;加入淀粉溶液,颜色变蓝,说明有I2生成,发生反应2Fe3++2I-===2Fe2++I2,氧化剂的氧化性强于氧化产物的氧化性,D正确。
9 B 1 mol/L Na2S溶液中存在质子守恒:c(OH-)=c(H+)+c(HS-)+2c(H2S),A错误;该溶液中S2-水解,且分步水解,溶液显碱性,已知室温下0.1 mol/L Na2S溶液pH≈13,这说明溶液中c(OH-)=0.1 mol/L,则该溶液中:c(Na+)>c(OH-)>c(HS-)>c(S2-),B正确;向0.1 mol/L Na2S溶液中通入过量Cl2,无淡黄色沉淀生成,应该是S2-被氧化为更高价态的可溶的酸根离子,并不是S2-未被氧化,C错误;Na2S过量,不涉及沉淀的转化,不能证明Ksp(ZnS)>Ksp(CuS),D错误。
10 C 反应Ⅰ是放热反应,反应Ⅱ是吸热反应,随温度升高,反应Ⅰ逆向移动,反应Ⅱ正向移动,CO的选择性上升,曲线表示的是CO的平衡选择性,A错误;压强增大,反应Ⅰ正向移动,CH3OH选择性增大,则CO的选择性减小,相同温度下,曲线①的选择性小,故p1>p2,B错误;随温度升高,CO的选择性接近100%,以反应Ⅱ为主,平衡受压强的影响减小,C正确;一个给定反应,温度不变,平衡常数不变,D错误。
11 (1) ①防止产生的大量气体使反应液溢出;及时排出产生的H2,避免发生爆炸 ②析出的硫酸盐晶体覆盖在铬铁表面,减小了反应的速率 (2) 6.0×10-7 mol/L (3) FeC2O4·2H2O+LiH2PO4LiFePO4+CO↑+CO2↑+3H2O↑
(4) 边搅拌边向滤液中滴加稍过量的H2O2,充分反应后继续向其中滴加NaOH溶液,至pH约2.5时停止滴加,加入P507萃取剂,充分振荡、静置、分液,向水层中边搅拌边滴加NaOH溶液至pH为8~12时停止滴加
解析:(1) ①金属单质在与硫酸反应时会产生大量H2,分批加入铬铁合金粉末并保持强制通风可以防止产生的大量气体使反应液溢出;及时排出产生的H2,避免发生爆炸。②硫酸浓度较大后,生成的硫酸盐的量增多,析出的硫酸盐晶体覆盖在铬铁表面,减小了反应的速率。(2) 当上层清液中c(Ni2+)=1.0×10-5 mol/L时,c(S2-)===3.0×10-16(mol/L),c(Co2+)===6.0×10-7(mol/L)。(3) FeC2O4·2H2O与LiH2PO4按物质的量之比1∶1混合,360 ℃条件下反应可获得LiFePO4,同时有CO和CO2生成,说明该过程中草酸发生歧化,根据得失电子守恒、元素守恒可得化学方程式。(4) 根据题目所给信息可知,P507萃取剂可以萃取Fe3+,所以需先加入H2O2将Fe2+氧化为Fe3+,然后加入NaOH溶液调节pH至2.5左右,再加入P507萃取剂萃取,分液后向水层中加入NaOH溶液得到Cr(OH)3沉淀,具体操作见答案。
12 (1) HOCH2CH2NH2具有碱性 高温、低压 (2)
O的电负性比C大,与O直接相连的碳带部分正电荷,由于甲基是推电子基团,“CH”中碳带正电荷略少,因此孤电子对更容易进攻“CH2”中的碳原子 (3)
(4) ①2H2O+2e-+2CO2===H2↑+2HCO或2HCO+2e-=== H2↑+2CO ②适当调高电压,适当增大CO2的流速 ③配位键(或共价键) ④生成的CO与催化剂Cu的活性位点结合,生成的配合物覆盖在催化剂表面,导电能力减弱
解析:(1) X+CO2―→HOCH2CH2NHCOO-,X的结构简式为HOCH2CH2NH2,—NH2具有碱性。解吸反应为HOCH2CH2NHCOO-―→X+CO2,加热使其分解,或减压使反应正向进行。(2) CO2的结构式为O===C===O,发生加成反应,带正电荷的碳原子连接带负电荷氧原子,带负电荷的氧原子连带正电荷的碳原子,构成五元环。与氧原子相连,“CH”和“CH2”中的碳原子均带有正电荷,“CH”连接甲基,甲基是推电子基团,“CH”中碳原子带正电荷少于“CH2”,“CH2”更易受负电性的N原子进攻。(3) 由投影式可知,体心有1个黑球,晶胞中黑球数为8×+1=2,沿x轴,y轴和z轴的投影都相同,由投影可知,晶胞中至少有4个白球,由Cu2O化学式可知,内部有4个白球。将晶胞分成8个小立方体,不相邻的4个小立方体的体心有1个白球。(4) ①铜基电极为阴极,电压为U1 V时,水中的H+放电生成H2,同时有OH-生成,OH-吸收铜基电极上的CO2生成HCO。或者OH-可以继续和溶液中的HCO反应生成CO。②由图示知,提高电压,H2的法拉第效率下降,有机物的法拉第效率上升。因为是CO2与水中H+的竞争反应,所以可以增大CO2的流速。③CO可以作配体与金属离子形成配位键,CO作配体时,配位原子是C原子。④电压从U2 V增大到U3 V时,由图可知,CO、HCOO-的法拉第效率减小,由③可知,CO可与催化剂Cu的活性位点结合形成配合物,生成的配合物覆盖在催化剂表面,导电能力减弱。电压继续增大,CO继续被还原,配合物转化为催化剂Cu,活性位点增多,电流增大。
同课章节目录
