“10道选择+2道大题”综合小卷(二)(含解析)2024-2025学年高考化学二轮复习 抢分练
文档属性
| 名称 | “10道选择+2道大题”综合小卷(二)(含解析)2024-2025学年高考化学二轮复习 抢分练 |  | |
| 格式 | doc | ||
| 文件大小 | 522.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-15 20:15:21 | ||
图片预览



文档简介
“10+2”综合小卷(二)
一、 选择题:每题只有一个选项符合题意。
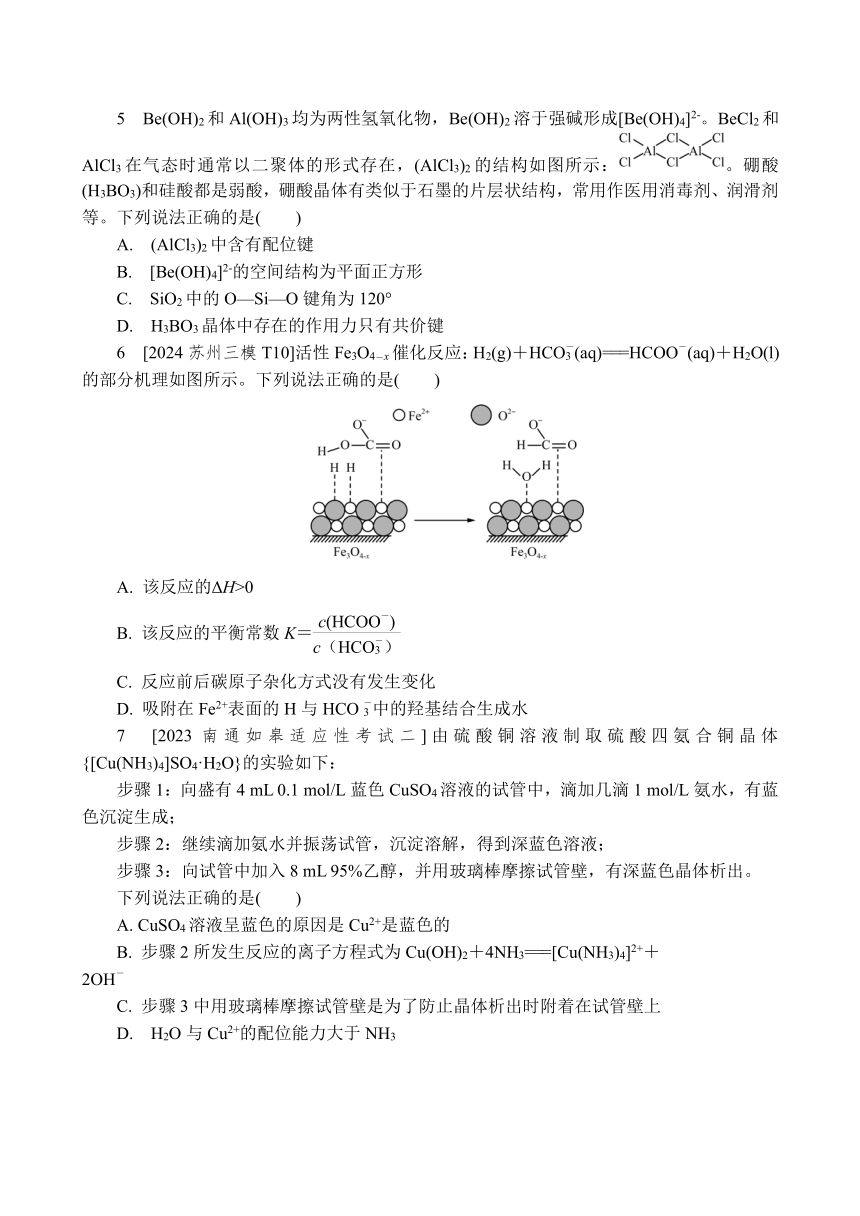
1 [2024无锡调研T2]碳化钙的晶胞如图所示,反应CaC2+2H2O===C2H2↑+Ca(OH)2常用于制备C2H2。下列有关说法正确的是( )
A. 1个C2H2中含有1个π键
B. C的电子式为[C C]2-
C. 碳化钙晶胞中含4个C
D. Ca(OH)2属于共价晶体
2 下列有关硫及其化合物的性质与用途具有对应关系的是( )
A. 二氧化硫具有氧化性,可用作葡萄酒的抗氧化剂
B. 亚硫酸钠溶液显碱性,可用于吸收少量的二氧化硫
C. 硫具有还原性,可用硫黄处理洒落的汞单质
D. 硫酸铜溶液具有酸性,可用作泳池杀菌剂
3 [2025南通海门中学调研T3]实验室由FeO、SiO2混合物制取FeCl3溶液的实验原理和装置不能达到实验目的的是( )
甲 乙 丙 丁
A. 用装置甲配制一定浓度的稀盐酸 B. 用装置乙浸出Fe2+
C. 用装置丙除去SiO2 D. 用装置丁获得FeCl3溶液
4 [2023南通海安期末]下列化学反应表示正确的是( )
A. CuSO4溶液中加入小粒金属钠:Cu2++2Na===Cu+2Na+
B. 用铜作电极电解CuSO4溶液:2Cu2++2H2O2Cu+O2↑+4H+
C. 稀硝酸洗涤做过银镜反应的试管:Ag+2H++NO===Ag++NO↑+H2O
D. 多余的[Ag(NH3)2]OH用硝酸处理:[Ag(NH3)2]++OH-+3H+===Ag++2NH+H2O
5 Be(OH)2和Al(OH)3均为两性氢氧化物,Be(OH)2溶于强碱形成[Be(OH)4]2-。BeCl2和 AlCl3在气态时通常以二聚体的形式存在,(AlCl3)2的结构如图所示:。硼酸(H3BO3)和硅酸都是弱酸,硼酸晶体有类似于石墨的片层状结构,常用作医用消毒剂、润滑剂等。下列说法正确的是( )
A. (AlCl3)2中含有配位键
B. [Be(OH)4]2-的空间结构为平面正方形
C. SiO2中的O—Si—O键角为120°
D. H3BO3晶体中存在的作用力只有共价键
6 [2024苏州三模T10]活性Fe3O4-x催化反应:H2(g)+HCO(aq)===HCOO-(aq)+H2O(l)的部分机理如图所示。下列说法正确的是( )
A. 该反应的ΔH>0
B. 该反应的平衡常数K= eq \f(c(HCOO-),c(HCO))
C. 反应前后碳原子杂化方式没有发生变化
D. 吸附在Fe2+表面的H与HCO中的羟基结合生成水
7 [2023南通如皋适应性考试二]由硫酸铜溶液制取硫酸四氨合铜晶体{[Cu(NH3)4]SO4·H2O}的实验如下:
步骤1:向盛有4 mL 0.1 mol/L蓝色CuSO4溶液的试管中,滴加几滴1 mol/L氨水,有蓝色沉淀生成;
步骤2:继续滴加氨水并振荡试管,沉淀溶解,得到深蓝色溶液;
步骤3:向试管中加入8 mL 95%乙醇,并用玻璃棒摩擦试管壁,有深蓝色晶体析出。
下列说法正确的是( )
A. CuSO4溶液呈蓝色的原因是Cu2+是蓝色的
B. 步骤2所发生反应的离子方程式为Cu(OH)2+4NH3===[Cu(NH3)4]2++
2OH-
C. 步骤3中用玻璃棒摩擦试管壁是为了防止晶体析出时附着在试管壁上
D. H2O与Cu2+的配位能力大于NH3
8 [2025苏州期中调研T8]一种浓差电池的放电原理是利用电解质溶液的浓度不同而产生电流。某浓差电池装置示意图如图所示,该电池使用前将开关K先与a连接一段时间后再与b连接。下列说法不正确的是( )
A. 交换膜应当选择阳离子交换膜
B. K与a连接的目的是形成两电极区溶液的浓度差
C. K与b连接时,电极B上发生的反应为Cu2++2e-===Cu
D. K与b连接时,导线中通过2 mol电子,约有1 mol离子通过交换膜
9 [2024徐州睢宁一中联考T9]化合物Z是一种治疗糖尿病药物的中间体,可由下列反应制得。
下列有关X、Y、Z的说法正确的是( )
A. 1 mol X中含有2 mol 碳氧π键
B. X在水中的溶解度比Y大
C. Z与足量H2加成的产物分子中含有2个手性碳原子
D. X、Y、Z分别与足量酸性KMnO4溶液反应所得芳香族化合物相同
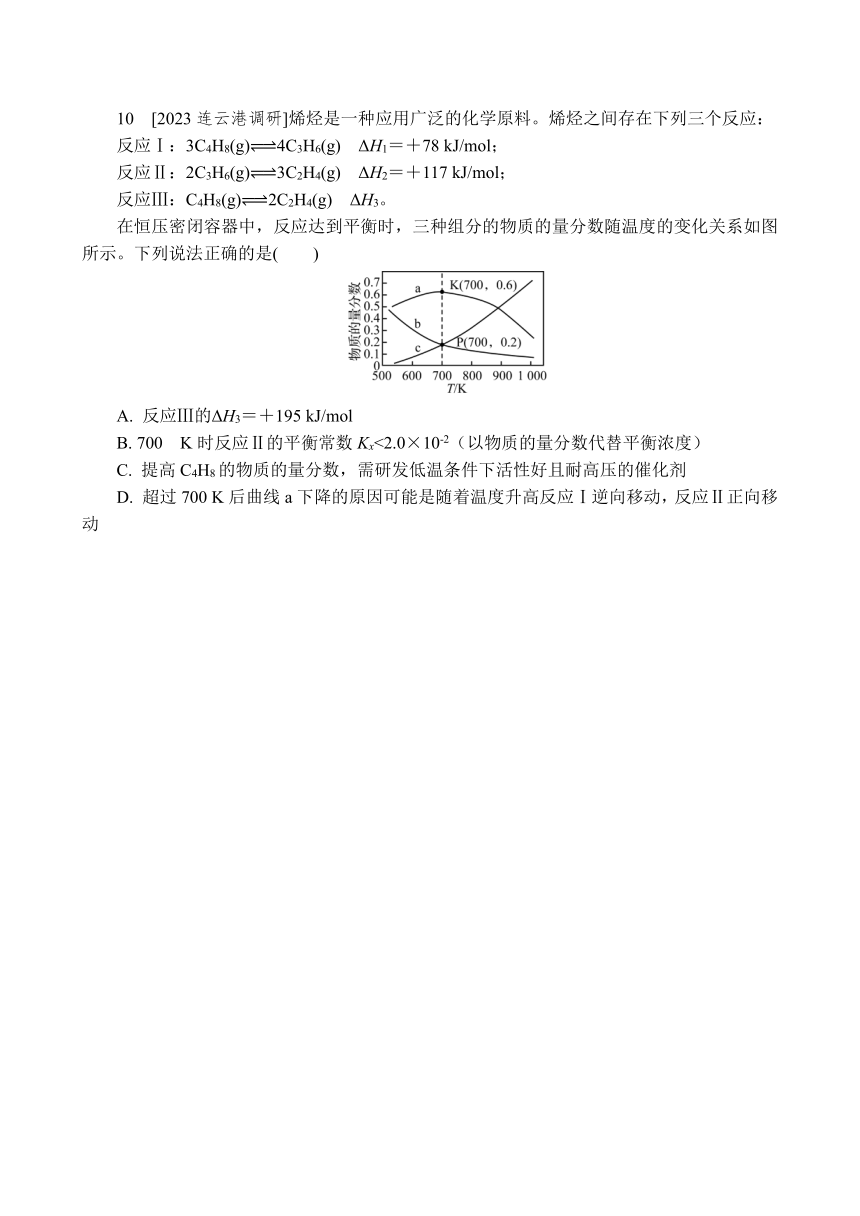
10 [2023连云港调研]烯烃是一种应用广泛的化学原料。烯烃之间存在下列三个反应:
反应Ⅰ:3C4H8(g) 4C3H6(g) ΔH1=+78 kJ/mol;
反应Ⅱ:2C3H6(g) 3C2H4(g) ΔH2=+117 kJ/mol;
反应Ⅲ:C4H8(g) 2C2H4(g) ΔH3。
在恒压密闭容器中,反应达到平衡时,三种组分的物质的量分数随温度的变化关系如图所示。下列说法正确的是( )
A. 反应Ⅲ的ΔH3=+195 kJ/mol
B. 700 K时反应Ⅱ的平衡常数Kx<2.0×10-2(以物质的量分数代替平衡浓度)
C. 提高C4H8的物质的量分数,需研发低温条件下活性好且耐高压的催化剂
D. 超过700 K后曲线a下降的原因可能是随着温度升高反应Ⅰ逆向移动,反应Ⅱ正向移动
二、 非选择题。
11 [2024苏锡常镇一调T14]钴的氧化物常用于制取催化剂和颜料等。以含钴废料(含Co2O3和少量Fe、Al、Mn、Ca、Mg等的氧化物及少量活性炭)为原料制取钴的氧化物的流程如下。
已知:萃取时发生的反应为Co2++n(HA)2 CoA2·(n-1)(HA)2+2H+。
(1) 除Fe、Al:先加入NaClO3溶液,再加入Na2CO3溶液调节pH。写出NaClO3氧化Fe2+的离子方程式:_________________________________________________
______________________________________________________________________。
(2) 除Ca、Mg:当某离子浓度c≤1×10-6 mol/L时,认为该离子已除尽。
①为使Ca2+、Mg2+除尽,必须保持溶液中c(F-)≥ mol/L。
②若调节溶液的pH偏低,将会导致Ca2+、Mg2+沉淀不完全,其原因是______
_____________________________________________________________________
[Ksp(CaF2)=1.0×10-10,Ksp(MgF2)=7.4×10-11,Ka(HF)=3.5×10-4]。
(3) 萃取、反萃取:加入某有机酸萃取剂(HA)2,实验测得Co2+萃取率随pH的变化如图所示。向萃取所得有机相中加入H2SO4,反萃取得到水相。
①该工艺中设计萃取、反萃取的目的是_________________________________
______________________________________________________________________。
②Co2+萃取率随pH升高先增大后减小的可能原因是_____________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
(4) 热分解:向反萃取所得水相中加入(NH4)2C2O4溶液,充分反应后,得到CoC2O4·2H2O。将CoC2O4·2H2O在空气中加热可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。
①B点剩余固体产物为 (Co—59,写出计算过程)。
②钴的一种氧化物的晶胞如图所示,在该晶体中与一个钴原子等距离且最近的钴原子有 个。
12 [2025南通海门中学调研T16]某学习小组利用下图所示装置测定空气中甲醛的含量。
(1) 高锰酸钾测定法
步骤Ⅰ:将40.00 mL 0.000 1 mol/L KMnO4溶液盛放于A中,再加入硫酸酸化。
步骤Ⅱ:取下玻璃塞,打开K1,关闭K2,使可滑动隔板慢慢由最右端拉至最左端,关闭K1,打开K2,缓慢推动滑动隔板至最右端,将气体全部推出。
步骤Ⅲ:重复上述操作至三颈烧中溶液恰好褪色。
①反应过程中有CO2逸出,写出A中发生反应的离子方程式:______________
______________________________________________________。
②若1 L待测空气中含有2.5×10-6 mol甲醛,则至少将“步骤Ⅱ”进行 次才能使溶液褪色。
③图中用毛细管代替玻璃导管,其目的是_______________________________
______________________________________________________________________。
(2) 银 Ferrozine 法
测定方法:先制备银氨溶液,然后向银氨溶液中通入甲醛,将银氨溶液还原为Ag,然后通过测定Ag的量计算出甲醛的含量。
①画出[Ag(NH3)2]+的结构式: 。
②制备银氨溶液时,仪器A中放置的药品是_______________________(填“AgNO3溶液”或“氨水”)。
③补充完整用含银废料[Ag、Al(OH)3]制备硝酸银晶体实验方案:取一定量的含银废料,_____________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________,
蒸发浓缩、冷却结晶,用无水乙醇洗涤2~3次,干燥(实验中必须使用的试剂和设备:10 mol/L HNO3、稀盐酸、通风设备)。
“10+2”综合小卷(二)
1 C C2H2分子的结构式为H—C≡C—H,有2个π键,A错误;C的电子式为,B错误;由均摊法可知,CaC2晶胞中含有的N(C)=8×+6×=4,C正确;Ca(OH)2属于离子晶体,D错误。
2 B SO2可用作葡萄酒的抗氧化剂,利用了SO2的还原性,A错误;亚硫酸钠溶液显碱性,能和酸性氧化物SO2反应,可用亚硫酸钠溶液吸收少量SO2,B正确;用硫黄处理洒落的汞单质,汞和硫反应生成硫化汞,利用了S的氧化性,C错误;硫酸铜是重金属盐,可以使蛋白质变性,可用作游泳池的杀菌剂,D错误。
3 A 装置甲为容量瓶,不可用于稀释浓盐酸,A错误;用装置乙浸出Fe2+,盐酸可与FeO发生反应得到FeCl2,B正确;过滤可分离不溶性杂质与溶液,SiO2不溶于盐酸,故过滤可分离出SiO2固体,C正确;用装置丁将氯气通入含有FeCl2的溶液,发生氧化还原反应得到FeCl3溶液,D正确。
4 D Na优先与CuSO4溶液中的H2O反应,不会置换出Cu,A错误;用铜作电极时,阳极铜失去电子被氧化,B错误;O原子不守恒,C错误;[Ag(NH3)2]OH与硝酸反应生成AgNO3、NH4NO3和H2O,则多余的[Ag(NH3)2]OH可用硝酸处理,D正确。
5 A (AlCl3)2中Al原子提供空轨道、Cl原子提供孤电子对,以此来形成配位键,A正确;[Be(OH)4]2-的中心原子为Be,Be原子和4个OH-形成共价键,Be原子采用sp3杂化,空间结构应为正四面体形,B错误;SiO2为共价晶体,每个O原子被2个Si原子共用,每个Si原子分别与4个O原子相连,故Si原子采用sp3杂化,形成正四面体结构,键角为109°28′,C错误;H3BO3晶体中存在的作用力除了共价键外,还有分子间作用力,D错误。
6 C 该反应是熵减反应,能自发,说明该反应放热,A错误;该反应中的H2也应写进平衡常数表达式,B错误;HCO、HCOO-中碳原子均为sp2杂化,C正确;吸附在O2-上的H原子显正电性,与HCO中的羟基结合生成水,D错误。
7 B 含Cu2+的溶液呈蓝色,是因为[Cu(H2O)4]2+呈蓝色,A错误;步骤3中用玻璃棒摩擦试管壁有利于生成晶核,C错误;由步骤1、2可知,最终生成[Cu(NH3)4]2+,可见NH3与Cu2+的配位能力大于H2O,D错误。
8 A 交换膜应当选择阴离子交换膜,阻止阳极Cu2+通过,以保证两侧溶液中有Cu2+浓度差,A错误;K与a连接时,电极B为阳极,电极反应式为Cu-2e-===Cu2+,电极A为阴极,电极反应式为Cu2++2e-===Cu,其目的是形成两电极区溶液的浓度差,B正确;K与b连接时,电极B为正极,电极反应式为Cu2++2e-===Cu,C正确;离子交换膜为阴离子交换膜,故K与b连接时,导线中通过2 mol电子,约有1 mol离子(即SO)通过交换膜,D正确。
9 B X分子中只有羧基上存在碳氧π键,故1 mol X中含有1 mol 碳氧π键,A错误;X分子中存在2个亲水基(酚羟基和羧基),而Y分子中醚键和酯基的亲水性都比较弱,故X在水中的溶解度比Y大,B正确;Z分子中苯环可以和H2发生加成反应,加成产物分子中含有3个手性碳原子,C错误;X分子中的甲基和酚羟基均被氧化,甲基被氧化为羧基,酚羟基被氧化会导致苯环结构被破坏,而Y和Z分子中的甲基和—CH2COOH均被氧化成羧基,产物不同,D错误。
10 C 得到反应Ⅲ,ΔH3=+104 kJ/mol,A错误;反应Ⅰ、Ⅱ是连续反应,随温度升高,丁烯逐渐减少,丙烯先增大后减少,乙烯逐渐增大,即丁烯、丙烯、乙烯分别是曲线b、a、c,700 K时反应Ⅱ的平衡常数K=≈0.022>2.0×10-2,B错误;反应Ⅰ、Ⅲ都是体积增大的反应且吸热,要提高C4H8的物质的量分数,需研发低温条件下活性好且耐高压的催化剂,加压后,平衡逆向移动,C正确;根据图中信息,丁烯的物质的量分数不断减小,则超过700 K后曲线a下降的原因可能是反应Ⅱ正向移动的程度增大,D错误。
11 (1) 6Fe2++ClO+6H+===6Fe3++Cl-+3H2O
(2) ①0.01 ②pH偏低,较多的F-与H+形成弱酸HF,导致溶液中F-浓度减小,使Ca2+、Mg2+不能完全转化为沉淀
(3) ①分离提纯并富集Co2+ ②当pH<6.5时,随着pH升高,溶液中c(H+)减小,平衡向正反应方向移动,更多的Co2+与萃取剂反应,当pH>6.5时,随着pH升高,溶液中c(OH-)增大,Co2+与OH-形成Co(OH)2沉淀
(4) ①Co3O4
n(CoC2O4)=n(CoC2O4·2H2O)==0.1 mol,
0.1 mol ×147 g/mol =14.7 g,
故A点为CoC2O4,设B点化学式为CoOx,
n(CoOx)=n(CoC2O4)=0.1 mol,
M(CoOx)==80.3 g/mol,
由59+16x=80.3,解得x≈1.33,CoOx为Co3O4
②12
解析:(2) ①Ksp(CaF2)=1.0×10-10,Ksp(MgF2)=7.4×10-11,则CaF2溶解度更大,使Ca2+除尽,则需要保证c(F-)≥= mol/L=0.01 mol/L。(4) ② 根据“均摊法”知,晶胞中含有黑球个数=8×+6×=4,白球个数=12×+1=4,则钴、氧各自周围等距离且最近的钴、氧原子数目是相同的,以体心白球为例,周围等距离且最近的白球为12个,故在该晶体中与一个钴原子等距离且最近的钴原子有12个。
12 (1) ①5HCHO+4MnO+12H+ ===4Mn2++5CO2+11H2O ②2 ③减小空气通入速率,使空气中的HCHO被充分吸收
(2) ① 或
②AgNO3溶液 ③向其中加入稍过量的稀盐酸充分反应,过滤、洗涤滤渣,将滤渣转移至烧杯中,打开通风设备,向滤渣中加入稍过量的10 mol/L HNO3至固体完全溶解
解析:实验(1)利用氧化还原滴定原理,测定空气中甲醛的含量,实验(2)硝酸银溶液中滴加氨水生成AgOH白色沉淀,加入过量氨水沉淀溶解,得到银氨溶液,故仪器A中为硝酸银溶液,仪器B中为氨水,反应生成银氨溶液,再向银氨溶液中通入甲醛,将银氨溶液还原为Ag,最后通过测定Ag的量计算出甲醛的含量。(1) ①甲醛和酸性高锰酸钾反应过程中有CO2逸出,甲醛被氧化,高锰酸钾被还原生成Mn2+。②40.00 mL 0.000 1 mol/L KMnO4的物质的量=0.04 L×0.000 1 mol/L =4×10-6 mol,由关系式:5HCHO~4MnO知,若1 L待测空气中含有2.5×10-6 mol甲醛,需要消耗n(KMnO4)=×2.5×10-6 mol=2×10-6 mol,则至少将“步骤Ⅱ”进行2次才能消耗完高锰酸钾,使溶液褪色。(2) ①[Ag(NH3)2]+中,Ag+提供空轨道,氨气中N原子提供孤电子对,形成配位键,氨气内N、H之间存在共价键,其结构式见答案。②硝酸银溶液中滴加氨水生成AgOH白色沉淀,加入过量氨水沉淀溶解,得到银氨溶液,故仪器A中为硝酸银溶液。
一、 选择题:每题只有一个选项符合题意。
1 [2024无锡调研T2]碳化钙的晶胞如图所示,反应CaC2+2H2O===C2H2↑+Ca(OH)2常用于制备C2H2。下列有关说法正确的是( )
A. 1个C2H2中含有1个π键
B. C的电子式为[C C]2-
C. 碳化钙晶胞中含4个C
D. Ca(OH)2属于共价晶体
2 下列有关硫及其化合物的性质与用途具有对应关系的是( )
A. 二氧化硫具有氧化性,可用作葡萄酒的抗氧化剂
B. 亚硫酸钠溶液显碱性,可用于吸收少量的二氧化硫
C. 硫具有还原性,可用硫黄处理洒落的汞单质
D. 硫酸铜溶液具有酸性,可用作泳池杀菌剂
3 [2025南通海门中学调研T3]实验室由FeO、SiO2混合物制取FeCl3溶液的实验原理和装置不能达到实验目的的是( )
甲 乙 丙 丁
A. 用装置甲配制一定浓度的稀盐酸 B. 用装置乙浸出Fe2+
C. 用装置丙除去SiO2 D. 用装置丁获得FeCl3溶液
4 [2023南通海安期末]下列化学反应表示正确的是( )
A. CuSO4溶液中加入小粒金属钠:Cu2++2Na===Cu+2Na+
B. 用铜作电极电解CuSO4溶液:2Cu2++2H2O2Cu+O2↑+4H+
C. 稀硝酸洗涤做过银镜反应的试管:Ag+2H++NO===Ag++NO↑+H2O
D. 多余的[Ag(NH3)2]OH用硝酸处理:[Ag(NH3)2]++OH-+3H+===Ag++2NH+H2O
5 Be(OH)2和Al(OH)3均为两性氢氧化物,Be(OH)2溶于强碱形成[Be(OH)4]2-。BeCl2和 AlCl3在气态时通常以二聚体的形式存在,(AlCl3)2的结构如图所示:。硼酸(H3BO3)和硅酸都是弱酸,硼酸晶体有类似于石墨的片层状结构,常用作医用消毒剂、润滑剂等。下列说法正确的是( )
A. (AlCl3)2中含有配位键
B. [Be(OH)4]2-的空间结构为平面正方形
C. SiO2中的O—Si—O键角为120°
D. H3BO3晶体中存在的作用力只有共价键
6 [2024苏州三模T10]活性Fe3O4-x催化反应:H2(g)+HCO(aq)===HCOO-(aq)+H2O(l)的部分机理如图所示。下列说法正确的是( )
A. 该反应的ΔH>0
B. 该反应的平衡常数K= eq \f(c(HCOO-),c(HCO))
C. 反应前后碳原子杂化方式没有发生变化
D. 吸附在Fe2+表面的H与HCO中的羟基结合生成水
7 [2023南通如皋适应性考试二]由硫酸铜溶液制取硫酸四氨合铜晶体{[Cu(NH3)4]SO4·H2O}的实验如下:
步骤1:向盛有4 mL 0.1 mol/L蓝色CuSO4溶液的试管中,滴加几滴1 mol/L氨水,有蓝色沉淀生成;
步骤2:继续滴加氨水并振荡试管,沉淀溶解,得到深蓝色溶液;
步骤3:向试管中加入8 mL 95%乙醇,并用玻璃棒摩擦试管壁,有深蓝色晶体析出。
下列说法正确的是( )
A. CuSO4溶液呈蓝色的原因是Cu2+是蓝色的
B. 步骤2所发生反应的离子方程式为Cu(OH)2+4NH3===[Cu(NH3)4]2++
2OH-
C. 步骤3中用玻璃棒摩擦试管壁是为了防止晶体析出时附着在试管壁上
D. H2O与Cu2+的配位能力大于NH3
8 [2025苏州期中调研T8]一种浓差电池的放电原理是利用电解质溶液的浓度不同而产生电流。某浓差电池装置示意图如图所示,该电池使用前将开关K先与a连接一段时间后再与b连接。下列说法不正确的是( )
A. 交换膜应当选择阳离子交换膜
B. K与a连接的目的是形成两电极区溶液的浓度差
C. K与b连接时,电极B上发生的反应为Cu2++2e-===Cu
D. K与b连接时,导线中通过2 mol电子,约有1 mol离子通过交换膜
9 [2024徐州睢宁一中联考T9]化合物Z是一种治疗糖尿病药物的中间体,可由下列反应制得。
下列有关X、Y、Z的说法正确的是( )
A. 1 mol X中含有2 mol 碳氧π键
B. X在水中的溶解度比Y大
C. Z与足量H2加成的产物分子中含有2个手性碳原子
D. X、Y、Z分别与足量酸性KMnO4溶液反应所得芳香族化合物相同
10 [2023连云港调研]烯烃是一种应用广泛的化学原料。烯烃之间存在下列三个反应:
反应Ⅰ:3C4H8(g) 4C3H6(g) ΔH1=+78 kJ/mol;
反应Ⅱ:2C3H6(g) 3C2H4(g) ΔH2=+117 kJ/mol;
反应Ⅲ:C4H8(g) 2C2H4(g) ΔH3。
在恒压密闭容器中,反应达到平衡时,三种组分的物质的量分数随温度的变化关系如图所示。下列说法正确的是( )
A. 反应Ⅲ的ΔH3=+195 kJ/mol
B. 700 K时反应Ⅱ的平衡常数Kx<2.0×10-2(以物质的量分数代替平衡浓度)
C. 提高C4H8的物质的量分数,需研发低温条件下活性好且耐高压的催化剂
D. 超过700 K后曲线a下降的原因可能是随着温度升高反应Ⅰ逆向移动,反应Ⅱ正向移动
二、 非选择题。
11 [2024苏锡常镇一调T14]钴的氧化物常用于制取催化剂和颜料等。以含钴废料(含Co2O3和少量Fe、Al、Mn、Ca、Mg等的氧化物及少量活性炭)为原料制取钴的氧化物的流程如下。
已知:萃取时发生的反应为Co2++n(HA)2 CoA2·(n-1)(HA)2+2H+。
(1) 除Fe、Al:先加入NaClO3溶液,再加入Na2CO3溶液调节pH。写出NaClO3氧化Fe2+的离子方程式:_________________________________________________
______________________________________________________________________。
(2) 除Ca、Mg:当某离子浓度c≤1×10-6 mol/L时,认为该离子已除尽。
①为使Ca2+、Mg2+除尽,必须保持溶液中c(F-)≥ mol/L。
②若调节溶液的pH偏低,将会导致Ca2+、Mg2+沉淀不完全,其原因是______
_____________________________________________________________________
[Ksp(CaF2)=1.0×10-10,Ksp(MgF2)=7.4×10-11,Ka(HF)=3.5×10-4]。
(3) 萃取、反萃取:加入某有机酸萃取剂(HA)2,实验测得Co2+萃取率随pH的变化如图所示。向萃取所得有机相中加入H2SO4,反萃取得到水相。
①该工艺中设计萃取、反萃取的目的是_________________________________
______________________________________________________________________。
②Co2+萃取率随pH升高先增大后减小的可能原因是_____________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
(4) 热分解:向反萃取所得水相中加入(NH4)2C2O4溶液,充分反应后,得到CoC2O4·2H2O。将CoC2O4·2H2O在空气中加热可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。
①B点剩余固体产物为 (Co—59,写出计算过程)。
②钴的一种氧化物的晶胞如图所示,在该晶体中与一个钴原子等距离且最近的钴原子有 个。
12 [2025南通海门中学调研T16]某学习小组利用下图所示装置测定空气中甲醛的含量。
(1) 高锰酸钾测定法
步骤Ⅰ:将40.00 mL 0.000 1 mol/L KMnO4溶液盛放于A中,再加入硫酸酸化。
步骤Ⅱ:取下玻璃塞,打开K1,关闭K2,使可滑动隔板慢慢由最右端拉至最左端,关闭K1,打开K2,缓慢推动滑动隔板至最右端,将气体全部推出。
步骤Ⅲ:重复上述操作至三颈烧中溶液恰好褪色。
①反应过程中有CO2逸出,写出A中发生反应的离子方程式:______________
______________________________________________________。
②若1 L待测空气中含有2.5×10-6 mol甲醛,则至少将“步骤Ⅱ”进行 次才能使溶液褪色。
③图中用毛细管代替玻璃导管,其目的是_______________________________
______________________________________________________________________。
(2) 银 Ferrozine 法
测定方法:先制备银氨溶液,然后向银氨溶液中通入甲醛,将银氨溶液还原为Ag,然后通过测定Ag的量计算出甲醛的含量。
①画出[Ag(NH3)2]+的结构式: 。
②制备银氨溶液时,仪器A中放置的药品是_______________________(填“AgNO3溶液”或“氨水”)。
③补充完整用含银废料[Ag、Al(OH)3]制备硝酸银晶体实验方案:取一定量的含银废料,_____________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________,
蒸发浓缩、冷却结晶,用无水乙醇洗涤2~3次,干燥(实验中必须使用的试剂和设备:10 mol/L HNO3、稀盐酸、通风设备)。
“10+2”综合小卷(二)
1 C C2H2分子的结构式为H—C≡C—H,有2个π键,A错误;C的电子式为,B错误;由均摊法可知,CaC2晶胞中含有的N(C)=8×+6×=4,C正确;Ca(OH)2属于离子晶体,D错误。
2 B SO2可用作葡萄酒的抗氧化剂,利用了SO2的还原性,A错误;亚硫酸钠溶液显碱性,能和酸性氧化物SO2反应,可用亚硫酸钠溶液吸收少量SO2,B正确;用硫黄处理洒落的汞单质,汞和硫反应生成硫化汞,利用了S的氧化性,C错误;硫酸铜是重金属盐,可以使蛋白质变性,可用作游泳池的杀菌剂,D错误。
3 A 装置甲为容量瓶,不可用于稀释浓盐酸,A错误;用装置乙浸出Fe2+,盐酸可与FeO发生反应得到FeCl2,B正确;过滤可分离不溶性杂质与溶液,SiO2不溶于盐酸,故过滤可分离出SiO2固体,C正确;用装置丁将氯气通入含有FeCl2的溶液,发生氧化还原反应得到FeCl3溶液,D正确。
4 D Na优先与CuSO4溶液中的H2O反应,不会置换出Cu,A错误;用铜作电极时,阳极铜失去电子被氧化,B错误;O原子不守恒,C错误;[Ag(NH3)2]OH与硝酸反应生成AgNO3、NH4NO3和H2O,则多余的[Ag(NH3)2]OH可用硝酸处理,D正确。
5 A (AlCl3)2中Al原子提供空轨道、Cl原子提供孤电子对,以此来形成配位键,A正确;[Be(OH)4]2-的中心原子为Be,Be原子和4个OH-形成共价键,Be原子采用sp3杂化,空间结构应为正四面体形,B错误;SiO2为共价晶体,每个O原子被2个Si原子共用,每个Si原子分别与4个O原子相连,故Si原子采用sp3杂化,形成正四面体结构,键角为109°28′,C错误;H3BO3晶体中存在的作用力除了共价键外,还有分子间作用力,D错误。
6 C 该反应是熵减反应,能自发,说明该反应放热,A错误;该反应中的H2也应写进平衡常数表达式,B错误;HCO、HCOO-中碳原子均为sp2杂化,C正确;吸附在O2-上的H原子显正电性,与HCO中的羟基结合生成水,D错误。
7 B 含Cu2+的溶液呈蓝色,是因为[Cu(H2O)4]2+呈蓝色,A错误;步骤3中用玻璃棒摩擦试管壁有利于生成晶核,C错误;由步骤1、2可知,最终生成[Cu(NH3)4]2+,可见NH3与Cu2+的配位能力大于H2O,D错误。
8 A 交换膜应当选择阴离子交换膜,阻止阳极Cu2+通过,以保证两侧溶液中有Cu2+浓度差,A错误;K与a连接时,电极B为阳极,电极反应式为Cu-2e-===Cu2+,电极A为阴极,电极反应式为Cu2++2e-===Cu,其目的是形成两电极区溶液的浓度差,B正确;K与b连接时,电极B为正极,电极反应式为Cu2++2e-===Cu,C正确;离子交换膜为阴离子交换膜,故K与b连接时,导线中通过2 mol电子,约有1 mol离子(即SO)通过交换膜,D正确。
9 B X分子中只有羧基上存在碳氧π键,故1 mol X中含有1 mol 碳氧π键,A错误;X分子中存在2个亲水基(酚羟基和羧基),而Y分子中醚键和酯基的亲水性都比较弱,故X在水中的溶解度比Y大,B正确;Z分子中苯环可以和H2发生加成反应,加成产物分子中含有3个手性碳原子,C错误;X分子中的甲基和酚羟基均被氧化,甲基被氧化为羧基,酚羟基被氧化会导致苯环结构被破坏,而Y和Z分子中的甲基和—CH2COOH均被氧化成羧基,产物不同,D错误。
10 C 得到反应Ⅲ,ΔH3=+104 kJ/mol,A错误;反应Ⅰ、Ⅱ是连续反应,随温度升高,丁烯逐渐减少,丙烯先增大后减少,乙烯逐渐增大,即丁烯、丙烯、乙烯分别是曲线b、a、c,700 K时反应Ⅱ的平衡常数K=≈0.022>2.0×10-2,B错误;反应Ⅰ、Ⅲ都是体积增大的反应且吸热,要提高C4H8的物质的量分数,需研发低温条件下活性好且耐高压的催化剂,加压后,平衡逆向移动,C正确;根据图中信息,丁烯的物质的量分数不断减小,则超过700 K后曲线a下降的原因可能是反应Ⅱ正向移动的程度增大,D错误。
11 (1) 6Fe2++ClO+6H+===6Fe3++Cl-+3H2O
(2) ①0.01 ②pH偏低,较多的F-与H+形成弱酸HF,导致溶液中F-浓度减小,使Ca2+、Mg2+不能完全转化为沉淀
(3) ①分离提纯并富集Co2+ ②当pH<6.5时,随着pH升高,溶液中c(H+)减小,平衡向正反应方向移动,更多的Co2+与萃取剂反应,当pH>6.5时,随着pH升高,溶液中c(OH-)增大,Co2+与OH-形成Co(OH)2沉淀
(4) ①Co3O4
n(CoC2O4)=n(CoC2O4·2H2O)==0.1 mol,
0.1 mol ×147 g/mol =14.7 g,
故A点为CoC2O4,设B点化学式为CoOx,
n(CoOx)=n(CoC2O4)=0.1 mol,
M(CoOx)==80.3 g/mol,
由59+16x=80.3,解得x≈1.33,CoOx为Co3O4
②12
解析:(2) ①Ksp(CaF2)=1.0×10-10,Ksp(MgF2)=7.4×10-11,则CaF2溶解度更大,使Ca2+除尽,则需要保证c(F-)≥= mol/L=0.01 mol/L。(4) ② 根据“均摊法”知,晶胞中含有黑球个数=8×+6×=4,白球个数=12×+1=4,则钴、氧各自周围等距离且最近的钴、氧原子数目是相同的,以体心白球为例,周围等距离且最近的白球为12个,故在该晶体中与一个钴原子等距离且最近的钴原子有12个。
12 (1) ①5HCHO+4MnO+12H+ ===4Mn2++5CO2+11H2O ②2 ③减小空气通入速率,使空气中的HCHO被充分吸收
(2) ① 或
②AgNO3溶液 ③向其中加入稍过量的稀盐酸充分反应,过滤、洗涤滤渣,将滤渣转移至烧杯中,打开通风设备,向滤渣中加入稍过量的10 mol/L HNO3至固体完全溶解
解析:实验(1)利用氧化还原滴定原理,测定空气中甲醛的含量,实验(2)硝酸银溶液中滴加氨水生成AgOH白色沉淀,加入过量氨水沉淀溶解,得到银氨溶液,故仪器A中为硝酸银溶液,仪器B中为氨水,反应生成银氨溶液,再向银氨溶液中通入甲醛,将银氨溶液还原为Ag,最后通过测定Ag的量计算出甲醛的含量。(1) ①甲醛和酸性高锰酸钾反应过程中有CO2逸出,甲醛被氧化,高锰酸钾被还原生成Mn2+。②40.00 mL 0.000 1 mol/L KMnO4的物质的量=0.04 L×0.000 1 mol/L =4×10-6 mol,由关系式:5HCHO~4MnO知,若1 L待测空气中含有2.5×10-6 mol甲醛,需要消耗n(KMnO4)=×2.5×10-6 mol=2×10-6 mol,则至少将“步骤Ⅱ”进行2次才能消耗完高锰酸钾,使溶液褪色。(2) ①[Ag(NH3)2]+中,Ag+提供空轨道,氨气中N原子提供孤电子对,形成配位键,氨气内N、H之间存在共价键,其结构式见答案。②硝酸银溶液中滴加氨水生成AgOH白色沉淀,加入过量氨水沉淀溶解,得到银氨溶液,故仪器A中为硝酸银溶液。
同课章节目录
