上海市青浦区2024-2025学年高三上学期期终学业质量调研(一模)化学试卷(PDF版,含答案)
文档属性
| 名称 | 上海市青浦区2024-2025学年高三上学期期终学业质量调研(一模)化学试卷(PDF版,含答案) |

|
|
| 格式 | |||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-16 15:10:57 | ||
图片预览



文档简介
2024-2025学年第一学期青浦区高三年级期终学业质量调研
化学学科试卷
(时间 60分钟,满分 100分)
考生注意:
1. 本考试设试卷和答题纸两部分,所有答题必须涂或写在答题纸上;做在试卷上一律不得分。
2. 答题前,考生务必在答题纸上将学校、姓名及考号填写清楚,并在规定的区域填涂相关信
息。答题时客观题用 2B铅笔涂写,主观题用黑色水笔填写。
3. 选择类试题中,标注“不定项”的试题,每小题有 1~2个正确选项,只有 1 个正确选项的,
多选不给分,有 2 个正确选项的,漏选 1 个给一半分,错选不给分;未特别标注的试题,每小
题只有 1个正确选项。
4. 答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 F-19 S-32 Ba-137
一、氮及其化合物
氮及其化合物在工农业生产、生活中有着重要的作用。
1.基态 N原子的价电子排布式为 。
2.液氨气化时破坏的作用力有 。(不定项)
A.离子键 B.共价键 C.氢键 D.范德华力
3.B3N3H6(无机苯)的结构与苯类似,也有大π键,结构式如右图所示。
该分子中,N原子的杂化形式为________。该分子的大π键中含有________
个电子。
A.1 B.2 C.3 D.6
HCN溶于水呈酸性,电离出的 CN-有毒。
4.HCN是 分子。
A.极性 B.非极性
5.比较 C、N元素的第一电离能大小,并从结构角度解释原因 。
6.HCN的酸根 CN-是一种配位能力很强的配体,食盐中常用的抗结剂 K4 [Fe(CN)6]就是一种由
CN-形成的配合物,其配离子[Fe(CN)6]4—的结构如右图所示:
1mol K4[Fe(CN)6]中含有σ键 mol。请结合配离子结构特点解释,食盐
中为什么可以安全添加K4 [Fe(CN)6]作为抗结剂_____________________________。
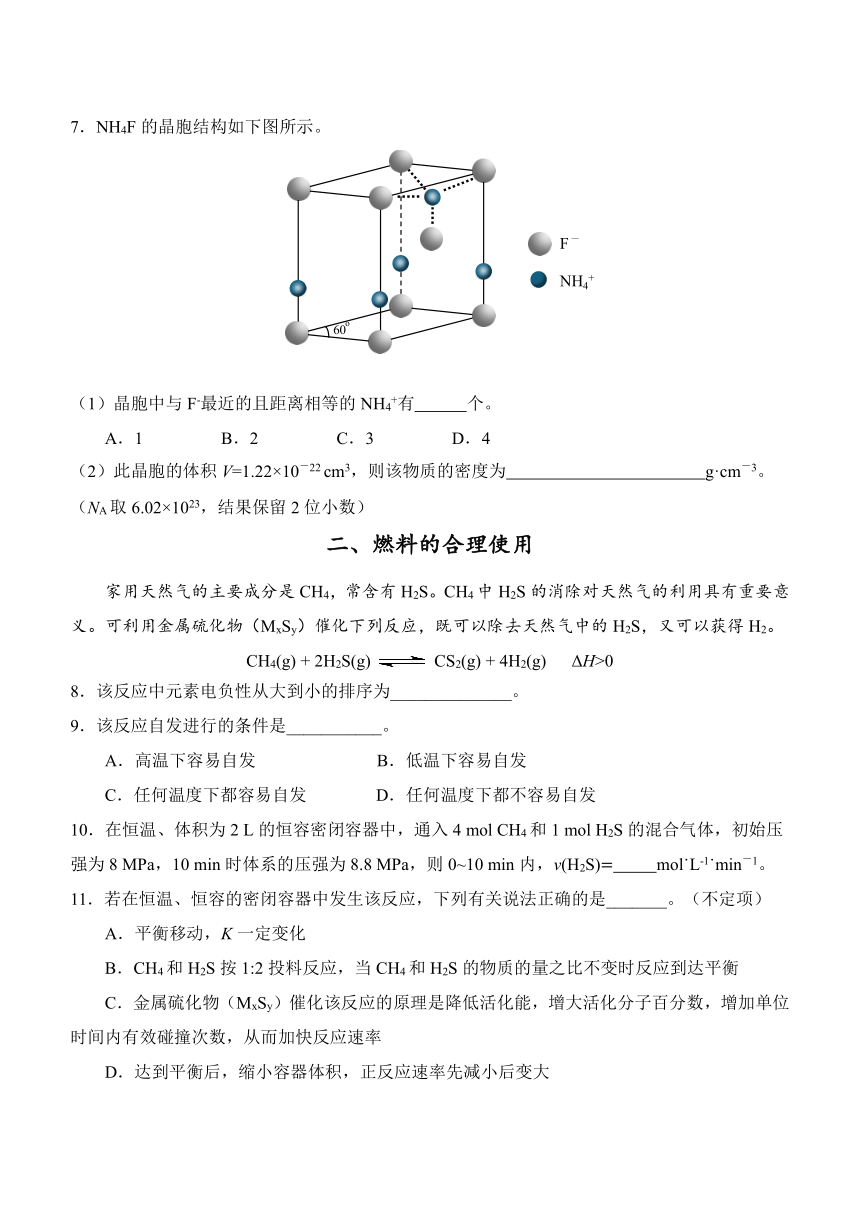
7.NH4F的晶胞结构如下图所示。
_
F
NH +4
60o
(1)晶胞中与 F-最近的且距离相等的 NH4+有 个。
A.1 B.2 C.3 D.4
(2)此晶胞的体积 V=1.22×10-22 cm3,则该物质的密度为 g·cm-3。
(NA取 6.02×1023,结果保留 2位小数)
二、燃料的合理使用
家用天然气的主要成分是 CH4,常含有 H2S。CH4中 H2S的消除对天然气的利用具有重要意
义。可利用金属硫化物(MxSy)催化下列反应,既可以除去天然气中的 H2S,又可以获得 H2。
CH4(g) + 2H2S(g) CS2(g) + 4H2(g) ΔH>0
8.该反应中元素电负性从大到小的排序为______________。
9.该反应自发进行的条件是___________。
A.高温下容易自发 B.低温下容易自发
C.任何温度下都容易自发 D.任何温度下都不容易自发
10.在恒温、体积为 2 L的恒容密闭容器中,通入 4 mol CH4和 1 mol H2S的混合气体,初始压
强为 8 MPa,10 min时体系的压强为 8.8 MPa,则 0~10 min内,v(H2S)= mol˙L-1˙min-1。
11.若在恒温、恒容的密闭容器中发生该反应,下列有关说法正确的是_______。(不定项)
A.平衡移动,K一定变化
B.CH4和 H2S按 1:2投料反应,当 CH4和 H2S的物质的量之比不变时反应到达平衡
C.金属硫化物(MxSy)催化该反应的原理是降低活化能,增大活化分子百分数,增加单位
时间内有效碰撞次数,从而加快反应速率
D.达到平衡后,缩小容器体积,正反应速率先减小后变大
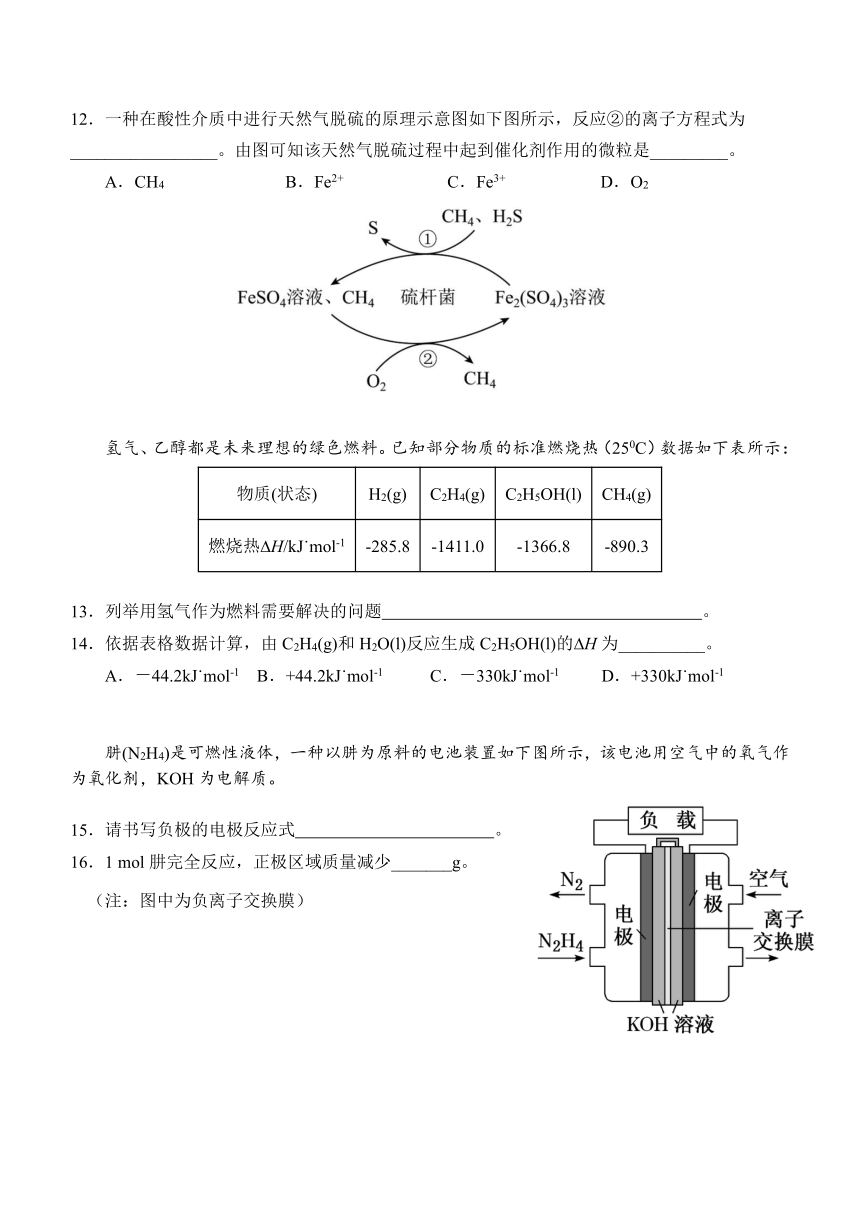
12.一种在酸性介质中进行天然气脱硫的原理示意图如下图所示,反应②的离子方程式为
_________________。由图可知该天然气脱硫过程中起到催化剂作用的微粒是_________。
A.CH4 B.Fe2+ C.Fe3+ D.O2
氢气、乙醇都是未来理想的绿色燃料。已知部分物质的标准燃烧热(250C)数据如下表所示:
物质(状态) H2(g) C2H4(g) C2H5OH(l) CH4(g)
燃烧热 H/kJ˙mol-1 -285.8 -1411.0 -1366.8 -890.3
13.列举用氢气作为燃料需要解决的问题 。
14.依据表格数据计算,由 C2H4(g)和 H2O(l)反应生成 C2H5OH(l)的 H为__________。
A.-44.2kJ˙mol-1 B.+44.2kJ˙mol-1 C.-330kJ˙mol-1 D.+330kJ˙mol-1
肼(N2H4)是可燃性液体,一种以肼为原料的电池装置如下图所示,该电池用空气中的氧气作
为氧化剂,KOH为电解质。
15.请书写负极的电极反应式 。
16.1 mol肼完全反应,正极区域质量减少_______g。
(注:图中为负离子交换膜)
三、气体的溶解
水是最常见的溶剂,不同气体在水中溶解程度不同。
常温常压下,1体积水能溶解约 2.6体积 H2S。通过 NaOH溶液调节氢硫酸 pH,溶液中各含
硫微粒物质的量分数δ随 pH c H S变化关系如下图[例如δ H S = 22 ]。c H2S +c HS- +c S2-
17.pH=7时,溶液中含硫微粒主要为 。(用微粒符号表示)
18. K a(1 H 2S) 。
K a(2 H 2S)
19.向 NaHS 溶液中加入一定量 CuSO4溶液,可产生 H2S气体,请结合平衡移动原理解释产生
气体的原因 。
20.pH=13时,c(Na+) - 3c(S2-) 0.1。(选填“>”、“<”或“=”)
常温常压下,1体积水能溶解约 40体积 SO2。
室温下,通过下列实验探究 SO2的性质。已知 Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8。
实验 1:将 SO2气体通入水中,测得溶液 pH=3。
实验 2:将 SO2气体通入 0.100 mol˙L-1NaOH溶液中,当溶液 pH=4时停止通气。
实验 3:将 SO2气体通入 0.100 mol˙L-1酸性 KMnO4溶液中,当溶液恰好褪色时停止通气。
21.请写出导致实验 1中溶液 pH=3主要的电离方程式 。
22.实验 2中 H2O的电离程度变化情况为 。
A.逐渐变大至不变 B.逐渐变小至不变
C.先变大,后变小至不变 D.先变小,后变大至不变
23.实验 3中,参与反应的 SO2与 KMnO4物质的量之比为 。
氨氮废水(主要溶质为 NH4Cl)可通过形成亚硫酸亚铁铵[(NH4)2Fe(SO3)2 H2O]沉淀进行处理。
向氨氮废水中依次加入 Na2SO3和 FeCl2溶液,使 NH4+、Fe2+、SO32-物质的量之比为 2:1:2,调节
初始 pH为 7.5进行反应,氨氮去除率和溶液 pH随时间变化如下图所示。
24.pH=5~8时生成(NH4)2Fe(SO3)2 H2O沉淀,该反应的离子方程式为 。
25.0~30 min时,氨氮去除率升高、溶液 pH降低的主要原因是 。
26.30 min后,溶液 pH继续降低的可能原因是 。
四、氯化钡晶体的制备
氯化钡常用于电子、仪表、冶金等工业。以重晶石矿(主要成分为 BaSO4,含少量 SiO2、Fe2O3
等)为原料制备纯净的 BaCl2 2H2O晶体途径如下:
27.“预处理”操作中包括将矿石粉碎,目的是 。
28.高温焙烧过程中,碳元素转化为一氧化碳,请结合脱硫 1中产生的气体,写出焙烧过程中
BaSO4发生反应的方程式 。
29.调节 pH所用试剂可能为 。(不定项)
A.盐酸 B.氧化铁 C.碳酸钠 D.氢氧化钡
30.调节 pH产生的沉淀成分为 。
31.“系列操作”包括蒸发浓缩、冷却结晶、 。
32.取实验制得的 BaCl2 2H2O样品(杂质不参与反应)2.600 g溶于水,配制成 100 mL 溶液。
用 0.200 mol˙L-1的 AgNO3溶液滴定,三次实验记录如下:
实验 BaCl2溶液体积 AgNO3溶液体积
1 10.00 mL 9.98 mL
2 10.00 mL 10.90 mL
3 10.00 mL 10.02 mL
(1)用 BaCl2 2H2O样品配制 100 mL BaCl2溶液,需要的定量仪器有 。
(2)计算样品纯度为 。(计算结果保留三位小数)
工业上也可用纯碱溶液浸泡重晶石矿,实现 BaSO4 转化为 BaCO3,进一步制得氯化钡。
33.若用 100 mL Na2CO3溶液将 2.33 g BaSO4 固体全都转化为 BaCO3,则所用 Na2CO3溶液的物
质的量浓度至少为 。(请写出计算过程)
已知:常温下 Ksp(BaSO4)=1.0×10-11,Ksp(BaCO3)=1.0×10-10]。(忽略溶液体积的变化)
五、共轭二烯烃
共轭二烯烃是一类特殊的烯烃,是常见的有机合成原料。以下是以共轭二烯 A为原料制备
化合物 I的合成路线(部分反应的条件省略)。
34.用系统命名法为 A命名_________________________。
35.反应①的反应类型为____________。
A.氧化反应 B.聚合反应 C.取代反应 D.加成反应
36.请写出化合物 H的含氧官能团的名称____________。
37.下列化合物 F可能的结构简式中,最合理的是____________。
A. B. C.
38.下列说法正确的是____________。(不定项)
A.化合物 A与 B都存在顺反异构体
B.化合物 C与 G含有的不对称碳原子的个数相同
C.化合物 E与 G都可以形成分子内氢键
D.化合物 E与 H互为同分异构体
39.请写出反应②不使用 Cu为催化剂、O2氧化的原因
_______________________________________________________________________________。
40.根据题意,化合物 H可以由 A与 J经过一步反应制得,请写出 J的结构简式____________。
41.请写出一种满足下列条件的化合物 E的同分异构体_________________。
①能与 FeCl3溶液发生显色反应,但不与浓溴水反应生成沉淀。
②分子中有 4种化学环境不同的氢原子。
由化合物 A也可以合成化合物 B:
42.请写出化合物 K制得 B的反应方程式________________________________________。
43.设计由 A合成 K的合成路线(必要的有机及无机试剂任选)。
(合成路线可表示为: )
答 案 2024.12
一、氮及其化合物(共 20分)
1.2s22p3(2分)
2.CD(2分)
3.sp2(2分) D(2分)
4.A(2分)
5.第一电离能:C(2分)
6.12(2分)[Fe(CN)6]4—无毒,CN—是一种配位能力很强的配体,[Fe(CN)6]4—难以解离出 CN—,
所以可以安全添加。(2分)
7.(1)D(2分)
(2)1.01(2分)
二、燃料的合理使用(共 21分)
8.S>C>H(2分)
9.A(2分)
10.0.025(2分)
11.C(2分)
12.4Fe2++O2+4H+=4Fe3++2H2O(2分),C(2分)
13.氢气的储存、运输和使用的安全性问题。(2分)
14.A(2分)
15.N H - -2 4+4OH -4e =N2↑+4H2O(2分)
16.36(3分)
三、气体的溶解(共 20分)
17.H2S、HS-(2分)
18.106(2分)
19.HS-发生电离:HS- H+ + S2-, S2-与 Cu2+结合生成 CuS沉淀,c(S2-)下降,电离平衡向
正方向移动,c(H+)增大,与 HS-结合生成 H2S气体。(2分)
20.<(2分)
21.H2SO3 H+ + HSO3-(2分)
22.C(2分)
23.5:2(2分)
24.2NH4++Fe2++2SO32-+H2O=(NH4)2Fe(SO3)2 H2O↓(2分)
25.SO32-水解产生 OH-,生成沉淀消耗大量 SO32-,c(H+)浓度变大。(2分)
26.SO32-被氧化为 SO42-,酸性增强。(2分)
四、氯化钡晶体的制备(共 19分)
27.增大反应物接触面积,加快化学反应速率。(2分)
高温
28.BaSO4+4C _
_________ BaS+4CO↑(2分)
29.BD(2分)
30.Fe(OH)3(或 Fe(OH)3、Fe2O3)(2分)
31.过滤、洗涤、干燥(2分)
32.(1)电子天平、100 mL 容量瓶(2分)
(2)0.938(3分)
33.1.1 mol˙L-1(4分)
BaSO4 s + CO32-( ) (aq) BaCO3 (s)+ SO42-(aq)
2
K= [SO4 ] = Ksp(BaSO4)=0.1,c(SO42-)= 2.33 233 =0.1mol˙L-1,c(CO32-)=1mol˙L-1
[CO 2 3 ] Ksp(BaCO3 0.1)
n(BaCO3)=n(BaSO4)=0.01mol,c(Na2CO )=1+ 0.013 =1.1mol˙L-1
0.1
五、共轭二烯烃(共 20分)
34.2,3-二甲基-1,3-丁二烯(2分)
35.D(1分)
36.酯基(1分)
37.A(2分)
38.BD(2分)
39.氧气可能会氧化 D分子内的碳碳双键。(2分)
40. (2分)
41. (2分)
42. (2分)
43.(每步 1分,共 4分)(第三、第四步用氧气氧化的不得分)
若使用基团保护法合成的也可以给分,如:
化学学科试卷
(时间 60分钟,满分 100分)
考生注意:
1. 本考试设试卷和答题纸两部分,所有答题必须涂或写在答题纸上;做在试卷上一律不得分。
2. 答题前,考生务必在答题纸上将学校、姓名及考号填写清楚,并在规定的区域填涂相关信
息。答题时客观题用 2B铅笔涂写,主观题用黑色水笔填写。
3. 选择类试题中,标注“不定项”的试题,每小题有 1~2个正确选项,只有 1 个正确选项的,
多选不给分,有 2 个正确选项的,漏选 1 个给一半分,错选不给分;未特别标注的试题,每小
题只有 1个正确选项。
4. 答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 F-19 S-32 Ba-137
一、氮及其化合物
氮及其化合物在工农业生产、生活中有着重要的作用。
1.基态 N原子的价电子排布式为 。
2.液氨气化时破坏的作用力有 。(不定项)
A.离子键 B.共价键 C.氢键 D.范德华力
3.B3N3H6(无机苯)的结构与苯类似,也有大π键,结构式如右图所示。
该分子中,N原子的杂化形式为________。该分子的大π键中含有________
个电子。
A.1 B.2 C.3 D.6
HCN溶于水呈酸性,电离出的 CN-有毒。
4.HCN是 分子。
A.极性 B.非极性
5.比较 C、N元素的第一电离能大小,并从结构角度解释原因 。
6.HCN的酸根 CN-是一种配位能力很强的配体,食盐中常用的抗结剂 K4 [Fe(CN)6]就是一种由
CN-形成的配合物,其配离子[Fe(CN)6]4—的结构如右图所示:
1mol K4[Fe(CN)6]中含有σ键 mol。请结合配离子结构特点解释,食盐
中为什么可以安全添加K4 [Fe(CN)6]作为抗结剂_____________________________。
7.NH4F的晶胞结构如下图所示。
_
F
NH +4
60o
(1)晶胞中与 F-最近的且距离相等的 NH4+有 个。
A.1 B.2 C.3 D.4
(2)此晶胞的体积 V=1.22×10-22 cm3,则该物质的密度为 g·cm-3。
(NA取 6.02×1023,结果保留 2位小数)
二、燃料的合理使用
家用天然气的主要成分是 CH4,常含有 H2S。CH4中 H2S的消除对天然气的利用具有重要意
义。可利用金属硫化物(MxSy)催化下列反应,既可以除去天然气中的 H2S,又可以获得 H2。
CH4(g) + 2H2S(g) CS2(g) + 4H2(g) ΔH>0
8.该反应中元素电负性从大到小的排序为______________。
9.该反应自发进行的条件是___________。
A.高温下容易自发 B.低温下容易自发
C.任何温度下都容易自发 D.任何温度下都不容易自发
10.在恒温、体积为 2 L的恒容密闭容器中,通入 4 mol CH4和 1 mol H2S的混合气体,初始压
强为 8 MPa,10 min时体系的压强为 8.8 MPa,则 0~10 min内,v(H2S)= mol˙L-1˙min-1。
11.若在恒温、恒容的密闭容器中发生该反应,下列有关说法正确的是_______。(不定项)
A.平衡移动,K一定变化
B.CH4和 H2S按 1:2投料反应,当 CH4和 H2S的物质的量之比不变时反应到达平衡
C.金属硫化物(MxSy)催化该反应的原理是降低活化能,增大活化分子百分数,增加单位
时间内有效碰撞次数,从而加快反应速率
D.达到平衡后,缩小容器体积,正反应速率先减小后变大
12.一种在酸性介质中进行天然气脱硫的原理示意图如下图所示,反应②的离子方程式为
_________________。由图可知该天然气脱硫过程中起到催化剂作用的微粒是_________。
A.CH4 B.Fe2+ C.Fe3+ D.O2
氢气、乙醇都是未来理想的绿色燃料。已知部分物质的标准燃烧热(250C)数据如下表所示:
物质(状态) H2(g) C2H4(g) C2H5OH(l) CH4(g)
燃烧热 H/kJ˙mol-1 -285.8 -1411.0 -1366.8 -890.3
13.列举用氢气作为燃料需要解决的问题 。
14.依据表格数据计算,由 C2H4(g)和 H2O(l)反应生成 C2H5OH(l)的 H为__________。
A.-44.2kJ˙mol-1 B.+44.2kJ˙mol-1 C.-330kJ˙mol-1 D.+330kJ˙mol-1
肼(N2H4)是可燃性液体,一种以肼为原料的电池装置如下图所示,该电池用空气中的氧气作
为氧化剂,KOH为电解质。
15.请书写负极的电极反应式 。
16.1 mol肼完全反应,正极区域质量减少_______g。
(注:图中为负离子交换膜)
三、气体的溶解
水是最常见的溶剂,不同气体在水中溶解程度不同。
常温常压下,1体积水能溶解约 2.6体积 H2S。通过 NaOH溶液调节氢硫酸 pH,溶液中各含
硫微粒物质的量分数δ随 pH c H S变化关系如下图[例如δ H S = 22 ]。c H2S +c HS- +c S2-
17.pH=7时,溶液中含硫微粒主要为 。(用微粒符号表示)
18. K a(1 H 2S) 。
K a(2 H 2S)
19.向 NaHS 溶液中加入一定量 CuSO4溶液,可产生 H2S气体,请结合平衡移动原理解释产生
气体的原因 。
20.pH=13时,c(Na+) - 3c(S2-) 0.1。(选填“>”、“<”或“=”)
常温常压下,1体积水能溶解约 40体积 SO2。
室温下,通过下列实验探究 SO2的性质。已知 Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8。
实验 1:将 SO2气体通入水中,测得溶液 pH=3。
实验 2:将 SO2气体通入 0.100 mol˙L-1NaOH溶液中,当溶液 pH=4时停止通气。
实验 3:将 SO2气体通入 0.100 mol˙L-1酸性 KMnO4溶液中,当溶液恰好褪色时停止通气。
21.请写出导致实验 1中溶液 pH=3主要的电离方程式 。
22.实验 2中 H2O的电离程度变化情况为 。
A.逐渐变大至不变 B.逐渐变小至不变
C.先变大,后变小至不变 D.先变小,后变大至不变
23.实验 3中,参与反应的 SO2与 KMnO4物质的量之比为 。
氨氮废水(主要溶质为 NH4Cl)可通过形成亚硫酸亚铁铵[(NH4)2Fe(SO3)2 H2O]沉淀进行处理。
向氨氮废水中依次加入 Na2SO3和 FeCl2溶液,使 NH4+、Fe2+、SO32-物质的量之比为 2:1:2,调节
初始 pH为 7.5进行反应,氨氮去除率和溶液 pH随时间变化如下图所示。
24.pH=5~8时生成(NH4)2Fe(SO3)2 H2O沉淀,该反应的离子方程式为 。
25.0~30 min时,氨氮去除率升高、溶液 pH降低的主要原因是 。
26.30 min后,溶液 pH继续降低的可能原因是 。
四、氯化钡晶体的制备
氯化钡常用于电子、仪表、冶金等工业。以重晶石矿(主要成分为 BaSO4,含少量 SiO2、Fe2O3
等)为原料制备纯净的 BaCl2 2H2O晶体途径如下:
27.“预处理”操作中包括将矿石粉碎,目的是 。
28.高温焙烧过程中,碳元素转化为一氧化碳,请结合脱硫 1中产生的气体,写出焙烧过程中
BaSO4发生反应的方程式 。
29.调节 pH所用试剂可能为 。(不定项)
A.盐酸 B.氧化铁 C.碳酸钠 D.氢氧化钡
30.调节 pH产生的沉淀成分为 。
31.“系列操作”包括蒸发浓缩、冷却结晶、 。
32.取实验制得的 BaCl2 2H2O样品(杂质不参与反应)2.600 g溶于水,配制成 100 mL 溶液。
用 0.200 mol˙L-1的 AgNO3溶液滴定,三次实验记录如下:
实验 BaCl2溶液体积 AgNO3溶液体积
1 10.00 mL 9.98 mL
2 10.00 mL 10.90 mL
3 10.00 mL 10.02 mL
(1)用 BaCl2 2H2O样品配制 100 mL BaCl2溶液,需要的定量仪器有 。
(2)计算样品纯度为 。(计算结果保留三位小数)
工业上也可用纯碱溶液浸泡重晶石矿,实现 BaSO4 转化为 BaCO3,进一步制得氯化钡。
33.若用 100 mL Na2CO3溶液将 2.33 g BaSO4 固体全都转化为 BaCO3,则所用 Na2CO3溶液的物
质的量浓度至少为 。(请写出计算过程)
已知:常温下 Ksp(BaSO4)=1.0×10-11,Ksp(BaCO3)=1.0×10-10]。(忽略溶液体积的变化)
五、共轭二烯烃
共轭二烯烃是一类特殊的烯烃,是常见的有机合成原料。以下是以共轭二烯 A为原料制备
化合物 I的合成路线(部分反应的条件省略)。
34.用系统命名法为 A命名_________________________。
35.反应①的反应类型为____________。
A.氧化反应 B.聚合反应 C.取代反应 D.加成反应
36.请写出化合物 H的含氧官能团的名称____________。
37.下列化合物 F可能的结构简式中,最合理的是____________。
A. B. C.
38.下列说法正确的是____________。(不定项)
A.化合物 A与 B都存在顺反异构体
B.化合物 C与 G含有的不对称碳原子的个数相同
C.化合物 E与 G都可以形成分子内氢键
D.化合物 E与 H互为同分异构体
39.请写出反应②不使用 Cu为催化剂、O2氧化的原因
_______________________________________________________________________________。
40.根据题意,化合物 H可以由 A与 J经过一步反应制得,请写出 J的结构简式____________。
41.请写出一种满足下列条件的化合物 E的同分异构体_________________。
①能与 FeCl3溶液发生显色反应,但不与浓溴水反应生成沉淀。
②分子中有 4种化学环境不同的氢原子。
由化合物 A也可以合成化合物 B:
42.请写出化合物 K制得 B的反应方程式________________________________________。
43.设计由 A合成 K的合成路线(必要的有机及无机试剂任选)。
(合成路线可表示为: )
答 案 2024.12
一、氮及其化合物(共 20分)
1.2s22p3(2分)
2.CD(2分)
3.sp2(2分) D(2分)
4.A(2分)
5.第一电离能:C
6.12(2分)[Fe(CN)6]4—无毒,CN—是一种配位能力很强的配体,[Fe(CN)6]4—难以解离出 CN—,
所以可以安全添加。(2分)
7.(1)D(2分)
(2)1.01(2分)
二、燃料的合理使用(共 21分)
8.S>C>H(2分)
9.A(2分)
10.0.025(2分)
11.C(2分)
12.4Fe2++O2+4H+=4Fe3++2H2O(2分),C(2分)
13.氢气的储存、运输和使用的安全性问题。(2分)
14.A(2分)
15.N H - -2 4+4OH -4e =N2↑+4H2O(2分)
16.36(3分)
三、气体的溶解(共 20分)
17.H2S、HS-(2分)
18.106(2分)
19.HS-发生电离:HS- H+ + S2-, S2-与 Cu2+结合生成 CuS沉淀,c(S2-)下降,电离平衡向
正方向移动,c(H+)增大,与 HS-结合生成 H2S气体。(2分)
20.<(2分)
21.H2SO3 H+ + HSO3-(2分)
22.C(2分)
23.5:2(2分)
24.2NH4++Fe2++2SO32-+H2O=(NH4)2Fe(SO3)2 H2O↓(2分)
25.SO32-水解产生 OH-,生成沉淀消耗大量 SO32-,c(H+)浓度变大。(2分)
26.SO32-被氧化为 SO42-,酸性增强。(2分)
四、氯化钡晶体的制备(共 19分)
27.增大反应物接触面积,加快化学反应速率。(2分)
高温
28.BaSO4+4C _
_________ BaS+4CO↑(2分)
29.BD(2分)
30.Fe(OH)3(或 Fe(OH)3、Fe2O3)(2分)
31.过滤、洗涤、干燥(2分)
32.(1)电子天平、100 mL 容量瓶(2分)
(2)0.938(3分)
33.1.1 mol˙L-1(4分)
BaSO4 s + CO32-( ) (aq) BaCO3 (s)+ SO42-(aq)
2
K= [SO4 ] = Ksp(BaSO4)=0.1,c(SO42-)= 2.33 233 =0.1mol˙L-1,c(CO32-)=1mol˙L-1
[CO 2 3 ] Ksp(BaCO3 0.1)
n(BaCO3)=n(BaSO4)=0.01mol,c(Na2CO )=1+ 0.013 =1.1mol˙L-1
0.1
五、共轭二烯烃(共 20分)
34.2,3-二甲基-1,3-丁二烯(2分)
35.D(1分)
36.酯基(1分)
37.A(2分)
38.BD(2分)
39.氧气可能会氧化 D分子内的碳碳双键。(2分)
40. (2分)
41. (2分)
42. (2分)
43.(每步 1分,共 4分)(第三、第四步用氧气氧化的不得分)
若使用基团保护法合成的也可以给分,如:
同课章节目录
