8.2.2 海水晒盐的原理 课件 (共23张PPT)2024-2025学年化学鲁教版九年级下册
文档属性
| 名称 | 8.2.2 海水晒盐的原理 课件 (共23张PPT)2024-2025学年化学鲁教版九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-18 00:00:00 | ||
图片预览






文档简介
(共23张PPT)
8.2.2 海水晒盐的原理
1.理解溶解度的含义,初步学会绘制和分析溶解度曲线。
2.能根据溶解度曲线,判断物质适用的结晶方法。
硝酸钾
一种白色粉末
易溶于水
氯化钠
俗名“食盐”
易溶于水
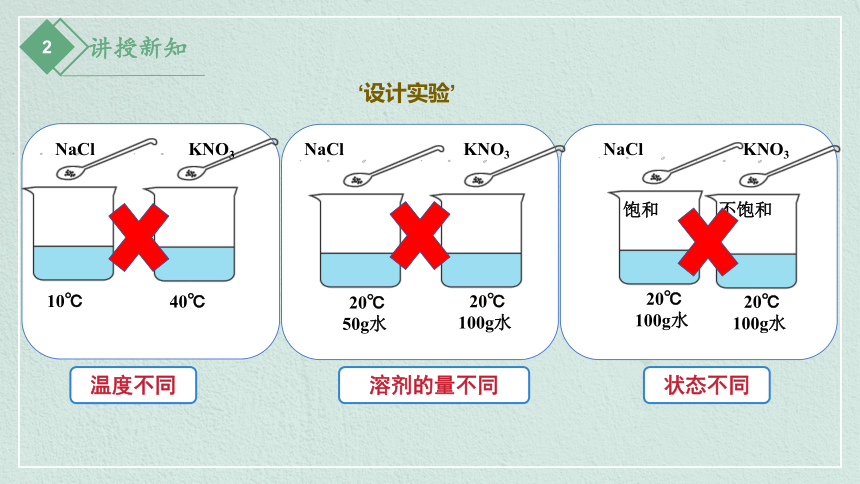
氯化钠与硝酸钾哪个的溶解能力更强呢?你能设计实验验证吗?
NaCl
KNO3
10℃
40℃
温度不同
‘设计实验’
NaCl
KNO3
20℃
50g水
20℃
100g水
溶剂的量不同
状态不同
NaCl
KNO3
20℃
100g水
20℃
100g水
饱和
不饱和
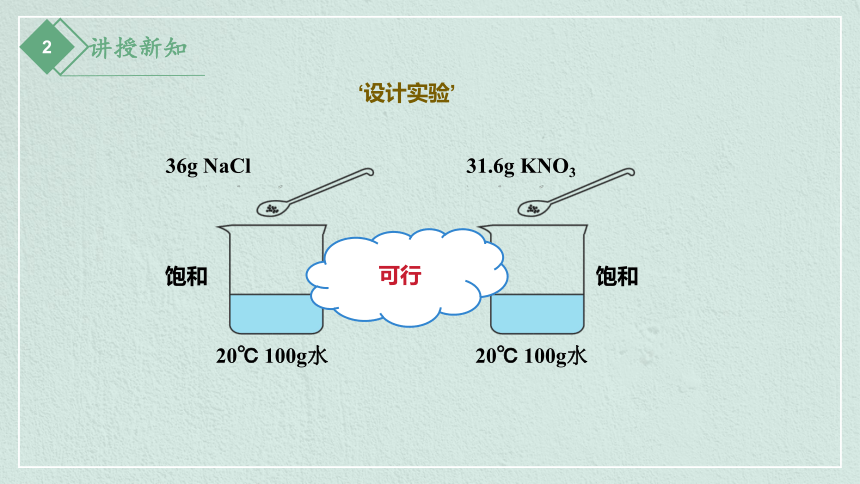
36g NaCl
31.6g KNO3
20℃ 100g水
20℃ 100g水
饱和
饱和
可行
‘设计实验’
四要素
01
条件
02
标准
03
状态
04
单位
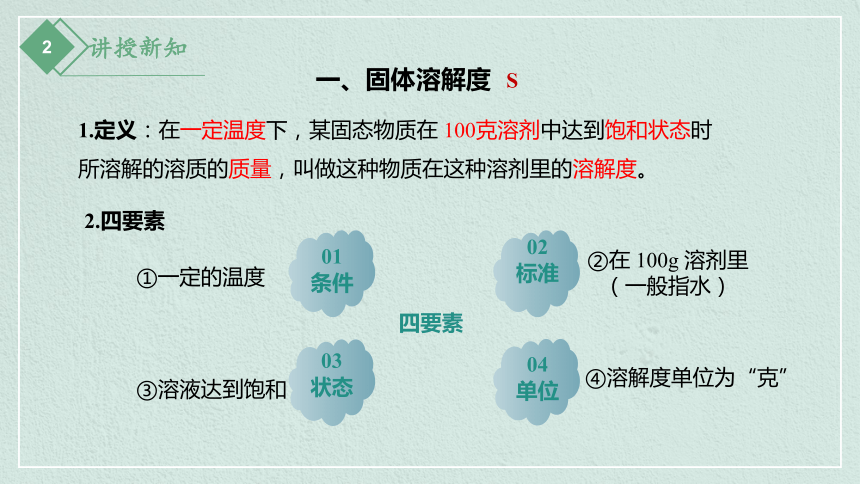
1.定义:在一定温度下,某固态物质在 100克溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂里的溶解度。
①一定的温度
②在 100g 溶剂里
(一般指水)
③溶液达到饱和
一、固体溶解度
S
2.四要素
④溶解度单位为“克”
例:NaCl在20℃时的溶解度为36g。
1. 20℃时,在100g水中达到_____状态时所溶解的NaCl的质量为36g。
2. 20℃时,在100g水中最___(多/少)溶解36gNaCl。
3. 20℃时,完全溶解36gNaCl,最___(多/少)需要100g水。
饱和
多
少
温度 溶质的质量 溶剂的质量 饱和溶液的质量
20℃
36g
100g
136g
4.
3.含义
1.把20克某物质溶解在100克水里恰好制成饱和溶液,这种物质的溶解度就是20克。
2.20℃时10克氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解度是10克。
3.20℃时10克氯化钠可溶解在100克水里,故20℃时氯化钠的溶解度是10克。
4.20℃时36克食盐溶解在100克水中恰好饱和,故20℃时食盐的溶解度是36。
5.20℃时, 100g水中最多溶解36g氯化钠,则氯化钠的溶解度为36g
一定温度
标准:100g溶剂
状态:饱和
单位:g
√
20℃ 易溶 可溶 微溶 难溶
溶解度/g >10 10~1 1~0.01 <0.01
4. 溶解能力与固体溶解度的关系
易溶
可溶
微溶
难(不)溶
0.01g
1g
10g
注:难溶,习惯上称“不溶”,绝对不溶的物质是没有的。
常温下:20℃
溶解度
溶解能力
打开可乐盖时有气体冒出
畅饮可乐后会打嗝
打开瓶塞,压强减小,CO2溶解性减弱,所以从水中逸出
温度升高CO2溶解性减弱,从体内逸出
闷热时,鱼在水面呼吸
温度升高O2溶解性减弱,鱼浮出水面呼吸
影响气体溶解度的因素
①压强:压强增大,气体溶解度变____。
②温度:温度升高,气体溶解度变____。
大
小
二、溶解度的表示方法
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3 51.1 54.0 56.7
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.8 55.2 60.2 65.6 71.3 77.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 168 202 246
---列表法
几种物质在不同温度时的溶解度
20℃时,NaCl和KNO3 的溶解性谁更强?
二、溶解度的表示方法
---溶解度曲线
思考:
1. 从溶解度曲线中,你能获得哪些信息?
2. 固体物质的溶解度随温度变化有什么规律?
曲线上的点
交点
该点温度下的溶解度(饱和溶液)
两物质在该点温度下的溶解度相等
168
A
B
138
点
由溶解度曲线获得的信息
线
陡升型
下降型
缓升型
大部分固体物质,
其溶解度随温度变化影响较大,如:KNO3
极少数物质
随温度升高溶解度反而减小,如:熟石灰
少数物质
其溶解度随温度变化影响较小,如:氯化钠
面
曲线下方的面上的点
曲线上方的面上的点
表示对应温度下该物质的不饱和溶液
表示对应温度下该物质的过饱和溶液
A
B
(1)多数固体物质的溶解度随着温度的升高而增大,如硝酸钾;
(2)少数固体物质的溶解度受温度变化的影响小,如氯化钠;
(3)极少数固体物质的溶解度随着温度的升高而减小,如氢氧化钙。
固体物质的溶解度随温度变化的规律
降温结晶
溶解度受温度的影响较大
80℃时,100g水中最多溶解169g硝酸钾
由80℃冷却到20℃
20℃时,100g水中只能溶解31.6g硝酸钾,析出硝酸钾晶体的质量为:
169g-31.6g=137.4g
冷却热饱和溶液析出晶体
物质提纯:
①当甲中含有少量乙(如KNO3中含有少量的NaCl)时,可采用冷却热饱和溶液(降温结晶)法分离(或提纯)出物质甲。
②当乙中含有少量甲(如NaCl中含有少量的KNO3)时,可采用蒸发结晶法分离(或提纯)出物质乙。
我国有许多盐碱湖,湖水中溶有大量的氯化钠和纯碱(碳酸钠)。那里的人们冬天捞碱,夏天晒盐。这是为什么呢?
冬天捞碱 夏天晒盐
氯化钠的溶解度受温度影响小,夏天时,温度高,水分蒸发后,氯化钠以晶体形式析出,得粗盐,这就是夏天晒盐。
而碳酸钠的溶解度受温度影响大,夏天温度高,它以溶液的形式存在,冬天时,温度降低,它以晶体形式析出,沉于湖底,可打捞得到,这就是冬天捞碱。
1.为了增大硝酸钾的溶解度,可采取的方法是( )
A.加入大量硝酸钾固体 B.升高温度
C.加入大量水 D.降低温度
B
2.10℃时,20g水中溶解了2g甲物质,正好形成饱和溶液;50℃时,100g水中最多溶解乙物质25g。则甲、乙两种物质的溶解度大小关系是( )
A.甲=乙 B.甲<乙 C.甲>乙 D.无法比较
D
3.已知:氯化氨在50℃时的溶解度为50g,则在50℃时氯化氨饱和溶液中溶质与溶液的比为( )
A.1:1 B.1:2 C.1:3 D.1:4
C
4.在20℃时,3g某物质溶于200g水中,恰好成为饱和溶液,则该物质属于( )
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
B
8.2.2 海水晒盐的原理
1.理解溶解度的含义,初步学会绘制和分析溶解度曲线。
2.能根据溶解度曲线,判断物质适用的结晶方法。
硝酸钾
一种白色粉末
易溶于水
氯化钠
俗名“食盐”
易溶于水
氯化钠与硝酸钾哪个的溶解能力更强呢?你能设计实验验证吗?
NaCl
KNO3
10℃
40℃
温度不同
‘设计实验’
NaCl
KNO3
20℃
50g水
20℃
100g水
溶剂的量不同
状态不同
NaCl
KNO3
20℃
100g水
20℃
100g水
饱和
不饱和
36g NaCl
31.6g KNO3
20℃ 100g水
20℃ 100g水
饱和
饱和
可行
‘设计实验’
四要素
01
条件
02
标准
03
状态
04
单位
1.定义:在一定温度下,某固态物质在 100克溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂里的溶解度。
①一定的温度
②在 100g 溶剂里
(一般指水)
③溶液达到饱和
一、固体溶解度
S
2.四要素
④溶解度单位为“克”
例:NaCl在20℃时的溶解度为36g。
1. 20℃时,在100g水中达到_____状态时所溶解的NaCl的质量为36g。
2. 20℃时,在100g水中最___(多/少)溶解36gNaCl。
3. 20℃时,完全溶解36gNaCl,最___(多/少)需要100g水。
饱和
多
少
温度 溶质的质量 溶剂的质量 饱和溶液的质量
20℃
36g
100g
136g
4.
3.含义
1.把20克某物质溶解在100克水里恰好制成饱和溶液,这种物质的溶解度就是20克。
2.20℃时10克氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解度是10克。
3.20℃时10克氯化钠可溶解在100克水里,故20℃时氯化钠的溶解度是10克。
4.20℃时36克食盐溶解在100克水中恰好饱和,故20℃时食盐的溶解度是36。
5.20℃时, 100g水中最多溶解36g氯化钠,则氯化钠的溶解度为36g
一定温度
标准:100g溶剂
状态:饱和
单位:g
√
20℃ 易溶 可溶 微溶 难溶
溶解度/g >10 10~1 1~0.01 <0.01
4. 溶解能力与固体溶解度的关系
易溶
可溶
微溶
难(不)溶
0.01g
1g
10g
注:难溶,习惯上称“不溶”,绝对不溶的物质是没有的。
常温下:20℃
溶解度
溶解能力
打开可乐盖时有气体冒出
畅饮可乐后会打嗝
打开瓶塞,压强减小,CO2溶解性减弱,所以从水中逸出
温度升高CO2溶解性减弱,从体内逸出
闷热时,鱼在水面呼吸
温度升高O2溶解性减弱,鱼浮出水面呼吸
影响气体溶解度的因素
①压强:压强增大,气体溶解度变____。
②温度:温度升高,气体溶解度变____。
大
小
二、溶解度的表示方法
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
KCl 27.6 31.0 34.0 37.0 40.0 42.6 45.5 48.3 51.1 54.0 56.7
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.8 55.2 60.2 65.6 71.3 77.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 168 202 246
---列表法
几种物质在不同温度时的溶解度
20℃时,NaCl和KNO3 的溶解性谁更强?
二、溶解度的表示方法
---溶解度曲线
思考:
1. 从溶解度曲线中,你能获得哪些信息?
2. 固体物质的溶解度随温度变化有什么规律?
曲线上的点
交点
该点温度下的溶解度(饱和溶液)
两物质在该点温度下的溶解度相等
168
A
B
138
点
由溶解度曲线获得的信息
线
陡升型
下降型
缓升型
大部分固体物质,
其溶解度随温度变化影响较大,如:KNO3
极少数物质
随温度升高溶解度反而减小,如:熟石灰
少数物质
其溶解度随温度变化影响较小,如:氯化钠
面
曲线下方的面上的点
曲线上方的面上的点
表示对应温度下该物质的不饱和溶液
表示对应温度下该物质的过饱和溶液
A
B
(1)多数固体物质的溶解度随着温度的升高而增大,如硝酸钾;
(2)少数固体物质的溶解度受温度变化的影响小,如氯化钠;
(3)极少数固体物质的溶解度随着温度的升高而减小,如氢氧化钙。
固体物质的溶解度随温度变化的规律
降温结晶
溶解度受温度的影响较大
80℃时,100g水中最多溶解169g硝酸钾
由80℃冷却到20℃
20℃时,100g水中只能溶解31.6g硝酸钾,析出硝酸钾晶体的质量为:
169g-31.6g=137.4g
冷却热饱和溶液析出晶体
物质提纯:
①当甲中含有少量乙(如KNO3中含有少量的NaCl)时,可采用冷却热饱和溶液(降温结晶)法分离(或提纯)出物质甲。
②当乙中含有少量甲(如NaCl中含有少量的KNO3)时,可采用蒸发结晶法分离(或提纯)出物质乙。
我国有许多盐碱湖,湖水中溶有大量的氯化钠和纯碱(碳酸钠)。那里的人们冬天捞碱,夏天晒盐。这是为什么呢?
冬天捞碱 夏天晒盐
氯化钠的溶解度受温度影响小,夏天时,温度高,水分蒸发后,氯化钠以晶体形式析出,得粗盐,这就是夏天晒盐。
而碳酸钠的溶解度受温度影响大,夏天温度高,它以溶液的形式存在,冬天时,温度降低,它以晶体形式析出,沉于湖底,可打捞得到,这就是冬天捞碱。
1.为了增大硝酸钾的溶解度,可采取的方法是( )
A.加入大量硝酸钾固体 B.升高温度
C.加入大量水 D.降低温度
B
2.10℃时,20g水中溶解了2g甲物质,正好形成饱和溶液;50℃时,100g水中最多溶解乙物质25g。则甲、乙两种物质的溶解度大小关系是( )
A.甲=乙 B.甲<乙 C.甲>乙 D.无法比较
D
3.已知:氯化氨在50℃时的溶解度为50g,则在50℃时氯化氨饱和溶液中溶质与溶液的比为( )
A.1:1 B.1:2 C.1:3 D.1:4
C
4.在20℃时,3g某物质溶于200g水中,恰好成为饱和溶液,则该物质属于( )
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
B
同课章节目录
