2025年中考化学题型专题复习 题型一 坐标图像题课件(28页ppt)
文档属性
| 名称 | 2025年中考化学题型专题复习 题型一 坐标图像题课件(28页ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-17 14:14:09 | ||
图片预览







文档简介
(共28张PPT)
七年级上册
题型一 坐标图像题
2025年中考化学题型专题复习
类型1 溶解度曲线
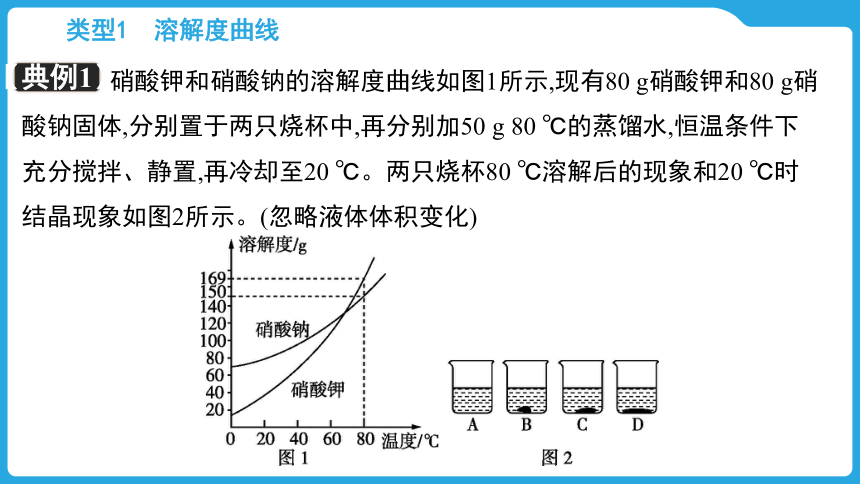
【典例1】
硝酸钾和硝酸钠的溶解度曲线如图1所示,现有80 g硝酸钾和80 g硝酸钠固体,分别置于两只烧杯中,再分别加50 g 80 ℃的蒸馏水,恒温条件下充分搅拌、静置,再冷却至20 ℃。两只烧杯80 ℃溶解后的现象和20 ℃时结晶现象如图2所示。(忽略液体体积变化)
类型1 溶解度曲线
【典例1】
(1)上述配制的硝酸钾和硝酸钠溶液在40 ℃时溶质质量分数较大的是 。
(2)图2中,盛硝酸钾的烧杯在80 ℃和20 ℃时的现象分别是 、 。(选填字母序号)
硝酸钠
A
D
类型1 溶解度曲线
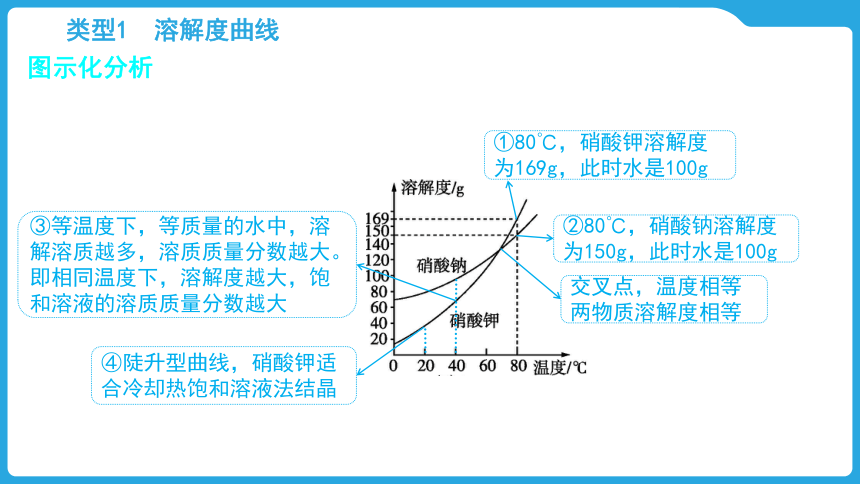
图示化分析
②80℃,硝酸钠溶解度为150g,此时水是100g
①80℃,硝酸钾溶解度为169g,此时水是100g
交叉点,温度相等两物质溶解度相等
④陡升型曲线,硝酸钾适合冷却热饱和溶液法结晶
③等温度下,等质量的水中,溶解溶质越多,溶质质量分数越大。即相同温度下,溶解度越大,饱和溶液的溶质质量分数越大
类型1 溶解度曲线
(1)降温到40 ℃时,50 g水中硝酸钠比硝酸钾溶解得更多,此时硝酸钠的溶质质量分数较大。
(2)80 ℃时硝酸钾完全溶解,所以对应烧杯A,20 ℃时,硝酸钾的溶解度比硝酸钠的溶解度小,所以盛硝酸钾的烧杯析出的固体最多,因此对应烧杯D。
类型1 溶解度曲线
针对练1
[2024广安中考]KNO3、KCl可用作钾肥,对大豆的生长具有重要的作用。KNO3、KCl的溶解度随温度变化的曲线如图所示,下列有关说法正确的是( )
B
类型1 溶解度曲线
针对练1
A.a点表示在18 ℃时,KCl和KNO3的溶解度相同
B.在70 ℃时,将238 g KNO3的饱和溶液降温至40 ℃,析出74 g KNO3
C.d点对应的KNO3溶液为饱和溶液
D.e点对应的KCl饱和溶液中溶质的质量分数为40%
√
类型1 溶解度曲线
A项,a点对应的温度在20~30 ℃之间,故错误;
B项,70 ℃时硝酸钾的溶解度为138 g,在70 ℃时,238 g KNO3的饱和溶液中含有138 g硝酸钾,含有100 g 水,降温至40 ℃,40 ℃时硝酸钾的溶解度为64 g,析出KNO3的质量为138 g-64 g=74 g,故正确;
C项,溶解度曲线图上的点都是对应温度下的饱和溶液,而曲线下方的点都是该温度下的不饱和溶液,故错误;
D项,e点对应的溶质质量分数应该是×100%,结果不等于40%,故错误。
类型2 pH变化曲线
【典例2】
化学学习小组用盐酸和烧碱探究中和反应的pH变化。实验时将一定量的盐酸溶液注入锥形瓶中,再逐滴加入烧碱溶液,边滴边振荡,通过传感器测定并绘出pH变化曲线如图。下列分析错误的是( )
A.a点到b点,锥形瓶中溶液温度逐渐升高
B.取a点溶液滴加紫色石蕊溶液,溶液变为红色
C.取b点溶液加入小苏打固体,有气泡产生
D.c点溶液中含有的溶质是NaCl和NaOH
C
类型2 pH变化曲线
图示化分析
①起点pH 7,烧杯中是盐酸
②a点pH 7,
0→b发生反应:NaOH+HCl NaCl+H2O
a点溶质:NaCl、HCl
③b点pH 7,中和反应放热,此时温度达到最高。
溶质:NaCl
④c点pH 7,
溶质:NaCl、NaOH
═
<
<
>
=
类型2 pH变化曲线
b点对应的溶质是NaCl,加入小苏打(碳酸氢钠)不会发生反应,故没有明显现象。
类型2 pH变化曲线
针对练2
[2024宜宾中考]某实验小组将稀盐酸逐滴加入Na2CO3溶液中,观察到先无气泡,过一段时间后产生气泡。
【问题提出】为什么滴入稀盐酸没有立即产生气泡
【实验探究】借助数字化实验进行探究。
一定温度下,用溶质质量分数为1.825%的
稀盐酸与20 mL饱和Na2CO3溶液反应,装置
如图1所示。随稀盐酸逐滴加入,充分搅拌,
采集到溶液的pH随滴入稀盐酸体积的变化
关系如图2所示。实验中发现AB段对应烧
杯中无气泡产生,B点后逐渐有气泡冒出,
C点后几乎无气泡。
类型2 pH变化曲线
针对练2
【查阅资料】NaHCO3溶液的pH约为8.2。
【实验分析】(1)图2中A点对应溶液的颜色是 。
(2)“液滴数传感器”采集的坐标数据是 。
(3)随着稀盐酸滴入,溶液pH (填
“增大”“不变”或“减小”)。
(4)图2中D点对应溶液中含有的溶质有
(填化学式)。
红色
稀盐酸体积
减小
HCl、NaCl
类型2 pH变化曲线
针对练2
【实验结论】
(5)稀盐酸滴入Na2CO3溶液,反应分两段进行。
AB段:反应的化学方程式是 。
BC段:AB段的生成物继续与稀盐酸
反应转化为CO2逸出。
Na2CO3+HCl NaCl+NaHCO3
类型2 pH变化曲线
类型3 金属与酸或盐的反应
【典例3】
将一定量锌和金属R的混合粉末加入一定量的氯化铜溶液中, 溶液质量的变化情况如图所示。(相对原子质量:Cu—64,Zn—65)反应结束后过滤,下列说法正确的是( )
A.金属活动性:R>Zn>Cu
B.滤液中一定有ZnCl2和金属R的盐,可能有CuCl2
C.滤渣中一定有Cu,可能有Zn和R
D.若向滤渣中加入稀硫酸有气泡产生,则滤渣中
一定有Zn
B
类型3 金属与酸或盐的反应
图示化分析
溶液质量增大(比较溶质的相对分子质量和系数的乘积),则第一段是Zn与氯化铜反应:Zn+CuCl2 Cu+ZnCl2
溶液质量减小(比较溶质的相对分子质量和系数的乘积),则第二段是金属R与氯化铜反应:R+CuCl2→Cu+RClX
溶液质量不再改变说明反应已经结束
Zn与氯化铜完全反应,此时溶质:ZnCl2、CuCl2
金属R与氯化铜完全反应,此时溶质中肯定有ZnCl2、RClX,可能有CuCl2
═
类型3 金属与酸或盐的反应
结合铜、锌的相对原子质量和题图分析可知,第一段是Zn与CuCl2溶液反应,第二段是R与CuCl2溶液反应,Zn已完全反应,说明金属活动性Zn>R>Cu,故A、C错误;
第三段溶液质量不再改变说明CuCl2溶液已经完全反应或R已完全反应或两者恰好都完全反应,故B正确;
若向滤渣中加稀硫酸有气泡产生,滤渣中一定有金属R,不可能有Zn,故D错误。
类型4 酸碱盐的反应顺序
【典例4】
向盛有100 g CuSO4和H2SO4混合溶液的烧杯中加入过量BaCl2溶液,充分反应后再滴加溶质质量分数为20%的NaOH溶液,烧杯中沉淀质量与滴加NaOH溶液质量的关系如图所示。(相对原子质量:H—1,O—16,Na—23,Cu—64,Ba—137)下列说法正确的是( )
A.加入NaOH溶液前,溶液中只有两种溶质
B.m=74.8
C.ab段发生反应的化学方程式为CuCl2+
2NaOH Cu(OH)2↓+2NaCl
D.取c点对应溶液,滴加稀H2SO4,不产生白色沉淀
C
类型4 酸碱盐的反应顺序
图示化分析
①CuSO4和H2SO4与过量的BaCl2反应,溶质为CuCl2、HCl、BaCl2,沉淀为BaSO4。
②反应过程分析如下图:
a点前加入NaOH溶液发生反应,但沉淀质量不变,是NaOH与HCl的中和反应:NaCl+HCl NaCl+H2O
ab段加入NaOH溶液反应产生了沉淀,因此是NaOH与CuCl2反应:2NaOH+CuCl2 Cu(OH)2↓+2NaCl
bc段反应停止,加入过量NaOH溶液,溶质:BaCl2、NaCl、NaOH
═
═
类型4 酸碱盐的反应顺序
图示化分析
设ab段反应生成Cu(OH)2的质量为x,
2NaOH+CuCl2 Cu(OH)2↓+2NaCl
80 98
40 g×20% x
x=9.8 g,m=9.8+69.9=79.7
类型4 酸碱盐的反应顺序
A项,向盛有100 g CuSO4和H2SO4混合溶液的烧杯中加入过量BaCl2溶液,分别发生反应CuSO4+BaCl2 BaSO4↓+CuCl2,H2SO4+BaCl2 BaSO4↓+2HCl,所以加入NaOH溶液前,溶液中含有CuCl2、HCl、BaCl2三种溶质,错误。
B项,ab段增加的沉淀的质量是生成Cu(OH)2的质量,根据化学方程式计算,m=79.7,错误。
D项,c点溶液中含有BaCl2,滴加稀H2SO4,立即出现白色沉淀,错误。
类型4 酸碱盐的反应顺序
针对练3
[2024云南中考]某溶液可能含有HCl、CuCl2、CuSO4中的一种或几种,为了探究其组成,向一定质量的该溶液中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。(相对原子质量:H—1,O—16,S—32,Cl—35.5,Cu—64,Ba—137)下列说法正确的是( )
B
类型4 酸碱盐的反应顺序
针对练3
A.d点后,溶液的pH保持不变
B.b点对应的溶液中有三种溶质
C.c点到d点的过程中,溶液中溶质总质量在减少
D.原溶液含有HCl、CuCl2和CuSO4
√
类型4 酸碱盐的反应顺序
根据生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系,一开始就有沉淀生成,但ac段无沉淀生成,说明溶液中一定有盐酸,ac段发生的反应为2HCl+Ba(OH)2 BaCl2+2H2O,OH-可以和H+结合,也可以和Cu2+结合,但酸碱中和反应优先发生,又反应一开始就有沉淀生成,说明刚开始生成的沉淀不是Cu2+与OH-结合生成的Cu(OH)2沉淀,而是Ba2+与S结合生成的BaSO4沉淀,故溶液中一定有CuSO4。
类型4 酸碱盐的反应顺序
图中反应分析如下:
由图像可知,反应生成BaSO4沉淀的质量为23.3 g,生成Cu(OH)2沉淀的质量为33.1 g-23.3 g=9.8 g,设生成23.3 g BaSO4沉淀需要CuSO4的质量为x,生成9.8 g Cu(OH)2沉淀需要CuSO4的质量为y,则有:
类型4 酸碱盐的反应顺序
①CuSO4~BaSO4 ②CuSO4~Cu(OH)2
160 233 160 98
x 23.3 g y 9.8 g
解得x=16 g、y=16 g,则原溶液中含有CuSO4,不含CuCl2。由上文分析可知,原溶液中还含有HCl,故D项错误。
A( )d点后反应停止,继续滴加氢氧化钡溶液,溶液碱性增强,故溶液的pH逐渐增大。
类型4 酸碱盐的反应顺序
B(√)b点时盐酸过量,此时溶液中存在的溶质有HCl、BaCl2和CuCl2。
C( )c点到d点的过程中,发生反应:Ba(OH)2+CuCl2 BaCl2+Cu(OH)2↓,每135份质量的CuCl2参与反应,生成208份质量的BaCl2,则反应后溶液的质量增大,即该过程溶液中溶质总质量在增大。
七年级上册
题型一 坐标图像题
2025年中考化学题型专题复习
类型1 溶解度曲线
【典例1】
硝酸钾和硝酸钠的溶解度曲线如图1所示,现有80 g硝酸钾和80 g硝酸钠固体,分别置于两只烧杯中,再分别加50 g 80 ℃的蒸馏水,恒温条件下充分搅拌、静置,再冷却至20 ℃。两只烧杯80 ℃溶解后的现象和20 ℃时结晶现象如图2所示。(忽略液体体积变化)
类型1 溶解度曲线
【典例1】
(1)上述配制的硝酸钾和硝酸钠溶液在40 ℃时溶质质量分数较大的是 。
(2)图2中,盛硝酸钾的烧杯在80 ℃和20 ℃时的现象分别是 、 。(选填字母序号)
硝酸钠
A
D
类型1 溶解度曲线
图示化分析
②80℃,硝酸钠溶解度为150g,此时水是100g
①80℃,硝酸钾溶解度为169g,此时水是100g
交叉点,温度相等两物质溶解度相等
④陡升型曲线,硝酸钾适合冷却热饱和溶液法结晶
③等温度下,等质量的水中,溶解溶质越多,溶质质量分数越大。即相同温度下,溶解度越大,饱和溶液的溶质质量分数越大
类型1 溶解度曲线
(1)降温到40 ℃时,50 g水中硝酸钠比硝酸钾溶解得更多,此时硝酸钠的溶质质量分数较大。
(2)80 ℃时硝酸钾完全溶解,所以对应烧杯A,20 ℃时,硝酸钾的溶解度比硝酸钠的溶解度小,所以盛硝酸钾的烧杯析出的固体最多,因此对应烧杯D。
类型1 溶解度曲线
针对练1
[2024广安中考]KNO3、KCl可用作钾肥,对大豆的生长具有重要的作用。KNO3、KCl的溶解度随温度变化的曲线如图所示,下列有关说法正确的是( )
B
类型1 溶解度曲线
针对练1
A.a点表示在18 ℃时,KCl和KNO3的溶解度相同
B.在70 ℃时,将238 g KNO3的饱和溶液降温至40 ℃,析出74 g KNO3
C.d点对应的KNO3溶液为饱和溶液
D.e点对应的KCl饱和溶液中溶质的质量分数为40%
√
类型1 溶解度曲线
A项,a点对应的温度在20~30 ℃之间,故错误;
B项,70 ℃时硝酸钾的溶解度为138 g,在70 ℃时,238 g KNO3的饱和溶液中含有138 g硝酸钾,含有100 g 水,降温至40 ℃,40 ℃时硝酸钾的溶解度为64 g,析出KNO3的质量为138 g-64 g=74 g,故正确;
C项,溶解度曲线图上的点都是对应温度下的饱和溶液,而曲线下方的点都是该温度下的不饱和溶液,故错误;
D项,e点对应的溶质质量分数应该是×100%,结果不等于40%,故错误。
类型2 pH变化曲线
【典例2】
化学学习小组用盐酸和烧碱探究中和反应的pH变化。实验时将一定量的盐酸溶液注入锥形瓶中,再逐滴加入烧碱溶液,边滴边振荡,通过传感器测定并绘出pH变化曲线如图。下列分析错误的是( )
A.a点到b点,锥形瓶中溶液温度逐渐升高
B.取a点溶液滴加紫色石蕊溶液,溶液变为红色
C.取b点溶液加入小苏打固体,有气泡产生
D.c点溶液中含有的溶质是NaCl和NaOH
C
类型2 pH变化曲线
图示化分析
①起点pH 7,烧杯中是盐酸
②a点pH 7,
0→b发生反应:NaOH+HCl NaCl+H2O
a点溶质:NaCl、HCl
③b点pH 7,中和反应放热,此时温度达到最高。
溶质:NaCl
④c点pH 7,
溶质:NaCl、NaOH
═
<
<
>
=
类型2 pH变化曲线
b点对应的溶质是NaCl,加入小苏打(碳酸氢钠)不会发生反应,故没有明显现象。
类型2 pH变化曲线
针对练2
[2024宜宾中考]某实验小组将稀盐酸逐滴加入Na2CO3溶液中,观察到先无气泡,过一段时间后产生气泡。
【问题提出】为什么滴入稀盐酸没有立即产生气泡
【实验探究】借助数字化实验进行探究。
一定温度下,用溶质质量分数为1.825%的
稀盐酸与20 mL饱和Na2CO3溶液反应,装置
如图1所示。随稀盐酸逐滴加入,充分搅拌,
采集到溶液的pH随滴入稀盐酸体积的变化
关系如图2所示。实验中发现AB段对应烧
杯中无气泡产生,B点后逐渐有气泡冒出,
C点后几乎无气泡。
类型2 pH变化曲线
针对练2
【查阅资料】NaHCO3溶液的pH约为8.2。
【实验分析】(1)图2中A点对应溶液的颜色是 。
(2)“液滴数传感器”采集的坐标数据是 。
(3)随着稀盐酸滴入,溶液pH (填
“增大”“不变”或“减小”)。
(4)图2中D点对应溶液中含有的溶质有
(填化学式)。
红色
稀盐酸体积
减小
HCl、NaCl
类型2 pH变化曲线
针对练2
【实验结论】
(5)稀盐酸滴入Na2CO3溶液,反应分两段进行。
AB段:反应的化学方程式是 。
BC段:AB段的生成物继续与稀盐酸
反应转化为CO2逸出。
Na2CO3+HCl NaCl+NaHCO3
类型2 pH变化曲线
类型3 金属与酸或盐的反应
【典例3】
将一定量锌和金属R的混合粉末加入一定量的氯化铜溶液中, 溶液质量的变化情况如图所示。(相对原子质量:Cu—64,Zn—65)反应结束后过滤,下列说法正确的是( )
A.金属活动性:R>Zn>Cu
B.滤液中一定有ZnCl2和金属R的盐,可能有CuCl2
C.滤渣中一定有Cu,可能有Zn和R
D.若向滤渣中加入稀硫酸有气泡产生,则滤渣中
一定有Zn
B
类型3 金属与酸或盐的反应
图示化分析
溶液质量增大(比较溶质的相对分子质量和系数的乘积),则第一段是Zn与氯化铜反应:Zn+CuCl2 Cu+ZnCl2
溶液质量减小(比较溶质的相对分子质量和系数的乘积),则第二段是金属R与氯化铜反应:R+CuCl2→Cu+RClX
溶液质量不再改变说明反应已经结束
Zn与氯化铜完全反应,此时溶质:ZnCl2、CuCl2
金属R与氯化铜完全反应,此时溶质中肯定有ZnCl2、RClX,可能有CuCl2
═
类型3 金属与酸或盐的反应
结合铜、锌的相对原子质量和题图分析可知,第一段是Zn与CuCl2溶液反应,第二段是R与CuCl2溶液反应,Zn已完全反应,说明金属活动性Zn>R>Cu,故A、C错误;
第三段溶液质量不再改变说明CuCl2溶液已经完全反应或R已完全反应或两者恰好都完全反应,故B正确;
若向滤渣中加稀硫酸有气泡产生,滤渣中一定有金属R,不可能有Zn,故D错误。
类型4 酸碱盐的反应顺序
【典例4】
向盛有100 g CuSO4和H2SO4混合溶液的烧杯中加入过量BaCl2溶液,充分反应后再滴加溶质质量分数为20%的NaOH溶液,烧杯中沉淀质量与滴加NaOH溶液质量的关系如图所示。(相对原子质量:H—1,O—16,Na—23,Cu—64,Ba—137)下列说法正确的是( )
A.加入NaOH溶液前,溶液中只有两种溶质
B.m=74.8
C.ab段发生反应的化学方程式为CuCl2+
2NaOH Cu(OH)2↓+2NaCl
D.取c点对应溶液,滴加稀H2SO4,不产生白色沉淀
C
类型4 酸碱盐的反应顺序
图示化分析
①CuSO4和H2SO4与过量的BaCl2反应,溶质为CuCl2、HCl、BaCl2,沉淀为BaSO4。
②反应过程分析如下图:
a点前加入NaOH溶液发生反应,但沉淀质量不变,是NaOH与HCl的中和反应:NaCl+HCl NaCl+H2O
ab段加入NaOH溶液反应产生了沉淀,因此是NaOH与CuCl2反应:2NaOH+CuCl2 Cu(OH)2↓+2NaCl
bc段反应停止,加入过量NaOH溶液,溶质:BaCl2、NaCl、NaOH
═
═
类型4 酸碱盐的反应顺序
图示化分析
设ab段反应生成Cu(OH)2的质量为x,
2NaOH+CuCl2 Cu(OH)2↓+2NaCl
80 98
40 g×20% x
x=9.8 g,m=9.8+69.9=79.7
类型4 酸碱盐的反应顺序
A项,向盛有100 g CuSO4和H2SO4混合溶液的烧杯中加入过量BaCl2溶液,分别发生反应CuSO4+BaCl2 BaSO4↓+CuCl2,H2SO4+BaCl2 BaSO4↓+2HCl,所以加入NaOH溶液前,溶液中含有CuCl2、HCl、BaCl2三种溶质,错误。
B项,ab段增加的沉淀的质量是生成Cu(OH)2的质量,根据化学方程式计算,m=79.7,错误。
D项,c点溶液中含有BaCl2,滴加稀H2SO4,立即出现白色沉淀,错误。
类型4 酸碱盐的反应顺序
针对练3
[2024云南中考]某溶液可能含有HCl、CuCl2、CuSO4中的一种或几种,为了探究其组成,向一定质量的该溶液中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。(相对原子质量:H—1,O—16,S—32,Cl—35.5,Cu—64,Ba—137)下列说法正确的是( )
B
类型4 酸碱盐的反应顺序
针对练3
A.d点后,溶液的pH保持不变
B.b点对应的溶液中有三种溶质
C.c点到d点的过程中,溶液中溶质总质量在减少
D.原溶液含有HCl、CuCl2和CuSO4
√
类型4 酸碱盐的反应顺序
根据生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系,一开始就有沉淀生成,但ac段无沉淀生成,说明溶液中一定有盐酸,ac段发生的反应为2HCl+Ba(OH)2 BaCl2+2H2O,OH-可以和H+结合,也可以和Cu2+结合,但酸碱中和反应优先发生,又反应一开始就有沉淀生成,说明刚开始生成的沉淀不是Cu2+与OH-结合生成的Cu(OH)2沉淀,而是Ba2+与S结合生成的BaSO4沉淀,故溶液中一定有CuSO4。
类型4 酸碱盐的反应顺序
图中反应分析如下:
由图像可知,反应生成BaSO4沉淀的质量为23.3 g,生成Cu(OH)2沉淀的质量为33.1 g-23.3 g=9.8 g,设生成23.3 g BaSO4沉淀需要CuSO4的质量为x,生成9.8 g Cu(OH)2沉淀需要CuSO4的质量为y,则有:
类型4 酸碱盐的反应顺序
①CuSO4~BaSO4 ②CuSO4~Cu(OH)2
160 233 160 98
x 23.3 g y 9.8 g
解得x=16 g、y=16 g,则原溶液中含有CuSO4,不含CuCl2。由上文分析可知,原溶液中还含有HCl,故D项错误。
A( )d点后反应停止,继续滴加氢氧化钡溶液,溶液碱性增强,故溶液的pH逐渐增大。
类型4 酸碱盐的反应顺序
B(√)b点时盐酸过量,此时溶液中存在的溶质有HCl、BaCl2和CuCl2。
C( )c点到d点的过程中,发生反应:Ba(OH)2+CuCl2 BaCl2+Cu(OH)2↓,每135份质量的CuCl2参与反应,生成208份质量的BaCl2,则反应后溶液的质量增大,即该过程溶液中溶质总质量在增大。
同课章节目录
