2025年中考化学题型专题复习 题型三 溶液综合题课件(19页ppt)
文档属性
| 名称 | 2025年中考化学题型专题复习 题型三 溶液综合题课件(19页ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 629.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-17 14:14:09 | ||
图片预览



文档简介
(共19张PPT)
七年级上册
题型三 溶液综合题
2025年中考化学题型专题复习
类型1 溶解度的应用情境
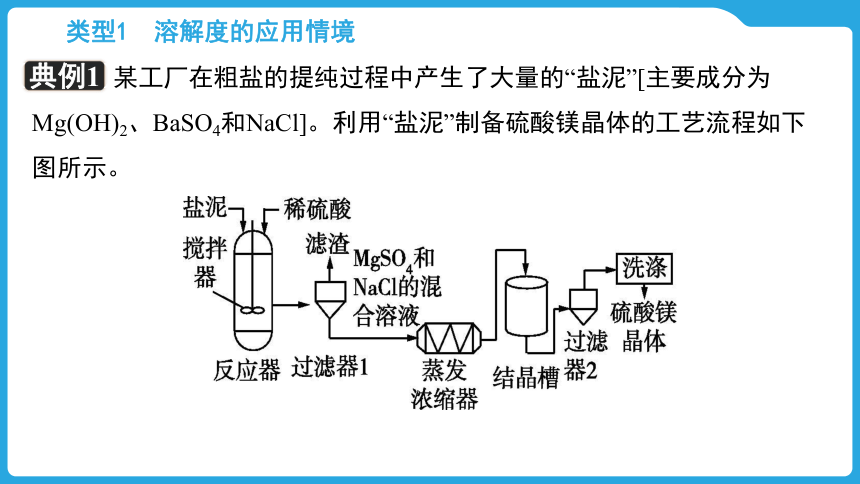
【典例1】
某工厂在粗盐的提纯过程中产生了大量的“盐泥”[主要成分为Mg(OH)2、BaSO4和NaCl]。利用“盐泥”制备硫酸镁晶体的工艺流程如下图所示。
类型1 溶解度的应用情境
【典例1】
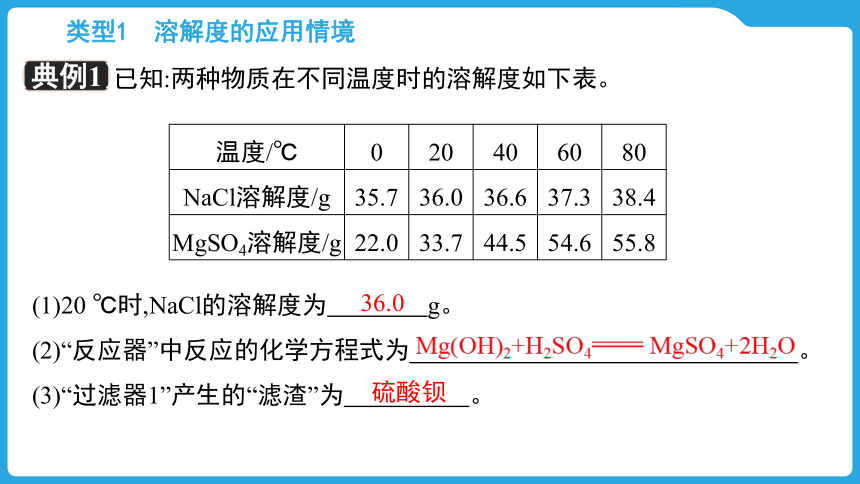
已知:两种物质在不同温度时的溶解度如下表。
(1)20 ℃时,NaCl的溶解度为 g。
(2)“反应器”中反应的化学方程式为 。
(3)“过滤器1”产生的“滤渣”为 。
36.0
Mg(OH)2+H2SO4 MgSO4+2H2O
硫酸钡
温度/℃ 0 20 40 60 80
NaCl溶解度/g 35.7 36.0 36.6 37.3 38.4
MgSO4溶解度/g 22.0 33.7 44.5 54.6 55.8
类型1 溶解度的应用情境
【典例1】
(4)“结晶槽”中获得硫酸镁晶体的方法是 结晶。
(5)从结晶槽中获得的硫酸镁晶体表面附着有杂质,需用试剂洗去。为避免晶体损失,最适宜的洗涤试剂是 。
冷却热饱和溶液(或降温)
饱和硫酸镁溶液
类型1 溶解度的应用情境
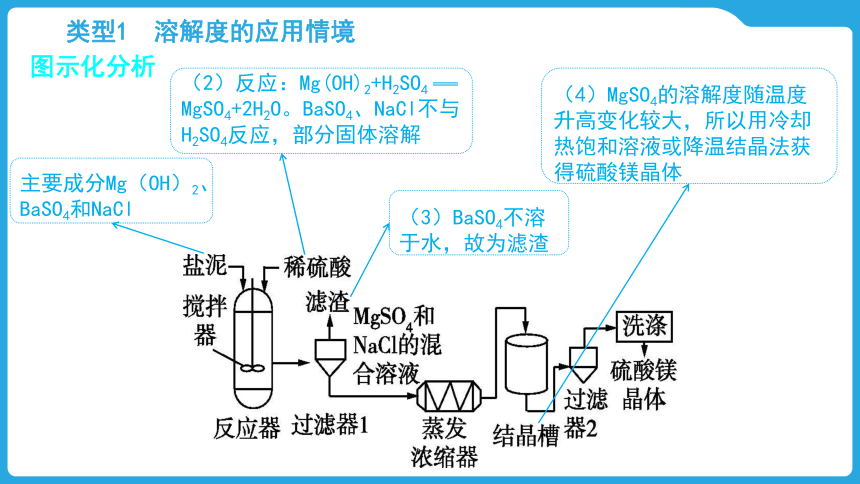
图示化分析
主要成分Mg(OH)2、BaSO4和NaCl
(2)反应:Mg(OH)2+H2SO4 MgSO4+2H2O。BaSO4、NaCl不与H2SO4反应,部分固体溶解
(3)BaSO4不溶于水,故为滤渣
(4)MgSO4的溶解度随温度升高变化较大,所以用冷却热饱和溶液或降温结晶法获得硫酸镁晶体
═
类型1 溶解度的应用情境
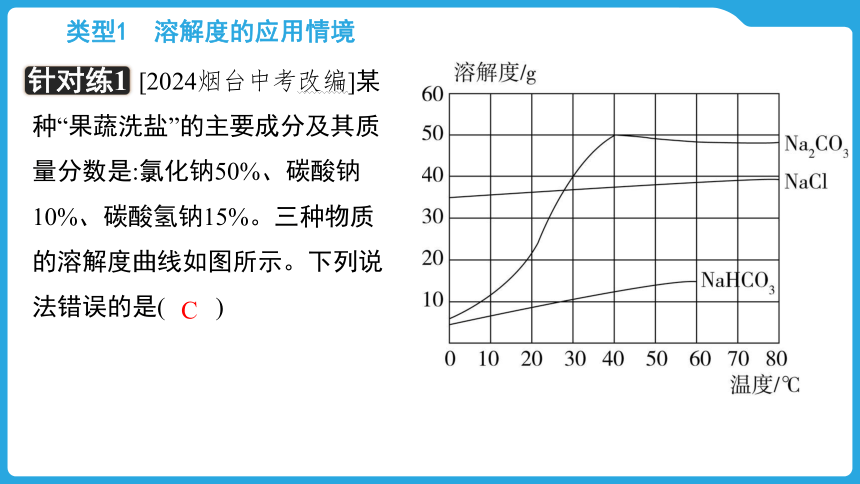
针对练1
[2024烟台中考改编]某种“果蔬洗盐”的主要成分及其质量分数是:氯化钠50%、碳酸钠10%、碳酸氢钠15%。三种物质的溶解度曲线如图所示。下列说法错误的是( )
C
类型1 溶解度的应用情境
针对练1
A.氯化钠、碳酸钠属于易溶物质
B.该“果蔬洗盐”不能与食醋一起使用
C.40 ℃时,Na2CO3饱和溶液的溶质质量分数等于50%
D.20 ℃时,将50 g“果蔬洗盐”放入100 g水中,形成的溶液是NaCl的不饱和溶液
√
类型1 溶解度的应用情境
B(√)该“果蔬洗盐”中含有Na2CO3、NaHCO3,二者均可与酸反应,食醋中含有醋酸,因此该“果蔬洗盐”不能与食醋一起使用。
类型1 溶解度的应用情境
针对练2
[2024遵义模拟]水是人类宝贵的自然资源,在生产、生活中起着十分重要的作用。
(1)把天然水净化成自来水。主要流程为:加明矾→
沉降→过滤→加活性炭→消毒杀菌。加明矾的作用是 。
(2)电解水实验如图所示,观察到的现象是
,检验b管中气体的方法是 。
吸附悬浮在水中的小颗粒,加速沉降
a、b两管中均产生气体且气体体积比约为2∶1
将带火星的木条(或燃着的木条)放在b管口,打开活塞,若木条复燃(或木条燃烧更旺),则为氧气
类型1 溶解度的应用情境
针对练2
(3)下表是KNO3、NaCl在不同温度下的溶解度。(两者溶解度互不影响)
①在一定温度下,将含69 g KNO3、18 g NaCl的混合物完全溶解在50 g水中。改变温度使KNO3析出、NaCl不析出,则温度t应控制的范围是 。
②实验室需要100 g 20%的KNO3溶液,现提供如下试剂:KNO3固体、10%KNO3溶液、蒸馏水。请设计配制溶液的方案:
方案一:取 g 10%的KNO3溶液蒸发至溶液100 g。
方案二: 。
20 ℃≤t<70 ℃
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
KNO3溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
NaCl溶解度/g 35.7 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39 39.8
200
取20 g硝酸钾固体溶于80 g蒸馏水中
类型1 溶解度的应用情境
(2)电解水生成氢气和氧气,正极产生氧气、负极产生氢气,观察图示信息,a、b两管分别与电源负极、正极相连,则可观察到a、b两管中均产生气体且气体体积比约为2∶1。b管收集到氧气,氧气具有助燃性,能使带火星的木条复燃,使燃着的木条燃烧更旺。
(3)①分析题干数据,将69 g硝酸钾溶解在50 g水中,改变温度使硝酸钾析出,需使温度处于硝酸钾溶解度小于138 g时的温度范围,此时18 g氯化钠在50 g水中仍全部溶解,需使温度处于氯化钠溶解度大于或等于36 g时的温度范围,根据溶解度表中数据,70 ℃时硝酸钾的溶解度为138 g,20 ℃时氯化钠的溶解度为36 g,可知该温度范围为20 ℃≤t<70 ℃。
类型1 溶解度的应用情境
②方案一:溶液稀释前后溶质质量不变,据此计算所需10%硝酸钾溶液的质量为100 g×20%÷10%=200 g。根据题干给出的试剂种类,结合已有方案,确定方案二为:使用硝酸钾固体与蒸馏水进行配制,所需硝酸钾固体质量为100 g×20%=20 g,所需蒸馏水质量为100 g-20 g=80 g。
类型2 跨学科实践——海洋资源的综合利用与制盐
【典例2】
“十四五”时期是我国迈向海洋强国的关键阶段,综合利用海洋资源,推动海洋经济高质量发展是实现海洋强国的重要保障。
Ⅰ.海水淡化
(1)蒸馏法淡化海水,该方法是利用海水中各物质的 不同进行分离的。
(2)在蒸馏前会对海水中的杂质进行预处理,先让活性炭“饱餐一顿”,再通过超滤膜净化。活性炭“饱餐一顿 ”利用了活性炭的 性,超滤膜净化的过程相当于化学实验的 操作。
(3)将净化后的水通过蒸馏得到的蒸馏水可用于配制溶液。用5 g氯化钠配制溶质质量分数为10%的氯化钠溶液,若量取水的体积时仰视量筒读数,则得到的溶液中溶质的质量分数会 (填“偏大”“偏小”或“无影响”)。
沸点
吸附
过滤
偏小
类型2 跨学科实践——海洋资源的综合利用与制盐
【典例2】
Ⅱ.海水晒盐
(4)晒盐时,采用的结晶方法是 ;海水晒盐后得到的卤水是氯化钠的 (填“饱和”或“不饱和”)溶液。
蒸发结晶
饱和
类型2 跨学科实践——海洋资源的综合利用与制盐
【典例2】
Ⅲ. 海水制碱
【查阅资料】向饱和食盐水中通入氨气得到饱和氨盐水,饱和氨盐水能与CO2发生反应:NaCl+NH3+CO2+H2O NaHCO3+NH4Cl。
(5)图1中固体X是 。
NaHCO3(或碳酸氢钠)
类型2 跨学科实践——海洋资源的综合利用与制盐
【典例2】
(6)如图2为NaCl和NaHCO3 两种物质在不同温度时的溶解度和溶解度曲线,请解释固体X析出的原因
。
在 0~60 ℃,NaHCO3的溶解度始终小于NaCl的溶解度
类型2 跨学科实践——海洋资源的综合利用与制盐
图示化分析
活性炭在净化水的过程中利用其疏松多孔的结构对颜色、异味进行吸附
此池是利用过滤原理净化水
NaHCO3溶解度明显小于NaCl,有NaHCO3析出
类型2 跨学科实践——海洋资源的综合利用与制盐
图示化分析
NaCl溶解度随温度升高变化不大,所以用蒸发结晶
类型2 跨学科实践——海洋资源的综合利用与制盐
(3)仰视量筒读数,实际测量水的体积偏大,因此溶质质量分数会偏小。(4)NaCl的溶解度随温度变化不大,所以需要蒸发结晶,卤水是由氯化钠结晶后过滤得到的,所以一定是饱和溶液。
七年级上册
题型三 溶液综合题
2025年中考化学题型专题复习
类型1 溶解度的应用情境
【典例1】
某工厂在粗盐的提纯过程中产生了大量的“盐泥”[主要成分为Mg(OH)2、BaSO4和NaCl]。利用“盐泥”制备硫酸镁晶体的工艺流程如下图所示。
类型1 溶解度的应用情境
【典例1】
已知:两种物质在不同温度时的溶解度如下表。
(1)20 ℃时,NaCl的溶解度为 g。
(2)“反应器”中反应的化学方程式为 。
(3)“过滤器1”产生的“滤渣”为 。
36.0
Mg(OH)2+H2SO4 MgSO4+2H2O
硫酸钡
温度/℃ 0 20 40 60 80
NaCl溶解度/g 35.7 36.0 36.6 37.3 38.4
MgSO4溶解度/g 22.0 33.7 44.5 54.6 55.8
类型1 溶解度的应用情境
【典例1】
(4)“结晶槽”中获得硫酸镁晶体的方法是 结晶。
(5)从结晶槽中获得的硫酸镁晶体表面附着有杂质,需用试剂洗去。为避免晶体损失,最适宜的洗涤试剂是 。
冷却热饱和溶液(或降温)
饱和硫酸镁溶液
类型1 溶解度的应用情境
图示化分析
主要成分Mg(OH)2、BaSO4和NaCl
(2)反应:Mg(OH)2+H2SO4 MgSO4+2H2O。BaSO4、NaCl不与H2SO4反应,部分固体溶解
(3)BaSO4不溶于水,故为滤渣
(4)MgSO4的溶解度随温度升高变化较大,所以用冷却热饱和溶液或降温结晶法获得硫酸镁晶体
═
类型1 溶解度的应用情境
针对练1
[2024烟台中考改编]某种“果蔬洗盐”的主要成分及其质量分数是:氯化钠50%、碳酸钠10%、碳酸氢钠15%。三种物质的溶解度曲线如图所示。下列说法错误的是( )
C
类型1 溶解度的应用情境
针对练1
A.氯化钠、碳酸钠属于易溶物质
B.该“果蔬洗盐”不能与食醋一起使用
C.40 ℃时,Na2CO3饱和溶液的溶质质量分数等于50%
D.20 ℃时,将50 g“果蔬洗盐”放入100 g水中,形成的溶液是NaCl的不饱和溶液
√
类型1 溶解度的应用情境
B(√)该“果蔬洗盐”中含有Na2CO3、NaHCO3,二者均可与酸反应,食醋中含有醋酸,因此该“果蔬洗盐”不能与食醋一起使用。
类型1 溶解度的应用情境
针对练2
[2024遵义模拟]水是人类宝贵的自然资源,在生产、生活中起着十分重要的作用。
(1)把天然水净化成自来水。主要流程为:加明矾→
沉降→过滤→加活性炭→消毒杀菌。加明矾的作用是 。
(2)电解水实验如图所示,观察到的现象是
,检验b管中气体的方法是 。
吸附悬浮在水中的小颗粒,加速沉降
a、b两管中均产生气体且气体体积比约为2∶1
将带火星的木条(或燃着的木条)放在b管口,打开活塞,若木条复燃(或木条燃烧更旺),则为氧气
类型1 溶解度的应用情境
针对练2
(3)下表是KNO3、NaCl在不同温度下的溶解度。(两者溶解度互不影响)
①在一定温度下,将含69 g KNO3、18 g NaCl的混合物完全溶解在50 g水中。改变温度使KNO3析出、NaCl不析出,则温度t应控制的范围是 。
②实验室需要100 g 20%的KNO3溶液,现提供如下试剂:KNO3固体、10%KNO3溶液、蒸馏水。请设计配制溶液的方案:
方案一:取 g 10%的KNO3溶液蒸发至溶液100 g。
方案二: 。
20 ℃≤t<70 ℃
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
KNO3溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
NaCl溶解度/g 35.7 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39 39.8
200
取20 g硝酸钾固体溶于80 g蒸馏水中
类型1 溶解度的应用情境
(2)电解水生成氢气和氧气,正极产生氧气、负极产生氢气,观察图示信息,a、b两管分别与电源负极、正极相连,则可观察到a、b两管中均产生气体且气体体积比约为2∶1。b管收集到氧气,氧气具有助燃性,能使带火星的木条复燃,使燃着的木条燃烧更旺。
(3)①分析题干数据,将69 g硝酸钾溶解在50 g水中,改变温度使硝酸钾析出,需使温度处于硝酸钾溶解度小于138 g时的温度范围,此时18 g氯化钠在50 g水中仍全部溶解,需使温度处于氯化钠溶解度大于或等于36 g时的温度范围,根据溶解度表中数据,70 ℃时硝酸钾的溶解度为138 g,20 ℃时氯化钠的溶解度为36 g,可知该温度范围为20 ℃≤t<70 ℃。
类型1 溶解度的应用情境
②方案一:溶液稀释前后溶质质量不变,据此计算所需10%硝酸钾溶液的质量为100 g×20%÷10%=200 g。根据题干给出的试剂种类,结合已有方案,确定方案二为:使用硝酸钾固体与蒸馏水进行配制,所需硝酸钾固体质量为100 g×20%=20 g,所需蒸馏水质量为100 g-20 g=80 g。
类型2 跨学科实践——海洋资源的综合利用与制盐
【典例2】
“十四五”时期是我国迈向海洋强国的关键阶段,综合利用海洋资源,推动海洋经济高质量发展是实现海洋强国的重要保障。
Ⅰ.海水淡化
(1)蒸馏法淡化海水,该方法是利用海水中各物质的 不同进行分离的。
(2)在蒸馏前会对海水中的杂质进行预处理,先让活性炭“饱餐一顿”,再通过超滤膜净化。活性炭“饱餐一顿 ”利用了活性炭的 性,超滤膜净化的过程相当于化学实验的 操作。
(3)将净化后的水通过蒸馏得到的蒸馏水可用于配制溶液。用5 g氯化钠配制溶质质量分数为10%的氯化钠溶液,若量取水的体积时仰视量筒读数,则得到的溶液中溶质的质量分数会 (填“偏大”“偏小”或“无影响”)。
沸点
吸附
过滤
偏小
类型2 跨学科实践——海洋资源的综合利用与制盐
【典例2】
Ⅱ.海水晒盐
(4)晒盐时,采用的结晶方法是 ;海水晒盐后得到的卤水是氯化钠的 (填“饱和”或“不饱和”)溶液。
蒸发结晶
饱和
类型2 跨学科实践——海洋资源的综合利用与制盐
【典例2】
Ⅲ. 海水制碱
【查阅资料】向饱和食盐水中通入氨气得到饱和氨盐水,饱和氨盐水能与CO2发生反应:NaCl+NH3+CO2+H2O NaHCO3+NH4Cl。
(5)图1中固体X是 。
NaHCO3(或碳酸氢钠)
类型2 跨学科实践——海洋资源的综合利用与制盐
【典例2】
(6)如图2为NaCl和NaHCO3 两种物质在不同温度时的溶解度和溶解度曲线,请解释固体X析出的原因
。
在 0~60 ℃,NaHCO3的溶解度始终小于NaCl的溶解度
类型2 跨学科实践——海洋资源的综合利用与制盐
图示化分析
活性炭在净化水的过程中利用其疏松多孔的结构对颜色、异味进行吸附
此池是利用过滤原理净化水
NaHCO3溶解度明显小于NaCl,有NaHCO3析出
类型2 跨学科实践——海洋资源的综合利用与制盐
图示化分析
NaCl溶解度随温度升高变化不大,所以用蒸发结晶
类型2 跨学科实践——海洋资源的综合利用与制盐
(3)仰视量筒读数,实际测量水的体积偏大,因此溶质质量分数会偏小。(4)NaCl的溶解度随温度变化不大,所以需要蒸发结晶,卤水是由氯化钠结晶后过滤得到的,所以一定是饱和溶液。
同课章节目录
