2025年中考化学题型专题复习 题型四 实验方案的设计与评价课件(22页ppt)
文档属性
| 名称 | 2025年中考化学题型专题复习 题型四 实验方案的设计与评价课件(22页ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 896.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-17 14:14:09 | ||
图片预览



文档简介
(共22张PPT)
七年级上册
题型四 实验方案的设计与评价
2025年中考化学题型专题复习
类型1 实验方案的设计
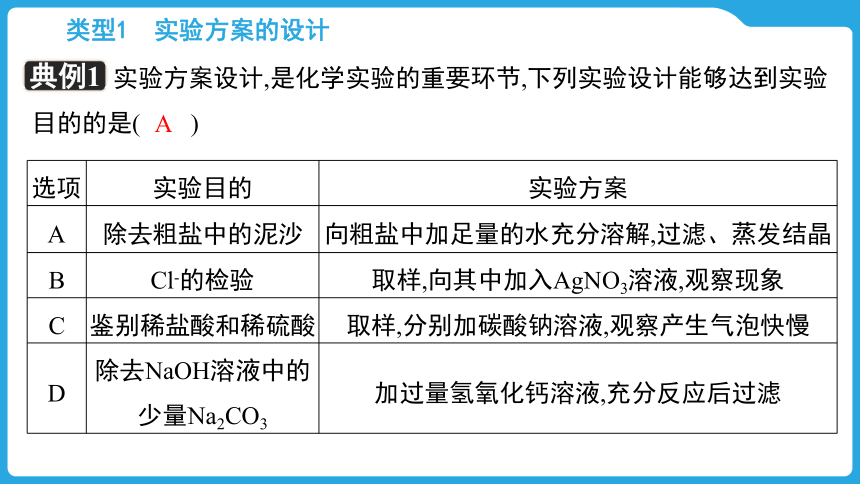
【典例1】
实验方案设计,是化学实验的重要环节,下列实验设计能够达到实验目的的是( )
A
选项 实验目的 实验方案
A 除去粗盐中的泥沙 向粗盐中加足量的水充分溶解,过滤、蒸发结晶
B Cl-的检验 取样,向其中加入AgNO3溶液,观察现象
C 鉴别稀盐酸和稀硫酸 取样,分别加碳酸钠溶液,观察产生气泡快慢
D 除去NaOH溶液中的少量Na2CO3 加过量氢氧化钙溶液,充分反应后过滤
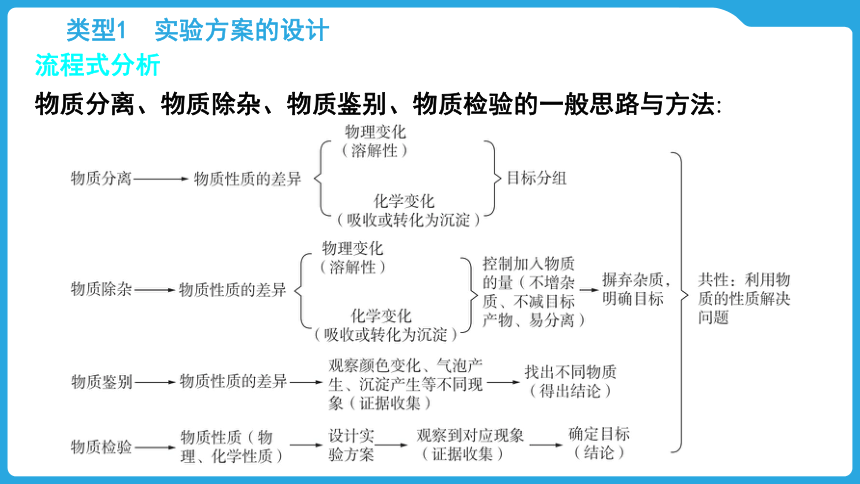
类型1 实验方案的设计
流程式分析
物质分离、物质除杂、物质鉴别、物质检验的一般思路与方法:
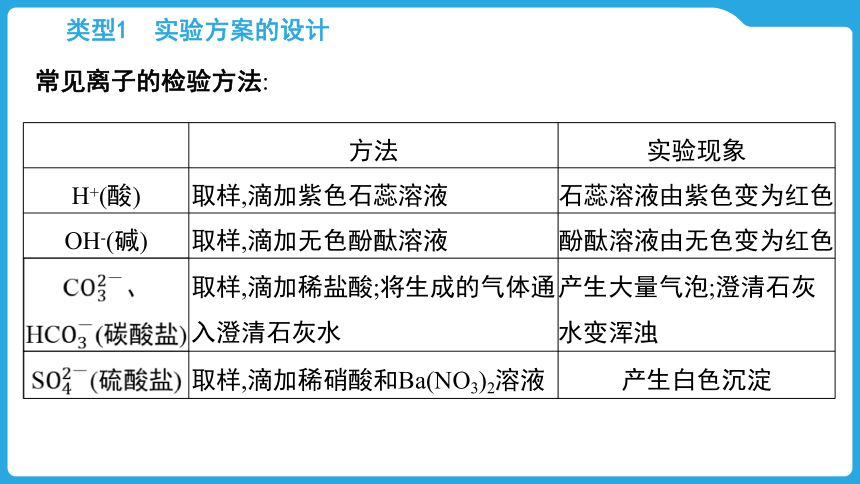
类型1 实验方案的设计
常见离子的检验方法:
方法 实验现象
H+(酸) 取样,滴加紫色石蕊溶液 石蕊溶液由紫色变为红色
OH-(碱) 取样,滴加无色酚酞溶液 酚酞溶液由无色变为红色
C、HC(碳酸盐) 取样,滴加稀盐酸;将生成的气体通入澄清石灰水 产生大量气泡;澄清石灰水变浑浊
S(硫酸盐) 取样,滴加稀硝酸和Ba(NO3)2溶液 产生白色沉淀
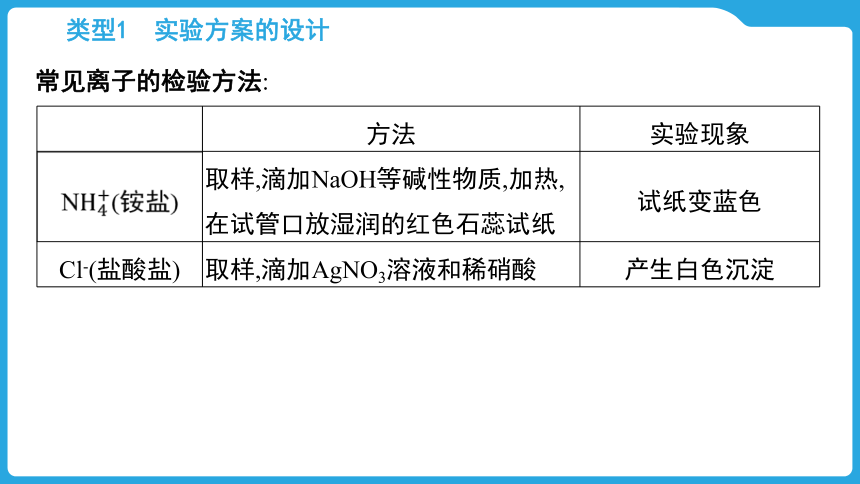
类型1 实验方案的设计
常见离子的检验方法:
方法 实验现象
N(铵盐) 取样,滴加NaOH等碱性物质,加热,在试管口放湿润的红色石蕊试纸 试纸变蓝色
Cl-(盐酸盐) 取样,滴加AgNO3溶液和稀硝酸 产生白色沉淀
类型1 实验方案的设计
A项考查物质的分离,利用物质的物理性质进行方案的设计,所以需要通过溶解、过滤、蒸发进行分离物质,故正确。
B项考查离子的检验,Cl-的检验一定要先加入稀硝酸排除其他离子的干扰,再加入硝酸银溶液,有白色沉淀产生才能证明是Cl-,故错误。
C项考查物质的鉴别,需鉴别Cl-和S,而加入碳酸钠是为了检验H+,故错误。
D项考查除杂问题,原则是不引入其他杂质也不减少目标产物的量,过量氢氧化钙会引入新杂质,故错误。
类型1 实验方案的设计
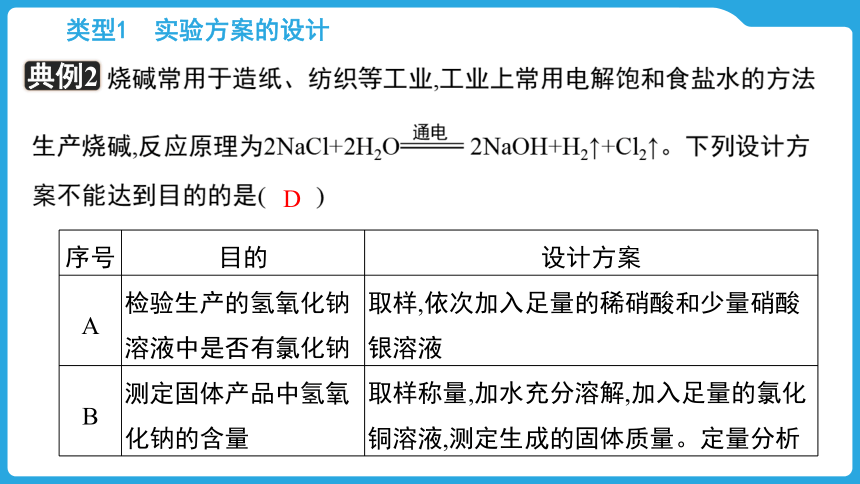
【典例2】
烧碱常用于造纸、纺织等工业,工业上常用电解饱和食盐水的方法生产烧碱,反应原理为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。下列设计方案不能达到目的的是( )
D
序号 目的 设计方案
A 检验生产的氢氧化钠溶液中是否有氯化钠 取样,依次加入足量的稀硝酸和少量硝酸银溶液
B 测定固体产品中氢氧化钠的含量 取样称量,加水充分溶解,加入足量的氯化铜溶液,测定生成的固体质量。定量分析
类型1 实验方案的设计
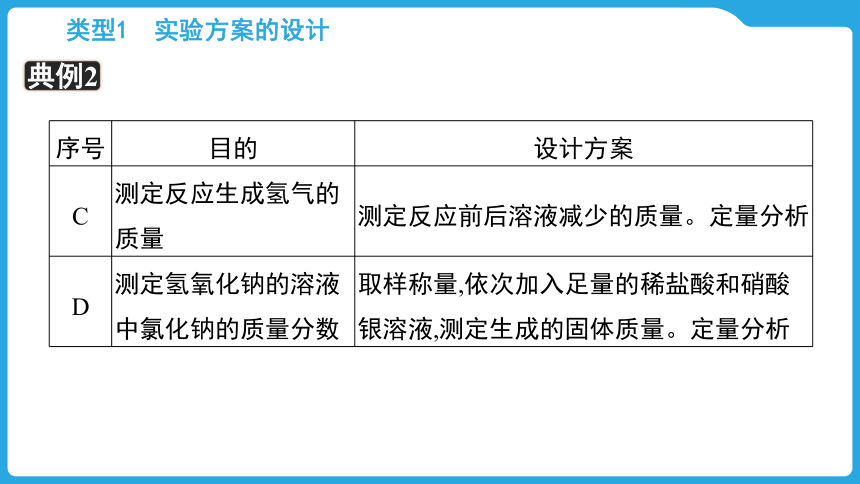
【典例2】
序号 目的 设计方案
C 测定反应生成氢气的质量 测定反应前后溶液减少的质量。定量分析
D 测定氢氧化钠的溶液中氯化钠的质量分数 取样称量,依次加入足量的稀盐酸和硝酸银溶液,测定生成的固体质量。定量分析
类型1 实验方案的设计
检验Cl-一定要先加入稀硝酸排除其他离子的干扰,再加入硝酸银溶液,有白色沉淀才能证明是Cl-,故A正确;
定量检验物质,加入氯化铜将氢氧根离子转化为沉淀,称量沉淀质量即可得出结论,故B正确;
利用质量守恒定律分析,测定反应前后溶液质量减少多少便能进行定量分析,故C正确;
定量检验物质氯化钠,加入稀盐酸会引入氯离子,故D错误。
类型1 实验方案的设计
流程式分析
物质检验、定量检验物质含量的一般思路与方法:
类型1 实验方案的设计
针对练1
[2024烟台中考]物质的检验、鉴别、除杂是化学研究的重要方法。下列实验方案能达到目的的是( )
D
选项 实验目的 实验方案
A 鉴别N2和CO2 将燃着的木条分别伸入气体中,观察现象
B 除去CO中少量的CO2 将混合气体通过足量的高温氧化铁粉末
C 除去CuCl2溶液中的HCl 加入过量的铁粉、过滤
D 检验稀盐酸中是否混有H2SO4 取样,加入BaCl2溶液,观察现象
类型1 实验方案的设计
N2和CO2均不能燃烧、不支持燃烧,均能使燃着的木条熄灭,A项实验方案不能达到目的。
CO能与足量的高温氧化铁粉末反应生成铁和二氧化碳,反而会把原物质除去,B项实验方案不能达到目的。
HCl、CuCl2溶液均能与过量的铁粉反应,不但能把杂质除去,也会把原物质除去,C项实验方案不能达到目的。
硫酸能与氯化钡溶液反应生成硫酸钡白色沉淀和盐酸,盐酸不能与氯化钡溶液反应,D项实验方案能达到目的。
类型2 实验方案的评价
【典例3】
碳酸钠和碳酸氢钠是厨房中常见的物质,同学们利用这两种物质进行如下探究活动。
【活动一】认识二者的性质及用途
(1)分别向碳酸钠和碳酸氢钠的水溶液中滴入酚酞溶液,溶液均变红,由此可知两种溶液的pH 7(填“>”“=”或“<”)。
(2)向碳酸氢钠溶液中加入稀盐酸,发现溶液中有大量气泡产生,原因是 。
(3)碳酸钠在生活和生产中有广泛应用,如工业上常用碳酸钠和氢氧化钙制备烧碱,写出该反应的化学方程式 。
>
碳酸氢根离子和氢离子反应生成二氧化碳(合理即可)
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
类型2 实验方案的评价
【典例3】
【活动二】探究二者的热稳定性同学们设计了如图1所示装置进行实验,部分夹持装置略去。
(4)加热后,a 中石灰水无变化,而b中石灰水变浑浊,小试管中有水滴。 经检验,小试管中剩余物质为碳酸钠。小试管中发生
反应的化学方程式为
,由此可得出的结论是
。
2NaHCO3 Na2CO3+
H2O+CO2↑
碳酸钠在加热
条件下比碳酸氢钠稳定(合理即可)
类型2 实验方案的评价
【典例3】
【活动三】了解纯碱的制备
(5)我国著名的科学家侯德榜先生,发明了联合制碱法(又称侯氏制碱法)。 通过氨碱法制得碳酸氢钠,经过进一步加热处理,最终得到纯碱样品。
【提出问题】针对制得的纯碱样品,需要明确样品中是否含有碳酸氢钠,如果存在,其具体的含量是多少
【查阅资料】无水硫酸铜为白色固体,遇水变成蓝色。
类型2 实验方案的评价
【典例3】
【实验探究】小组同学利用如图2装置进行实验探究,已知反应前A 装置硬质玻璃管中纯碱样品的质量为m,两个U形管及无水硫酸铜的总质量为m1。
类型2 实验方案的评价
【典例3】
【实验操作】
步骤一:打开弹簧夹,先通入一段时间的氮气,后关闭弹簧夹,再点燃酒精灯。
步骤二:当观察到D装置中导管口不再有气泡冒出时,熄灭酒精灯,同时打开弹簧夹,继续通入氮气一段时间,待装置冷却后,关闭弹簧夹。
步骤三:称量实验后两个U 形管及里面物质的总质量为m2。
类型2 实验方案的评价
【典例3】
【实验结论】
①实验结束后,C 装置中无明显变化,通过实验证明样品中的确含有碳酸氢钠,得出此结论的依据是 。
②步骤二中通入氮气的作用是 。
③该样品中碳酸氢钠的质量分数为 ×100%(用含m、m1、m2的代数式表示)。
B中无水硫酸铜变成蓝色
将玻璃管中的水蒸气尽可能排入装置B中
类型2 实验方案的评价
【典例3】
【交流与讨论】
(6)甲同学认为该实验设计存在缺陷,导致测得的碳酸氢钠的含量偏高,请指出该设计的不足之处: 。
第一次通入氮气时,装置内的水蒸气也被装置B吸收
类型2 实验方案的评价
图示化分析
此类型的题都是利用物质的性质对物质进行鉴别,常见气体的检验与吸收试剂如下表:
物质 检验 吸收
水 无水硫酸铜(遇水变蓝) 液体:浓硫酸 固体:碱石灰
二氧化碳 澄清石灰水 氢氧化钠溶液等
氯化氢 硝酸酸化的硝酸银溶液 饱和碳酸氢钠溶液等
类型2 实验方案的评价
图示化分析
加热不分解,a中无明显现象
生成CO2,则发生反应:
CO2+Ca(OH)2 CaCO3↓+H2O
△
碳酸氢钠受热分解:2NaHCO3 Na2CO3+H2O+CO2↑
思路:
①分析图像
②找准装置特点
③根据现象得出结论
═
═
类型2 实验方案的评价
图示化分析
思路:
①分析图像
②找准装置特点,有气体参与的实验要关注气体的性质及作用
③根据现象得出结论
氮气化学性质稳定,一方面排空气,防止空气对实验造成影响;另一方面将装置中气体都排入后续装置中
利用CuSO4遇水变蓝的性质,检验水的生成
防止空气中的水蒸气对实验造成影响
七年级上册
题型四 实验方案的设计与评价
2025年中考化学题型专题复习
类型1 实验方案的设计
【典例1】
实验方案设计,是化学实验的重要环节,下列实验设计能够达到实验目的的是( )
A
选项 实验目的 实验方案
A 除去粗盐中的泥沙 向粗盐中加足量的水充分溶解,过滤、蒸发结晶
B Cl-的检验 取样,向其中加入AgNO3溶液,观察现象
C 鉴别稀盐酸和稀硫酸 取样,分别加碳酸钠溶液,观察产生气泡快慢
D 除去NaOH溶液中的少量Na2CO3 加过量氢氧化钙溶液,充分反应后过滤
类型1 实验方案的设计
流程式分析
物质分离、物质除杂、物质鉴别、物质检验的一般思路与方法:
类型1 实验方案的设计
常见离子的检验方法:
方法 实验现象
H+(酸) 取样,滴加紫色石蕊溶液 石蕊溶液由紫色变为红色
OH-(碱) 取样,滴加无色酚酞溶液 酚酞溶液由无色变为红色
C、HC(碳酸盐) 取样,滴加稀盐酸;将生成的气体通入澄清石灰水 产生大量气泡;澄清石灰水变浑浊
S(硫酸盐) 取样,滴加稀硝酸和Ba(NO3)2溶液 产生白色沉淀
类型1 实验方案的设计
常见离子的检验方法:
方法 实验现象
N(铵盐) 取样,滴加NaOH等碱性物质,加热,在试管口放湿润的红色石蕊试纸 试纸变蓝色
Cl-(盐酸盐) 取样,滴加AgNO3溶液和稀硝酸 产生白色沉淀
类型1 实验方案的设计
A项考查物质的分离,利用物质的物理性质进行方案的设计,所以需要通过溶解、过滤、蒸发进行分离物质,故正确。
B项考查离子的检验,Cl-的检验一定要先加入稀硝酸排除其他离子的干扰,再加入硝酸银溶液,有白色沉淀产生才能证明是Cl-,故错误。
C项考查物质的鉴别,需鉴别Cl-和S,而加入碳酸钠是为了检验H+,故错误。
D项考查除杂问题,原则是不引入其他杂质也不减少目标产物的量,过量氢氧化钙会引入新杂质,故错误。
类型1 实验方案的设计
【典例2】
烧碱常用于造纸、纺织等工业,工业上常用电解饱和食盐水的方法生产烧碱,反应原理为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。下列设计方案不能达到目的的是( )
D
序号 目的 设计方案
A 检验生产的氢氧化钠溶液中是否有氯化钠 取样,依次加入足量的稀硝酸和少量硝酸银溶液
B 测定固体产品中氢氧化钠的含量 取样称量,加水充分溶解,加入足量的氯化铜溶液,测定生成的固体质量。定量分析
类型1 实验方案的设计
【典例2】
序号 目的 设计方案
C 测定反应生成氢气的质量 测定反应前后溶液减少的质量。定量分析
D 测定氢氧化钠的溶液中氯化钠的质量分数 取样称量,依次加入足量的稀盐酸和硝酸银溶液,测定生成的固体质量。定量分析
类型1 实验方案的设计
检验Cl-一定要先加入稀硝酸排除其他离子的干扰,再加入硝酸银溶液,有白色沉淀才能证明是Cl-,故A正确;
定量检验物质,加入氯化铜将氢氧根离子转化为沉淀,称量沉淀质量即可得出结论,故B正确;
利用质量守恒定律分析,测定反应前后溶液质量减少多少便能进行定量分析,故C正确;
定量检验物质氯化钠,加入稀盐酸会引入氯离子,故D错误。
类型1 实验方案的设计
流程式分析
物质检验、定量检验物质含量的一般思路与方法:
类型1 实验方案的设计
针对练1
[2024烟台中考]物质的检验、鉴别、除杂是化学研究的重要方法。下列实验方案能达到目的的是( )
D
选项 实验目的 实验方案
A 鉴别N2和CO2 将燃着的木条分别伸入气体中,观察现象
B 除去CO中少量的CO2 将混合气体通过足量的高温氧化铁粉末
C 除去CuCl2溶液中的HCl 加入过量的铁粉、过滤
D 检验稀盐酸中是否混有H2SO4 取样,加入BaCl2溶液,观察现象
类型1 实验方案的设计
N2和CO2均不能燃烧、不支持燃烧,均能使燃着的木条熄灭,A项实验方案不能达到目的。
CO能与足量的高温氧化铁粉末反应生成铁和二氧化碳,反而会把原物质除去,B项实验方案不能达到目的。
HCl、CuCl2溶液均能与过量的铁粉反应,不但能把杂质除去,也会把原物质除去,C项实验方案不能达到目的。
硫酸能与氯化钡溶液反应生成硫酸钡白色沉淀和盐酸,盐酸不能与氯化钡溶液反应,D项实验方案能达到目的。
类型2 实验方案的评价
【典例3】
碳酸钠和碳酸氢钠是厨房中常见的物质,同学们利用这两种物质进行如下探究活动。
【活动一】认识二者的性质及用途
(1)分别向碳酸钠和碳酸氢钠的水溶液中滴入酚酞溶液,溶液均变红,由此可知两种溶液的pH 7(填“>”“=”或“<”)。
(2)向碳酸氢钠溶液中加入稀盐酸,发现溶液中有大量气泡产生,原因是 。
(3)碳酸钠在生活和生产中有广泛应用,如工业上常用碳酸钠和氢氧化钙制备烧碱,写出该反应的化学方程式 。
>
碳酸氢根离子和氢离子反应生成二氧化碳(合理即可)
Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
类型2 实验方案的评价
【典例3】
【活动二】探究二者的热稳定性同学们设计了如图1所示装置进行实验,部分夹持装置略去。
(4)加热后,a 中石灰水无变化,而b中石灰水变浑浊,小试管中有水滴。 经检验,小试管中剩余物质为碳酸钠。小试管中发生
反应的化学方程式为
,由此可得出的结论是
。
2NaHCO3 Na2CO3+
H2O+CO2↑
碳酸钠在加热
条件下比碳酸氢钠稳定(合理即可)
类型2 实验方案的评价
【典例3】
【活动三】了解纯碱的制备
(5)我国著名的科学家侯德榜先生,发明了联合制碱法(又称侯氏制碱法)。 通过氨碱法制得碳酸氢钠,经过进一步加热处理,最终得到纯碱样品。
【提出问题】针对制得的纯碱样品,需要明确样品中是否含有碳酸氢钠,如果存在,其具体的含量是多少
【查阅资料】无水硫酸铜为白色固体,遇水变成蓝色。
类型2 实验方案的评价
【典例3】
【实验探究】小组同学利用如图2装置进行实验探究,已知反应前A 装置硬质玻璃管中纯碱样品的质量为m,两个U形管及无水硫酸铜的总质量为m1。
类型2 实验方案的评价
【典例3】
【实验操作】
步骤一:打开弹簧夹,先通入一段时间的氮气,后关闭弹簧夹,再点燃酒精灯。
步骤二:当观察到D装置中导管口不再有气泡冒出时,熄灭酒精灯,同时打开弹簧夹,继续通入氮气一段时间,待装置冷却后,关闭弹簧夹。
步骤三:称量实验后两个U 形管及里面物质的总质量为m2。
类型2 实验方案的评价
【典例3】
【实验结论】
①实验结束后,C 装置中无明显变化,通过实验证明样品中的确含有碳酸氢钠,得出此结论的依据是 。
②步骤二中通入氮气的作用是 。
③该样品中碳酸氢钠的质量分数为 ×100%(用含m、m1、m2的代数式表示)。
B中无水硫酸铜变成蓝色
将玻璃管中的水蒸气尽可能排入装置B中
类型2 实验方案的评价
【典例3】
【交流与讨论】
(6)甲同学认为该实验设计存在缺陷,导致测得的碳酸氢钠的含量偏高,请指出该设计的不足之处: 。
第一次通入氮气时,装置内的水蒸气也被装置B吸收
类型2 实验方案的评价
图示化分析
此类型的题都是利用物质的性质对物质进行鉴别,常见气体的检验与吸收试剂如下表:
物质 检验 吸收
水 无水硫酸铜(遇水变蓝) 液体:浓硫酸 固体:碱石灰
二氧化碳 澄清石灰水 氢氧化钠溶液等
氯化氢 硝酸酸化的硝酸银溶液 饱和碳酸氢钠溶液等
类型2 实验方案的评价
图示化分析
加热不分解,a中无明显现象
生成CO2,则发生反应:
CO2+Ca(OH)2 CaCO3↓+H2O
△
碳酸氢钠受热分解:2NaHCO3 Na2CO3+H2O+CO2↑
思路:
①分析图像
②找准装置特点
③根据现象得出结论
═
═
类型2 实验方案的评价
图示化分析
思路:
①分析图像
②找准装置特点,有气体参与的实验要关注气体的性质及作用
③根据现象得出结论
氮气化学性质稳定,一方面排空气,防止空气对实验造成影响;另一方面将装置中气体都排入后续装置中
利用CuSO4遇水变蓝的性质,检验水的生成
防止空气中的水蒸气对实验造成影响
同课章节目录
