2025年中考化学题型专题复习 题型五 金属实验题课件(23页ppt)
文档属性
| 名称 | 2025年中考化学题型专题复习 题型五 金属实验题课件(23页ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1017.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-02-17 14:14:09 | ||
图片预览





文档简介
(共23张PPT)
七年级上册
题型五 金属实验题
2025年中考化学题型专题复习
类型1 金属活动性的探究问题
【典例1】
金属材料的广泛应用,极大地促进了社会发展。
(1)镓(Ga)及其化合物应用广泛,常用于半导体、合金、磁性材料等领域。已知镓在化合物中常为+3价,金属活动性顺序:Zn>Ga>Fe。
①写出镓与稀盐酸反应的化学方程式 。
②根据上述信息,下列预测不合理的是 (填字母)。
A.镓具有导电性
B.氧化镓的化学式为Ga2O3
C.镓能与硫酸铝溶液反应生成铝
D.H2或CO在高温条件下能将镓的氧化物转化为金属镓
2Ga+6HCl 2GaCl3+3H2↑
C
类型1 金属活动性的探究问题
【典例1】
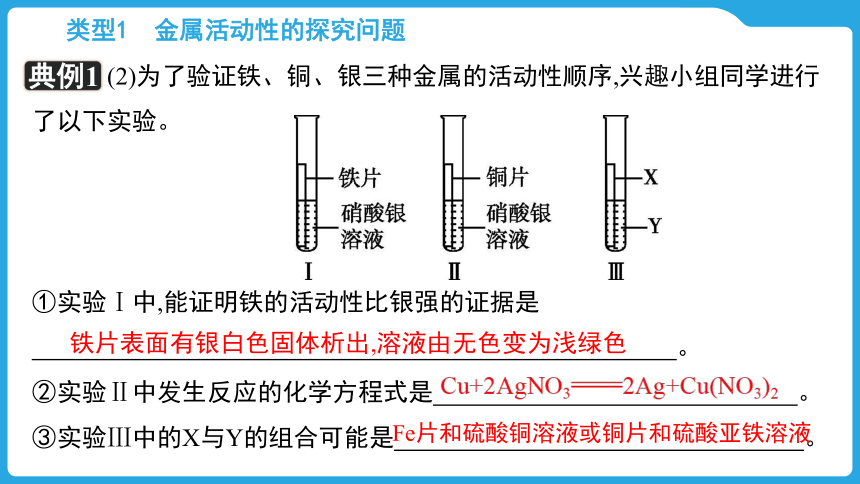
(2)为了验证铁、铜、银三种金属的活动性顺序,兴趣小组同学进行了以下实验。
①实验Ⅰ中,能证明铁的活动性比银强的证据是 。
②实验Ⅱ中发生反应的化学方程式是 。
③实验Ⅲ中的X与Y的组合可能是 。
铁片表面有银白色固体析出,溶液由无色变为浅绿色
Cu+2AgNO32Ag+Cu(NO3)2
Fe片和硫酸铜溶液或铜片和硫酸亚铁溶液
类型1 金属活动性的探究问题
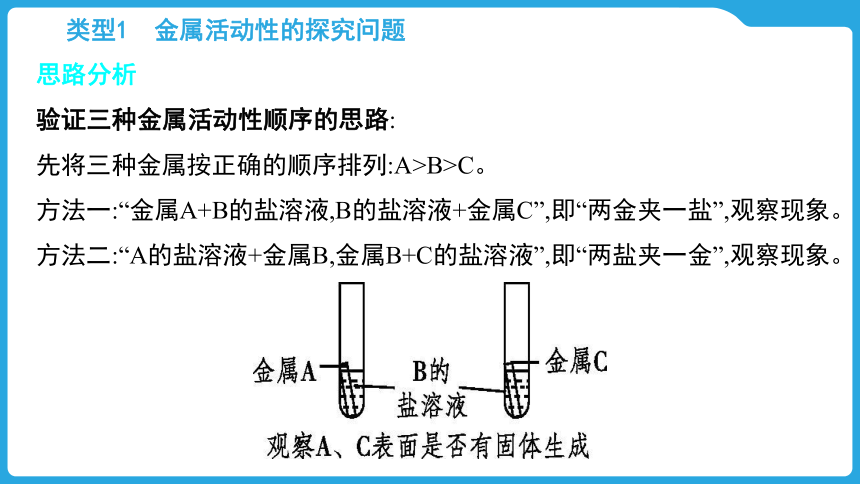
思路分析
验证三种金属活动性顺序的思路:
先将三种金属按正确的顺序排列:A>B>C。
方法一:“金属A+B的盐溶液,B的盐溶液+金属C”,即“两金夹一盐”,观察现象。
方法二:“A的盐溶液+金属B,金属B+C的盐溶液”,即“两盐夹一金”,观察现象。
类型1 金属活动性的探究问题
(1)②根据活动性Zn>Ga>Fe,Al的活动性>Zn,所以Ga不能与硫酸铝溶液反应,C不正确。
(2)①通过实验现象证明铁的活动性比银强,铁表面有银白色固体析出,溶液由无色变为浅绿色。
③通过实验Ⅰ得到金属活动性Fe>Ag,通过实验Ⅱ得到金属活动性Cu>Ag,无法判断Fe、Cu的金属活动性强弱,为了判断Fe、Cu的金属活动性强弱,可以将Fe片放入铜的盐溶液中,也可以将Cu片放入铁的盐溶液中。
类型1 金属活动性的探究问题
针对练1
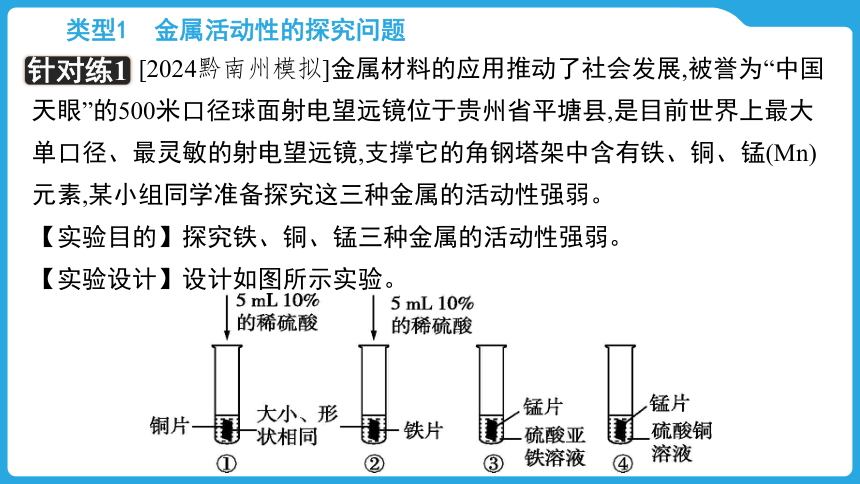
[2024黔南州模拟]金属材料的应用推动了社会发展,被誉为“中国天眼”的500米口径球面射电望远镜位于贵州省平塘县,是目前世界上最大单口径、最灵敏的射电望远镜,支撑它的角钢塔架中含有铁、铜、锰(Mn)元素,某小组同学准备探究这三种金属的活动性强弱。
【实验目的】探究铁、铜、锰三种金属的活动性强弱。
【实验设计】设计如图所示实验。
类型1 金属活动性的探究问题
针对练1
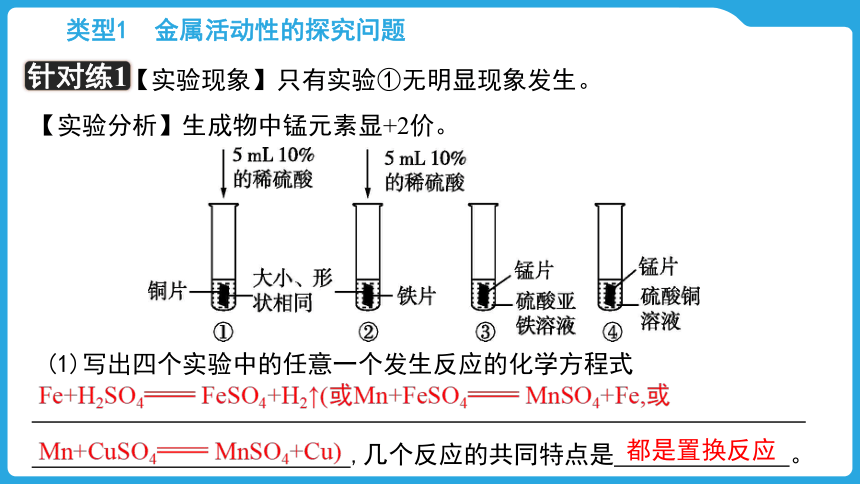
【实验现象】只有实验①无明显现象发生。
【实验分析】生成物中锰元素显+2价。
(1)写出四个实验中的任意一个发生反应的化学方程式 ,几个反应的共同特点是 。
Fe+H2SO4 FeSO4+H2↑(或Mn+FeSO4 MnSO4+Fe,或Mn+CuSO4 MnSO4+Cu)
都是置换反应
类型1 金属活动性的探究问题
针对练1
(2)同学们分析发现,不需要进行实验 (填序号)也可以达到实验目的。
【实验结论】
(3)铁、铜、锰三种金属的活动性强弱为 。
【实验拓展】
(4)现将由5.5 g锰、5.6 g铁、6.4 g铜组成的混合物放入一定量的稀硫酸中,充分反应后过滤得到固体12 g,则产生氢气的质量为 g。(相对原子质量:H—1,Mn—55,Fe—56,Cu—64)
④
Mn>Fe>Cu
0.2
类型1 金属活动性的探究问题
(1)只有实验①无明显现象发生,说明实验①无反应发生,实验②③④都有反应发生。②中铁与稀硫酸反应生成硫酸亚铁和氢气Fe+H2SO4 FeSO4+ H2↑;③中锰与硫酸亚铁反应生成硫酸锰和铁Mn+FeSO4 MnSO4+Fe;
④中锰与硫酸铜反应生成硫酸锰和铜Mn+CuSO4 MnSO4+Cu。上述反应都是金属与酸或盐的反应,都属于置换反应。
(2)由实验①可知,金属活动性:(H)>Cu;由实验②可知,金属活动性:Fe>(H);由实验③可知,金属活动性:Mn>Fe;由实验④可知,金属活动性:Mn>Cu。实验①②③已经说明金属活动性:Mn>Fe>(H)>Cu,所以不需要进行实验④也可以达到实验目的。
类型1 金属活动性的探究问题
(4)由(2)可知,金属活动性:Mn>Fe>(H)>Cu,充分反应后过滤得到的12 g固体中含有6.4 g Cu,则未参加反应的Fe为12 g-6.4 g=5.6 g,即只有5.5 g Mn与稀硫酸反应,设生成的氢气质量为x。
Mn+H2SO4 MnSO4+H2↑
55 2
5.5 g x
解得x=0.2 g,
即产生氢气的质量为0.2 g。
类型2 有关流程图及定量研究的问题
【典例2】
金属材料的应用推动了社会的发展。新型材料的研制,已成为现代高新技术的重要物质基础。
(1)目前常用的1元硬币为钢芯镀镍合金,具有耐腐蚀、 等优点。
(2)镁和铝可熔炼成Mg17Al12镁合金,熔炼过程只能在真空中,不能在空气中进行的原因是 (写其中一个化学方程式)。
硬度大
2Mg+O2 2MgO(或4Al+3O2 2Al2O3)
类型2 有关流程图及定量研究的问题
【典例2】
(3)某废弃物中可能含有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分并回收金属,取样品进行如图实验。(相对原子质量:H—1,O—16,Mg—24,Cu—64,Zn—65)
①步骤Ⅱ的操作是 。
②步骤Ⅱ中产生的现象是 。步骤Ⅲ中锌和稀硫酸反应的化学方程式为 。
过滤
有红色固体产生、有气泡产生、溶液由蓝色变为无色
Zn+H2SO4 ZnSO4+H2↑
类型2 有关流程图及定量研究的问题
【典例2】
③若溶液C中只含一种溶质,则样品的成分是 。
④通过测氢气的质量,也可确定样品的成分,则w的值为 (用含m和n的代数式表示)。
Cu、CuO、Zn
≤w≤
类型2 有关流程图及定量研究的问题
图示化分析
Cu、CuO、Mg、Zn中的一种或几种
Cu不与酸反应,其余都反应,CuO+H2SO4═CuSO4+H2O,
Mg+H2SO4═MgSO4+H2↑,Zn+H2SO4═ZnSO4+H2↑
加酸有铜剩余,说明样品中一定有Cu
加过量的锌粉得到的固体B中有铜,说明溶液A中一定有CuSO4,且还有过量的稀H2SO4溶液,现象为有红色固体析出、有气泡产生、溶液由蓝色变为无色
一定有CuSO4、H2SO4,可能有ZnSO4、MgSO4
生成的Cu和过量的Zn
一定有ZnSO4,可能有MgSO4
Cu是CuO与酸反应生成CuSO4中置换出来的,因此可求出CuO的质量
可以是Mg、Zn任一种反应产生的,也可以是Mg、Zn的混合物反应产生的
类型2 有关流程图及定量研究的问题
图示化分析
Mg+H2SO4 ZnSO4+H2↑
24 2 65 2
(m-2n) g x (m-2n) g y
x= y=
≤w≤
类型2 有关流程图及定量研究的问题
(2)熔炼过程只能在真空中进行,因为Mg、Al均能与氧气反应,化学方程式为2Mg+O2 2MgO、4Al+3O2 2Al2O3。
(3)①将固液分离的方法是过滤。
②Zn先与CuSO4反应再与H2SO4反应,有红色固体产生、有气体产生、溶液由蓝色变为无色。步骤Ⅲ中过量的锌和稀H2SO4反应:Zn+H2SO4 ZnSO4+H2↑。
类型2 有关流程图及定量研究的问题
④样品为m g,根据步骤Ⅰ现象知一定有Cu,为n g,根据步骤Ⅲ知一定有CuO,经计算CuO也为n g,所以剩余金属的质量为(m-2n) g,利用极值法进行计算:
Mg+H2SO4 MgSO4+H2
24 2
(m-2n) g x
x=
类型2 有关流程图及定量研究的问题
Zn+H2SO4 ZnSO4+H2↑
65 2
(m-2n) g y
y=
w的值是一个范围:≤w≤
类型2 有关流程图及定量研究的问题
针对练2
[2024遵义模拟]铜合金在生活中应用广泛,铜合金中还可能有Zn、Fe、Ni等,回答下列问题:
(1)铜合金相比纯铜的优点为 。
(2)Ni的活泼性介于Fe与Cu之间,写出一组能验证该结论的试剂: 。
硬度大、抗腐蚀性强
Ni、硫酸亚铁溶液、硫酸铜溶液(合理即可)
类型2 有关流程图及定量研究的问题
针对练2
(3)某化学工业废水中含有CuSO4 、FeSO4,通过下列流程回收FeSO4和Cu。
①操作Ⅰ的名称为 。
②加入试剂a时反应的化学方程式为 。
③试剂b需过量的目的是 ,反应的现象为 。
过滤
Fe+CuSO4 Cu+FeSO4
使铁完全转化为硫酸亚铁
固体减少,产生气泡且溶液由无色变成浅绿色
类型2 有关流程图及定量研究的问题
针对练2
(4)含铜60%的某铜合金,其成分可能为Cu-Zn 合金或Cu-Fe合金,请从定量角度设计实验证明该铜合金的组成 。(相对原子质量:H—1,Fe—56,Zn—65)
取该铜合金a g,加入足量的稀硫酸,若测得生成氢气的质量为a g,说明该铜合金为Cu-Zn合金,若测得氢气的质量为a g,说明该合金为Cu-Fe
类型2 有关流程图及定量研究的问题
(2)要判断Cu、Fe、Ni的金属活动性,利用金属的化学性质(与酸反应、与盐溶液反应)设计实验,根据题意Ni的金属活动性介于Fe与 Cu之间,可以将Ni分别放入Fe、 Cu的盐溶液中进行实验。
(3)②加入Fe,可将CuSO4中的Cu置换出来:Fe+CuSO4 Cu+FeSO4。
③过量试剂b是将铁完全转化为硫酸亚铁;现象为固体减少,产生气泡,溶液由无色变成浅绿色。
类型2 有关流程图及定量研究的问题
(4)假设该合金是Cu-Zn 合金,质量为a g,则锌的质量为40% a g,加入足量的稀硫酸,则测得生成氢气的质量为a g;假设该合金是Cu-Fe合金,则铁的质量为40% a g,加入足量的稀硫酸,则测得生成氢气的质量为a g。
七年级上册
题型五 金属实验题
2025年中考化学题型专题复习
类型1 金属活动性的探究问题
【典例1】
金属材料的广泛应用,极大地促进了社会发展。
(1)镓(Ga)及其化合物应用广泛,常用于半导体、合金、磁性材料等领域。已知镓在化合物中常为+3价,金属活动性顺序:Zn>Ga>Fe。
①写出镓与稀盐酸反应的化学方程式 。
②根据上述信息,下列预测不合理的是 (填字母)。
A.镓具有导电性
B.氧化镓的化学式为Ga2O3
C.镓能与硫酸铝溶液反应生成铝
D.H2或CO在高温条件下能将镓的氧化物转化为金属镓
2Ga+6HCl 2GaCl3+3H2↑
C
类型1 金属活动性的探究问题
【典例1】
(2)为了验证铁、铜、银三种金属的活动性顺序,兴趣小组同学进行了以下实验。
①实验Ⅰ中,能证明铁的活动性比银强的证据是 。
②实验Ⅱ中发生反应的化学方程式是 。
③实验Ⅲ中的X与Y的组合可能是 。
铁片表面有银白色固体析出,溶液由无色变为浅绿色
Cu+2AgNO32Ag+Cu(NO3)2
Fe片和硫酸铜溶液或铜片和硫酸亚铁溶液
类型1 金属活动性的探究问题
思路分析
验证三种金属活动性顺序的思路:
先将三种金属按正确的顺序排列:A>B>C。
方法一:“金属A+B的盐溶液,B的盐溶液+金属C”,即“两金夹一盐”,观察现象。
方法二:“A的盐溶液+金属B,金属B+C的盐溶液”,即“两盐夹一金”,观察现象。
类型1 金属活动性的探究问题
(1)②根据活动性Zn>Ga>Fe,Al的活动性>Zn,所以Ga不能与硫酸铝溶液反应,C不正确。
(2)①通过实验现象证明铁的活动性比银强,铁表面有银白色固体析出,溶液由无色变为浅绿色。
③通过实验Ⅰ得到金属活动性Fe>Ag,通过实验Ⅱ得到金属活动性Cu>Ag,无法判断Fe、Cu的金属活动性强弱,为了判断Fe、Cu的金属活动性强弱,可以将Fe片放入铜的盐溶液中,也可以将Cu片放入铁的盐溶液中。
类型1 金属活动性的探究问题
针对练1
[2024黔南州模拟]金属材料的应用推动了社会发展,被誉为“中国天眼”的500米口径球面射电望远镜位于贵州省平塘县,是目前世界上最大单口径、最灵敏的射电望远镜,支撑它的角钢塔架中含有铁、铜、锰(Mn)元素,某小组同学准备探究这三种金属的活动性强弱。
【实验目的】探究铁、铜、锰三种金属的活动性强弱。
【实验设计】设计如图所示实验。
类型1 金属活动性的探究问题
针对练1
【实验现象】只有实验①无明显现象发生。
【实验分析】生成物中锰元素显+2价。
(1)写出四个实验中的任意一个发生反应的化学方程式 ,几个反应的共同特点是 。
Fe+H2SO4 FeSO4+H2↑(或Mn+FeSO4 MnSO4+Fe,或Mn+CuSO4 MnSO4+Cu)
都是置换反应
类型1 金属活动性的探究问题
针对练1
(2)同学们分析发现,不需要进行实验 (填序号)也可以达到实验目的。
【实验结论】
(3)铁、铜、锰三种金属的活动性强弱为 。
【实验拓展】
(4)现将由5.5 g锰、5.6 g铁、6.4 g铜组成的混合物放入一定量的稀硫酸中,充分反应后过滤得到固体12 g,则产生氢气的质量为 g。(相对原子质量:H—1,Mn—55,Fe—56,Cu—64)
④
Mn>Fe>Cu
0.2
类型1 金属活动性的探究问题
(1)只有实验①无明显现象发生,说明实验①无反应发生,实验②③④都有反应发生。②中铁与稀硫酸反应生成硫酸亚铁和氢气Fe+H2SO4 FeSO4+ H2↑;③中锰与硫酸亚铁反应生成硫酸锰和铁Mn+FeSO4 MnSO4+Fe;
④中锰与硫酸铜反应生成硫酸锰和铜Mn+CuSO4 MnSO4+Cu。上述反应都是金属与酸或盐的反应,都属于置换反应。
(2)由实验①可知,金属活动性:(H)>Cu;由实验②可知,金属活动性:Fe>(H);由实验③可知,金属活动性:Mn>Fe;由实验④可知,金属活动性:Mn>Cu。实验①②③已经说明金属活动性:Mn>Fe>(H)>Cu,所以不需要进行实验④也可以达到实验目的。
类型1 金属活动性的探究问题
(4)由(2)可知,金属活动性:Mn>Fe>(H)>Cu,充分反应后过滤得到的12 g固体中含有6.4 g Cu,则未参加反应的Fe为12 g-6.4 g=5.6 g,即只有5.5 g Mn与稀硫酸反应,设生成的氢气质量为x。
Mn+H2SO4 MnSO4+H2↑
55 2
5.5 g x
解得x=0.2 g,
即产生氢气的质量为0.2 g。
类型2 有关流程图及定量研究的问题
【典例2】
金属材料的应用推动了社会的发展。新型材料的研制,已成为现代高新技术的重要物质基础。
(1)目前常用的1元硬币为钢芯镀镍合金,具有耐腐蚀、 等优点。
(2)镁和铝可熔炼成Mg17Al12镁合金,熔炼过程只能在真空中,不能在空气中进行的原因是 (写其中一个化学方程式)。
硬度大
2Mg+O2 2MgO(或4Al+3O2 2Al2O3)
类型2 有关流程图及定量研究的问题
【典例2】
(3)某废弃物中可能含有Cu、CuO、Mg、Zn中的一种或几种,为确定其成分并回收金属,取样品进行如图实验。(相对原子质量:H—1,O—16,Mg—24,Cu—64,Zn—65)
①步骤Ⅱ的操作是 。
②步骤Ⅱ中产生的现象是 。步骤Ⅲ中锌和稀硫酸反应的化学方程式为 。
过滤
有红色固体产生、有气泡产生、溶液由蓝色变为无色
Zn+H2SO4 ZnSO4+H2↑
类型2 有关流程图及定量研究的问题
【典例2】
③若溶液C中只含一种溶质,则样品的成分是 。
④通过测氢气的质量,也可确定样品的成分,则w的值为 (用含m和n的代数式表示)。
Cu、CuO、Zn
≤w≤
类型2 有关流程图及定量研究的问题
图示化分析
Cu、CuO、Mg、Zn中的一种或几种
Cu不与酸反应,其余都反应,CuO+H2SO4═CuSO4+H2O,
Mg+H2SO4═MgSO4+H2↑,Zn+H2SO4═ZnSO4+H2↑
加酸有铜剩余,说明样品中一定有Cu
加过量的锌粉得到的固体B中有铜,说明溶液A中一定有CuSO4,且还有过量的稀H2SO4溶液,现象为有红色固体析出、有气泡产生、溶液由蓝色变为无色
一定有CuSO4、H2SO4,可能有ZnSO4、MgSO4
生成的Cu和过量的Zn
一定有ZnSO4,可能有MgSO4
Cu是CuO与酸反应生成CuSO4中置换出来的,因此可求出CuO的质量
可以是Mg、Zn任一种反应产生的,也可以是Mg、Zn的混合物反应产生的
类型2 有关流程图及定量研究的问题
图示化分析
Mg+H2SO4 ZnSO4+H2↑
24 2 65 2
(m-2n) g x (m-2n) g y
x= y=
≤w≤
类型2 有关流程图及定量研究的问题
(2)熔炼过程只能在真空中进行,因为Mg、Al均能与氧气反应,化学方程式为2Mg+O2 2MgO、4Al+3O2 2Al2O3。
(3)①将固液分离的方法是过滤。
②Zn先与CuSO4反应再与H2SO4反应,有红色固体产生、有气体产生、溶液由蓝色变为无色。步骤Ⅲ中过量的锌和稀H2SO4反应:Zn+H2SO4 ZnSO4+H2↑。
类型2 有关流程图及定量研究的问题
④样品为m g,根据步骤Ⅰ现象知一定有Cu,为n g,根据步骤Ⅲ知一定有CuO,经计算CuO也为n g,所以剩余金属的质量为(m-2n) g,利用极值法进行计算:
Mg+H2SO4 MgSO4+H2
24 2
(m-2n) g x
x=
类型2 有关流程图及定量研究的问题
Zn+H2SO4 ZnSO4+H2↑
65 2
(m-2n) g y
y=
w的值是一个范围:≤w≤
类型2 有关流程图及定量研究的问题
针对练2
[2024遵义模拟]铜合金在生活中应用广泛,铜合金中还可能有Zn、Fe、Ni等,回答下列问题:
(1)铜合金相比纯铜的优点为 。
(2)Ni的活泼性介于Fe与Cu之间,写出一组能验证该结论的试剂: 。
硬度大、抗腐蚀性强
Ni、硫酸亚铁溶液、硫酸铜溶液(合理即可)
类型2 有关流程图及定量研究的问题
针对练2
(3)某化学工业废水中含有CuSO4 、FeSO4,通过下列流程回收FeSO4和Cu。
①操作Ⅰ的名称为 。
②加入试剂a时反应的化学方程式为 。
③试剂b需过量的目的是 ,反应的现象为 。
过滤
Fe+CuSO4 Cu+FeSO4
使铁完全转化为硫酸亚铁
固体减少,产生气泡且溶液由无色变成浅绿色
类型2 有关流程图及定量研究的问题
针对练2
(4)含铜60%的某铜合金,其成分可能为Cu-Zn 合金或Cu-Fe合金,请从定量角度设计实验证明该铜合金的组成 。(相对原子质量:H—1,Fe—56,Zn—65)
取该铜合金a g,加入足量的稀硫酸,若测得生成氢气的质量为a g,说明该铜合金为Cu-Zn合金,若测得氢气的质量为a g,说明该合金为Cu-Fe
类型2 有关流程图及定量研究的问题
(2)要判断Cu、Fe、Ni的金属活动性,利用金属的化学性质(与酸反应、与盐溶液反应)设计实验,根据题意Ni的金属活动性介于Fe与 Cu之间,可以将Ni分别放入Fe、 Cu的盐溶液中进行实验。
(3)②加入Fe,可将CuSO4中的Cu置换出来:Fe+CuSO4 Cu+FeSO4。
③过量试剂b是将铁完全转化为硫酸亚铁;现象为固体减少,产生气泡,溶液由无色变成浅绿色。
类型2 有关流程图及定量研究的问题
(4)假设该合金是Cu-Zn 合金,质量为a g,则锌的质量为40% a g,加入足量的稀硫酸,则测得生成氢气的质量为a g;假设该合金是Cu-Fe合金,则铁的质量为40% a g,加入足量的稀硫酸,则测得生成氢气的质量为a g。
同课章节目录
