九年级上学期化学鲁教版(2024)期末模拟测评卷B卷(含答案)
文档属性
| 名称 | 九年级上学期化学鲁教版(2024)期末模拟测评卷B卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 446.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-18 00:00:00 | ||
图片预览


文档简介
九年级上学期化学鲁教版(2024)期末模拟测评卷B卷
(试卷满分:100分;考试时间:60分钟)
可能用到的相对原子质量:O-16 K-39 Fe-56
一、选择题(本大题共15小题,每题4分,共60分)
1.下列关于物质变化的说法正确的是( )
A.发光、放热的变化一定是化学变化
B.有气体产生的变化一定是化学变化
C.有颜色改变的变化一定是化学变化
D.化学变化常伴随着能量的吸收和释放
2.为了探究薯片袋中充入的气体是什么将气体收集在集气瓶中,滴入澄清石灰水振荡后没有变浑浊,将燃烧的木条伸入瓶中,木条熄灭,这是科学探究中的( )
A.作出猜想 B.设计实验 C.进行实验 D.得出结论
3.已知某铁原子的实际质量为m g,其相对原子质量为56。银(Ag)的相对原子质量为108,银(Ag)原子的质量为( )
A. B. C. D.
4.纳米铁粉在空气中能自燃并生成一种红色氧化物。对比铁丝在空气中不能燃烧,而在氧气中能剧烈燃烧的事实,某同学得出的下列结论不正确的是( )
A.纳米铁粉在空气中自燃的产物不是四氧化三铁
B.相同的反应物在不同条件下反应生成的产物可能不同
C.把铁加工成纳米铁粉,发生的是化学变化
D.反应物间的接触面积大小是反应能否发生的因素之一
5.下列有关分子、原子、离子、元素的说法中,正确的是( )
A.原子都是由质子、中子、核外电子构成的
B.原子核内的质子数和中子数一定相等
C.氮气是由氮分子构成的,铁是由铁原子直接构成的
D.保持水的化学性质的最小微观粒子是氢原子和氧原子
6.金银花作为常见的中药材,具有清热解毒、消炎退肿等功效,其有效成分之一是绿原酸()。下列有关绿原酸的说法正确的是( )
A.绿原酸分子由碳、氢、氧三个元素组成
B.绿原酸中碳元素的质量分数最大
C.绿原酸的相对分子质量是354 g
D.绿原酸中碳、氢、氧元素的质量之比为16:18:9
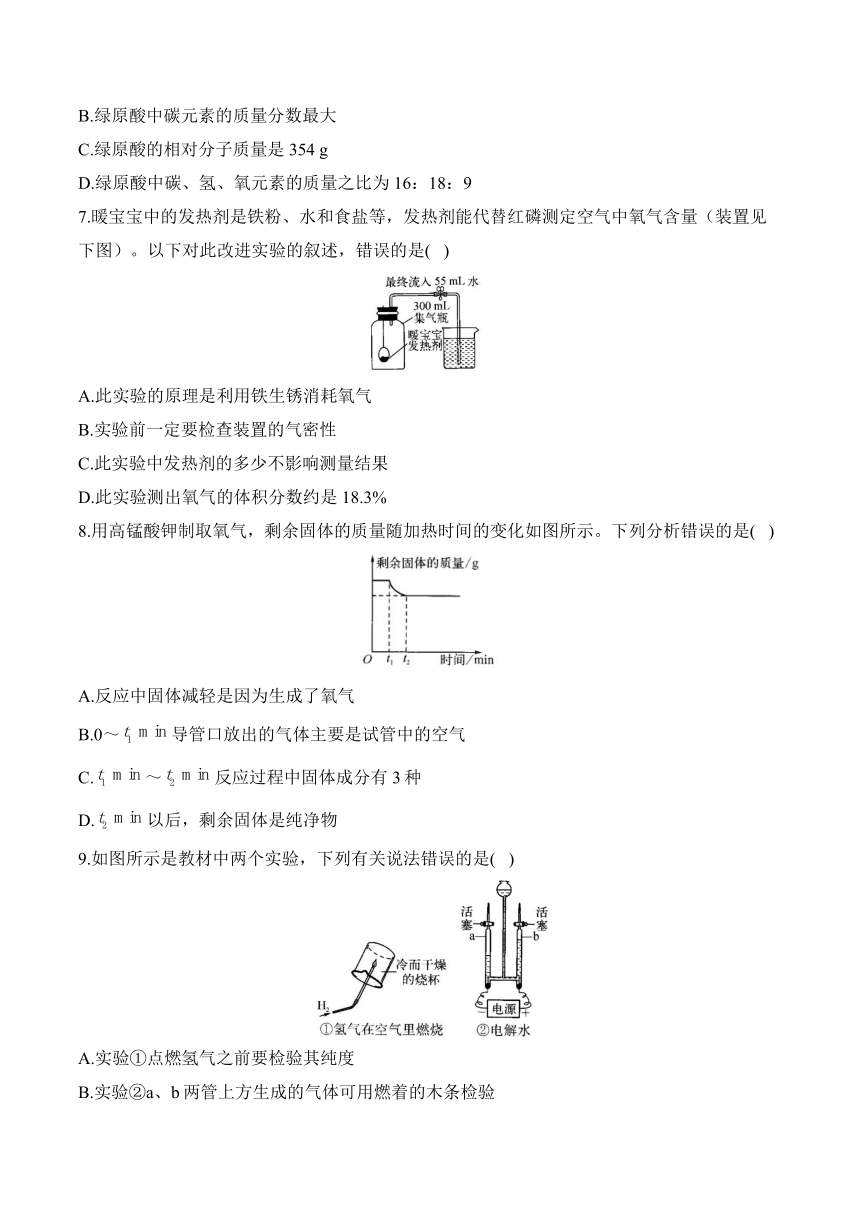
7.暖宝宝中的发热剂是铁粉、水和食盐等,发热剂能代替红磷测定空气中氧气含量(装置见下图)。以下对此改进实验的叙述,错误的是( )
A.此实验的原理是利用铁生锈消耗氧气
B.实验前一定要检查装置的气密性
C.此实验中发热剂的多少不影响测量结果
D.此实验测出氧气的体积分数约是18.3%
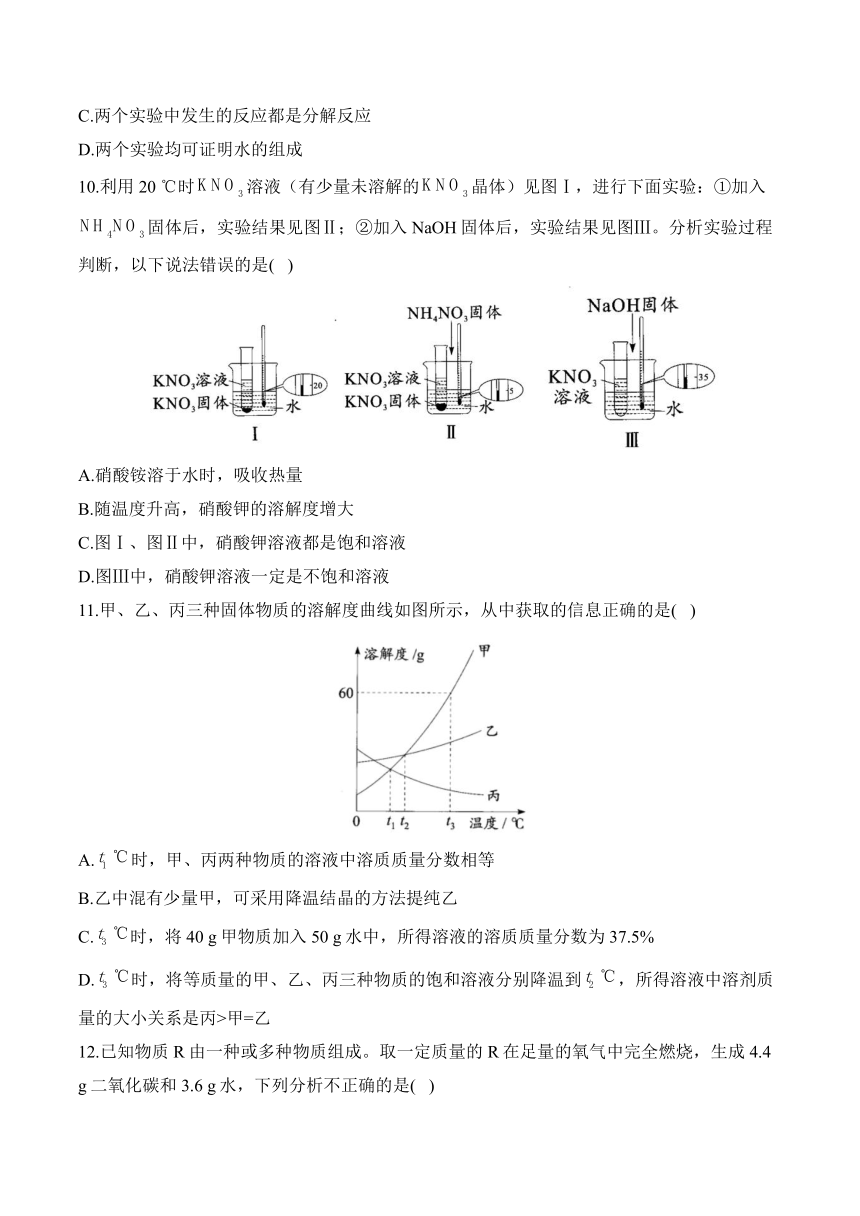
8.用高锰酸钾制取氧气,剩余固体的质量随加热时间的变化如图所示。下列分析错误的是( )
A.反应中固体减轻是因为生成了氧气
B.0~导管口放出的气体主要是试管中的空气
C.~反应过程中固体成分有3种
D.以后,剩余固体是纯净物
9.如图所示是教材中两个实验,下列有关说法错误的是( )
A.实验①点燃氢气之前要检验其纯度
B.实验②a、b两管上方生成的气体可用燃着的木条检验
C.两个实验中发生的反应都是分解反应
D.两个实验均可证明水的组成
10.利用20 ℃时溶液(有少量未溶解的晶体)见图Ⅰ,进行下面实验:①加入固体后,实验结果见图Ⅱ;②加入NaOH固体后,实验结果见图Ⅲ。分析实验过程判断,以下说法错误的是( )
A.硝酸铵溶于水时,吸收热量
B.随温度升高,硝酸钾的溶解度增大
C.图Ⅰ、图Ⅱ中,硝酸钾溶液都是饱和溶液
D.图Ⅲ中,硝酸钾溶液一定是不饱和溶液
11.甲、乙、丙三种固体物质的溶解度曲线如图所示,从中获取的信息正确的是( )
A.时,甲、丙两种物质的溶液中溶质质量分数相等
B.乙中混有少量甲,可采用降温结晶的方法提纯乙
C.时,将40 g甲物质加入50 g水中,所得溶液的溶质质量分数为37.5%
D.时,将等质量的甲、乙、丙三种物质的饱和溶液分别降温到,所得溶液中溶剂质量的大小关系是丙>甲=乙
12.已知物质R由一种或多种物质组成。取一定质量的R在足量的氧气中完全燃烧,生成4.4 g二氧化碳和3.6 g水,下列分析不正确的是( )
A.参加反应的R和氧气的质量总和一定等于8.0 g
B.所取R质量的最小值为1.6 g
C.R可能是酒精()
D.若R为CO和的混合物,则CO和的分子个数比为1:2
13.在一密闭容器中,有甲、乙、丙、丁四种物质,反应前各物质的质量关系如下图刻度纸所示(例如:丙的质量为5 g,丁的质量为3 g)。充分反应后,在同一张刻度纸上再次记录各物质的质量变化:刻度线Ⅰ向左移动16格;刻度线Ⅱ向左移动8格;刻度线Ⅲ向左移动8格。下列说法正确的是( )
A.该反应是化合反应 B.丙一定是催化剂
C.反应后丁的质量为8g D.参加反应的乙和丁的质量比为1:1
14.碱式碳酸锌是制备功能材料ZnO的原料,其热分解的产物为三种常见氧化物(热分解前后各元素化合价不变)。在如图所示的热分解装置中加入54.7 g碱式碳酸锌,完全反应后测得装置A增重5.4 g,装置B增重8.8 g(加热前后均通一段时间的;装置气密性良好,药品量足,实验操作正确;浓硫酸具有吸水性;碱石灰能吸收和)。下列说法正确的是( )
①x:y=3:1
②该装置的缺陷是无尾气处理装置③生成的ZnO的质量为8.1 g
④装置B的作用是吸收碱式碳酸锌分解产生的
⑤若将装置A、B的位置颠倒,则无法算出x:y
A.①④ B.①④⑤ C.②③④⑤ D.①②④⑤
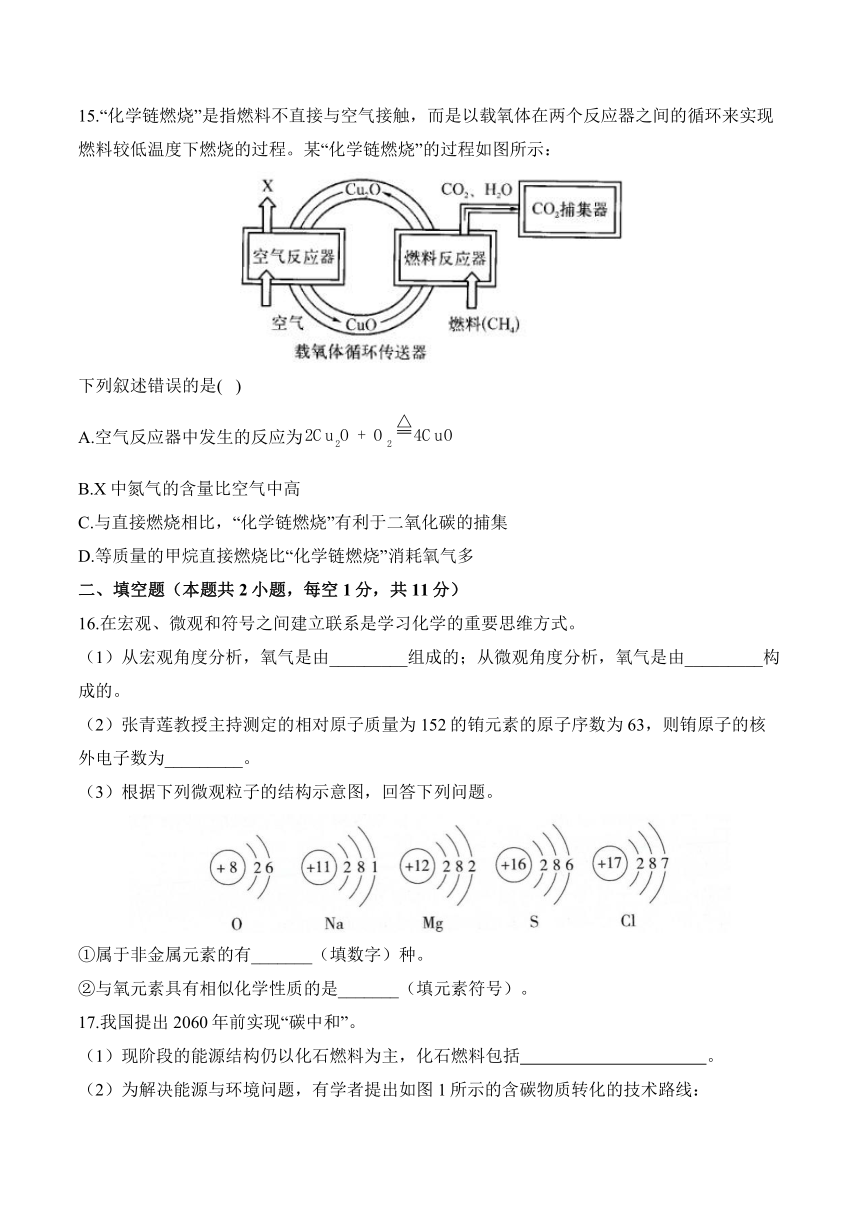
15.“化学链燃烧”是指燃料不直接与空气接触,而是以载氧体在两个反应器之间的循环来实现燃料较低温度下燃烧的过程。某“化学链燃烧”的过程如图所示:
下列叙述错误的是( )
A.空气反应器中发生的反应为
B.X中氮气的含量比空气中高
C.与直接燃烧相比,“化学链燃烧”有利于二氧化碳的捕集
D.等质量的甲烷直接燃烧比“化学链燃烧”消耗氧气多
二、填空题(本题共2小题,每空1分,共11分)
16.在宏观、微观和符号之间建立联系是学习化学的重要思维方式。
(1)从宏观角度分析,氧气是由_________组成的;从微观角度分析,氧气是由_________构成的。
(2)张青莲教授主持测定的相对原子质量为152的铕元素的原子序数为63,则铕原子的核外电子数为_________。
(3)根据下列微观粒子的结构示意图,回答下列问题。
①属于非金属元素的有_______(填数字)种。
②与氧元素具有相似化学性质的是_______(填元素符号)。
17.我国提出2060年前实现“碳中和”。
(1)现阶段的能源结构仍以化石燃料为主,化石燃料包括 。
(2)为解决能源与环境问题,有学者提出如图1所示的含碳物质转化的技术路线:
①反应I属于________(填基本反应类型)。
②反应Ⅱ中,参加反应的和生成的的分子数目之比为_______。
③我国学者开发出促进反应Ⅲ的一种新型催化剂,图2是催化过程的微观示意图,该_______(填化学式)、氧和过程的中间产物氢进一步转化为甲醇和水。
(3)我国是世界上首个成功试采海域可燃冰的国家。可燃冰是被分子形成的笼包裹,在海底低温和高压作用下形成的结晶物质。
①可燃冰样品常存放于液氮储存罐中,其原因是 。
②可燃冰有多种结构,某H型可燃冰的化学式为,分析其结构发现:平均34个分子构成6个笼,每个笼只容纳1个或分子。这6个笼内容纳的与分子个数比是__________(填最小整数比)。
二、填空题(本题共2小题,每空1分,共11分)
18.某化学兴趣小组在实验室里用右图所示的电解器进行水的探究。(电解器的气密性非常好)。
【提出问题】为什么水分子中氢、氧原子个数比为2:1
【探究课题】假设水的化学式为,测定的值。
【实验探究】
(1)电解水11 min后赶出水中溶解的气体,同时测定电解过程中a、b管中气体在标准状况下的体积,相关数据记录在下表中:
时间/min(或操作) 2 4 6 9 11 赶出水中溶解的气体
a管中气体体积/mL 12 29 49 79 99 100
b管中气体体积/mL 4 11 21 36 46 50
(2)确定b管中气体成分。实验如下所示:
实验操作 实验现象 结论
_________ _________ _________
【实验分析】
(1)电解器玻璃管a中的电极连电源的_________(填“正”或“负”)极。电解器中的液体为很稀的硫酸钠溶液,此处硫酸钠的作用为 ,硫酸钠的化学式为_________。
(2)分析上表中的数据可知:电解开始阶段a管收集到的气体与b管收集到的气体体积比明显偏大,可能的原因是 。
【探究结论】查阅资料可知:在标准状况下,氢气的密度是0.089 g/L,氧气的密度是1.429 g/L。利用有关数据及假设的化学式,列出x与y的关系式:_________(仅列式,不要求出结果),求解可得出x:y的值约为2:1。
18.在“质量守恒定律”的教学中,老师引导同学们进行“化学反应中反应物与生成物的质量关系”的实验探究,请你参与探究并回答有关问题:
(1)如图1、2所示,将锥形瓶(反应物未接触)放在天平上,右盘加砝码使之平衡,取下锥形瓶,将锥形瓶中两种物质混合,反应完全后将锥形瓶再放回天平左盘上。
①把图1锥形瓶重新放回到天平上,天平________(填“能”或“不能”)保持平衡。
②把图2锥形瓶重新放回到天平上,天平_______(填“能”或“不能”)保持平衡,理由是
。
③从原子的角度分析化学反应遵守“质量守恒定律”的原因是 。
(2)如图3所示,用细线系住铜棒使之平衡,然后在铜棒一端用酒精灯加热。
①写出铜棒反应的化学方程式: 。
②加热一段时间后,铜棒________(填“能”或“不能”)保持平衡。
③本实验现象与质量守恒定律_________(填“有”或“没有”)矛盾。
20.下图是实验室制取二氧化碳并验证其性质的实验装置图。请回答下列问题:
(1)将A、E装置连接时,应将 A装置的导管a与E装置的导管_________(填“b”或“c”)相连接。检验E装置中二氧化碳已收集满的方法是 。
(2)将A、B装置连接,观察到的现象是 ,可验证二氧化碳的性质是____ _____。
(3)将 A、C装置连接,可验证二氧化碳与氢氧化钙反应,该反应的化学方程式为______ _ 。用E装置收集满一瓶二氧化碳气体,取下双孔橡胶塞,将瓶中的气体沿D装置烧杯左侧内壁缓慢倒入,观察到的现象是 ,这些现象说明二氧化碳具有的物理性质是 ,化学性质是 、______ ___。
四、计算题(本题共1小题,共5分)
21.高铁酸钾()是一种绿色水处理剂,温度较高时易发生反应:。小佳同学为检测某高铁酸钾颗粒纯度,取10g样品加热至固体质量不再发生变化,剩余固体质量为9.04g。
(1)生成氧气的质量为______g。
(2)样品中高铁酸钾的质量分数是多少?(写出计算过程)
答案以及解析
1.答案:D
解析:A、B、C(×):变化过程中的现象不能作为判断发生化学变化的根本依据,如灯泡通电发光、放热,属于物理变化。
2.答案:C
3.答案:C
解析:原子的相对原子质量与原子的质量成正比,设银(Ag)原子的质量为x,则,。
4.答案:C
解析:四氧化三铁是黑色固体,而纳米铁粉在空气中自燃生成一种红色氧化物;相同的反应物在不同条件下反应生成的产物可能不同;把铁加工成纳米铁粉,过程中没有新物质生成,是物理变化;反应物间的接触面积大小是反应能否发生的因素之一。
5.答案:C
解析:A(×):原子是由质子、中子、核外电子构成的,但并不是所有原子都有中子,如普通氢原子内没有中子。B(×):原子核内的质子数和中子数不一定相等。D(×):水是由水分子构成的,由分子构成的物质,分子是保持其化学性质的最小微观粒子,所以保持水的化学性质的最小微观粒子是水分子。
6.答案:B
解析:元素只讲种类,不讲个数,绿原酸由碳、氢、氧三种元素组成;绿原酸中碳、氢、氧三种元素的质量比为(16×12):(18×1):(9×16)=32:3:24,故碳元素的质量分数最大;相对分子质量的单位为“1”,不是“g”,故绿原酸的相对分子质量是354。
7.答案:C
解析:利用暖宝宝的发热剂来测定氧气含量,就是利用铁与水、氧气等发生反应生成铁锈,从而根据消耗氧气的量来测定;如果装置漏气,会使进入的水偏少,测定结果偏小,故实验前要检查装置的气密性;发热剂的量会影响氧气含量的测定,如果发热剂的量不足,不能将氧气完全消耗,则测定的含量会偏小;根据图中数据可知,测得氧气体积为55 mL,则氧气体积分数约为。
8.答案:D
解析:反应中生成的氧气逸出,所以固体减轻;0~高锰酸钾的质量没有减少,即高锰酸钾还没有分解,因此导管口放出的气体主要是试管中的空气;~反应过程中,高锰酸钾部分分解,因此固体成分有3种:锰酸钾、二氧化锰和高锰酸钾;以后,高锰酸钾完全分解,剩余固体是锰酸钾和二氧化锰的混合物。
9.答案:C
解析:氢气具有可燃性,与空气混合达到一定范围会发生爆炸,因此点燃氢气前要验纯。电解水实验中负极产生的气体是氢气,用燃着的木条检验,气体燃烧,发出淡蓝色火焰;正极产生的气体是氧气,用燃着的木条检验,木条会燃烧得更旺。实验①中氢气和氧气在点燃的条件下反应生成水,属于化合反应;实验②中水在通电的条件下反应生成氢气和氧气,属于分解反应。化学反应前后元素的种类不变,两实验可以证明水的组成。
10.答案:D
11.答案: C
解析:时,甲、丙两种物质的溶解度相等,若二者为饱和溶液,溶质质量分数相等,若二者为不饱和溶液,则无法确定溶质质量分数的大小,A错误;甲物质的溶解度受温度影响较大,乙物质的溶解度受温度影响较小,当乙中混有少量甲时,可采用蒸发结晶的方法提纯乙,B错误;时,甲物质的溶解度为,水中最多能溶解甲的质量为,故此时所得溶液的溶质质量分数为,C正确;时,甲、乙、丙三种物质溶解度的大小关系是甲>乙>丙,该温度下,等质量的甲、乙、丙三种物质的饱和溶液中,溶剂质量的大小关系是丙>乙>甲,降温不会影响溶剂质量,故降温后所得溶液中溶剂质量的大小关系依然是丙>乙>甲,D错误。
12.答案:C
解析:根据质量守恒定律,反应前参加反应的R和氧气的质量总和为4.4 g+3.6 g=8 g;反应后g×44×100%=的二氧化碳中碳元素的质量为,水中氢元素的质量为,根据反应前后元素的种类和质量不变,故反应前R中的碳元素和氢元素分别为1.2 g和0.4 g,则R质量的最小值为1.2 g+0.4 g=1.6 g;R中C、H元素质量比为1.2 g:0.4 g=3:1,而酒精()中C、H元素质量比为(2×12):(6×1)=4:1;R中C、H原子个数比为,若R为CO和的混合物,则CO和的分子个数比为1:2。
13.答案:D
解析:根据题意,反应前后各物质质量变化如下表:
物质 甲 乙 丙 丁
反应前的质量/g 16 2 5 3
反应后的质量/g 0 10 5 11
变化的质量/g(“+”“-”分别表示增加、减少) -16 +8 0 +8
反应后甲的质量减少,乙和丁的质量增加,则甲为反应物,乙和丁均为生成物,故该反应的表达式为甲→乙+丁,该反应由一种反应物生成两种其他物质,属于分解反应,A错误;反应前后丙的质量不变,则丙可能为催化剂或不参加反应的杂质,B错误;反应后丁的质量为11 g,C错误;该反应中参加反应的乙和丁的质量均为8 g,故参加反应的乙和丁的质量比为8 g:8 g=1:1,D正确。
14.答案:B
解析:①从题目可知:A增重5.4 g,则反应生成水的质量为5.4 g,B增重8.8 g,则生成二氧化碳的质量为8.8 g,根据化学反应前后元素质量不变,可得:碱式碳酸锌中氢元素的质量为,碳元素的质量为,故;②生成的产物二氧化碳和水均被吸收,氮气不会污染空气,所以尾气不需要进行处理;③根据化学反应中参加反应的各物质质量总和等于生成的各物质的质量总和,可得生成的ZnO的质量为54.7 g-5.4 g-8.8 g=40.5 g;④反应生成的水蒸气被装置A中浓硫酸吸收,生成的二氧化碳被装置B中碱石灰吸收;⑤若将装置A、B的位置颠倒,二氧化碳和水均被碱石灰吸收,无法得出水和二氧化碳具体的质量,也就无法计算出x:y的数值。
15.答案:D
解析:空气反应器中和空气中的氧气反应生成氧化铜,氧气被消耗,X中氮气的含量比空气中高;与直接燃烧相比,“化学链燃烧”产生的气体生成物只有二氧化碳和水蒸气,水蒸气冷却后变为液态水,有利于二氧化碳的捕集;消耗等质量甲烷,生成的二氧化碳和水的质量不变,参加反应的氧气的质量也不变,则等质量的甲烷直接燃烧和“化学链燃烧”消耗的氧气一样多。
16.答案:(1)氧元素氧分子
(2)63
(3)①3 ②S
17.答案:(1)煤、石油、天然气
(2)①分解反应;②1:2;③CO
(3)①防止甲烷泄漏;②2:1
解析:(2)①反应I是一种物质生成三种物质、和,属于分解反应。②反应Ⅱ的化学方程式为,可知参加反应的和生成的的分子数目之比为1:2。
(3)①由题干可知,可燃冰是被分子形成的笼包裹,在液氮的作用下水分子能够牢牢包裹甲烷分子,防止甲烷泄漏。②设6个笼内容纳的分子的个数为x,则分子的个数为6-x,H型可燃冰的化学式为,所以x:(34+6-x)=1:9,解得x=4,6-x=2,所以与分子个数比是2:1。
18.答案:【实验探究】(2)取带火星的木条,放在b管尖嘴处,打开b管活塞;带火星的木条复燃;b管中的气体为氧气
【实验分析】(1)负;增强导电性;
(2)氧气在水中溶解的量比氢气多
【探究结论】
解析:【探究结论】化学反应前后,元素种类不变,氢、氧元素质量比等于生成的氢气与氧气的质量比。
19.答案:(1)①能;②不能;反应产生的气体氧化碳逸散到了空气中;③化学反应前后,原子的质量、种类、数目都没有发生变化
(2)①;②不能;③没有
解析:①由于反应发生在密闭体系内,故把图1锥形瓶重新放回到天平上,天平能保持平衡。②稀盐酸与碳酸钙反应产生的二氧化碳气体逸散到空气中,使得锥形瓶内物质的总质量减少,故把图2锥形瓶重新放回到天平上,天平不能保持平衡。
(2)①。②加热一段时间后,由于生成的氧化铜质量大于原来铜的质量,故铜棒不能保持平衡。③本实验现象与质量守恒定律没有矛盾,前后质量不相等的原因是铜与空气中的氧气发生了反应,增加的是参加反应的氧气的质量,并不违背质量守恒定律。
20.答案:(1)c;用燃着的木条靠近E装置的b导管口,若木条熄灭,则已收集满
(2)紫色石蕊溶液变红;能与水反应
(3);燃着的蜡烛由下至上依次熄灭;密度比空气大;不能燃烧;不支持燃烧
解析:(3)蜡烛熄灭说明二氧化碳具有不能燃烧、不支持燃烧的化学性质;下层的蜡烛先熄灭,说明二氧化碳密度比空气大的物理性质。
21.答案:(1)0.96g
(2)79.2%
解析:(1)生成氧气的质量=10g-9.04g=0.96g;
(2)解:设样品中高铁酸钾的质量为x
样品中高铁酸钾的质量分数:
答:样品中高铁酸钾的质量分数为79.2%。
(试卷满分:100分;考试时间:60分钟)
可能用到的相对原子质量:O-16 K-39 Fe-56
一、选择题(本大题共15小题,每题4分,共60分)
1.下列关于物质变化的说法正确的是( )
A.发光、放热的变化一定是化学变化
B.有气体产生的变化一定是化学变化
C.有颜色改变的变化一定是化学变化
D.化学变化常伴随着能量的吸收和释放
2.为了探究薯片袋中充入的气体是什么将气体收集在集气瓶中,滴入澄清石灰水振荡后没有变浑浊,将燃烧的木条伸入瓶中,木条熄灭,这是科学探究中的( )
A.作出猜想 B.设计实验 C.进行实验 D.得出结论
3.已知某铁原子的实际质量为m g,其相对原子质量为56。银(Ag)的相对原子质量为108,银(Ag)原子的质量为( )
A. B. C. D.
4.纳米铁粉在空气中能自燃并生成一种红色氧化物。对比铁丝在空气中不能燃烧,而在氧气中能剧烈燃烧的事实,某同学得出的下列结论不正确的是( )
A.纳米铁粉在空气中自燃的产物不是四氧化三铁
B.相同的反应物在不同条件下反应生成的产物可能不同
C.把铁加工成纳米铁粉,发生的是化学变化
D.反应物间的接触面积大小是反应能否发生的因素之一
5.下列有关分子、原子、离子、元素的说法中,正确的是( )
A.原子都是由质子、中子、核外电子构成的
B.原子核内的质子数和中子数一定相等
C.氮气是由氮分子构成的,铁是由铁原子直接构成的
D.保持水的化学性质的最小微观粒子是氢原子和氧原子
6.金银花作为常见的中药材,具有清热解毒、消炎退肿等功效,其有效成分之一是绿原酸()。下列有关绿原酸的说法正确的是( )
A.绿原酸分子由碳、氢、氧三个元素组成
B.绿原酸中碳元素的质量分数最大
C.绿原酸的相对分子质量是354 g
D.绿原酸中碳、氢、氧元素的质量之比为16:18:9
7.暖宝宝中的发热剂是铁粉、水和食盐等,发热剂能代替红磷测定空气中氧气含量(装置见下图)。以下对此改进实验的叙述,错误的是( )
A.此实验的原理是利用铁生锈消耗氧气
B.实验前一定要检查装置的气密性
C.此实验中发热剂的多少不影响测量结果
D.此实验测出氧气的体积分数约是18.3%
8.用高锰酸钾制取氧气,剩余固体的质量随加热时间的变化如图所示。下列分析错误的是( )
A.反应中固体减轻是因为生成了氧气
B.0~导管口放出的气体主要是试管中的空气
C.~反应过程中固体成分有3种
D.以后,剩余固体是纯净物
9.如图所示是教材中两个实验,下列有关说法错误的是( )
A.实验①点燃氢气之前要检验其纯度
B.实验②a、b两管上方生成的气体可用燃着的木条检验
C.两个实验中发生的反应都是分解反应
D.两个实验均可证明水的组成
10.利用20 ℃时溶液(有少量未溶解的晶体)见图Ⅰ,进行下面实验:①加入固体后,实验结果见图Ⅱ;②加入NaOH固体后,实验结果见图Ⅲ。分析实验过程判断,以下说法错误的是( )
A.硝酸铵溶于水时,吸收热量
B.随温度升高,硝酸钾的溶解度增大
C.图Ⅰ、图Ⅱ中,硝酸钾溶液都是饱和溶液
D.图Ⅲ中,硝酸钾溶液一定是不饱和溶液
11.甲、乙、丙三种固体物质的溶解度曲线如图所示,从中获取的信息正确的是( )
A.时,甲、丙两种物质的溶液中溶质质量分数相等
B.乙中混有少量甲,可采用降温结晶的方法提纯乙
C.时,将40 g甲物质加入50 g水中,所得溶液的溶质质量分数为37.5%
D.时,将等质量的甲、乙、丙三种物质的饱和溶液分别降温到,所得溶液中溶剂质量的大小关系是丙>甲=乙
12.已知物质R由一种或多种物质组成。取一定质量的R在足量的氧气中完全燃烧,生成4.4 g二氧化碳和3.6 g水,下列分析不正确的是( )
A.参加反应的R和氧气的质量总和一定等于8.0 g
B.所取R质量的最小值为1.6 g
C.R可能是酒精()
D.若R为CO和的混合物,则CO和的分子个数比为1:2
13.在一密闭容器中,有甲、乙、丙、丁四种物质,反应前各物质的质量关系如下图刻度纸所示(例如:丙的质量为5 g,丁的质量为3 g)。充分反应后,在同一张刻度纸上再次记录各物质的质量变化:刻度线Ⅰ向左移动16格;刻度线Ⅱ向左移动8格;刻度线Ⅲ向左移动8格。下列说法正确的是( )
A.该反应是化合反应 B.丙一定是催化剂
C.反应后丁的质量为8g D.参加反应的乙和丁的质量比为1:1
14.碱式碳酸锌是制备功能材料ZnO的原料,其热分解的产物为三种常见氧化物(热分解前后各元素化合价不变)。在如图所示的热分解装置中加入54.7 g碱式碳酸锌,完全反应后测得装置A增重5.4 g,装置B增重8.8 g(加热前后均通一段时间的;装置气密性良好,药品量足,实验操作正确;浓硫酸具有吸水性;碱石灰能吸收和)。下列说法正确的是( )
①x:y=3:1
②该装置的缺陷是无尾气处理装置③生成的ZnO的质量为8.1 g
④装置B的作用是吸收碱式碳酸锌分解产生的
⑤若将装置A、B的位置颠倒,则无法算出x:y
A.①④ B.①④⑤ C.②③④⑤ D.①②④⑤
15.“化学链燃烧”是指燃料不直接与空气接触,而是以载氧体在两个反应器之间的循环来实现燃料较低温度下燃烧的过程。某“化学链燃烧”的过程如图所示:
下列叙述错误的是( )
A.空气反应器中发生的反应为
B.X中氮气的含量比空气中高
C.与直接燃烧相比,“化学链燃烧”有利于二氧化碳的捕集
D.等质量的甲烷直接燃烧比“化学链燃烧”消耗氧气多
二、填空题(本题共2小题,每空1分,共11分)
16.在宏观、微观和符号之间建立联系是学习化学的重要思维方式。
(1)从宏观角度分析,氧气是由_________组成的;从微观角度分析,氧气是由_________构成的。
(2)张青莲教授主持测定的相对原子质量为152的铕元素的原子序数为63,则铕原子的核外电子数为_________。
(3)根据下列微观粒子的结构示意图,回答下列问题。
①属于非金属元素的有_______(填数字)种。
②与氧元素具有相似化学性质的是_______(填元素符号)。
17.我国提出2060年前实现“碳中和”。
(1)现阶段的能源结构仍以化石燃料为主,化石燃料包括 。
(2)为解决能源与环境问题,有学者提出如图1所示的含碳物质转化的技术路线:
①反应I属于________(填基本反应类型)。
②反应Ⅱ中,参加反应的和生成的的分子数目之比为_______。
③我国学者开发出促进反应Ⅲ的一种新型催化剂,图2是催化过程的微观示意图,该_______(填化学式)、氧和过程的中间产物氢进一步转化为甲醇和水。
(3)我国是世界上首个成功试采海域可燃冰的国家。可燃冰是被分子形成的笼包裹,在海底低温和高压作用下形成的结晶物质。
①可燃冰样品常存放于液氮储存罐中,其原因是 。
②可燃冰有多种结构,某H型可燃冰的化学式为,分析其结构发现:平均34个分子构成6个笼,每个笼只容纳1个或分子。这6个笼内容纳的与分子个数比是__________(填最小整数比)。
二、填空题(本题共2小题,每空1分,共11分)
18.某化学兴趣小组在实验室里用右图所示的电解器进行水的探究。(电解器的气密性非常好)。
【提出问题】为什么水分子中氢、氧原子个数比为2:1
【探究课题】假设水的化学式为,测定的值。
【实验探究】
(1)电解水11 min后赶出水中溶解的气体,同时测定电解过程中a、b管中气体在标准状况下的体积,相关数据记录在下表中:
时间/min(或操作) 2 4 6 9 11 赶出水中溶解的气体
a管中气体体积/mL 12 29 49 79 99 100
b管中气体体积/mL 4 11 21 36 46 50
(2)确定b管中气体成分。实验如下所示:
实验操作 实验现象 结论
_________ _________ _________
【实验分析】
(1)电解器玻璃管a中的电极连电源的_________(填“正”或“负”)极。电解器中的液体为很稀的硫酸钠溶液,此处硫酸钠的作用为 ,硫酸钠的化学式为_________。
(2)分析上表中的数据可知:电解开始阶段a管收集到的气体与b管收集到的气体体积比明显偏大,可能的原因是 。
【探究结论】查阅资料可知:在标准状况下,氢气的密度是0.089 g/L,氧气的密度是1.429 g/L。利用有关数据及假设的化学式,列出x与y的关系式:_________(仅列式,不要求出结果),求解可得出x:y的值约为2:1。
18.在“质量守恒定律”的教学中,老师引导同学们进行“化学反应中反应物与生成物的质量关系”的实验探究,请你参与探究并回答有关问题:
(1)如图1、2所示,将锥形瓶(反应物未接触)放在天平上,右盘加砝码使之平衡,取下锥形瓶,将锥形瓶中两种物质混合,反应完全后将锥形瓶再放回天平左盘上。
①把图1锥形瓶重新放回到天平上,天平________(填“能”或“不能”)保持平衡。
②把图2锥形瓶重新放回到天平上,天平_______(填“能”或“不能”)保持平衡,理由是
。
③从原子的角度分析化学反应遵守“质量守恒定律”的原因是 。
(2)如图3所示,用细线系住铜棒使之平衡,然后在铜棒一端用酒精灯加热。
①写出铜棒反应的化学方程式: 。
②加热一段时间后,铜棒________(填“能”或“不能”)保持平衡。
③本实验现象与质量守恒定律_________(填“有”或“没有”)矛盾。
20.下图是实验室制取二氧化碳并验证其性质的实验装置图。请回答下列问题:
(1)将A、E装置连接时,应将 A装置的导管a与E装置的导管_________(填“b”或“c”)相连接。检验E装置中二氧化碳已收集满的方法是 。
(2)将A、B装置连接,观察到的现象是 ,可验证二氧化碳的性质是____ _____。
(3)将 A、C装置连接,可验证二氧化碳与氢氧化钙反应,该反应的化学方程式为______ _ 。用E装置收集满一瓶二氧化碳气体,取下双孔橡胶塞,将瓶中的气体沿D装置烧杯左侧内壁缓慢倒入,观察到的现象是 ,这些现象说明二氧化碳具有的物理性质是 ,化学性质是 、______ ___。
四、计算题(本题共1小题,共5分)
21.高铁酸钾()是一种绿色水处理剂,温度较高时易发生反应:。小佳同学为检测某高铁酸钾颗粒纯度,取10g样品加热至固体质量不再发生变化,剩余固体质量为9.04g。
(1)生成氧气的质量为______g。
(2)样品中高铁酸钾的质量分数是多少?(写出计算过程)
答案以及解析
1.答案:D
解析:A、B、C(×):变化过程中的现象不能作为判断发生化学变化的根本依据,如灯泡通电发光、放热,属于物理变化。
2.答案:C
3.答案:C
解析:原子的相对原子质量与原子的质量成正比,设银(Ag)原子的质量为x,则,。
4.答案:C
解析:四氧化三铁是黑色固体,而纳米铁粉在空气中自燃生成一种红色氧化物;相同的反应物在不同条件下反应生成的产物可能不同;把铁加工成纳米铁粉,过程中没有新物质生成,是物理变化;反应物间的接触面积大小是反应能否发生的因素之一。
5.答案:C
解析:A(×):原子是由质子、中子、核外电子构成的,但并不是所有原子都有中子,如普通氢原子内没有中子。B(×):原子核内的质子数和中子数不一定相等。D(×):水是由水分子构成的,由分子构成的物质,分子是保持其化学性质的最小微观粒子,所以保持水的化学性质的最小微观粒子是水分子。
6.答案:B
解析:元素只讲种类,不讲个数,绿原酸由碳、氢、氧三种元素组成;绿原酸中碳、氢、氧三种元素的质量比为(16×12):(18×1):(9×16)=32:3:24,故碳元素的质量分数最大;相对分子质量的单位为“1”,不是“g”,故绿原酸的相对分子质量是354。
7.答案:C
解析:利用暖宝宝的发热剂来测定氧气含量,就是利用铁与水、氧气等发生反应生成铁锈,从而根据消耗氧气的量来测定;如果装置漏气,会使进入的水偏少,测定结果偏小,故实验前要检查装置的气密性;发热剂的量会影响氧气含量的测定,如果发热剂的量不足,不能将氧气完全消耗,则测定的含量会偏小;根据图中数据可知,测得氧气体积为55 mL,则氧气体积分数约为。
8.答案:D
解析:反应中生成的氧气逸出,所以固体减轻;0~高锰酸钾的质量没有减少,即高锰酸钾还没有分解,因此导管口放出的气体主要是试管中的空气;~反应过程中,高锰酸钾部分分解,因此固体成分有3种:锰酸钾、二氧化锰和高锰酸钾;以后,高锰酸钾完全分解,剩余固体是锰酸钾和二氧化锰的混合物。
9.答案:C
解析:氢气具有可燃性,与空气混合达到一定范围会发生爆炸,因此点燃氢气前要验纯。电解水实验中负极产生的气体是氢气,用燃着的木条检验,气体燃烧,发出淡蓝色火焰;正极产生的气体是氧气,用燃着的木条检验,木条会燃烧得更旺。实验①中氢气和氧气在点燃的条件下反应生成水,属于化合反应;实验②中水在通电的条件下反应生成氢气和氧气,属于分解反应。化学反应前后元素的种类不变,两实验可以证明水的组成。
10.答案:D
11.答案: C
解析:时,甲、丙两种物质的溶解度相等,若二者为饱和溶液,溶质质量分数相等,若二者为不饱和溶液,则无法确定溶质质量分数的大小,A错误;甲物质的溶解度受温度影响较大,乙物质的溶解度受温度影响较小,当乙中混有少量甲时,可采用蒸发结晶的方法提纯乙,B错误;时,甲物质的溶解度为,水中最多能溶解甲的质量为,故此时所得溶液的溶质质量分数为,C正确;时,甲、乙、丙三种物质溶解度的大小关系是甲>乙>丙,该温度下,等质量的甲、乙、丙三种物质的饱和溶液中,溶剂质量的大小关系是丙>乙>甲,降温不会影响溶剂质量,故降温后所得溶液中溶剂质量的大小关系依然是丙>乙>甲,D错误。
12.答案:C
解析:根据质量守恒定律,反应前参加反应的R和氧气的质量总和为4.4 g+3.6 g=8 g;反应后g×44×100%=的二氧化碳中碳元素的质量为,水中氢元素的质量为,根据反应前后元素的种类和质量不变,故反应前R中的碳元素和氢元素分别为1.2 g和0.4 g,则R质量的最小值为1.2 g+0.4 g=1.6 g;R中C、H元素质量比为1.2 g:0.4 g=3:1,而酒精()中C、H元素质量比为(2×12):(6×1)=4:1;R中C、H原子个数比为,若R为CO和的混合物,则CO和的分子个数比为1:2。
13.答案:D
解析:根据题意,反应前后各物质质量变化如下表:
物质 甲 乙 丙 丁
反应前的质量/g 16 2 5 3
反应后的质量/g 0 10 5 11
变化的质量/g(“+”“-”分别表示增加、减少) -16 +8 0 +8
反应后甲的质量减少,乙和丁的质量增加,则甲为反应物,乙和丁均为生成物,故该反应的表达式为甲→乙+丁,该反应由一种反应物生成两种其他物质,属于分解反应,A错误;反应前后丙的质量不变,则丙可能为催化剂或不参加反应的杂质,B错误;反应后丁的质量为11 g,C错误;该反应中参加反应的乙和丁的质量均为8 g,故参加反应的乙和丁的质量比为8 g:8 g=1:1,D正确。
14.答案:B
解析:①从题目可知:A增重5.4 g,则反应生成水的质量为5.4 g,B增重8.8 g,则生成二氧化碳的质量为8.8 g,根据化学反应前后元素质量不变,可得:碱式碳酸锌中氢元素的质量为,碳元素的质量为,故;②生成的产物二氧化碳和水均被吸收,氮气不会污染空气,所以尾气不需要进行处理;③根据化学反应中参加反应的各物质质量总和等于生成的各物质的质量总和,可得生成的ZnO的质量为54.7 g-5.4 g-8.8 g=40.5 g;④反应生成的水蒸气被装置A中浓硫酸吸收,生成的二氧化碳被装置B中碱石灰吸收;⑤若将装置A、B的位置颠倒,二氧化碳和水均被碱石灰吸收,无法得出水和二氧化碳具体的质量,也就无法计算出x:y的数值。
15.答案:D
解析:空气反应器中和空气中的氧气反应生成氧化铜,氧气被消耗,X中氮气的含量比空气中高;与直接燃烧相比,“化学链燃烧”产生的气体生成物只有二氧化碳和水蒸气,水蒸气冷却后变为液态水,有利于二氧化碳的捕集;消耗等质量甲烷,生成的二氧化碳和水的质量不变,参加反应的氧气的质量也不变,则等质量的甲烷直接燃烧和“化学链燃烧”消耗的氧气一样多。
16.答案:(1)氧元素氧分子
(2)63
(3)①3 ②S
17.答案:(1)煤、石油、天然气
(2)①分解反应;②1:2;③CO
(3)①防止甲烷泄漏;②2:1
解析:(2)①反应I是一种物质生成三种物质、和,属于分解反应。②反应Ⅱ的化学方程式为,可知参加反应的和生成的的分子数目之比为1:2。
(3)①由题干可知,可燃冰是被分子形成的笼包裹,在液氮的作用下水分子能够牢牢包裹甲烷分子,防止甲烷泄漏。②设6个笼内容纳的分子的个数为x,则分子的个数为6-x,H型可燃冰的化学式为,所以x:(34+6-x)=1:9,解得x=4,6-x=2,所以与分子个数比是2:1。
18.答案:【实验探究】(2)取带火星的木条,放在b管尖嘴处,打开b管活塞;带火星的木条复燃;b管中的气体为氧气
【实验分析】(1)负;增强导电性;
(2)氧气在水中溶解的量比氢气多
【探究结论】
解析:【探究结论】化学反应前后,元素种类不变,氢、氧元素质量比等于生成的氢气与氧气的质量比。
19.答案:(1)①能;②不能;反应产生的气体氧化碳逸散到了空气中;③化学反应前后,原子的质量、种类、数目都没有发生变化
(2)①;②不能;③没有
解析:①由于反应发生在密闭体系内,故把图1锥形瓶重新放回到天平上,天平能保持平衡。②稀盐酸与碳酸钙反应产生的二氧化碳气体逸散到空气中,使得锥形瓶内物质的总质量减少,故把图2锥形瓶重新放回到天平上,天平不能保持平衡。
(2)①。②加热一段时间后,由于生成的氧化铜质量大于原来铜的质量,故铜棒不能保持平衡。③本实验现象与质量守恒定律没有矛盾,前后质量不相等的原因是铜与空气中的氧气发生了反应,增加的是参加反应的氧气的质量,并不违背质量守恒定律。
20.答案:(1)c;用燃着的木条靠近E装置的b导管口,若木条熄灭,则已收集满
(2)紫色石蕊溶液变红;能与水反应
(3);燃着的蜡烛由下至上依次熄灭;密度比空气大;不能燃烧;不支持燃烧
解析:(3)蜡烛熄灭说明二氧化碳具有不能燃烧、不支持燃烧的化学性质;下层的蜡烛先熄灭,说明二氧化碳密度比空气大的物理性质。
21.答案:(1)0.96g
(2)79.2%
解析:(1)生成氧气的质量=10g-9.04g=0.96g;
(2)解:设样品中高铁酸钾的质量为x
样品中高铁酸钾的质量分数:
答:样品中高铁酸钾的质量分数为79.2%。
同课章节目录
