7.1 物质的溶解 课件(共13张PPT) 2024-2025学年初中化学科粤版九年下册
文档属性
| 名称 | 7.1 物质的溶解 课件(共13张PPT) 2024-2025学年初中化学科粤版九年下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 588.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-19 15:57:28 | ||
图片预览





文档简介
(共13张PPT)
第七单元 溶 液
7.1 物质的溶解
新知导学
新知导入
我们在日常生活或实验活动中经常用到溶液,在大家的印象中,是不是物质溶于水就能形成溶液 是不是任何物质溶于水都能形成溶液 那么,什么是溶液 溶液又是怎样形成的呢
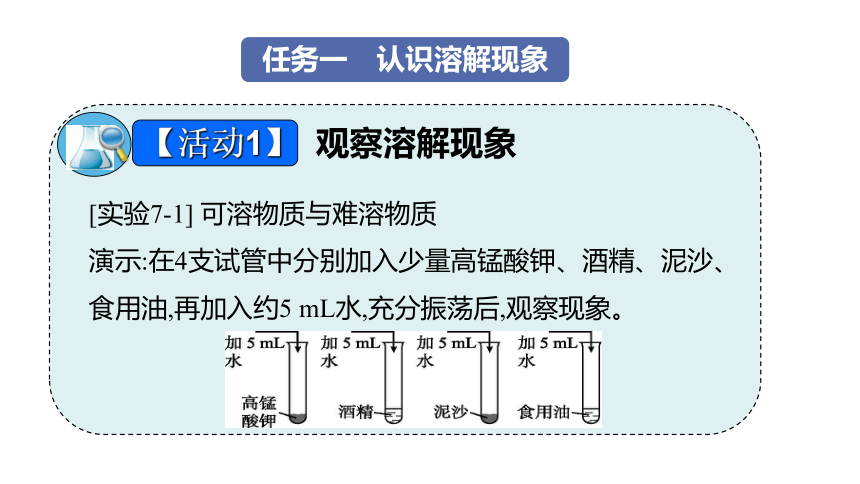
任务一 认识溶解现象
观察溶解现象
[实验7-1] 可溶物质与难溶物质
演示:在4支试管中分别加入少量高锰酸钾、酒精、泥沙、食用油,再加入约5 mL水,充分振荡后,观察现象。
【活动1】
任务二 认识溶液
认识溶液、溶质、溶剂的概念
溶液:由一种或一种以上的物质分散到另一种物质中所形成的均一且稳定的混合物。
溶质:被溶解的物质。
溶剂:能溶解其他物质的物质。
任务二 认识溶液
讨论溶液的组成和特征
1.在[实验7-1]的溶液中,溶质分别是什么 溶剂分别是什么
2.你怎么理解溶液具有均一、稳定的特点 透明溶液一定是无色的吗
3.尝试从微观粒子的角度分析氯化钠固体也能在水中“消失”的原因。
【活动2】
任务二 认识溶液
1.溶液由溶质在溶剂中溶解而形成。
高锰酸钾溶于水,溶质是高锰酸钾,溶剂是水;酒精溶于水,溶质是酒精,溶剂是水;泥沙、食用油难溶于水,二者均不能形成溶液。
2.“均一”指溶液各部分组成、性质完全一样;“稳定”指外界条件不变时,溶质和溶剂不会分离,即当水分(溶剂)不蒸发,温度、压强不改变时,溶液长时间放置不会分层,也不会有溶质析出。
3.分散到溶剂中的分子或离子,达到均一且稳定的状态后,仍处于不停地无规则运动状态中;氯化钠固体溶于水是氯离子和钠离子分散到水分子之间。
【归纳】
1.列举几种常见的水溶液。
2.列举日常生活中其他液体溶剂。
【学以致用】
任务二 认识溶液
探究物质溶解时伴随的热现象
【活动3】
溶质 加入固体前水的温度/℃ 固体完全溶解时溶液的温度/℃ 溶解前后的温度变化/℃
NaCl
NH4NO3
NaOH
[实验7-2] 观察实验,填写空白:
任务三 探究物质溶解时伴随的热现象
固体物质溶解时常伴随有吸热或放热现象;
有些固体物质溶解时,溶液温度降低,说明物质溶解时会吸热,如硝酸铵;
有些固体物质溶解时,溶液温度升高,说明物质溶解时会放热,如氢氧化钠;
有些固体物质溶解时,溶液温度不变,说明物质溶解时没有明显的热现象,如氯化钠。
【归纳】
任务三:探究物质溶解时伴随的热现象
课堂小结
课堂小结
课堂练习
课堂练习
1.下列对溶液的说法中,正确的是 ( )
A.溶液一定是无色透明的 B.只有水才能作溶剂
C.溶液是均一、稳定的混合物 D.溶液中的溶质只能是固体
2.如图所示,容器的气密性良好,导管内有一段红墨水,试管中盛有适量的冷水。若要红墨水向右移动,可向试管中加入下列物质中的 ( )
A.NH4NO3固体 B.蔗糖
C.食盐 D.NaOH固体
C
D
课堂练习
课堂练习
溶液 碘酒 澄清石灰水 白酒 高锰酸钾溶液 盐酸
溶质
溶剂
3.写出下表溶液中溶质和溶剂的名称或化学式。
I2
水
Ca(OH)2
C2H5OH
KMnO4
HCl
乙醇
水
水
水
谢 谢 观 看
第七单元 溶 液
7.1 物质的溶解
新知导学
新知导入
我们在日常生活或实验活动中经常用到溶液,在大家的印象中,是不是物质溶于水就能形成溶液 是不是任何物质溶于水都能形成溶液 那么,什么是溶液 溶液又是怎样形成的呢
任务一 认识溶解现象
观察溶解现象
[实验7-1] 可溶物质与难溶物质
演示:在4支试管中分别加入少量高锰酸钾、酒精、泥沙、食用油,再加入约5 mL水,充分振荡后,观察现象。
【活动1】
任务二 认识溶液
认识溶液、溶质、溶剂的概念
溶液:由一种或一种以上的物质分散到另一种物质中所形成的均一且稳定的混合物。
溶质:被溶解的物质。
溶剂:能溶解其他物质的物质。
任务二 认识溶液
讨论溶液的组成和特征
1.在[实验7-1]的溶液中,溶质分别是什么 溶剂分别是什么
2.你怎么理解溶液具有均一、稳定的特点 透明溶液一定是无色的吗
3.尝试从微观粒子的角度分析氯化钠固体也能在水中“消失”的原因。
【活动2】
任务二 认识溶液
1.溶液由溶质在溶剂中溶解而形成。
高锰酸钾溶于水,溶质是高锰酸钾,溶剂是水;酒精溶于水,溶质是酒精,溶剂是水;泥沙、食用油难溶于水,二者均不能形成溶液。
2.“均一”指溶液各部分组成、性质完全一样;“稳定”指外界条件不变时,溶质和溶剂不会分离,即当水分(溶剂)不蒸发,温度、压强不改变时,溶液长时间放置不会分层,也不会有溶质析出。
3.分散到溶剂中的分子或离子,达到均一且稳定的状态后,仍处于不停地无规则运动状态中;氯化钠固体溶于水是氯离子和钠离子分散到水分子之间。
【归纳】
1.列举几种常见的水溶液。
2.列举日常生活中其他液体溶剂。
【学以致用】
任务二 认识溶液
探究物质溶解时伴随的热现象
【活动3】
溶质 加入固体前水的温度/℃ 固体完全溶解时溶液的温度/℃ 溶解前后的温度变化/℃
NaCl
NH4NO3
NaOH
[实验7-2] 观察实验,填写空白:
任务三 探究物质溶解时伴随的热现象
固体物质溶解时常伴随有吸热或放热现象;
有些固体物质溶解时,溶液温度降低,说明物质溶解时会吸热,如硝酸铵;
有些固体物质溶解时,溶液温度升高,说明物质溶解时会放热,如氢氧化钠;
有些固体物质溶解时,溶液温度不变,说明物质溶解时没有明显的热现象,如氯化钠。
【归纳】
任务三:探究物质溶解时伴随的热现象
课堂小结
课堂小结
课堂练习
课堂练习
1.下列对溶液的说法中,正确的是 ( )
A.溶液一定是无色透明的 B.只有水才能作溶剂
C.溶液是均一、稳定的混合物 D.溶液中的溶质只能是固体
2.如图所示,容器的气密性良好,导管内有一段红墨水,试管中盛有适量的冷水。若要红墨水向右移动,可向试管中加入下列物质中的 ( )
A.NH4NO3固体 B.蔗糖
C.食盐 D.NaOH固体
C
D
课堂练习
课堂练习
溶液 碘酒 澄清石灰水 白酒 高锰酸钾溶液 盐酸
溶质
溶剂
3.写出下表溶液中溶质和溶剂的名称或化学式。
I2
水
Ca(OH)2
C2H5OH
KMnO4
HCl
乙醇
水
水
水
谢 谢 观 看
