7.3 第1课时 溶质的质量分数及其简单计算 课件(共23张PPT) 2024-2025学年初中化学科粤版九年下册
文档属性
| 名称 | 7.3 第1课时 溶质的质量分数及其简单计算 课件(共23张PPT) 2024-2025学年初中化学科粤版九年下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 534.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-19 19:13:33 | ||
图片预览





文档简介
(共23张PPT)
第七单元 溶 液
7.3 第1课时 溶质的质量分数及其简单计算
新知导学
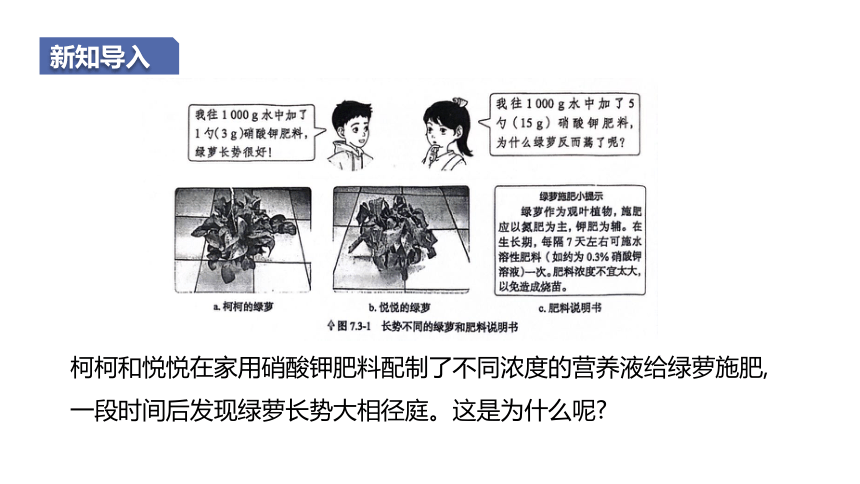
新知导入
柯柯和悦悦在家用硝酸钾肥料配制了不同浓度的营养液给绿萝施肥,一段时间后发现绿萝长势大相径庭。这是为什么呢
新知导学
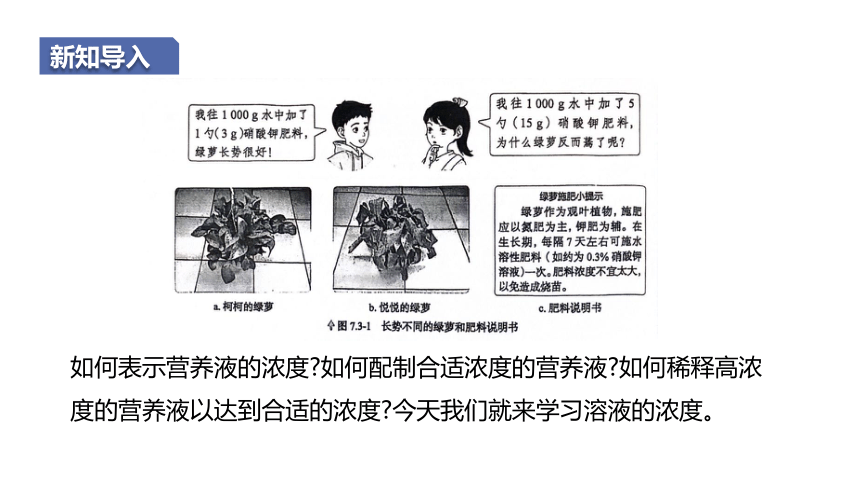
新知导入
如何表示营养液的浓度 如何配制合适浓度的营养液 如何稀释高浓度的营养液以达到合适的浓度 今天我们就来学习溶液的浓度。
任务一 溶液浓度的表示方法
生活中经常会用颜色的深浅,甜、酸、咸、淡的程度大小等说明溶液的浓稀程度,但不准确,在实际应用中,有时需要知道准确的浓度大小。
任务一 溶液浓度的表示方法
认识溶质的质量分数
阅读教材P46,并回答问题。
问题1:什么是浓度
问题2:什么是溶质质量分数
问题3:溶质质量分数的表达式是什么
【活动1】
任务一 溶液浓度的表示方法
认识溶质的质量分数
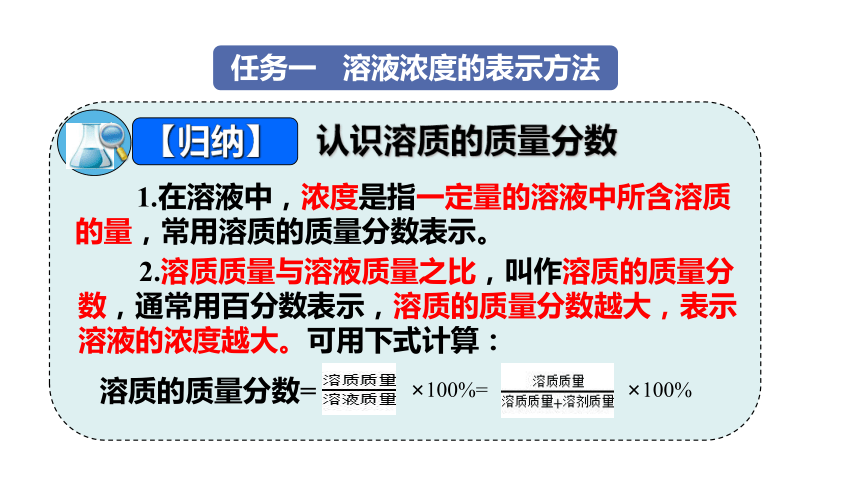
【归纳】
1.在溶液中,浓度是指一定量的溶液中所含溶质的量,常用溶质的质量分数表示。
2.溶质质量与溶液质量之比,叫作溶质的质量分数,通常用百分数表示,溶质的质量分数越大,表示溶液的浓度越大。可用下式计算:
×100%=
×100%
溶质的质量分数=
任务一 溶液浓度的表示方法
还可以怎样计算饱和溶液的溶质质量分数
【讨论】
【归纳】
同一温度下,同一溶质的溶液,饱和溶液的浓度最大,即溶质质量分数最大。
饱和溶液中溶质的质量分数的计算公式如下:饱和溶液中溶质的质量分数=
×100%
任务二 溶质质量分数的相关计算
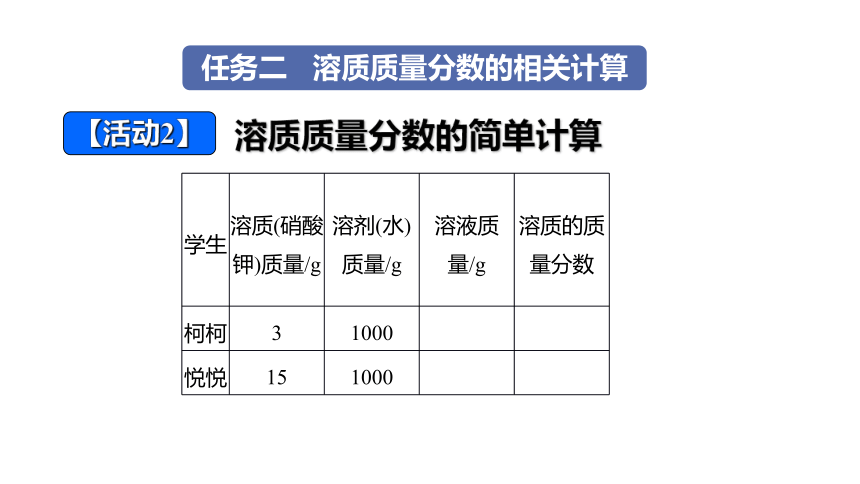
【活动2】
溶质质量分数的简单计算
学生 溶质(硝酸 钾)质量/g 溶剂(水) 质量/g 溶液质 量/g 溶质的质
量分数
柯柯 3 1000
悦悦 15 1000
任务二 溶质质量分数的相关计算
【归纳】
进行溶质质量分数的计算时,需要注意:
(4)影响溶液中溶质的质量分数的因素只有溶质的质量和溶液的质量,与溶液的温度、是否饱和、溶质的种类、溶剂的种类等均无关。
(1)不能将溶剂质量与溶液质量混淆。溶液质量可以按下列方法计算:
溶液质量= 溶质质量+溶剂质量;
溶液质量=溶液体积×溶液密度。
(2)计算公式中溶质质量与溶液质量单位必须统一。
(3)溶质质量是指已溶解在溶剂里的溶质的质量,不包括未溶解的部分或结晶析出的部分。
任务二 溶质质量分数的相关计算
【活动3】
有关溶液稀释的计算
如何将悦悦配制的过高浓度的营养液转变为适合绿萝生长的营养液呢?
思考:
任务二 溶质质量分数的相关计算
【归纳】
分析稀释前后各个量及它们之间的关系:
稀释计算依据:
溶液稀释前后溶质的质量不变。
任务二 溶质质量分数的相关计算
【归纳】
分析稀释前后各个量及它们之间的关系:
加水稀释计算公式:
加入稀溶液稀释浓溶液:
A·a%=B·b% 或 A·a%=(A+M水)·b%
A·a%+B·b%=(A+B)·c%
任务二 溶质质量分数的相关计算
【练习】
配制用于铅蓄电池的溶质质量分数为28%硫酸溶液460 g,问需要溶质质量分数为98%的浓硫酸的体积是多少 已知98%的浓硫酸密度为1.84 g·cm-3。
任务二 溶质质量分数的相关计算
【活动4】
某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液的溶质质量分数,测得数据如下,如何计算该过氧化氢溶液的溶质质量分数
涉及化学反应的溶质的质量分数的计算
任务二 溶质质量分数的相关计算
【活动4】
思考并讨论:
1.已知量是什么 是纯量吗 未知量是什么
2.已知量和未知量是什么关系 通过什么可以联系起来
涉及化学反应的溶质的质量分数的计算
任务二 溶质质量分数的相关计算
【归纳】
计算步骤和格式:
①设:根据题意设未知量,未知量不能带单位。
②写:确定反应原理,正确书写化学方程式。
③找:找出已知量和未知量的关系,代入相关物质的质量。
④列:列出比例式,在化学反应中各物质的质量成比例(代入化学方程式的量必须是纯净物的质量)。
任务二 溶质质量分数的相关计算
【归纳】
计算步骤和格式:
⑤求:准确计算所求溶液中溶质的质量与溶液的质量(化学反应后所得溶液中的溶质为反应后生成的可溶物质;溶液质量不包括产生的气体、生成的沉淀、难溶的固体杂质的质量),代入公式计算所求溶质的质量分数。
⑥答:简明地写出答案。
课堂小结
课堂小结
课堂小结
课堂练习
1.欲将30 ℃的不饱和的硝酸钾溶液变成饱和溶液,下列说法正确的是 ( )
A.溶液中溶剂的质量一定减少
B.溶液中溶质的质量一定增加
C.溶液中溶质的质量分数可能不变
D.溶液中溶质的质量分数一定变大
C
课堂小结
课堂练习
2.化学实验室现有98%的浓硫酸,但是在实验中同学们需要用较稀的硫酸。要把50 g质量分数为98%、密度为1.84 g/cm3的浓硫酸稀释为质量分数为20%的稀硫酸,需要水的体积为( )
A.196 mL B.106 mL C.106.5 mL D.195 mL
D
课堂小结
课堂练习
3.已知氯化钾在40 ℃时的溶解度为40 g,则该温度下氯化钾饱和溶液中溶质的质量分数是 (计算结果精确至0.1%)。
28.6%
课堂小结
课堂练习
4.取含杂质的锌粒10 g放入烧杯中,加入稀硫酸,测得加入稀硫酸的质量与产生氢气质量的关系如图所示(提示:杂质不与稀硫酸反应)。求:
(1)完全反应时生成氢气的质量是 g。
(2)计算该硫酸的溶质质量分数。
0.2
解:设该硫酸的溶质质量为x。
Zn+H2SO4= ZnSO4+H2↑
98 2
x 0.2g
= x=9.8g
该硫酸的溶质质量分数为 —— ×100%=19.6%
答:该硫酸的溶质质量分数为19.6%。
9.8g
50g
98
2
9.8g
x
谢 谢 观 看
第七单元 溶 液
7.3 第1课时 溶质的质量分数及其简单计算
新知导学
新知导入
柯柯和悦悦在家用硝酸钾肥料配制了不同浓度的营养液给绿萝施肥,一段时间后发现绿萝长势大相径庭。这是为什么呢
新知导学
新知导入
如何表示营养液的浓度 如何配制合适浓度的营养液 如何稀释高浓度的营养液以达到合适的浓度 今天我们就来学习溶液的浓度。
任务一 溶液浓度的表示方法
生活中经常会用颜色的深浅,甜、酸、咸、淡的程度大小等说明溶液的浓稀程度,但不准确,在实际应用中,有时需要知道准确的浓度大小。
任务一 溶液浓度的表示方法
认识溶质的质量分数
阅读教材P46,并回答问题。
问题1:什么是浓度
问题2:什么是溶质质量分数
问题3:溶质质量分数的表达式是什么
【活动1】
任务一 溶液浓度的表示方法
认识溶质的质量分数
【归纳】
1.在溶液中,浓度是指一定量的溶液中所含溶质的量,常用溶质的质量分数表示。
2.溶质质量与溶液质量之比,叫作溶质的质量分数,通常用百分数表示,溶质的质量分数越大,表示溶液的浓度越大。可用下式计算:
×100%=
×100%
溶质的质量分数=
任务一 溶液浓度的表示方法
还可以怎样计算饱和溶液的溶质质量分数
【讨论】
【归纳】
同一温度下,同一溶质的溶液,饱和溶液的浓度最大,即溶质质量分数最大。
饱和溶液中溶质的质量分数的计算公式如下:饱和溶液中溶质的质量分数=
×100%
任务二 溶质质量分数的相关计算
【活动2】
溶质质量分数的简单计算
学生 溶质(硝酸 钾)质量/g 溶剂(水) 质量/g 溶液质 量/g 溶质的质
量分数
柯柯 3 1000
悦悦 15 1000
任务二 溶质质量分数的相关计算
【归纳】
进行溶质质量分数的计算时,需要注意:
(4)影响溶液中溶质的质量分数的因素只有溶质的质量和溶液的质量,与溶液的温度、是否饱和、溶质的种类、溶剂的种类等均无关。
(1)不能将溶剂质量与溶液质量混淆。溶液质量可以按下列方法计算:
溶液质量= 溶质质量+溶剂质量;
溶液质量=溶液体积×溶液密度。
(2)计算公式中溶质质量与溶液质量单位必须统一。
(3)溶质质量是指已溶解在溶剂里的溶质的质量,不包括未溶解的部分或结晶析出的部分。
任务二 溶质质量分数的相关计算
【活动3】
有关溶液稀释的计算
如何将悦悦配制的过高浓度的营养液转变为适合绿萝生长的营养液呢?
思考:
任务二 溶质质量分数的相关计算
【归纳】
分析稀释前后各个量及它们之间的关系:
稀释计算依据:
溶液稀释前后溶质的质量不变。
任务二 溶质质量分数的相关计算
【归纳】
分析稀释前后各个量及它们之间的关系:
加水稀释计算公式:
加入稀溶液稀释浓溶液:
A·a%=B·b% 或 A·a%=(A+M水)·b%
A·a%+B·b%=(A+B)·c%
任务二 溶质质量分数的相关计算
【练习】
配制用于铅蓄电池的溶质质量分数为28%硫酸溶液460 g,问需要溶质质量分数为98%的浓硫酸的体积是多少 已知98%的浓硫酸密度为1.84 g·cm-3。
任务二 溶质质量分数的相关计算
【活动4】
某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液的溶质质量分数,测得数据如下,如何计算该过氧化氢溶液的溶质质量分数
涉及化学反应的溶质的质量分数的计算
任务二 溶质质量分数的相关计算
【活动4】
思考并讨论:
1.已知量是什么 是纯量吗 未知量是什么
2.已知量和未知量是什么关系 通过什么可以联系起来
涉及化学反应的溶质的质量分数的计算
任务二 溶质质量分数的相关计算
【归纳】
计算步骤和格式:
①设:根据题意设未知量,未知量不能带单位。
②写:确定反应原理,正确书写化学方程式。
③找:找出已知量和未知量的关系,代入相关物质的质量。
④列:列出比例式,在化学反应中各物质的质量成比例(代入化学方程式的量必须是纯净物的质量)。
任务二 溶质质量分数的相关计算
【归纳】
计算步骤和格式:
⑤求:准确计算所求溶液中溶质的质量与溶液的质量(化学反应后所得溶液中的溶质为反应后生成的可溶物质;溶液质量不包括产生的气体、生成的沉淀、难溶的固体杂质的质量),代入公式计算所求溶质的质量分数。
⑥答:简明地写出答案。
课堂小结
课堂小结
课堂小结
课堂练习
1.欲将30 ℃的不饱和的硝酸钾溶液变成饱和溶液,下列说法正确的是 ( )
A.溶液中溶剂的质量一定减少
B.溶液中溶质的质量一定增加
C.溶液中溶质的质量分数可能不变
D.溶液中溶质的质量分数一定变大
C
课堂小结
课堂练习
2.化学实验室现有98%的浓硫酸,但是在实验中同学们需要用较稀的硫酸。要把50 g质量分数为98%、密度为1.84 g/cm3的浓硫酸稀释为质量分数为20%的稀硫酸,需要水的体积为( )
A.196 mL B.106 mL C.106.5 mL D.195 mL
D
课堂小结
课堂练习
3.已知氯化钾在40 ℃时的溶解度为40 g,则该温度下氯化钾饱和溶液中溶质的质量分数是 (计算结果精确至0.1%)。
28.6%
课堂小结
课堂练习
4.取含杂质的锌粒10 g放入烧杯中,加入稀硫酸,测得加入稀硫酸的质量与产生氢气质量的关系如图所示(提示:杂质不与稀硫酸反应)。求:
(1)完全反应时生成氢气的质量是 g。
(2)计算该硫酸的溶质质量分数。
0.2
解:设该硫酸的溶质质量为x。
Zn+H2SO4= ZnSO4+H2↑
98 2
x 0.2g
= x=9.8g
该硫酸的溶质质量分数为 —— ×100%=19.6%
答:该硫酸的溶质质量分数为19.6%。
9.8g
50g
98
2
9.8g
x
谢 谢 观 看
