8.4 第1课时 盐的组成和分类 盐的化学性质 课件(共14张PPT) 2024-2025学年化学沪教版九年级下册
文档属性
| 名称 | 8.4 第1课时 盐的组成和分类 盐的化学性质 课件(共14张PPT) 2024-2025学年化学沪教版九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 226.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-20 00:00:00 | ||
图片预览






文档简介
(共14张PPT)
第8章 酸、碱、盐及其应用
第4节 几种重要的盐
第1课时 盐的组成和分类 盐的化学性质
新知导学
交流与讨论
盐与生产生活息息相关,你知道的盐有哪些?
新知导学
交流讨论
回忆盐酸与氢氧化钠或氢氧化钠发生中和反应生成盐和水的事实,总结盐的组成有何特点?
盐:由金属离子(或铵根离子)与酸根离子组成的化合物
氯化钠←钠离子 + 氯离子
盐← 金属离子 + 酸根
铵根
新知导学
交流讨论
氯化钠(NaCl)、氯化钙(CaCl2)、碳酸钠(Na2CO3)、硫酸铜(CuSO4)、硝酸铵(NH4NO3)、碳酸钙都是盐,它们在组成上有什么相同之处
氯化钠、碳酸钠都含有钠离子,属于钠盐;
氯化钠和氯化钙都含有氯离子,属于盐酸盐;
碳酸钠和碳酸钙都含有碳酸根,属于碳酸盐
新知导学
交流讨论
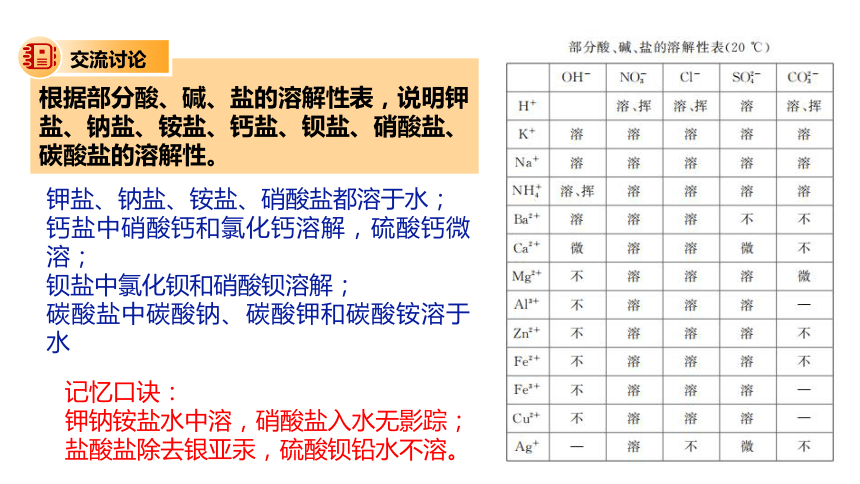
根据部分酸、碱、盐的溶解性表,说明钾盐、钠盐、铵盐、钙盐、钡盐、硝酸盐、碳酸盐的溶解性。
钾盐、钠盐、铵盐、硝酸盐都溶于水;
钙盐中硝酸钙和氯化钙溶解,硫酸钙微溶;
钡盐中氯化钡和硝酸钡溶解;
碳酸盐中碳酸钠、碳酸钾和碳酸铵溶于水
记忆口诀:
钾钠铵盐水中溶,硝酸盐入水无影踪;
盐酸盐除去银亚汞,硫酸钡铅水不溶。
新知导学
交流讨论
写出下列反应的化学方程式,并判断它们的反应类型。
(1)铁与硫酸铜溶液反应。
(2)碳酸钠溶液、石灰石分别与足量稀盐酸反应,放出二氧化碳气体。
(3)硫酸铜溶液与氢氧化钠溶液混合生成氢氧化铜沉淀。
(1)Fe+CuSO4==FeSO4+Cu 置换反应
(2)Na2CO3+2HCl==2NaCl+H2O+CO2↑ 复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑ 复分解反应
(3)2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 复分解反应
盐与金属反应
盐与酸反应
盐与碱反应
新知导学
交流讨论
除此之外,部分盐与盐也可能发生复分解反应,如氯化钙与碳酸钠可发生复分解反应,试写出其反应的化学方程式。
Na2CO3+CaCl2==CaCO3↓+2NaCl
盐与盐反应
新知导学
归纳整理
①金属+盐→新金属+新盐
②盐+酸→新盐+新酸
③碱+盐→新碱+新盐
④盐1+盐2→新盐1+新盐2
综上整理盐具有的化学性质。
新知导学
交流讨论
(1)以铁与硫酸铜反应为例,结合金属活动性顺序表,你有什么发现?
(2)试着判断锌能否与硫酸铜反应,铜能否与硝酸银反应?如果可以,写出对应的方程式。
(1)在金属活动性顺序表中,除非常活泼的金属外,排在前面的金属一般可以将位于该金属后面的、比它不活泼的金属从其盐溶液中置换出来。
(2)Zn+CuSO4==ZnSO4+Cu
Cu+2AgNO3==Cu(NO3)2+2Ag
课堂小结
1.盐的组成
2.盐的分类
3.盐的化学性质
4.金属活动性的应用
课堂巩固
酸
1.有下列物质:HNO3、KNO3、KOH、AgNO3、BaSO4、FeCl3、H3PO4、Mg(OH)2、H2CO3、MgCO3,其中哪些属于酸?哪些属于碱?哪些属于盐?
碱
盐
HNO3、H3PO4、H2CO3
KOH、Mg(OH)2
KNO3、AgNO3、BaSO4、FeCl3、MgCO3
课堂巩固
2.部分盐和酸的溶解性(20℃)如下表所示。下列说法不正确的是( )
Cl- SO42- CO32-
H+ 溶、挥 溶 溶、挥
Ca2+ 溶 微 不
Mg2+ 溶 溶 微
A.盐酸是挥发性酸
B.MgSO4是可溶性盐
C.常温下溶解度:CaCO3>CaSO4
D.常温下,MgSO4溶液与稀盐酸不发生反应
C
课堂巩固
3.现有X、Y、Z三种金属,X、Y分别与稀硫酸、与含Z元素的硝酸盐溶液作用的现象如下表所示。
反应 X Y
与稀硫酸作用 无反应 溶解并放出气体
与含Z的硝酸盐溶液作用 表面析出Z单质 表面析出Z单质
根据表中的实验结果,判断这三种金属活动性由强到弱的顺序是( )
A.Z、Y、X B.X、Y、Z C.Y、X、Z D.X、Z、Y
C
谢 谢 观 看
第8章 酸、碱、盐及其应用
第4节 几种重要的盐
第1课时 盐的组成和分类 盐的化学性质
新知导学
交流与讨论
盐与生产生活息息相关,你知道的盐有哪些?
新知导学
交流讨论
回忆盐酸与氢氧化钠或氢氧化钠发生中和反应生成盐和水的事实,总结盐的组成有何特点?
盐:由金属离子(或铵根离子)与酸根离子组成的化合物
氯化钠←钠离子 + 氯离子
盐← 金属离子 + 酸根
铵根
新知导学
交流讨论
氯化钠(NaCl)、氯化钙(CaCl2)、碳酸钠(Na2CO3)、硫酸铜(CuSO4)、硝酸铵(NH4NO3)、碳酸钙都是盐,它们在组成上有什么相同之处
氯化钠、碳酸钠都含有钠离子,属于钠盐;
氯化钠和氯化钙都含有氯离子,属于盐酸盐;
碳酸钠和碳酸钙都含有碳酸根,属于碳酸盐
新知导学
交流讨论
根据部分酸、碱、盐的溶解性表,说明钾盐、钠盐、铵盐、钙盐、钡盐、硝酸盐、碳酸盐的溶解性。
钾盐、钠盐、铵盐、硝酸盐都溶于水;
钙盐中硝酸钙和氯化钙溶解,硫酸钙微溶;
钡盐中氯化钡和硝酸钡溶解;
碳酸盐中碳酸钠、碳酸钾和碳酸铵溶于水
记忆口诀:
钾钠铵盐水中溶,硝酸盐入水无影踪;
盐酸盐除去银亚汞,硫酸钡铅水不溶。
新知导学
交流讨论
写出下列反应的化学方程式,并判断它们的反应类型。
(1)铁与硫酸铜溶液反应。
(2)碳酸钠溶液、石灰石分别与足量稀盐酸反应,放出二氧化碳气体。
(3)硫酸铜溶液与氢氧化钠溶液混合生成氢氧化铜沉淀。
(1)Fe+CuSO4==FeSO4+Cu 置换反应
(2)Na2CO3+2HCl==2NaCl+H2O+CO2↑ 复分解反应
CaCO3+2HCl==CaCl2+H2O+CO2↑ 复分解反应
(3)2NaOH+CuSO4==Cu(OH)2↓+Na2SO4 复分解反应
盐与金属反应
盐与酸反应
盐与碱反应
新知导学
交流讨论
除此之外,部分盐与盐也可能发生复分解反应,如氯化钙与碳酸钠可发生复分解反应,试写出其反应的化学方程式。
Na2CO3+CaCl2==CaCO3↓+2NaCl
盐与盐反应
新知导学
归纳整理
①金属+盐→新金属+新盐
②盐+酸→新盐+新酸
③碱+盐→新碱+新盐
④盐1+盐2→新盐1+新盐2
综上整理盐具有的化学性质。
新知导学
交流讨论
(1)以铁与硫酸铜反应为例,结合金属活动性顺序表,你有什么发现?
(2)试着判断锌能否与硫酸铜反应,铜能否与硝酸银反应?如果可以,写出对应的方程式。
(1)在金属活动性顺序表中,除非常活泼的金属外,排在前面的金属一般可以将位于该金属后面的、比它不活泼的金属从其盐溶液中置换出来。
(2)Zn+CuSO4==ZnSO4+Cu
Cu+2AgNO3==Cu(NO3)2+2Ag
课堂小结
1.盐的组成
2.盐的分类
3.盐的化学性质
4.金属活动性的应用
课堂巩固
酸
1.有下列物质:HNO3、KNO3、KOH、AgNO3、BaSO4、FeCl3、H3PO4、Mg(OH)2、H2CO3、MgCO3,其中哪些属于酸?哪些属于碱?哪些属于盐?
碱
盐
HNO3、H3PO4、H2CO3
KOH、Mg(OH)2
KNO3、AgNO3、BaSO4、FeCl3、MgCO3
课堂巩固
2.部分盐和酸的溶解性(20℃)如下表所示。下列说法不正确的是( )
Cl- SO42- CO32-
H+ 溶、挥 溶 溶、挥
Ca2+ 溶 微 不
Mg2+ 溶 溶 微
A.盐酸是挥发性酸
B.MgSO4是可溶性盐
C.常温下溶解度:CaCO3>CaSO4
D.常温下,MgSO4溶液与稀盐酸不发生反应
C
课堂巩固
3.现有X、Y、Z三种金属,X、Y分别与稀硫酸、与含Z元素的硝酸盐溶液作用的现象如下表所示。
反应 X Y
与稀硫酸作用 无反应 溶解并放出气体
与含Z的硝酸盐溶液作用 表面析出Z单质 表面析出Z单质
根据表中的实验结果,判断这三种金属活动性由强到弱的顺序是( )
A.Z、Y、X B.X、Y、Z C.Y、X、Z D.X、Z、Y
C
谢 谢 观 看
同课章节目录
