8.3 中和反应 课件(共17张PPT) 2024-2025学年化学沪教版九年级下册
文档属性
| 名称 | 8.3 中和反应 课件(共17张PPT) 2024-2025学年化学沪教版九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-20 00:00:00 | ||
图片预览





文档简介
(共17张PPT)
第8章 酸、碱、盐及其应用
第3节 中和反应
酸可以使紫色石蕊变红,碱使紫色石蕊变蓝。酸可与金属氧化物反应,碱可与非金属氧化物反应。酸碱相遇又会有什么变化呢?
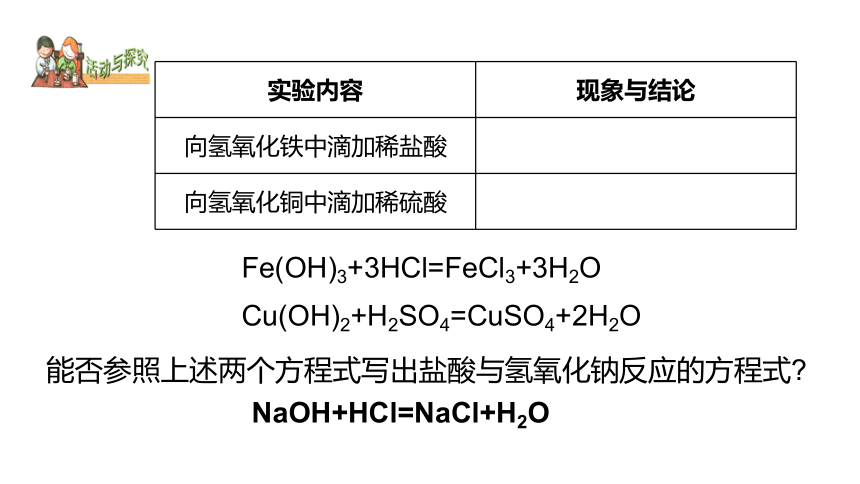
实验内容 现象与结论
向氢氧化铁中滴加稀盐酸
向氢氧化铜中滴加稀硫酸
Fe(OH)3+3HCl=FeCl3+3H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
能否参照上述两个方程式写出盐酸与氢氧化钠反应的方程式
NaOH+HCl=NaCl+H2O
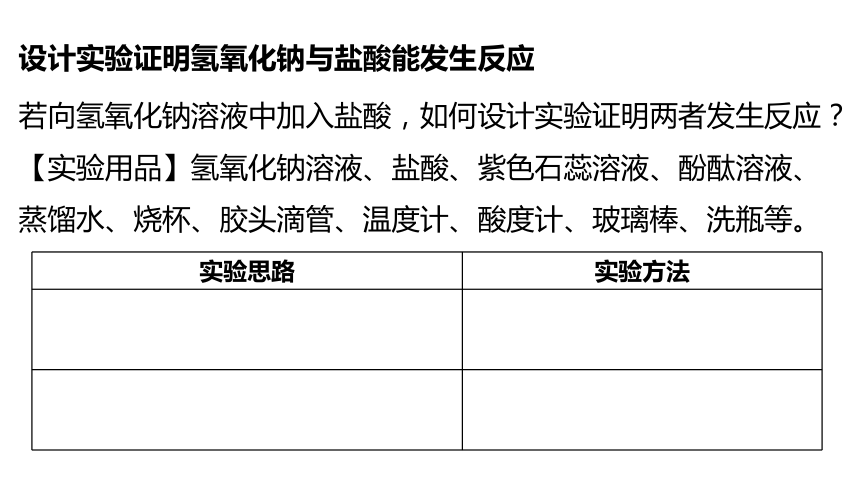
若向氢氧化钠溶液中加入盐酸,如何设计实验证明两者发生反应?
【实验用品】氢氧化钠溶液、盐酸、紫色石蕊溶液、酚酞溶液、蒸馏水、烧杯、胶头滴管、温度计、酸度计、玻璃棒、洗瓶等。
实验思路 实验方法
设计实验证明氢氧化钠与盐酸能发生反应
加入盐酸的量 溶液颜色 溶液的酸碱性 溶液温度/℃
少量
恰好反应
实验探究
【实验1】在盛有少量氢氧化钠溶液的烧杯中,滴加2~3滴酚酞溶液,插入一支温度计,测量溶液的温度。用胶头滴管吸取稀盐酸逐滴加入盛有氢氧化钠溶液的烧杯中,边滴加边用玻璃棒搅拌,当烧杯中溶液刚好变为无色时,停止加入稀盐酸。
酚酞作用:
可判断反应的发生和中和反应的终点
玻璃棒作用:
使溶液充分接触,充分反应
实验探究
【实验2】取实验1所得的少量溶液于一支试管中,另取一个胶头滴管,向试管中加入1滴氢氧化钠溶液。
【实验3】用玻璃棒蘸取实验1所得的溶液,加热至蒸干。
实验分析
(1)实验2溶液的颜色又发生什么变化?这说明了什么?
(2)实验3观察到什么现象?能否证明是氯化钠?进而证明二者发生反应?
归纳:
酸和碱生成盐和水的反应叫作中和反应
思考
①中和反应是否属于复分解反应?
②有盐和水产生的反应一定是中和反应吗?
中和反应的研究
利用数字传感器分析氢氧化钠与盐酸反应实验数据:
结合pH图像(绿线)分析,在大约85s时,反应进行的情况如何?此时溶液中的溶质是什么?此时温度图像(蓝线)有什么特点?40s、100s时溶液中的溶质是什么?
时间 40s 85s 100s
pH
溶质
分析氢氧化钠与盐酸发生中和反应,化学方程式可表示为:
NaOH+HCl==NaCl+H2O
中和反应微观实质
反应物 生成物
物质
微观粒子
NaOH、HCl
NaCl、H2O
H+、OH-、Na+、Cl-
H2O、Na+、Cl-
实质:H++OH-==H2O
中和反应实质:氢离子和氢氧根离子结合为水分子
中和反应的应用
治疗胃酸过多
改良酸性土壤
处理工厂废水
生活中
农业中
工业中
课堂小结
中和反应
1.概念
(1)酸和碱反应生成盐和水的反应
(2)表达式:酸 + 碱→盐 + 水
2.实质:H++OH-==H2O
3.中和反应的应用
(1)工业中:酸性和碱性废水中和处理后排放
(2)生活中:用含有氢氧化铝的药物中和胃酸,缓解胃酸过多引起的不适;使用洁厕灵清理下水道的水垢(水垢中含有氢氧化镁等难溶物)
(3)农业中:熟石灰治理酸性土壤
课堂巩固
1.下列属于中和反应的是( )
A.H2SO4+CuO==CuSO4+H2O
B.HCl+KOH==KCl+H2O
C.3NaOH+FeCl3==3NaCl+Fe(OH)3↓
D.CO2+Ca(OH)2==CaCO3↓+H2O
B
课堂巩固
2.氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图如下。下列说法不正确的是( )
A.盐酸中存在的微观粒子有水分子和氯化氢分子
B.该反应的微观实质是H+和OH-结合
生成水分子
C.Na+和Cl-在该反应过程中没有被消耗
D.恰好完全反应时,溶液呈中性
A
课堂巩固
3.常温下,将10mL5%NaOH溶液逐滴加入盛有5mL5%稀盐酸(含2滴酚酞溶液)的锥形瓶中,边滴边振荡。下列有关说法正确的是( )
A.滴加过程中,锥形瓶内溶液中Na+的数目不断增加
B.滴加过程中,溶液恰好由无色变为红色时,溶液pH为7
C.滴加过程中,锥形瓶内溶液温度不断升高
D.滴加结束后,取少量溶液蒸干,所得白色固体是NaCl
A
课堂巩固
4.如图所示的U形管中是滴有酚酞溶液的蒸
馏水,向左、右两管中同时逐滴滴加一定量
的氢氧化钠稀溶液和稀盐酸。
(1)开始时, (填“左”或“右”)
管溶液呈红色。
(2)充分反应后U形管中溶液全部呈无色,此时溶液中的溶质除酚酞外一定含有 ,可能含有 。
左
NaCl
HCl
谢 谢 观 看
第8章 酸、碱、盐及其应用
第3节 中和反应
酸可以使紫色石蕊变红,碱使紫色石蕊变蓝。酸可与金属氧化物反应,碱可与非金属氧化物反应。酸碱相遇又会有什么变化呢?
实验内容 现象与结论
向氢氧化铁中滴加稀盐酸
向氢氧化铜中滴加稀硫酸
Fe(OH)3+3HCl=FeCl3+3H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
能否参照上述两个方程式写出盐酸与氢氧化钠反应的方程式
NaOH+HCl=NaCl+H2O
若向氢氧化钠溶液中加入盐酸,如何设计实验证明两者发生反应?
【实验用品】氢氧化钠溶液、盐酸、紫色石蕊溶液、酚酞溶液、蒸馏水、烧杯、胶头滴管、温度计、酸度计、玻璃棒、洗瓶等。
实验思路 实验方法
设计实验证明氢氧化钠与盐酸能发生反应
加入盐酸的量 溶液颜色 溶液的酸碱性 溶液温度/℃
少量
恰好反应
实验探究
【实验1】在盛有少量氢氧化钠溶液的烧杯中,滴加2~3滴酚酞溶液,插入一支温度计,测量溶液的温度。用胶头滴管吸取稀盐酸逐滴加入盛有氢氧化钠溶液的烧杯中,边滴加边用玻璃棒搅拌,当烧杯中溶液刚好变为无色时,停止加入稀盐酸。
酚酞作用:
可判断反应的发生和中和反应的终点
玻璃棒作用:
使溶液充分接触,充分反应
实验探究
【实验2】取实验1所得的少量溶液于一支试管中,另取一个胶头滴管,向试管中加入1滴氢氧化钠溶液。
【实验3】用玻璃棒蘸取实验1所得的溶液,加热至蒸干。
实验分析
(1)实验2溶液的颜色又发生什么变化?这说明了什么?
(2)实验3观察到什么现象?能否证明是氯化钠?进而证明二者发生反应?
归纳:
酸和碱生成盐和水的反应叫作中和反应
思考
①中和反应是否属于复分解反应?
②有盐和水产生的反应一定是中和反应吗?
中和反应的研究
利用数字传感器分析氢氧化钠与盐酸反应实验数据:
结合pH图像(绿线)分析,在大约85s时,反应进行的情况如何?此时溶液中的溶质是什么?此时温度图像(蓝线)有什么特点?40s、100s时溶液中的溶质是什么?
时间 40s 85s 100s
pH
溶质
分析氢氧化钠与盐酸发生中和反应,化学方程式可表示为:
NaOH+HCl==NaCl+H2O
中和反应微观实质
反应物 生成物
物质
微观粒子
NaOH、HCl
NaCl、H2O
H+、OH-、Na+、Cl-
H2O、Na+、Cl-
实质:H++OH-==H2O
中和反应实质:氢离子和氢氧根离子结合为水分子
中和反应的应用
治疗胃酸过多
改良酸性土壤
处理工厂废水
生活中
农业中
工业中
课堂小结
中和反应
1.概念
(1)酸和碱反应生成盐和水的反应
(2)表达式:酸 + 碱→盐 + 水
2.实质:H++OH-==H2O
3.中和反应的应用
(1)工业中:酸性和碱性废水中和处理后排放
(2)生活中:用含有氢氧化铝的药物中和胃酸,缓解胃酸过多引起的不适;使用洁厕灵清理下水道的水垢(水垢中含有氢氧化镁等难溶物)
(3)农业中:熟石灰治理酸性土壤
课堂巩固
1.下列属于中和反应的是( )
A.H2SO4+CuO==CuSO4+H2O
B.HCl+KOH==KCl+H2O
C.3NaOH+FeCl3==3NaCl+Fe(OH)3↓
D.CO2+Ca(OH)2==CaCO3↓+H2O
B
课堂巩固
2.氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图如下。下列说法不正确的是( )
A.盐酸中存在的微观粒子有水分子和氯化氢分子
B.该反应的微观实质是H+和OH-结合
生成水分子
C.Na+和Cl-在该反应过程中没有被消耗
D.恰好完全反应时,溶液呈中性
A
课堂巩固
3.常温下,将10mL5%NaOH溶液逐滴加入盛有5mL5%稀盐酸(含2滴酚酞溶液)的锥形瓶中,边滴边振荡。下列有关说法正确的是( )
A.滴加过程中,锥形瓶内溶液中Na+的数目不断增加
B.滴加过程中,溶液恰好由无色变为红色时,溶液pH为7
C.滴加过程中,锥形瓶内溶液温度不断升高
D.滴加结束后,取少量溶液蒸干,所得白色固体是NaCl
A
课堂巩固
4.如图所示的U形管中是滴有酚酞溶液的蒸
馏水,向左、右两管中同时逐滴滴加一定量
的氢氧化钠稀溶液和稀盐酸。
(1)开始时, (填“左”或“右”)
管溶液呈红色。
(2)充分反应后U形管中溶液全部呈无色,此时溶液中的溶质除酚酞外一定含有 ,可能含有 。
左
NaCl
HCl
谢 谢 观 看
同课章节目录
