2.1 空气的组成 课件 (共14张PPT) 2024-2025学年化学沪教版九年级上册
文档属性
| 名称 | 2.1 空气的组成 课件 (共14张PPT) 2024-2025学年化学沪教版九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 716.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-19 00:00:00 | ||
图片预览






文档简介
(共14张PPT)
第2章 空气与水资源
第1节 空气的组成
人类对空气组成的认识经历了漫长的历史过程。18世纪中叶以前,人们一直把空气看作是单一成分的物质。随着科学的发展,人们对空气的认识逐步深入。根据现有的知识,你能告诉大家,空气中有哪些成分吗?如何证明这些物质的存在?
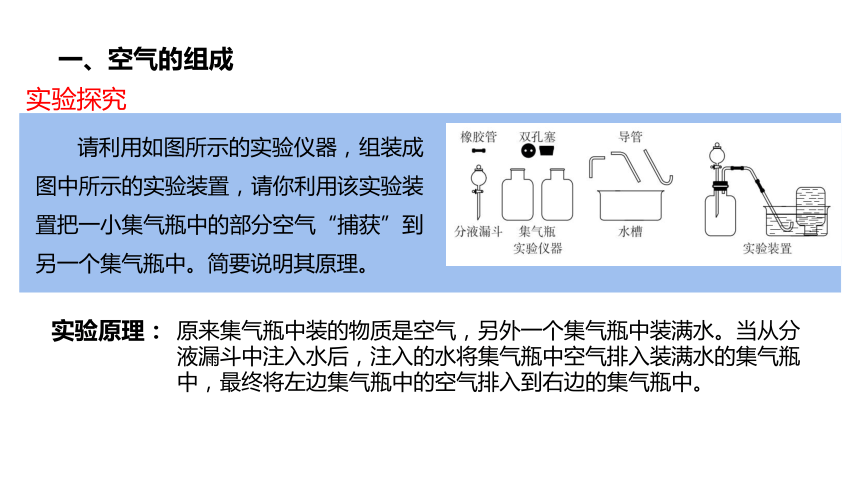
请利用如图所示的实验仪器,组装成图中所示的实验装置,请你利用该实验装置把一小集气瓶中的部分空气“捕获”到另一个集气瓶中。简要说明其原理。
一、空气的组成
实验原理:
原来集气瓶中装的物质是空气,另外一个集气瓶中装满水。当从分液漏斗中注入水后,注入的水将集气瓶中空气排入装满水的集气瓶中,最终将左边集气瓶中的空气排入到右边的集气瓶中。
实验探究
为了成功地进行实验,首先应检查装置的气密性,确保装置不漏气,那么如何检查装置的气密性呢?
一、空气的组成
检查装置气密性的方法:
导管放入水中,形成了密闭体系,用手握住试管后,试管内温度上升,导致气压变大,气体从导管口逸出,产生气泡;松开手后,温度恢复,试管内气体减少,导致气压变小,导管中会形成一段水柱,说明装置的气密性良好。
1.将集气瓶的容积划分为5等份并加以标记。
2.将橡胶管上的止水夹夹紧,在燃烧匙内装入足量的红磷,在酒精灯火焰上点燃后,将燃烧匙迅速伸入集气瓶内,塞紧橡皮塞,观察到什么现象?红磷在集气瓶中燃烧,消耗了什么气体?
实验现象:
红磷燃烧时发出黄白色火焰,同时放出热量,随着反应的进行,瓶内充满白烟。
实验分析:
红磷燃烧,消耗的气体是氧气。
一、空气的组成
测定空气中氧气的含量
观察思考
3.待火焰熄灭后,观察红磷是否有剩余。待集气瓶冷却到室温后,把导管插入盛水的烧杯中,打开止水夹,观察到什么现象?
4.依据实验现象推断空气中氧气所占的体积分数。
实验现象:
待集气瓶冷却到室温时,打开止水夹,在大气压的作用下,烧杯中的水被压入集气瓶中,进入瓶内的水的体积约占集气瓶容积的1/5。
实验分析:
空气中的氧气约占空气总体积的1/5。
一、空气的组成
测定空气中氧气的含量
误差分析
红磷的量不足
装置漏气
未等装置冷却至室温就打开止水夹
点燃的红磷没有迅速伸入集气瓶中
思考
能否用蜡烛代替红磷进行相同实验,为什么?
不能用蜡烛来代替红磷。因为蜡烛燃烧的产物中有气体,可弥补被消耗的氧气的体积使密闭体系内气体的压强变化不大。
一、空气的组成
测定空气中氧气的含量
实验开始时没有夹或没夹紧止水夹
由两种或两种以上物质混合而成
空 气
糖水
食盐水
……
只由一种物质组成
氧 气
氮 气
二氧化碳
水
……
混合物:
纯净物:
一、空气的组成
二、氮气和稀有气体
氮气
氮气是空气中含量最多的气体。氮气无色、无气味,常温、常压下1体积水中大约只能溶解0.02体积的氮气。氮气在极低温条件下加压才能液化成无色液体,液氮通常储存于黑色钢瓶中。
二、氮气和稀有气体
稀有气体
稀有气体在空气中的含量不高,在通常条件下不与其他物质发生化学反应。稀有气体有着重要的应用,如氦气可用来填充电子管、气球、气体温度计和潜水服,也可用作焊接金属的保护气;氖气常被用作霓虹灯的填充气,放电时能发出橘红色的光;氩气可用作电弧焊接的保护气等。
课堂小结
第一节 空气的组成
1.检查装置气密性的方法
2.测定空气中氧气含量
(1)实验原理 (2)实验装置 (3)实验步骤
(4)实验结论 (5)实验反思
3.纯净物和混合物
4.氮气和稀有气体的性质和用途
课堂巩固
1.空气是一种宝贵的自然资源。下列有关空气的说法中错误的是( )
A.洁净的空气仍然属于混合物
B.食品包装中充入氮气可以防腐
C.稀有气体可作焊接金属的保护气
D.空气中氮气的质量分数约为78%
D
课堂巩固
2.判断下列物质中哪些是纯净物,哪些是混合物,把序号填入对应的横线中。
①雨水 ②煤 ③生理盐水 ④氮气 ⑤牛奶 ⑥冰水 ⑦二氧化碳⑧铁 ⑨洁净的空气
纯净物: ;混合物: 。
④⑥⑦⑧
①②③⑤⑨
谢 谢 观 看
第2章 空气与水资源
第1节 空气的组成
人类对空气组成的认识经历了漫长的历史过程。18世纪中叶以前,人们一直把空气看作是单一成分的物质。随着科学的发展,人们对空气的认识逐步深入。根据现有的知识,你能告诉大家,空气中有哪些成分吗?如何证明这些物质的存在?
请利用如图所示的实验仪器,组装成图中所示的实验装置,请你利用该实验装置把一小集气瓶中的部分空气“捕获”到另一个集气瓶中。简要说明其原理。
一、空气的组成
实验原理:
原来集气瓶中装的物质是空气,另外一个集气瓶中装满水。当从分液漏斗中注入水后,注入的水将集气瓶中空气排入装满水的集气瓶中,最终将左边集气瓶中的空气排入到右边的集气瓶中。
实验探究
为了成功地进行实验,首先应检查装置的气密性,确保装置不漏气,那么如何检查装置的气密性呢?
一、空气的组成
检查装置气密性的方法:
导管放入水中,形成了密闭体系,用手握住试管后,试管内温度上升,导致气压变大,气体从导管口逸出,产生气泡;松开手后,温度恢复,试管内气体减少,导致气压变小,导管中会形成一段水柱,说明装置的气密性良好。
1.将集气瓶的容积划分为5等份并加以标记。
2.将橡胶管上的止水夹夹紧,在燃烧匙内装入足量的红磷,在酒精灯火焰上点燃后,将燃烧匙迅速伸入集气瓶内,塞紧橡皮塞,观察到什么现象?红磷在集气瓶中燃烧,消耗了什么气体?
实验现象:
红磷燃烧时发出黄白色火焰,同时放出热量,随着反应的进行,瓶内充满白烟。
实验分析:
红磷燃烧,消耗的气体是氧气。
一、空气的组成
测定空气中氧气的含量
观察思考
3.待火焰熄灭后,观察红磷是否有剩余。待集气瓶冷却到室温后,把导管插入盛水的烧杯中,打开止水夹,观察到什么现象?
4.依据实验现象推断空气中氧气所占的体积分数。
实验现象:
待集气瓶冷却到室温时,打开止水夹,在大气压的作用下,烧杯中的水被压入集气瓶中,进入瓶内的水的体积约占集气瓶容积的1/5。
实验分析:
空气中的氧气约占空气总体积的1/5。
一、空气的组成
测定空气中氧气的含量
误差分析
红磷的量不足
装置漏气
未等装置冷却至室温就打开止水夹
点燃的红磷没有迅速伸入集气瓶中
思考
能否用蜡烛代替红磷进行相同实验,为什么?
不能用蜡烛来代替红磷。因为蜡烛燃烧的产物中有气体,可弥补被消耗的氧气的体积使密闭体系内气体的压强变化不大。
一、空气的组成
测定空气中氧气的含量
实验开始时没有夹或没夹紧止水夹
由两种或两种以上物质混合而成
空 气
糖水
食盐水
……
只由一种物质组成
氧 气
氮 气
二氧化碳
水
……
混合物:
纯净物:
一、空气的组成
二、氮气和稀有气体
氮气
氮气是空气中含量最多的气体。氮气无色、无气味,常温、常压下1体积水中大约只能溶解0.02体积的氮气。氮气在极低温条件下加压才能液化成无色液体,液氮通常储存于黑色钢瓶中。
二、氮气和稀有气体
稀有气体
稀有气体在空气中的含量不高,在通常条件下不与其他物质发生化学反应。稀有气体有着重要的应用,如氦气可用来填充电子管、气球、气体温度计和潜水服,也可用作焊接金属的保护气;氖气常被用作霓虹灯的填充气,放电时能发出橘红色的光;氩气可用作电弧焊接的保护气等。
课堂小结
第一节 空气的组成
1.检查装置气密性的方法
2.测定空气中氧气含量
(1)实验原理 (2)实验装置 (3)实验步骤
(4)实验结论 (5)实验反思
3.纯净物和混合物
4.氮气和稀有气体的性质和用途
课堂巩固
1.空气是一种宝贵的自然资源。下列有关空气的说法中错误的是( )
A.洁净的空气仍然属于混合物
B.食品包装中充入氮气可以防腐
C.稀有气体可作焊接金属的保护气
D.空气中氮气的质量分数约为78%
D
课堂巩固
2.判断下列物质中哪些是纯净物,哪些是混合物,把序号填入对应的横线中。
①雨水 ②煤 ③生理盐水 ④氮气 ⑤牛奶 ⑥冰水 ⑦二氧化碳⑧铁 ⑨洁净的空气
纯净物: ;混合物: 。
④⑥⑦⑧
①②③⑤⑨
谢 谢 观 看
同课章节目录
