2.3 氧气的制备 课件(共24张PPT) 2024-2025学年化学沪教版九年级上册
文档属性
| 名称 | 2.3 氧气的制备 课件(共24张PPT) 2024-2025学年化学沪教版九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-20 14:29:01 | ||
图片预览






文档简介
(共24张PPT)
第2章 空气与水资源
第3节 氧气的制备
交流讨论
在分离液态空气制取氧气时,一般先将空气除尘,再除去二氧化碳和水蒸气等,获得净化后的气体混合物。已知在1.01×105Pa时,氧气的沸点为-183℃,氮气的沸点为-196℃。请和同学讨论并设计从上述气体混合物中获取氧气的方案。
在低温条件下压缩空气使其液化。随后控制温度使沸点较低的液态氮先从液态空气中分离出来,剩下的就是沸点较高的液态氧。
方案
原理
利用氮气和氧气的沸点不同
实验室制取氧气
下列哪些物质可以作为制取氧气的原料?
KMnO4
H2O2
CH4
NH3
KClO3
NaCl
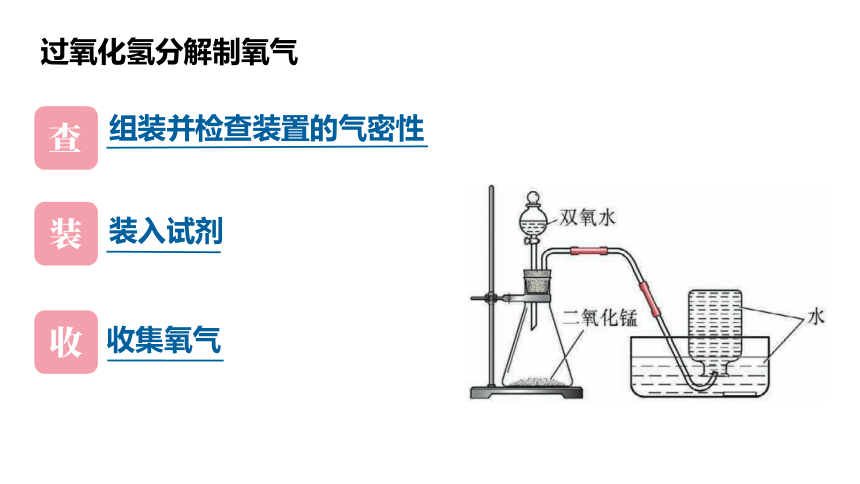
实验室制取氧气
过氧化氢分解制氧气
过氧化氢 水 + 氧气
二氧化锰
物质性质:
制备原理:
过氧化氢溶液--无色液体
二氧化锰--黑色固体、不溶于水
过氧化氢分解制氧气
收集装置
排水法
检验方法
验满方法
将带火星的木条伸入集气瓶内,若木条复燃,则为氧气
瓶中无水,瓶口有大气泡向外冒出
过氧化氢分解制氧气
收集装置
向上排空气法
检验方法
验满方法
将带火星的木条伸入集气瓶内,若木条复燃,则为氧气
将带火星的木条伸到集气瓶口,若木条复燃,则氧气已集满
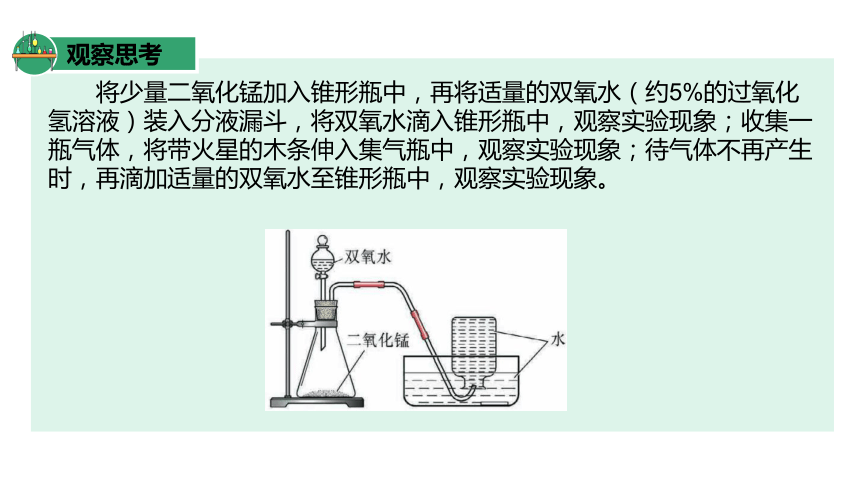
观察思考
将少量二氧化锰加入锥形瓶中,再将适量的双氧水(约5%的过氧化氢溶液)装入分液漏斗,将双氧水滴入锥形瓶中,观察实验现象;收集一瓶气体,将带火星的木条伸入集气瓶中,观察实验现象;待气体不再产生时,再滴加适量的双氧水至锥形瓶中,观察实验现象。
过氧化氢分解制氧气
组装并检查装置的气密性
装入试剂
收集氧气
探究新知
在化学反应中能增大化学反应速率,但本身的质量和化学性质在化学反应前后都没有发生变化的物质称为该反应的催化剂。
催化剂
高锰酸钾制氧气
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
物质性质:
制备原理:
高锰酸钾--紫黑色固体、能溶于水
基础实验
在老师的帮助下,根据“方法导引”中的实验注意事项,完成下列实验,观察实验现象。
【实验1】利用下图的实验装置,加热装有少量高锰酸钾的试管,收集一瓶氧气,将带有火星的木条伸入集气瓶中检验生成的气体。
高锰酸钾制氧气
实验步骤
①组装仪器、检查装置气密性
②装入高锰酸钾、在试管口放一团棉花
将导管的一端放入水中,用手紧握试管,若导管口有气泡冒出,移开手后过一段时间,导管中会形成一段水柱,则装置的气密性良好。
防止KMnO4粉末进入导管造成堵塞或污染水槽。
高锰酸钾制氧气
实验步骤
③固定试管
Q1:试管内的导管稍露出橡皮塞
有利于气体的收集
Q2:试管口略向下倾斜
防止冷凝水倒流使试管炸裂
Q3:夹在中上部
距试管口约1/3处
高锰酸钾制氧气
实验步骤
④点燃酒精灯,加热试管
Q:先预热,再用外焰对药品部位加热
防止受热不均使试管炸裂
Q1:开始收集时机
导管口有气泡连续、均匀冒出时开始收集
Q2:停止收集时机
瓶内无水,瓶口有大气泡向外冒出时停止收集
⑤点燃酒精灯,加热试管
高锰酸钾制氧气
实验步骤
⑥在水中盖上玻璃片,取出集气瓶正放在桌面上,将导管移出水面
Q:在水中盖上玻璃片,取出集气瓶正放在桌面上
防止气体外逸
Q:先撤导管后熄灭酒精灯
防止水倒吸,使试管炸裂
⑦熄灭酒精灯
氯酸钾制氧气
物理性质:
制备原理:
氯酸钾--白色固体,能溶于水
二氧化锰--黑色固体、不溶于水
氯酸钾 氯化钾 + 氧气
二氧化锰
加热
探究新知
【讨论】三个制取氧气的反应有什么共同特征?与化合反应有什么不同?
高锰酸钾 锰酸钾+二氧化锰+氧气
加热
过氧化氢 水 + 氧气
二氧化锰
氯酸钾 氯化钾 + 氧气
二氧化锰
加热
探究新知
分解反应
分解反应的特点:一变多
由一种物质生成两种或两种以上新物质的反应,称为分解反应。
表示: AB→A+B
分解反应和化合反应都是化学反应的基本类型
课堂小结
课堂巩固
1.下列反应中既不是化合反应,又不是分解反应的是( )
A.加热氯酸钾制氧气 B.木炭在氧气中燃烧
C.石蜡在空气中燃烧 D.磷在空气中燃烧
C
课堂巩固
2.实验室制取氧气的常用如图所示装置。
请回答下列问题。
(1)写出图中标注编号的仪器的名称:① ;② 。
(2)写出实验室用B装置制取氧气反应的文字表达式: ;该装置的优点是 。
铁架台
锥形瓶
过氧化氢 水 + 氧气
二氧化锰
节能
课堂巩固
2.实验室制取氧气的常用装置如图所示。
请回答下列问题。
(3)若用氯酸钾和二氧化锰混合物共热
制取氧气,并用排水法收集氧气,实验操
作步骤如下:①点燃酒精灯并收集气体;②熄灭酒精灯;③加入试剂并固定仪器;④检查装置的气密性;⑤从水槽中撤出导管。正确的操作顺序是 (填序号)。
④③①⑤②
谢 谢 观 看
第2章 空气与水资源
第3节 氧气的制备
交流讨论
在分离液态空气制取氧气时,一般先将空气除尘,再除去二氧化碳和水蒸气等,获得净化后的气体混合物。已知在1.01×105Pa时,氧气的沸点为-183℃,氮气的沸点为-196℃。请和同学讨论并设计从上述气体混合物中获取氧气的方案。
在低温条件下压缩空气使其液化。随后控制温度使沸点较低的液态氮先从液态空气中分离出来,剩下的就是沸点较高的液态氧。
方案
原理
利用氮气和氧气的沸点不同
实验室制取氧气
下列哪些物质可以作为制取氧气的原料?
KMnO4
H2O2
CH4
NH3
KClO3
NaCl
实验室制取氧气
过氧化氢分解制氧气
过氧化氢 水 + 氧气
二氧化锰
物质性质:
制备原理:
过氧化氢溶液--无色液体
二氧化锰--黑色固体、不溶于水
过氧化氢分解制氧气
收集装置
排水法
检验方法
验满方法
将带火星的木条伸入集气瓶内,若木条复燃,则为氧气
瓶中无水,瓶口有大气泡向外冒出
过氧化氢分解制氧气
收集装置
向上排空气法
检验方法
验满方法
将带火星的木条伸入集气瓶内,若木条复燃,则为氧气
将带火星的木条伸到集气瓶口,若木条复燃,则氧气已集满
观察思考
将少量二氧化锰加入锥形瓶中,再将适量的双氧水(约5%的过氧化氢溶液)装入分液漏斗,将双氧水滴入锥形瓶中,观察实验现象;收集一瓶气体,将带火星的木条伸入集气瓶中,观察实验现象;待气体不再产生时,再滴加适量的双氧水至锥形瓶中,观察实验现象。
过氧化氢分解制氧气
组装并检查装置的气密性
装入试剂
收集氧气
探究新知
在化学反应中能增大化学反应速率,但本身的质量和化学性质在化学反应前后都没有发生变化的物质称为该反应的催化剂。
催化剂
高锰酸钾制氧气
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
物质性质:
制备原理:
高锰酸钾--紫黑色固体、能溶于水
基础实验
在老师的帮助下,根据“方法导引”中的实验注意事项,完成下列实验,观察实验现象。
【实验1】利用下图的实验装置,加热装有少量高锰酸钾的试管,收集一瓶氧气,将带有火星的木条伸入集气瓶中检验生成的气体。
高锰酸钾制氧气
实验步骤
①组装仪器、检查装置气密性
②装入高锰酸钾、在试管口放一团棉花
将导管的一端放入水中,用手紧握试管,若导管口有气泡冒出,移开手后过一段时间,导管中会形成一段水柱,则装置的气密性良好。
防止KMnO4粉末进入导管造成堵塞或污染水槽。
高锰酸钾制氧气
实验步骤
③固定试管
Q1:试管内的导管稍露出橡皮塞
有利于气体的收集
Q2:试管口略向下倾斜
防止冷凝水倒流使试管炸裂
Q3:夹在中上部
距试管口约1/3处
高锰酸钾制氧气
实验步骤
④点燃酒精灯,加热试管
Q:先预热,再用外焰对药品部位加热
防止受热不均使试管炸裂
Q1:开始收集时机
导管口有气泡连续、均匀冒出时开始收集
Q2:停止收集时机
瓶内无水,瓶口有大气泡向外冒出时停止收集
⑤点燃酒精灯,加热试管
高锰酸钾制氧气
实验步骤
⑥在水中盖上玻璃片,取出集气瓶正放在桌面上,将导管移出水面
Q:在水中盖上玻璃片,取出集气瓶正放在桌面上
防止气体外逸
Q:先撤导管后熄灭酒精灯
防止水倒吸,使试管炸裂
⑦熄灭酒精灯
氯酸钾制氧气
物理性质:
制备原理:
氯酸钾--白色固体,能溶于水
二氧化锰--黑色固体、不溶于水
氯酸钾 氯化钾 + 氧气
二氧化锰
加热
探究新知
【讨论】三个制取氧气的反应有什么共同特征?与化合反应有什么不同?
高锰酸钾 锰酸钾+二氧化锰+氧气
加热
过氧化氢 水 + 氧气
二氧化锰
氯酸钾 氯化钾 + 氧气
二氧化锰
加热
探究新知
分解反应
分解反应的特点:一变多
由一种物质生成两种或两种以上新物质的反应,称为分解反应。
表示: AB→A+B
分解反应和化合反应都是化学反应的基本类型
课堂小结
课堂巩固
1.下列反应中既不是化合反应,又不是分解反应的是( )
A.加热氯酸钾制氧气 B.木炭在氧气中燃烧
C.石蜡在空气中燃烧 D.磷在空气中燃烧
C
课堂巩固
2.实验室制取氧气的常用如图所示装置。
请回答下列问题。
(1)写出图中标注编号的仪器的名称:① ;② 。
(2)写出实验室用B装置制取氧气反应的文字表达式: ;该装置的优点是 。
铁架台
锥形瓶
过氧化氢 水 + 氧气
二氧化锰
节能
课堂巩固
2.实验室制取氧气的常用装置如图所示。
请回答下列问题。
(3)若用氯酸钾和二氧化锰混合物共热
制取氧气,并用排水法收集氧气,实验操
作步骤如下:①点燃酒精灯并收集气体;②熄灭酒精灯;③加入试剂并固定仪器;④检查装置的气密性;⑤从水槽中撤出导管。正确的操作顺序是 (填序号)。
④③①⑤②
谢 谢 观 看
同课章节目录
