2025人教版高中化学选择性必修2强化练习题--题型整合练 分子结构与物质的性质(含解析)
文档属性
| 名称 | 2025人教版高中化学选择性必修2强化练习题--题型整合练 分子结构与物质的性质(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 602.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-24 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学选择性必修2
题型整合练 分子结构与物质的性质
题型1 元素化合物中粒子的结构与性质
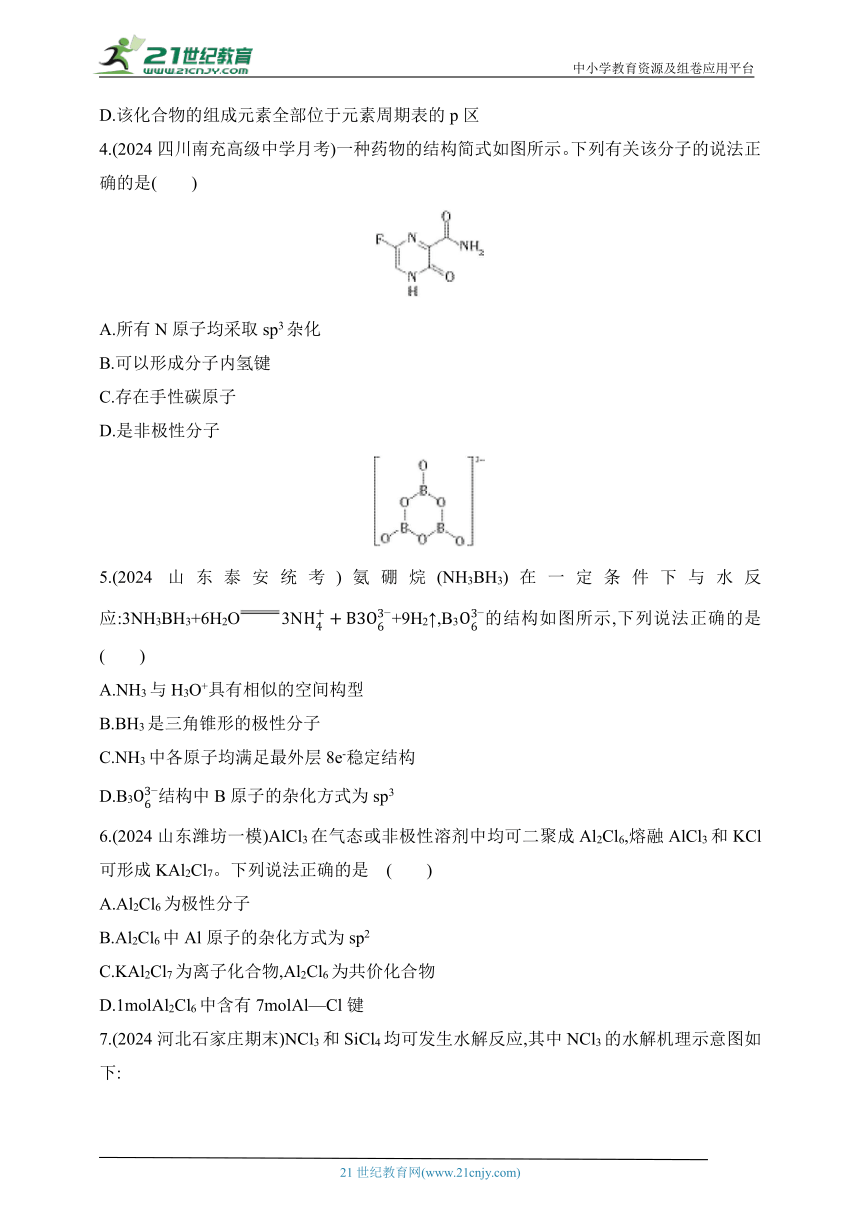
1.(2024福建福安第一中学检测)SiCl4可发生水解反应,机理如图:
下列说法正确的是( )
A.将用毛皮摩擦过的橡胶棒靠近SiCl4液流,液流会发生偏转
B.中间体中的Si采取sp3杂化
C.键的极性大小比较:Si—O>Si—C
D.中间体SiCl4(H2O)生成的过程中有极性键的断裂与形成
2.(2024贵州贵阳一模)甲烷催化重整法制甲酸的物质转化过程如图所示。下列有关分析错误的是( )
A.反应过程中,既有极性键的断裂与形成,又有非极性键的形成与断裂
B.物质转化总反应为CH4+2H2OHCOOH+3H2
C.反应Ⅱ反应前后,物质中所含σ键的总数未变
D.CH4、CO2、H2均为非极性分子,HCOOH、H2O均为极性分子
3.(2024安徽合肥统考)离子液体可作溶剂、电解质等。1-正丁基-3-甲基咪唑六氟磷酸盐是一种离子液体,结构简式如图,下列关于它的叙述正确的是( )
或
A.含有的C、N、P元素均为sp3杂化
B.该盐属于含共价键的离子化合物
C.电负性:F>N>H>C
D.该化合物的组成元素全部位于元素周期表的p区
4.(2024四川南充高级中学月考)一种药物的结构简式如图所示。下列有关该分子的说法正确的是( )
A.所有N原子均采取sp3杂化
B.可以形成分子内氢键
C.存在手性碳原子
D.是非极性分子
5.(2024山东泰安统考)氨硼烷(NH3BH3)在一定条件下与水反应:3NH3BH3+6H2O3N+9H2↑,B3的结构如图所示,下列说法正确的是( )
A.NH3与H3O+具有相似的空间构型
B.BH3是三角锥形的极性分子
C.NH3中各原子均满足最外层8e-稳定结构
D.B3结构中B原子的杂化方式为sp3
6.(2024山东潍坊一模)AlCl3在气态或非极性溶剂中均可二聚成Al2Cl6,熔融AlCl3和KCl可形成KAl2Cl7。下列说法正确的是 ( )
A.Al2Cl6为极性分子
B.Al2Cl6中Al原子的杂化方式为sp2
C.KAl2Cl7为离子化合物,Al2Cl6为共价化合物
D.1molAl2Cl6中含有7molAl—Cl键
7.(2024河北石家庄期末)NCl3和SiCl4均可发生水解反应,其中NCl3的水解机理示意图如下:
下列说法正确的是( )
A.NCl3和SiCl4均为极性分子
B.NCl3和NH3中的N均为sp2杂化
C.SiCl4中原子均满足8电子稳定结构
D.NHCl2和NH3均不能与H2O形成氢键
题型2 元素推断中分子的结构与性质
8.(2024山东德州期末)周期表前四周期的元素X、Y、Z、Q、R原子序数依次增大。X的核外电子总数与其周期序数相同,基态Y原子核外有7种运动状态不同的电子,Z的价层电子中的未成对电子有2个,Q与Z同族,R的最外层只有1个电子,内层全充满。下列判断正确的是( )
A.X2Z2是非极性分子
B.第一电离能:Z>Y>Q
C.R为金属元素,位于s区
D.QZ3分子空间构型为平面三角形
9.(2024吉林长春期末)某种离子液体的结构如图所示,X、Y、Z、M、Q为原子序数依次增大的五种短周期非金属元素,Z的原子序数等于X、Y原子序数之和,Q为非金属性最强的元素。
下列说法正确的是( )
A.MX3的键角大于ZX4的键角
B.Y的VSEPR模型为正四面体形
C.YQ3是极性分子,MQ3是非极性分子
D.M2的键能小于Q2的键能
10.(2024江西中学生标准学术能力诊断性测试)常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH和原子半径、原子序数的关系如图所示。下列说法错误的是( )
A.电负性:Z>Y>X
B.W和X形成的化合物XW3中含有离子键和共价键
C.简单氢化物的稳定性:Z>Y
D.Y2Z2为非极性分子,YZ2为极性分子,二者中的Y原子都是sp3杂化
11.(2024福建南平统考)A、B、C、D、E分别代表五种短周期主族元素,且原子序数依次增大,已知B的最外层电子排布式是ns2npn+1;C的p轨道上未成对的电子比B少一个;D的二价阳离子与C的阴离子具有相同的电子层结构;E与D同周期且E在该周期主族元素中原子半径最小;B与A元素能形成一种具有刺激性气味的气体。
(1)B与E形成的化合物中各原子最外层都达到8电子稳定结构的分子属于 (填“极性”或“非极性”)分子。
(2)元素B的最高价氧化物的水化物的含氧酸根离子中心原子的杂化类型为 ,空间构型是 。
(3)B元素的简单氢化物的沸点 (填“高于”或“低于”)E元素的氢化物,理由是 。
答案与分层梯度式解析
题型整合练 分子结构与物质的性质
1.C
电负性:O>C,则键的极性:Si—O>Si—C,C正确。
解题技法
由杂化轨道理论分析,中间体SiCl4(H2O)中的Si有5个杂化轨道,推测中间体SiCl4(H2O)中的Si采取的杂化类型可能为sp3d。
2.C
分析图可知,总反应为CH4+2H2OHCOOH+3H2,B正确;反应Ⅱ是CH4+2H2OCO2+4H2,假设1molCH4与2molH2O反应生成1molCO2和4molH2,则反应前、后σ键总物质的量分别为8mol、6mol,所含σ键的总数改变,C错误;CH4、CO2、H2分子空间结构对称,均为非极性分子,HCOOH、H2O分子空间结构不对称,均为极性分子,D正确。
3.B 该盐中C原子的杂化类型有sp2、sp3,A错误;该盐中含阴、阳离子,属于离子化合物,离子内部含有共价键,B正确;非金属性:F>N>C>H,电负性:F>N>C>H,C错误;H位于s区,C、N、F、P位于p区,D错误。
4.B
该有机物无饱和碳原子,不存在手性碳原子,C错误;该分子结构不对称,是极性分子,D错误。
5.A NH3与H3O+空间结构都是三角锥形,A正确;BH3是平面三角形的非极性分子,B错误;NH3中N原子满足最外层8e-稳定结构,H原子最外层只有2个电子,C错误;通过B3的结构图可知,B形成3个σ键,无孤电子对,价层电子对数为3,是sp2杂化,D错误。
6.C Al2Cl6为对称结构(),为非极性分子,每个Al原子形成4个共价键,为sp3杂化,1molAl2Cl6中含有8molAl—Cl键,A、B、D错误;KAl2Cl7是由K+与[Al2Cl7]-形成的离子化合物,Al2Cl6为共价化合物,C正确。
7.C NCl3是三角锥形的极性分子,SiCl4为正四面体形的非极性分子,A错误;NCl3和NH3中心原子的价层电子对数均为3+=4,是sp3杂化,B错误;SiCl4的电子式为····,各原子都达到8电子稳定结构,C正确;NHCl2和NH3分子中均存在N—H键,均能与水形成氢键,D错误。
8.D 周期表前四周期的元素X、Y、Z、Q、R原子序数依次增大,X的核外电子总数与其周期序数相同,则X为H;基态Y原子核外有7种运动状态不同的电子,则Y为N;R的最外层只有1个电子,内层全充满,则R为Cu;Z的价层电子中的未成对电子有2个,Q与Z同族,原子序数均小于Cu,则Z为O,Q为S。H2O2是极性分子,A错误;第一电离能:N>O,B错误;Cu位于ds区,C错误;SO3分子空间构型为平面三角形,D正确。
9.B X、Y、Z、M、Q为原子序数依次增大的五种短周期非金属元素,Q为非金属性最强的元素,则Q为F元素;由Z的原子序数等于X、Y原子序数之和及阴、阳离子的结构中X、Y、Z、M形成的共价键数目可知X为H元素、Y为B元素、Z为C元素、M为N元素。NH3、CH4分子中中心原子的价层电子对数均为4,孤电子对数分别为1、0,键角:CH4>NH3,A错误;B中心原子的价层电子对数为4,VSEPR模型为正四面体形,B正确;BF3是非极性分子,NF3是三角锥形的极性分子,C错误;N2分子中的键能大于氟气分子中F—F键的键能,D错误。
方法规律
中心原子杂化类型相同的,孤电子对数越多,对成键电子对的斥力越大,分子的键角越小。
10.D 常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH分别为2、12、小于2、2,原子序数依次增大,X的原子半径最大,W的原子半径最小,Y的原子半径小于X、大于Z,则W为N元素、X为Na元素、Z为Cl元素,Y为S元素。元素的非金属性越强电负性越大,电负性:Cl>S>Na,A正确;NaN3中含有离子键和共价键,B正确;非金属性Cl>S,则简单氢化物稳定性:HCl>H2S,C正确;S2Cl2为极性分子,SCl2为V形结构的极性分子,二者中的S原子都是sp3杂化,D错误。
11.答案 (1)极性 (2)sp2 平面三角形 (3)高于 氨分子间可以形成氢键,HCl分子间不能形成氢键
解析 B为短周期元素,如果n=2,B的最外层电子排布式是2s22p3,则B为N元素;如果n=3,B的最外层电子排布式是3s23p4,则B为S元素,根据原子序数的大小,若B为S,则E元素不是短周期元素,不符合题意,则B为N元素;C的p轨道上未成对的电子比B少一个,则C的p轨道上未成对的电子有2个,且能形成阴离子,D的二价阳离子与C的阴离子具有相同的电子层结构,则C为O元素,D为Mg元素;E与D同周期且E在该周期主族元素中原子半径最小,则E为Cl元素;B与A能形成一种具有刺激性气味的气体,该气体为NH3,则A为H。
(1)N原子最外层电子数为5,Cl原子最外层电子数为7,则N与Cl形成的化合物中各原子最外层都达到8电子稳定结构的分子为NCl3,属于极性分子。(2)元素B的最高价氧化物的水化物为HNO3,N中心原子N原子的价层电子对数为3+=3,N的杂化类型为sp2,N空间构型是平面三角形。(3)B元素的简单氢化物为NH3,E元素的氢化物为HCl,氨分子间可以形成氢键,HCl分子间不能形成氢键,故NH3沸点高于HCl。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学选择性必修2
题型整合练 分子结构与物质的性质
题型1 元素化合物中粒子的结构与性质
1.(2024福建福安第一中学检测)SiCl4可发生水解反应,机理如图:
下列说法正确的是( )
A.将用毛皮摩擦过的橡胶棒靠近SiCl4液流,液流会发生偏转
B.中间体中的Si采取sp3杂化
C.键的极性大小比较:Si—O>Si—C
D.中间体SiCl4(H2O)生成的过程中有极性键的断裂与形成
2.(2024贵州贵阳一模)甲烷催化重整法制甲酸的物质转化过程如图所示。下列有关分析错误的是( )
A.反应过程中,既有极性键的断裂与形成,又有非极性键的形成与断裂
B.物质转化总反应为CH4+2H2OHCOOH+3H2
C.反应Ⅱ反应前后,物质中所含σ键的总数未变
D.CH4、CO2、H2均为非极性分子,HCOOH、H2O均为极性分子
3.(2024安徽合肥统考)离子液体可作溶剂、电解质等。1-正丁基-3-甲基咪唑六氟磷酸盐是一种离子液体,结构简式如图,下列关于它的叙述正确的是( )
或
A.含有的C、N、P元素均为sp3杂化
B.该盐属于含共价键的离子化合物
C.电负性:F>N>H>C
D.该化合物的组成元素全部位于元素周期表的p区
4.(2024四川南充高级中学月考)一种药物的结构简式如图所示。下列有关该分子的说法正确的是( )
A.所有N原子均采取sp3杂化
B.可以形成分子内氢键
C.存在手性碳原子
D.是非极性分子
5.(2024山东泰安统考)氨硼烷(NH3BH3)在一定条件下与水反应:3NH3BH3+6H2O3N+9H2↑,B3的结构如图所示,下列说法正确的是( )
A.NH3与H3O+具有相似的空间构型
B.BH3是三角锥形的极性分子
C.NH3中各原子均满足最外层8e-稳定结构
D.B3结构中B原子的杂化方式为sp3
6.(2024山东潍坊一模)AlCl3在气态或非极性溶剂中均可二聚成Al2Cl6,熔融AlCl3和KCl可形成KAl2Cl7。下列说法正确的是 ( )
A.Al2Cl6为极性分子
B.Al2Cl6中Al原子的杂化方式为sp2
C.KAl2Cl7为离子化合物,Al2Cl6为共价化合物
D.1molAl2Cl6中含有7molAl—Cl键
7.(2024河北石家庄期末)NCl3和SiCl4均可发生水解反应,其中NCl3的水解机理示意图如下:
下列说法正确的是( )
A.NCl3和SiCl4均为极性分子
B.NCl3和NH3中的N均为sp2杂化
C.SiCl4中原子均满足8电子稳定结构
D.NHCl2和NH3均不能与H2O形成氢键
题型2 元素推断中分子的结构与性质
8.(2024山东德州期末)周期表前四周期的元素X、Y、Z、Q、R原子序数依次增大。X的核外电子总数与其周期序数相同,基态Y原子核外有7种运动状态不同的电子,Z的价层电子中的未成对电子有2个,Q与Z同族,R的最外层只有1个电子,内层全充满。下列判断正确的是( )
A.X2Z2是非极性分子
B.第一电离能:Z>Y>Q
C.R为金属元素,位于s区
D.QZ3分子空间构型为平面三角形
9.(2024吉林长春期末)某种离子液体的结构如图所示,X、Y、Z、M、Q为原子序数依次增大的五种短周期非金属元素,Z的原子序数等于X、Y原子序数之和,Q为非金属性最强的元素。
下列说法正确的是( )
A.MX3的键角大于ZX4的键角
B.Y的VSEPR模型为正四面体形
C.YQ3是极性分子,MQ3是非极性分子
D.M2的键能小于Q2的键能
10.(2024江西中学生标准学术能力诊断性测试)常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH和原子半径、原子序数的关系如图所示。下列说法错误的是( )
A.电负性:Z>Y>X
B.W和X形成的化合物XW3中含有离子键和共价键
C.简单氢化物的稳定性:Z>Y
D.Y2Z2为非极性分子,YZ2为极性分子,二者中的Y原子都是sp3杂化
11.(2024福建南平统考)A、B、C、D、E分别代表五种短周期主族元素,且原子序数依次增大,已知B的最外层电子排布式是ns2npn+1;C的p轨道上未成对的电子比B少一个;D的二价阳离子与C的阴离子具有相同的电子层结构;E与D同周期且E在该周期主族元素中原子半径最小;B与A元素能形成一种具有刺激性气味的气体。
(1)B与E形成的化合物中各原子最外层都达到8电子稳定结构的分子属于 (填“极性”或“非极性”)分子。
(2)元素B的最高价氧化物的水化物的含氧酸根离子中心原子的杂化类型为 ,空间构型是 。
(3)B元素的简单氢化物的沸点 (填“高于”或“低于”)E元素的氢化物,理由是 。
答案与分层梯度式解析
题型整合练 分子结构与物质的性质
1.C
电负性:O>C,则键的极性:Si—O>Si—C,C正确。
解题技法
由杂化轨道理论分析,中间体SiCl4(H2O)中的Si有5个杂化轨道,推测中间体SiCl4(H2O)中的Si采取的杂化类型可能为sp3d。
2.C
分析图可知,总反应为CH4+2H2OHCOOH+3H2,B正确;反应Ⅱ是CH4+2H2OCO2+4H2,假设1molCH4与2molH2O反应生成1molCO2和4molH2,则反应前、后σ键总物质的量分别为8mol、6mol,所含σ键的总数改变,C错误;CH4、CO2、H2分子空间结构对称,均为非极性分子,HCOOH、H2O分子空间结构不对称,均为极性分子,D正确。
3.B 该盐中C原子的杂化类型有sp2、sp3,A错误;该盐中含阴、阳离子,属于离子化合物,离子内部含有共价键,B正确;非金属性:F>N>C>H,电负性:F>N>C>H,C错误;H位于s区,C、N、F、P位于p区,D错误。
4.B
该有机物无饱和碳原子,不存在手性碳原子,C错误;该分子结构不对称,是极性分子,D错误。
5.A NH3与H3O+空间结构都是三角锥形,A正确;BH3是平面三角形的非极性分子,B错误;NH3中N原子满足最外层8e-稳定结构,H原子最外层只有2个电子,C错误;通过B3的结构图可知,B形成3个σ键,无孤电子对,价层电子对数为3,是sp2杂化,D错误。
6.C Al2Cl6为对称结构(),为非极性分子,每个Al原子形成4个共价键,为sp3杂化,1molAl2Cl6中含有8molAl—Cl键,A、B、D错误;KAl2Cl7是由K+与[Al2Cl7]-形成的离子化合物,Al2Cl6为共价化合物,C正确。
7.C NCl3是三角锥形的极性分子,SiCl4为正四面体形的非极性分子,A错误;NCl3和NH3中心原子的价层电子对数均为3+=4,是sp3杂化,B错误;SiCl4的电子式为····,各原子都达到8电子稳定结构,C正确;NHCl2和NH3分子中均存在N—H键,均能与水形成氢键,D错误。
8.D 周期表前四周期的元素X、Y、Z、Q、R原子序数依次增大,X的核外电子总数与其周期序数相同,则X为H;基态Y原子核外有7种运动状态不同的电子,则Y为N;R的最外层只有1个电子,内层全充满,则R为Cu;Z的价层电子中的未成对电子有2个,Q与Z同族,原子序数均小于Cu,则Z为O,Q为S。H2O2是极性分子,A错误;第一电离能:N>O,B错误;Cu位于ds区,C错误;SO3分子空间构型为平面三角形,D正确。
9.B X、Y、Z、M、Q为原子序数依次增大的五种短周期非金属元素,Q为非金属性最强的元素,则Q为F元素;由Z的原子序数等于X、Y原子序数之和及阴、阳离子的结构中X、Y、Z、M形成的共价键数目可知X为H元素、Y为B元素、Z为C元素、M为N元素。NH3、CH4分子中中心原子的价层电子对数均为4,孤电子对数分别为1、0,键角:CH4>NH3,A错误;B中心原子的价层电子对数为4,VSEPR模型为正四面体形,B正确;BF3是非极性分子,NF3是三角锥形的极性分子,C错误;N2分子中的键能大于氟气分子中F—F键的键能,D错误。
方法规律
中心原子杂化类型相同的,孤电子对数越多,对成键电子对的斥力越大,分子的键角越小。
10.D 常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH分别为2、12、小于2、2,原子序数依次增大,X的原子半径最大,W的原子半径最小,Y的原子半径小于X、大于Z,则W为N元素、X为Na元素、Z为Cl元素,Y为S元素。元素的非金属性越强电负性越大,电负性:Cl>S>Na,A正确;NaN3中含有离子键和共价键,B正确;非金属性Cl>S,则简单氢化物稳定性:HCl>H2S,C正确;S2Cl2为极性分子,SCl2为V形结构的极性分子,二者中的S原子都是sp3杂化,D错误。
11.答案 (1)极性 (2)sp2 平面三角形 (3)高于 氨分子间可以形成氢键,HCl分子间不能形成氢键
解析 B为短周期元素,如果n=2,B的最外层电子排布式是2s22p3,则B为N元素;如果n=3,B的最外层电子排布式是3s23p4,则B为S元素,根据原子序数的大小,若B为S,则E元素不是短周期元素,不符合题意,则B为N元素;C的p轨道上未成对的电子比B少一个,则C的p轨道上未成对的电子有2个,且能形成阴离子,D的二价阳离子与C的阴离子具有相同的电子层结构,则C为O元素,D为Mg元素;E与D同周期且E在该周期主族元素中原子半径最小,则E为Cl元素;B与A能形成一种具有刺激性气味的气体,该气体为NH3,则A为H。
(1)N原子最外层电子数为5,Cl原子最外层电子数为7,则N与Cl形成的化合物中各原子最外层都达到8电子稳定结构的分子为NCl3,属于极性分子。(2)元素B的最高价氧化物的水化物为HNO3,N中心原子N原子的价层电子对数为3+=3,N的杂化类型为sp2,N空间构型是平面三角形。(3)B元素的简单氢化物为NH3,E元素的氢化物为HCl,氨分子间可以形成氢键,HCl分子间不能形成氢键,故NH3沸点高于HCl。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
