2025人教版高中化学选择性必修2强化练习题--专题强化练2 电离能和电负性的应用(含解析)
文档属性
| 名称 | 2025人教版高中化学选择性必修2强化练习题--专题强化练2 电离能和电负性的应用(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 394.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-24 09:19:52 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学选择性必修2
专题强化练2 电离能和电负性的应用
1.(2024安徽皖中联盟期末)下表是某些元素的各级电离能数据,下列说法不正确的是( )
元素电离能/(kJ·mol-1) I1 I2 I3 I4
X 500 4600 6900 9500
Y 740 1500 7700 10500
Z 580 1800 2700 11600
A.X元素最有可能为Li
B.基态Y原子的价层电子数可能为2
C.Y元素不一定是主族元素
D.Z的氯化物的化学式可能为ZCl3
2.(2024山东菏泽期末)下表中列出了几种常见元素的电负性数值,根据表中数据结合已学知识推断下列结论不正确的是( )
元素 Na Mg Al Si P S Cl
电负性 0.9 1.2 1.5 1.8 2.1 2.5 3.0
A.F的电负性数值最大
B.K的电负性数值小于Na
C.同周期主族元素电负性越大,金属性越强
D.电负性数值在1.8左右的元素既有金属性又有非金属性
3.(2024安徽亳州期末)明矾的化学式为KAl(SO4)2·12H2O。下列说法正确的是( )
A.S元素位于第三周期第ⅤA族
B.基态铝离子的核外电子排布式为1s22s22p63s23p1
C.明矾所含的元素中,电负性最小的是K元素
D.基态氧原子的第一电离能小于基态硫原子的第一电离能
4.(2023四川绵阳期末)中国科学家首次在月球上发现新矿物,并命名为“嫦娥石”。嫦娥石发现于嫦娥五号月壤的玄武岩碎屑中,是新的磷酸盐矿物。下列说法正确的是( )
A.原子半径:r(Na)B.金属性:Ca>Mg>Na
C.第一电离能:I1(P)>I1(Mg)>I1(Na)
D.电负性:χ(P)>χ(Ca)>χ(Mg)
5.XY是由电负性相差最大的两种主族元素(放射性元素除外)所形成的化合物,下列有关XY及其组成元素的说法不正确的是( )
A.X元素的第一电离能远大于其第二电离能
B.Y元素的单质中含有共价键
C.Y元素位于元素周期表的右上方
D.XY一定是离子化合物
6.(2024河南南阳开学考)已知X、Y、Z是同一周期的主族金属元素,I为电离能。根据下表所列数据判断错误的是( )
元素电离能/(kJ·mol-1) I1 I2 I3 I4 I5
X 500 4600 6900 x 13350
Y 740 1450 7730 10540 13630
Z 580 1800 2700 11600 14830
A.X、Y、Z三种元素的常见化合价依次为+1、+2、+3
B.x值可能在9200~11050之间
C.若X、Y、Z是第三周期元素,则它们分别为Na、Al、Mg
D.Y的I1大于Z的I1,Y的I2小于Z的I2,两者关系恰好相反与ns能级上电子数目有关
7.(2023湖北荆州八县期末联考)北京工商大学苏发兵课题组合成的CuO/ZnO纳米材料能提高有机硅单体合成反应的选择性和产率。化学反应如下:
下列有关叙述错误的是( )
A.甲中氯、氢、碳的电负性依次减小
B.上述物质中有4种元素位于周期表p区
C.催化剂中第二电离能与第一电离能之差:Cu>Zn
D.基态Cu原子M层电子排布式为3s23p63d10
8.(2023吉林松花江中学期末)短周期主族元素X、Y、Z、W的原子序数依次增大,W的最外层电子数比X的最外层电子数少1,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物(ZXY)2,其结构式为。下列说法正确的是( )
A.第一电离能:Y>Z>X
B.W位于元素周期表的s区
C.电负性:Y>Z>W
D.简单气态氢化物的热稳定性:Y>Z
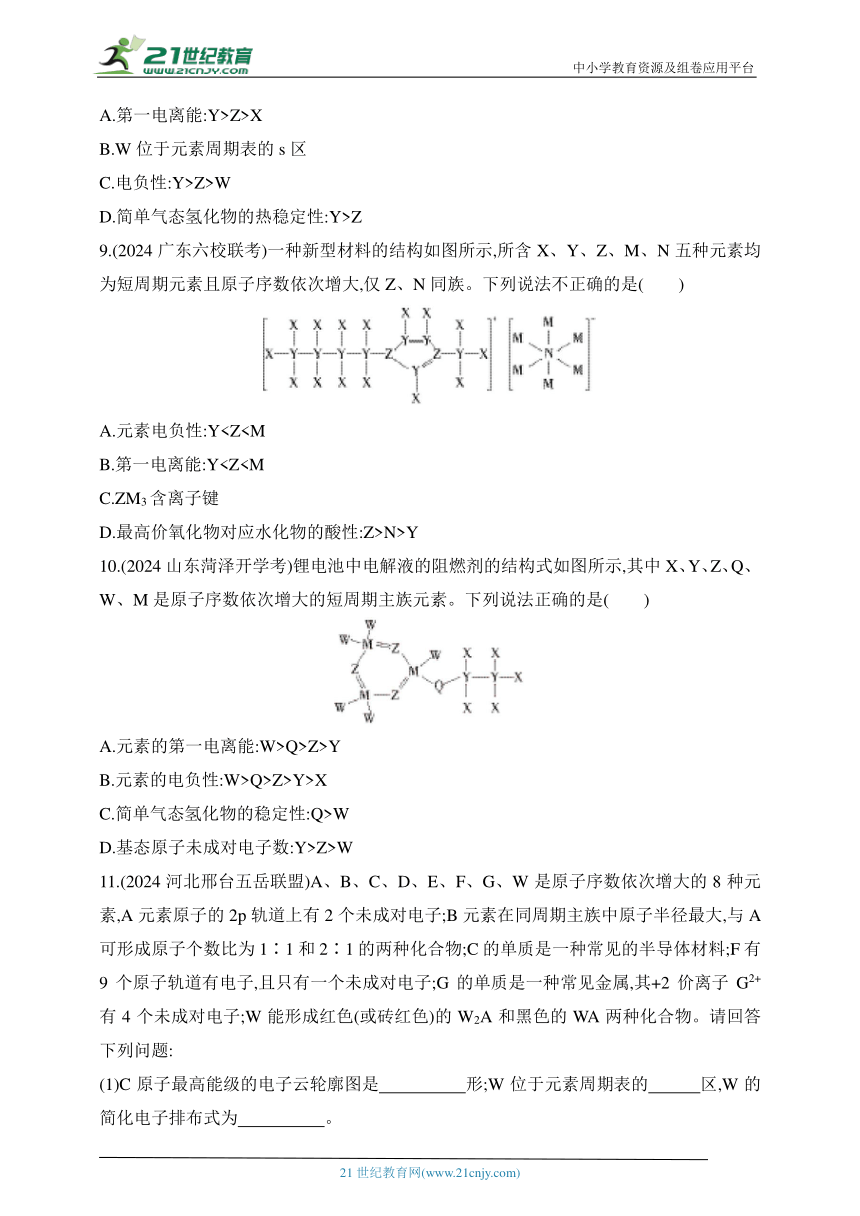
9.(2024广东六校联考)一种新型材料的结构如图所示,所含X、Y、Z、M、N五种元素均为短周期元素且原子序数依次增大,仅Z、N同族。下列说法不正确的是( )
A.元素电负性:YB.第一电离能:YC.ZM3含离子键
D.最高价氧化物对应水化物的酸性:Z>N>Y
10.(2024山东菏泽开学考)锂电池中电解液的阻燃剂的结构式如图所示,其中X、Y、Z、Q、W、M是原子序数依次增大的短周期主族元素。下列说法正确的是( )
A.元素的第一电离能:W>Q>Z>Y
B.元素的电负性:W>Q>Z>Y>X
C.简单气态氢化物的稳定性:Q>W
D.基态原子未成对电子数:Y>Z>W
11.(2024河北邢台五岳联盟)A、B、C、D、E、F、G、W是原子序数依次增大的8种元素,A元素原子的2p轨道上有2个未成对电子;B元素在同周期主族中原子半径最大,与A可形成原子个数比为1∶1和2∶1的两种化合物;C的单质是一种常见的半导体材料;F有9个原子轨道有电子,且只有一个未成对电子;G的单质是一种常见金属,其+2价离子G2+有4个未成对电子;W能形成红色(或砖红色)的W2A和黑色的WA两种化合物。请回答下列问题:
(1)C原子最高能级的电子云轮廓图是 形;W位于元素周期表的 区,W的简化电子排布式为 。
(2)D、E、F三种元素第一电离能从大到小的顺序是 (用元素符号及“>”表示)。
(3)A、B、C、D四种元素电负性由大到小的顺序是 (用元素符号及“>”表示)。
(4)G3+比G2+稳定,原因是 。
答案与分层梯度式解析
专题强化练2 电离能和电负性的应用
1.A 锂原子核外只有3个电子,没有I4,则X元素不可能为Li,A错误;Y元素的第三电离能远大于第二电离能,则Y的常见化合价为+2价,基态Y原子的价层电子数可能为2,其可能是主族元素,也可能是副族元素,B、C正确;Z元素的第四电离能远大于第三电离能,则Z的常见化合价为+3价,Z的氯化物的化学式可能为ZCl3,D正确。
方法规律
根据电离能判断元素化合价时,当In+1 In时,元素的常见化合价为+n价。
2.C 由表中数据知,第三周期主族元素随着原子序数递增,电负性逐渐增大,又知同主族元素从上到下电负性逐渐减小,所以F的电负性最大,A正确;K的电负性数值小于Na,B正确;同周期主族元素电负性越大,金属性越弱,C错误;金属元素的电负性一般小于1.8,非金属元素的电负性一般大于1.8,电负性数值在1.8左右的元素既有金属性又有非金属性,D正确。
3.C S元素位于第三周期第ⅥA族,A错误;基态Al3+核外有10个电子,电子排布式为1s22s22p6,B错误;明矾所含的元素中,K元素的金属性最强,电负性最小,C正确;同主族元素从上到下第一电离能逐渐减小,则第一电离能O>S,D错误。
4.C 钠、镁、磷为同周期元素,原子半径:r(Na)>r(Mg)>r(P),故A错误;Na、Mg是同周期元素,金属性:Na>Mg,故B错误;Na、Mg、P是同周期元素,第一电离能:I1(P)>I1(Mg)>I1(Na),故C正确;元素的非金属性越强,电负性越大,元素的非金属性:P>Mg>Ca,所以电负性χ(P)>χ(Mg)>χ(Ca),故D错误。
5.A 根据题中信息分析可知,XY为CsF。Cs原子第一电离能较小,其第二电离能远大于第一电离能,A错误;Y为F元素,其单质F2中含有共价键,B正确;Y为F元素,F元素位于元素周期表中第二周期第ⅦA族,在元素周期表右上方,C正确;CsF是由活泼的金属元素和活泼的非金属元素形成的化合物,属于离子化合物,D正确。
6.C 根据题表中数据可知,X元素的第二电离能远大于第一电离能,Y元素的第三电离能远大于第二电离能,Z元素的第四电离能远大于第三电离能,则X、Y、Z常见化合价依次为+1、+2、+3,A正确;X逐级失去的第2、3、4、5个电子处于同一电子层,相邻两级电离能差接近,I3-I2=2300,则x值可能在(6900+2300)~(13350-2300)之间,即在9200~11050之间,B正确;若X、Y、Z是第三周期元素,则它们分别为Na、Mg、Al,C错误;Y、Z分别为第ⅡA族、第ⅢA族的元素,Y的价层电子排布式是ns2,为s轨道全充满的稳定结构,Z的价层电子排布式为ns2np1,其中np轨道上的一个电子容易失去,则I1(Y)>I1(Z),Y、Z失去1个电子后,再失去第2个电子时,分别失去的是(Y)ns1、(Z)ns2(全充满结构)上的电子,则I2(Y)7.A 碳的电负性大于氢,A项错误;Cl、C、Si、O位于p区,B项正确;铜、锌基态原子价层电子排布式分别为3d104s1、3d104s2,第二电离能与第一电离能之差较大的是铜,C项正确;基态铜原子电子排布式为1s22s22p63s23p63d104s1,M层电子排布式为3s23p63d10,D项正确。
8.A 根据题意可推知X为C,Y为N,Z为O,W的最外层电子数比X的最外层电子数少1,则W为Al。同一周期元素从左到右,第一电离能呈增大的趋势,但一般第ⅡA族元素大于第ⅢA族元素,第ⅤA族元素大于第ⅥA族元素,因此第一电离能:N>O>C,A正确;W为Al,其价层电子排布式为3s23p1,位于元素周期表的p区,B错误;同周期主族元素从左到右电负性逐渐增大,同主族元素从上到下,电负性逐渐减小,电负性:O>N>Al,C错误;非金属性O>N,则简单气态氢化物的热稳定性:H2O>NH3,D错误。
9.C X、Y、Z、M、N五种元素均为短周期元素且原子序数依次增大,Z、N同族:
元素电负性:CH3PO4>H2CO3,D正确。
10.B X、Y、Z、Q、W、M是原子序数依次增大的短周期主族元素,由阻燃剂的结构式中各原子的成键数目可知,X、Y、Z、Q、W、M分别是H、C、N、O、F、P元素。第一电离能:F>N>O>C,A错误;非金属性越强,电负性越大,电负性:F>O>N>C>H,B正确;非金属性F>O,则简单气态氢化物的稳定性:HF>H2O,C错误;基态原子未成对电子数:N>C>F,D错误。
11.答案 (1)哑铃 ds [Ar]3d104s1
(2)Cl>P>S
(3)O>P>Si>Na
(4)Fe3+的3d能级处于半充满稳定状态
解析 A元素原子的2p轨道上有2个未成对电子,电子排布式为1s22s22p2或1s22s22p4,A可能为C元素或O元素;B在同周期主族中原子半径最大,则B为Na元素,Na可以与A形成原子个数比为1∶1和2∶1的化合物,则A为O元素;C的单质是一种常见的半导体材料,则C为Si元素;F有9个原子轨道有电子,且只有1个未成对电子,电子排布式为1s22s22p63s23p5,则F为Cl元素;A、B、C、D、E、F、G、W原子序数依次增大,则D为P元素,E为S元素;G2+中有4个未成对电子,则G原子电子排布式为1s22s22p63s23p63d54s1或1s22s22p63s23p63d64s2,G可能为Cr或Fe,但Cr并不是一种常见的金属,则G为Fe元素;W能形成红色(或砖红色)的W2A和黑色的WA两种化合物,则W为Cu元素。
(1)Si元素原子电子排布式为1s22s22p63s23p2,最高能级电子云轮廓图是哑铃形。Cu位于元素周期表的ds区,Cu的简化电子排布式为[Ar]3d104s1。
(2)第一电离能:Cl>P>S。
(3)同周期主族元素的电负性从左向右依次增大,同主族元素的电负性从上到下依次减小,电负性:O>P>Si>Na。
(4)Fe3+的电子排布式为[Ar]3d5,Fe2+的电子排布式为[Ar]3d6,Fe3+的3d能级处于半充满稳定状态,因此Fe3+比Fe2+稳定。
方法点拨
(1)同周期主族元素,从左到右非金属性逐渐增强,电负性逐渐增大,第一电离能呈增大趋势。
(2)当元素的核外电子排布轨道是全空、半充满和全充满状态时,第一电离能就会出现反常现象。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学选择性必修2
专题强化练2 电离能和电负性的应用
1.(2024安徽皖中联盟期末)下表是某些元素的各级电离能数据,下列说法不正确的是( )
元素电离能/(kJ·mol-1) I1 I2 I3 I4
X 500 4600 6900 9500
Y 740 1500 7700 10500
Z 580 1800 2700 11600
A.X元素最有可能为Li
B.基态Y原子的价层电子数可能为2
C.Y元素不一定是主族元素
D.Z的氯化物的化学式可能为ZCl3
2.(2024山东菏泽期末)下表中列出了几种常见元素的电负性数值,根据表中数据结合已学知识推断下列结论不正确的是( )
元素 Na Mg Al Si P S Cl
电负性 0.9 1.2 1.5 1.8 2.1 2.5 3.0
A.F的电负性数值最大
B.K的电负性数值小于Na
C.同周期主族元素电负性越大,金属性越强
D.电负性数值在1.8左右的元素既有金属性又有非金属性
3.(2024安徽亳州期末)明矾的化学式为KAl(SO4)2·12H2O。下列说法正确的是( )
A.S元素位于第三周期第ⅤA族
B.基态铝离子的核外电子排布式为1s22s22p63s23p1
C.明矾所含的元素中,电负性最小的是K元素
D.基态氧原子的第一电离能小于基态硫原子的第一电离能
4.(2023四川绵阳期末)中国科学家首次在月球上发现新矿物,并命名为“嫦娥石”。嫦娥石发现于嫦娥五号月壤的玄武岩碎屑中,是新的磷酸盐矿物。下列说法正确的是( )
A.原子半径:r(Na)
C.第一电离能:I1(P)>I1(Mg)>I1(Na)
D.电负性:χ(P)>χ(Ca)>χ(Mg)
5.XY是由电负性相差最大的两种主族元素(放射性元素除外)所形成的化合物,下列有关XY及其组成元素的说法不正确的是( )
A.X元素的第一电离能远大于其第二电离能
B.Y元素的单质中含有共价键
C.Y元素位于元素周期表的右上方
D.XY一定是离子化合物
6.(2024河南南阳开学考)已知X、Y、Z是同一周期的主族金属元素,I为电离能。根据下表所列数据判断错误的是( )
元素电离能/(kJ·mol-1) I1 I2 I3 I4 I5
X 500 4600 6900 x 13350
Y 740 1450 7730 10540 13630
Z 580 1800 2700 11600 14830
A.X、Y、Z三种元素的常见化合价依次为+1、+2、+3
B.x值可能在9200~11050之间
C.若X、Y、Z是第三周期元素,则它们分别为Na、Al、Mg
D.Y的I1大于Z的I1,Y的I2小于Z的I2,两者关系恰好相反与ns能级上电子数目有关
7.(2023湖北荆州八县期末联考)北京工商大学苏发兵课题组合成的CuO/ZnO纳米材料能提高有机硅单体合成反应的选择性和产率。化学反应如下:
下列有关叙述错误的是( )
A.甲中氯、氢、碳的电负性依次减小
B.上述物质中有4种元素位于周期表p区
C.催化剂中第二电离能与第一电离能之差:Cu>Zn
D.基态Cu原子M层电子排布式为3s23p63d10
8.(2023吉林松花江中学期末)短周期主族元素X、Y、Z、W的原子序数依次增大,W的最外层电子数比X的最外层电子数少1,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物(ZXY)2,其结构式为。下列说法正确的是( )
A.第一电离能:Y>Z>X
B.W位于元素周期表的s区
C.电负性:Y>Z>W
D.简单气态氢化物的热稳定性:Y>Z
9.(2024广东六校联考)一种新型材料的结构如图所示,所含X、Y、Z、M、N五种元素均为短周期元素且原子序数依次增大,仅Z、N同族。下列说法不正确的是( )
A.元素电负性:Y
D.最高价氧化物对应水化物的酸性:Z>N>Y
10.(2024山东菏泽开学考)锂电池中电解液的阻燃剂的结构式如图所示,其中X、Y、Z、Q、W、M是原子序数依次增大的短周期主族元素。下列说法正确的是( )
A.元素的第一电离能:W>Q>Z>Y
B.元素的电负性:W>Q>Z>Y>X
C.简单气态氢化物的稳定性:Q>W
D.基态原子未成对电子数:Y>Z>W
11.(2024河北邢台五岳联盟)A、B、C、D、E、F、G、W是原子序数依次增大的8种元素,A元素原子的2p轨道上有2个未成对电子;B元素在同周期主族中原子半径最大,与A可形成原子个数比为1∶1和2∶1的两种化合物;C的单质是一种常见的半导体材料;F有9个原子轨道有电子,且只有一个未成对电子;G的单质是一种常见金属,其+2价离子G2+有4个未成对电子;W能形成红色(或砖红色)的W2A和黑色的WA两种化合物。请回答下列问题:
(1)C原子最高能级的电子云轮廓图是 形;W位于元素周期表的 区,W的简化电子排布式为 。
(2)D、E、F三种元素第一电离能从大到小的顺序是 (用元素符号及“>”表示)。
(3)A、B、C、D四种元素电负性由大到小的顺序是 (用元素符号及“>”表示)。
(4)G3+比G2+稳定,原因是 。
答案与分层梯度式解析
专题强化练2 电离能和电负性的应用
1.A 锂原子核外只有3个电子,没有I4,则X元素不可能为Li,A错误;Y元素的第三电离能远大于第二电离能,则Y的常见化合价为+2价,基态Y原子的价层电子数可能为2,其可能是主族元素,也可能是副族元素,B、C正确;Z元素的第四电离能远大于第三电离能,则Z的常见化合价为+3价,Z的氯化物的化学式可能为ZCl3,D正确。
方法规律
根据电离能判断元素化合价时,当In+1 In时,元素的常见化合价为+n价。
2.C 由表中数据知,第三周期主族元素随着原子序数递增,电负性逐渐增大,又知同主族元素从上到下电负性逐渐减小,所以F的电负性最大,A正确;K的电负性数值小于Na,B正确;同周期主族元素电负性越大,金属性越弱,C错误;金属元素的电负性一般小于1.8,非金属元素的电负性一般大于1.8,电负性数值在1.8左右的元素既有金属性又有非金属性,D正确。
3.C S元素位于第三周期第ⅥA族,A错误;基态Al3+核外有10个电子,电子排布式为1s22s22p6,B错误;明矾所含的元素中,K元素的金属性最强,电负性最小,C正确;同主族元素从上到下第一电离能逐渐减小,则第一电离能O>S,D错误。
4.C 钠、镁、磷为同周期元素,原子半径:r(Na)>r(Mg)>r(P),故A错误;Na、Mg是同周期元素,金属性:Na>Mg,故B错误;Na、Mg、P是同周期元素,第一电离能:I1(P)>I1(Mg)>I1(Na),故C正确;元素的非金属性越强,电负性越大,元素的非金属性:P>Mg>Ca,所以电负性χ(P)>χ(Mg)>χ(Ca),故D错误。
5.A 根据题中信息分析可知,XY为CsF。Cs原子第一电离能较小,其第二电离能远大于第一电离能,A错误;Y为F元素,其单质F2中含有共价键,B正确;Y为F元素,F元素位于元素周期表中第二周期第ⅦA族,在元素周期表右上方,C正确;CsF是由活泼的金属元素和活泼的非金属元素形成的化合物,属于离子化合物,D正确。
6.C 根据题表中数据可知,X元素的第二电离能远大于第一电离能,Y元素的第三电离能远大于第二电离能,Z元素的第四电离能远大于第三电离能,则X、Y、Z常见化合价依次为+1、+2、+3,A正确;X逐级失去的第2、3、4、5个电子处于同一电子层,相邻两级电离能差接近,I3-I2=2300,则x值可能在(6900+2300)~(13350-2300)之间,即在9200~11050之间,B正确;若X、Y、Z是第三周期元素,则它们分别为Na、Mg、Al,C错误;Y、Z分别为第ⅡA族、第ⅢA族的元素,Y的价层电子排布式是ns2,为s轨道全充满的稳定结构,Z的价层电子排布式为ns2np1,其中np轨道上的一个电子容易失去,则I1(Y)>I1(Z),Y、Z失去1个电子后,再失去第2个电子时,分别失去的是(Y)ns1、(Z)ns2(全充满结构)上的电子,则I2(Y)
8.A 根据题意可推知X为C,Y为N,Z为O,W的最外层电子数比X的最外层电子数少1,则W为Al。同一周期元素从左到右,第一电离能呈增大的趋势,但一般第ⅡA族元素大于第ⅢA族元素,第ⅤA族元素大于第ⅥA族元素,因此第一电离能:N>O>C,A正确;W为Al,其价层电子排布式为3s23p1,位于元素周期表的p区,B错误;同周期主族元素从左到右电负性逐渐增大,同主族元素从上到下,电负性逐渐减小,电负性:O>N>Al,C错误;非金属性O>N,则简单气态氢化物的热稳定性:H2O>NH3,D错误。
9.C X、Y、Z、M、N五种元素均为短周期元素且原子序数依次增大,Z、N同族:
元素电负性:C
10.B X、Y、Z、Q、W、M是原子序数依次增大的短周期主族元素,由阻燃剂的结构式中各原子的成键数目可知,X、Y、Z、Q、W、M分别是H、C、N、O、F、P元素。第一电离能:F>N>O>C,A错误;非金属性越强,电负性越大,电负性:F>O>N>C>H,B正确;非金属性F>O,则简单气态氢化物的稳定性:HF>H2O,C错误;基态原子未成对电子数:N>C>F,D错误。
11.答案 (1)哑铃 ds [Ar]3d104s1
(2)Cl>P>S
(3)O>P>Si>Na
(4)Fe3+的3d能级处于半充满稳定状态
解析 A元素原子的2p轨道上有2个未成对电子,电子排布式为1s22s22p2或1s22s22p4,A可能为C元素或O元素;B在同周期主族中原子半径最大,则B为Na元素,Na可以与A形成原子个数比为1∶1和2∶1的化合物,则A为O元素;C的单质是一种常见的半导体材料,则C为Si元素;F有9个原子轨道有电子,且只有1个未成对电子,电子排布式为1s22s22p63s23p5,则F为Cl元素;A、B、C、D、E、F、G、W原子序数依次增大,则D为P元素,E为S元素;G2+中有4个未成对电子,则G原子电子排布式为1s22s22p63s23p63d54s1或1s22s22p63s23p63d64s2,G可能为Cr或Fe,但Cr并不是一种常见的金属,则G为Fe元素;W能形成红色(或砖红色)的W2A和黑色的WA两种化合物,则W为Cu元素。
(1)Si元素原子电子排布式为1s22s22p63s23p2,最高能级电子云轮廓图是哑铃形。Cu位于元素周期表的ds区,Cu的简化电子排布式为[Ar]3d104s1。
(2)第一电离能:Cl>P>S。
(3)同周期主族元素的电负性从左向右依次增大,同主族元素的电负性从上到下依次减小,电负性:O>P>Si>Na。
(4)Fe3+的电子排布式为[Ar]3d5,Fe2+的电子排布式为[Ar]3d6,Fe3+的3d能级处于半充满稳定状态,因此Fe3+比Fe2+稳定。
方法点拨
(1)同周期主族元素,从左到右非金属性逐渐增强,电负性逐渐增大,第一电离能呈增大趋势。
(2)当元素的核外电子排布轨道是全空、半充满和全充满状态时,第一电离能就会出现反常现象。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
