【高效备课】9.2.1溶解度(饱和溶液、不溶液) 教学设计--人教版(2024)化学九年级下
文档属性
| 名称 | 【高效备课】9.2.1溶解度(饱和溶液、不溶液) 教学设计--人教版(2024)化学九年级下 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-23 22:40:24 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
9.2.1溶解度(饱和溶液、不溶液) 教学设计
课题 课题2.1溶解度(饱和溶液、不溶液) 授课教师 化学 课型 公开课
教 材 分 析 饱和溶液与不饱和溶液是初中重要的化学概念,在学习了溶液的形成后,从定性过渡到定量,为溶解度的学习奠定基础。本节课需要解决三个关键问题,饱和溶液与不饱和溶液的概念和判断方法,饱和溶液与不饱和溶液的相互转化,饱和溶液与不饱和溶液和浓溶液与稀溶液之间的关系。
学 情 分 析 饱和溶液与不饱和溶液的概念建立起来不难,学生容易接受。后两个问题比较抽象,逻辑性也强,是学生学习的难点。通过实验和对比分析可以解决这两个难点,只有学生真正理解了,才能更好地掌握知识,将知识应用于生活。本课试图让学生对溶解和溶液有系统的整体认识,利用问题链将思路拓展、认识拔高,让学生对大自然的多样性肃然起敬。
核 心 素 养 目 标 1.化学观念:了解饱和溶液、不饱和溶液的含义;了解结晶现象,知道结晶的两种方法。 2.科学思维:“饱和”与“不饱和”的相对性及互相转化方法,体会定量研究在实际中的价值和应用。 3.科学探究与实践:利用物质的溶解性,设计粗盐提纯等物质分离的方案。 4.科学态度与责任:认识绝大多数物质在溶剂中的溶解是有限度的,了解饱和溶液的含义。
教 学 重 难 点 重点: 1.饱和溶液和不饱和溶液的概念及转化;2.蒸发结晶法与降温结晶法的应用。 难点: 饱和溶液和不饱和溶液的判。
教学 方法 自主学习、小组合作、实验探究、相互反思、习题专练、交流掌握
教学 环节 教学活动 设计意图
一、 复习巩固 你能说出下列溶液的溶质和溶剂吗 温故知新
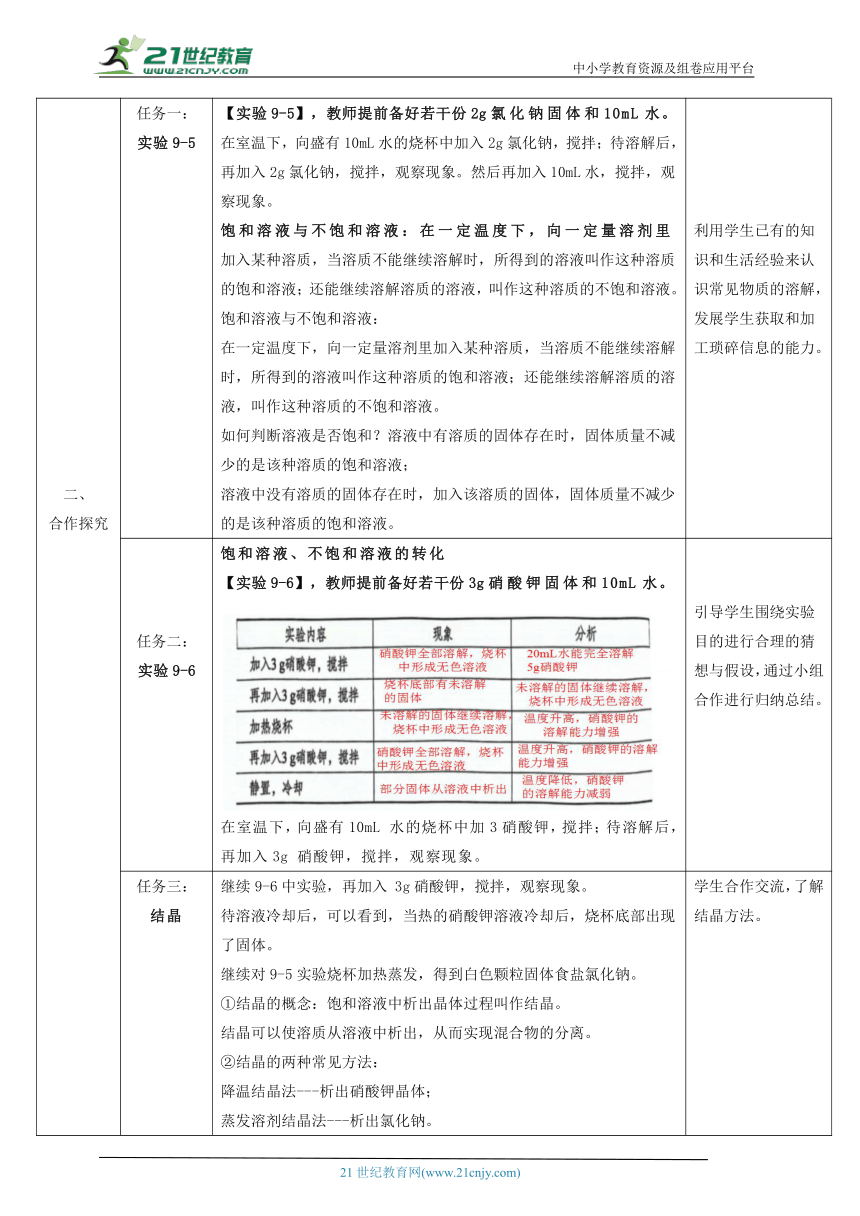
二、 合作探究 任务一: 实验9-5 【实验9-5】,教师提前备好若干份2g氯化钠固体和10mL水。 在室温下,向盛有10mL水的烧杯中加入2g氯化钠,搅拌;待溶解后,再加入2g氯化钠,搅拌,观察现象。然后再加入10mL水,搅拌,观察现象。 饱和溶液与不饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫作这种溶质的饱和溶液;还能继续溶解溶质的溶液,叫作这种溶质的不饱和溶液。 饱和溶液与不饱和溶液: 在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫作这种溶质的饱和溶液;还能继续溶解溶质的溶液,叫作这种溶质的不饱和溶液。 如何判断溶液是否饱和?溶液中有溶质的固体存在时,固体质量不减少的是该种溶质的饱和溶液; 溶液中没有溶质的固体存在时,加入该溶质的固体,固体质量不减少的是该种溶质的饱和溶液。 利用学生已有的知识和生活经验来认识常见物质的溶解,发展学生获取和加工琐碎信息的能力。
任务二: 实验9-6 饱和溶液、不饱和溶液的转化 【实验9-6】,教师提前备好若干份3g硝酸钾固体和10mL水。 在室温下,向盛有10mL 水的烧杯中加3硝酸钾,搅拌;待溶解后,再加入3g 硝酸钾,搅拌,观察现象。 引导学生围绕实验目的进行合理的猜想与假设,通过小组合作进行归纳总结。
任务三: 结晶 继续9-6中实验,再加入 3g硝酸钾,搅拌,观察现象。 待溶液冷却后,可以看到,当热的硝酸钾溶液冷却后,烧杯底部出现了固体。 继续对9-5实验烧杯加热蒸发,得到白色颗粒固体食盐氯化钠。 ①结晶的概念:饱和溶液中析出晶体过程叫作结晶。 结晶可以使溶质从溶液中析出,从而实现混合物的分离。 ②结晶的两种常见方法: 降温结晶法---析出硝酸钾晶体; 蒸发溶剂结晶法---析出氯化钠。 ③思考与讨论 查阅教材资料,了解用海水晒盐(风吹日晒)的过程,与同学交流。 学生合作交流,了解结晶方法。
任务四: 总结 1.在一定温度下,硝酸钾不能无限制地溶解在一定量的水中。 2.温度升高时,一定量的水中可以溶解更多的硝酸钾;温度降低时,一定量的水中溶解的硝酸钾会减少。 3.当溶剂的量不变时,溶解溶质的多少与温度有关。 培养学生对探究的结果进行逆向思考的意识,发展学生的辩证观。
三、小结作业 1.总结:学生畅谈本节课的收获是什么。 本节主要内容: 总结所学知识,鼓励学生课后查阅相关资料,了解更多相关知识。
四、板书设计 第九单元 溶液
课题1.2溶本节课以饱和溶液与不饱和溶液为主体,同时建构起对于溶解相对完整的认识。从溶解是物理变化还是化学变化人手,从氯化钠能否无限溶于水开始研究,建立概念,进行辨析,最后,以酒精、醋酸能无限溶于水中结尾。既前后呼应,又有整体高度。在最后总结时,能看到学生的眼睛熠熠生辉。 液及其应用 饱和溶液和不饱和溶液 二、结晶 直观形象,突出本节课重点知识,形成完整的知识体系。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
9.2.1溶解度(饱和溶液、不溶液) 教学设计
课题 课题2.1溶解度(饱和溶液、不溶液) 授课教师 化学 课型 公开课
教 材 分 析 饱和溶液与不饱和溶液是初中重要的化学概念,在学习了溶液的形成后,从定性过渡到定量,为溶解度的学习奠定基础。本节课需要解决三个关键问题,饱和溶液与不饱和溶液的概念和判断方法,饱和溶液与不饱和溶液的相互转化,饱和溶液与不饱和溶液和浓溶液与稀溶液之间的关系。
学 情 分 析 饱和溶液与不饱和溶液的概念建立起来不难,学生容易接受。后两个问题比较抽象,逻辑性也强,是学生学习的难点。通过实验和对比分析可以解决这两个难点,只有学生真正理解了,才能更好地掌握知识,将知识应用于生活。本课试图让学生对溶解和溶液有系统的整体认识,利用问题链将思路拓展、认识拔高,让学生对大自然的多样性肃然起敬。
核 心 素 养 目 标 1.化学观念:了解饱和溶液、不饱和溶液的含义;了解结晶现象,知道结晶的两种方法。 2.科学思维:“饱和”与“不饱和”的相对性及互相转化方法,体会定量研究在实际中的价值和应用。 3.科学探究与实践:利用物质的溶解性,设计粗盐提纯等物质分离的方案。 4.科学态度与责任:认识绝大多数物质在溶剂中的溶解是有限度的,了解饱和溶液的含义。
教 学 重 难 点 重点: 1.饱和溶液和不饱和溶液的概念及转化;2.蒸发结晶法与降温结晶法的应用。 难点: 饱和溶液和不饱和溶液的判。
教学 方法 自主学习、小组合作、实验探究、相互反思、习题专练、交流掌握
教学 环节 教学活动 设计意图
一、 复习巩固 你能说出下列溶液的溶质和溶剂吗 温故知新
二、 合作探究 任务一: 实验9-5 【实验9-5】,教师提前备好若干份2g氯化钠固体和10mL水。 在室温下,向盛有10mL水的烧杯中加入2g氯化钠,搅拌;待溶解后,再加入2g氯化钠,搅拌,观察现象。然后再加入10mL水,搅拌,观察现象。 饱和溶液与不饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫作这种溶质的饱和溶液;还能继续溶解溶质的溶液,叫作这种溶质的不饱和溶液。 饱和溶液与不饱和溶液: 在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫作这种溶质的饱和溶液;还能继续溶解溶质的溶液,叫作这种溶质的不饱和溶液。 如何判断溶液是否饱和?溶液中有溶质的固体存在时,固体质量不减少的是该种溶质的饱和溶液; 溶液中没有溶质的固体存在时,加入该溶质的固体,固体质量不减少的是该种溶质的饱和溶液。 利用学生已有的知识和生活经验来认识常见物质的溶解,发展学生获取和加工琐碎信息的能力。
任务二: 实验9-6 饱和溶液、不饱和溶液的转化 【实验9-6】,教师提前备好若干份3g硝酸钾固体和10mL水。 在室温下,向盛有10mL 水的烧杯中加3硝酸钾,搅拌;待溶解后,再加入3g 硝酸钾,搅拌,观察现象。 引导学生围绕实验目的进行合理的猜想与假设,通过小组合作进行归纳总结。
任务三: 结晶 继续9-6中实验,再加入 3g硝酸钾,搅拌,观察现象。 待溶液冷却后,可以看到,当热的硝酸钾溶液冷却后,烧杯底部出现了固体。 继续对9-5实验烧杯加热蒸发,得到白色颗粒固体食盐氯化钠。 ①结晶的概念:饱和溶液中析出晶体过程叫作结晶。 结晶可以使溶质从溶液中析出,从而实现混合物的分离。 ②结晶的两种常见方法: 降温结晶法---析出硝酸钾晶体; 蒸发溶剂结晶法---析出氯化钠。 ③思考与讨论 查阅教材资料,了解用海水晒盐(风吹日晒)的过程,与同学交流。 学生合作交流,了解结晶方法。
任务四: 总结 1.在一定温度下,硝酸钾不能无限制地溶解在一定量的水中。 2.温度升高时,一定量的水中可以溶解更多的硝酸钾;温度降低时,一定量的水中溶解的硝酸钾会减少。 3.当溶剂的量不变时,溶解溶质的多少与温度有关。 培养学生对探究的结果进行逆向思考的意识,发展学生的辩证观。
三、小结作业 1.总结:学生畅谈本节课的收获是什么。 本节主要内容: 总结所学知识,鼓励学生课后查阅相关资料,了解更多相关知识。
四、板书设计 第九单元 溶液
课题1.2溶本节课以饱和溶液与不饱和溶液为主体,同时建构起对于溶解相对完整的认识。从溶解是物理变化还是化学变化人手,从氯化钠能否无限溶于水开始研究,建立概念,进行辨析,最后,以酒精、醋酸能无限溶于水中结尾。既前后呼应,又有整体高度。在最后总结时,能看到学生的眼睛熠熠生辉。 液及其应用 饱和溶液和不饱和溶液 二、结晶 直观形象,突出本节课重点知识,形成完整的知识体系。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
