【核心素养】7.3溶液稀释的表示 课件--科粤版(2024)九年级化学下册
文档属性
| 名称 | 【核心素养】7.3溶液稀释的表示 课件--科粤版(2024)九年级化学下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-23 22:46:04 | ||
图片预览







文档简介
(共20张PPT)
第七单元 溶液
溶液浓稀的表示 第3课时
(科粤版)九年级
下
01
教学目标
内容总览
02
新知导入
03
探究新知
04
课堂练习
05
课堂总结
06
板书设计
教学目标
了解有色溶液的颜色深浅与溶液浓稀的关系;
01
02
能够进行溶质质量分数的简单计算;
03
掌握配制一定质量分数的溶液的操作步骤及方法。
新知导入
想一想
喷洒农药
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木。
探究新知
浓度
溶液中溶质质量的多少如何表示呢?
是浓还是稀?
探究新知
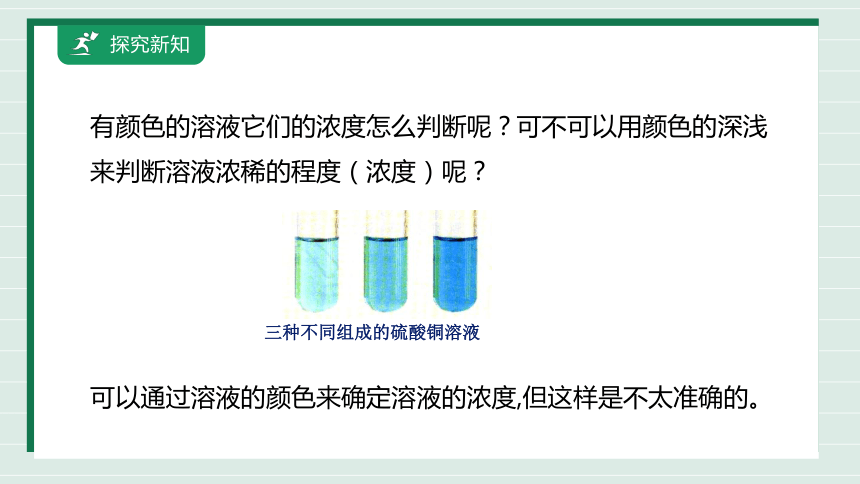
有颜色的溶液它们的浓度怎么判断呢?可不可以用颜色的深浅来判断溶液浓稀的程度(浓度)呢?
可以通过溶液的颜色来确定溶液的浓度,但这样是不太准确的。
三种不同组成的硫酸铜溶液
探究新知
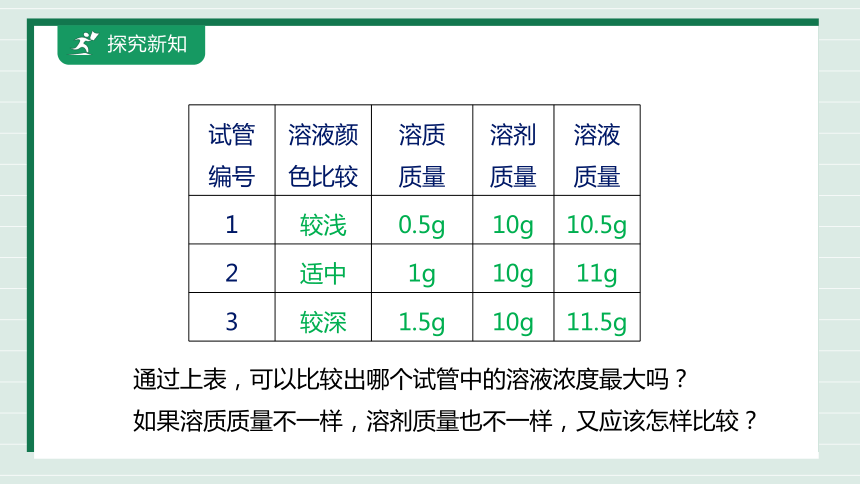
试管 编号 溶液颜色比较 溶质 质量 溶剂 质量 溶液
质量
1 较浅 0.5g 10g 10.5g
2 适中 1g 10g 11g
3 较深 1.5g 10g 11.5g
通过上表,可以比较出哪个试管中的溶液浓度最大吗?
如果溶质质量不一样,溶剂质量也不一样,又应该怎样比较?
探究新知
溶质的质量分数
1.定义:溶质的质量分数是溶质的质量与溶液的质量之比。
2.表达式:
探究新知
配制一定溶质质量分数的溶液
任务二
配制50g质量分数为5%的氯化钠溶液
1.计算:配制50g质量分数为5%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠 g;水 g。
2.称量:用托盘天平称量所需的氯化钠,放入烧杯中。
3.量取:用量筒量取所需的水,倒入盛有氯化钠的烧杯中。
4.溶解:用玻璃棒搅拌,使氯化钠溶解。
5.装瓶、贴标签。
探究新知
配制过程:
探究新知
溶解度与溶质质量分数的区别与联系
物质溶解性的量度,受温度影响
表示溶液中溶质质量的多少,不受外界条件影响
100g
无要求
达到饱和
不一定
S = X100g
溶质质量
溶剂质量
A% = X100%
溶质质量
溶液质量
克(g)
无单位
饱和溶液:A%= X100%
溶解度
100g+溶解度
课堂练习
例
20℃时KNO3的溶解度为31.6g,将20g KNO3投入50g水中,充分搅拌,制成20℃时溶液,求该溶液中溶质的质量分数?
解:20℃时KNO3的溶解度为31.6g。50g水中最多溶解KNO315.8g。
A% = ×100%
溶质质量
溶液质量
= ×100% =24%
15.8g
50g+15.8g
或
= ×100%=24%
31.6g
100g+31.6g
A%= ×100%
溶解度
100g+溶解度
答:溶液中溶质的质量分数为24%。
探究新知
有关溶液稀释的计算
任务三
配制铅蓄电池用的28%硫酸溶液460g,问需要98%的浓硫酸的体积是多少?(已知浓硫酸的密度为1.84g/cm3.)
解:设需要98%的浓硫酸的质量为x
460g×28% = x×98%
x = 131.4g
这些浓硫酸的体积为
答:配制28%硫酸溶液460g,需要98%的浓硫酸71.4 cm3
体积(V)= = =71.4cm3
质量(m)
密度(ρ)
131.4g
1.84g/cm3.
例
课堂练习
1.把12g某固体放入90g水中充分溶解后过滤,滤出该固体2g,则该滤液的溶质质量分数是( )
A.10% B.11.7%
C.12% D.13.3%
A
课堂练习
2.有10%氢氧化钠溶液100g,欲将其溶质质量分数提到20%,则可采取的措施是( )
A.蒸发掉45 g水
B.蒸发掉50 g水
C.加入10 g固体NaOH
D.倒入100 g氢氧化钠同样浓度的溶液
B
课堂练习
3.实验室配制100 g 10%的氯化钠溶液,有关实验操作不正确的是 ( )
A.用托盘天平称取10.0 g氯化钠
B.用量筒量取90.0 mL 的水
C.将称取的氯化钠倒入量筒中溶解
D.将配制的溶液装入试剂瓶中,贴上标签
C
课堂练习
C
4.配制一定溶质质量分数的氯化钠溶液,下列实验操作不正确的是( )
A.氯化钠的取用 B.氯化钠的称量 C.水的取用 D.氯化钠的溶解
课堂总结
2.配制一定溶质质量分数的溶液,一般要经过计算、称量(或量取)、溶解(或稀释)、装瓶存放等步骤。
1.溶质的质量分数:溶质的质量分数是溶质的质量与溶液的质量之比。
表达式:
19
https://www.21cnjy.com/help/help_extract.php
让备课更有效
www.21cnjy.com
Thanks!
第七单元 溶液
溶液浓稀的表示 第3课时
(科粤版)九年级
下
01
教学目标
内容总览
02
新知导入
03
探究新知
04
课堂练习
05
课堂总结
06
板书设计
教学目标
了解有色溶液的颜色深浅与溶液浓稀的关系;
01
02
能够进行溶质质量分数的简单计算;
03
掌握配制一定质量分数的溶液的操作步骤及方法。
新知导入
想一想
喷洒农药
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木。
探究新知
浓度
溶液中溶质质量的多少如何表示呢?
是浓还是稀?
探究新知
有颜色的溶液它们的浓度怎么判断呢?可不可以用颜色的深浅来判断溶液浓稀的程度(浓度)呢?
可以通过溶液的颜色来确定溶液的浓度,但这样是不太准确的。
三种不同组成的硫酸铜溶液
探究新知
试管 编号 溶液颜色比较 溶质 质量 溶剂 质量 溶液
质量
1 较浅 0.5g 10g 10.5g
2 适中 1g 10g 11g
3 较深 1.5g 10g 11.5g
通过上表,可以比较出哪个试管中的溶液浓度最大吗?
如果溶质质量不一样,溶剂质量也不一样,又应该怎样比较?
探究新知
溶质的质量分数
1.定义:溶质的质量分数是溶质的质量与溶液的质量之比。
2.表达式:
探究新知
配制一定溶质质量分数的溶液
任务二
配制50g质量分数为5%的氯化钠溶液
1.计算:配制50g质量分数为5%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠 g;水 g。
2.称量:用托盘天平称量所需的氯化钠,放入烧杯中。
3.量取:用量筒量取所需的水,倒入盛有氯化钠的烧杯中。
4.溶解:用玻璃棒搅拌,使氯化钠溶解。
5.装瓶、贴标签。
探究新知
配制过程:
探究新知
溶解度与溶质质量分数的区别与联系
物质溶解性的量度,受温度影响
表示溶液中溶质质量的多少,不受外界条件影响
100g
无要求
达到饱和
不一定
S = X100g
溶质质量
溶剂质量
A% = X100%
溶质质量
溶液质量
克(g)
无单位
饱和溶液:A%= X100%
溶解度
100g+溶解度
课堂练习
例
20℃时KNO3的溶解度为31.6g,将20g KNO3投入50g水中,充分搅拌,制成20℃时溶液,求该溶液中溶质的质量分数?
解:20℃时KNO3的溶解度为31.6g。50g水中最多溶解KNO315.8g。
A% = ×100%
溶质质量
溶液质量
= ×100% =24%
15.8g
50g+15.8g
或
= ×100%=24%
31.6g
100g+31.6g
A%= ×100%
溶解度
100g+溶解度
答:溶液中溶质的质量分数为24%。
探究新知
有关溶液稀释的计算
任务三
配制铅蓄电池用的28%硫酸溶液460g,问需要98%的浓硫酸的体积是多少?(已知浓硫酸的密度为1.84g/cm3.)
解:设需要98%的浓硫酸的质量为x
460g×28% = x×98%
x = 131.4g
这些浓硫酸的体积为
答:配制28%硫酸溶液460g,需要98%的浓硫酸71.4 cm3
体积(V)= = =71.4cm3
质量(m)
密度(ρ)
131.4g
1.84g/cm3.
例
课堂练习
1.把12g某固体放入90g水中充分溶解后过滤,滤出该固体2g,则该滤液的溶质质量分数是( )
A.10% B.11.7%
C.12% D.13.3%
A
课堂练习
2.有10%氢氧化钠溶液100g,欲将其溶质质量分数提到20%,则可采取的措施是( )
A.蒸发掉45 g水
B.蒸发掉50 g水
C.加入10 g固体NaOH
D.倒入100 g氢氧化钠同样浓度的溶液
B
课堂练习
3.实验室配制100 g 10%的氯化钠溶液,有关实验操作不正确的是 ( )
A.用托盘天平称取10.0 g氯化钠
B.用量筒量取90.0 mL 的水
C.将称取的氯化钠倒入量筒中溶解
D.将配制的溶液装入试剂瓶中,贴上标签
C
课堂练习
C
4.配制一定溶质质量分数的氯化钠溶液,下列实验操作不正确的是( )
A.氯化钠的取用 B.氯化钠的称量 C.水的取用 D.氯化钠的溶解
课堂总结
2.配制一定溶质质量分数的溶液,一般要经过计算、称量(或量取)、溶解(或稀释)、装瓶存放等步骤。
1.溶质的质量分数:溶质的质量分数是溶质的质量与溶液的质量之比。
表达式:
19
https://www.21cnjy.com/help/help_extract.php
让备课更有效
www.21cnjy.com
Thanks!
