2025人教版高中化学必修第二册强化练习题--第五章 化工生产中的重要非金属元素(含解析)
文档属性
| 名称 | 2025人教版高中化学必修第二册强化练习题--第五章 化工生产中的重要非金属元素(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 744.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-24 09:56:36 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学必修第二册
第五章 化工生产中的重要非金属元素
注意事项
1.全卷满分100分。考试用时75分钟。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 Si-28 S-32 Fe-56 Ba-137。
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.中华传统文化中蕴含着很多化学知识,下列说法错误的是( )
A.“落红不是无情物,化作春泥更护花”蕴含着自然界中的碳、氮循环
B.《元丰行示德逢》里“雷蟠电掣云滔滔,夜半载雨输亭皋”涉及化学反应N2+O22NO
C.《天工开物》中有“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其矾指的是金属硫酸盐
D.《天工开物》中“凡火药,硫为纯阳”,其硫指的是浓硫酸
2.下列说法正确的是( )
A.玻璃钢和压电陶瓷都属于新型无机非金属材料
B.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
C.二氧化硫可用于杀菌,是一种食品添加剂
D.植物直接吸收利用空气中的NO和NO2作为肥料,实现氮的固定
3.氮和硫是化工生产中的重要元素。下列相关物质的性质与用途具有对应关系的是( )
A.液氨汽化时吸收大量热,可用作制冷剂
B.碳酸氢铵受热易分解,可用作化学肥料
C.二氧化硫易溶于水,可用作纸浆漂白剂
D.浓硫酸具有脱水性,可用作气体干燥剂
4.下列离子组在指定条件下的溶液中,一定能大量共存的是( )
A.能使pH试纸变红的溶液:N、Na+、S、Fe3+、N
B.含有大量N的溶液:H+、Fe2+、S、Cl-
C.含有大量Cl-的溶液:Fe3+、Mg2+、S、OH-
D.加入铁粉后产生大量氢气的溶液:N、Na+、C、S
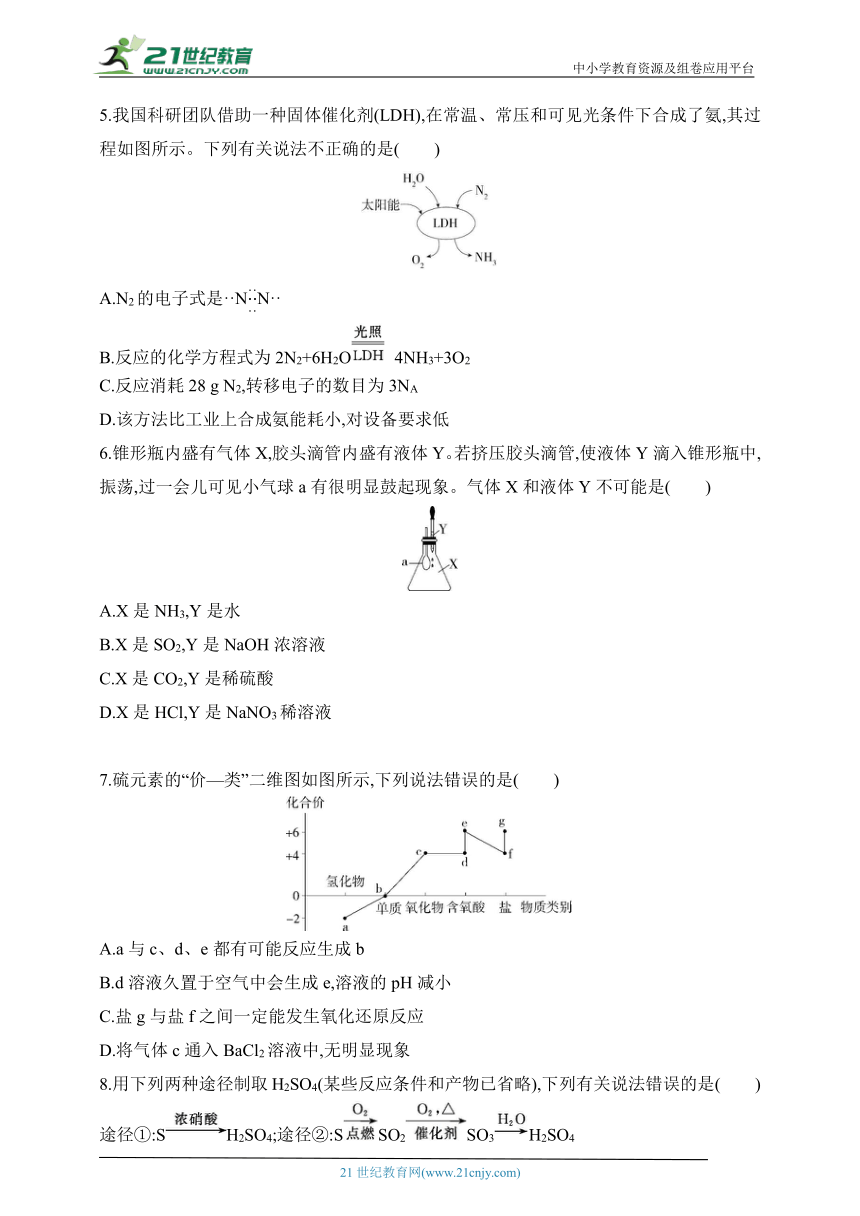
5.我国科研团队借助一种固体催化剂(LDH),在常温、常压和可见光条件下合成了氨,其过程如图所示。下列有关说法不正确的是( )
A.N2的电子式是··NN··
B.反应的化学方程式为2N2+6H2O 4NH3+3O2
C.反应消耗28 g N2,转移电子的数目为3NA
D.该方法比工业上合成氨能耗小,对设备要求低
6.锥形瓶内盛有气体X,胶头滴管内盛有液体Y。若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿可见小气球a有很明显鼓起现象。气体X和液体Y不可能是( )
A.X是NH3,Y是水
B.X是SO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
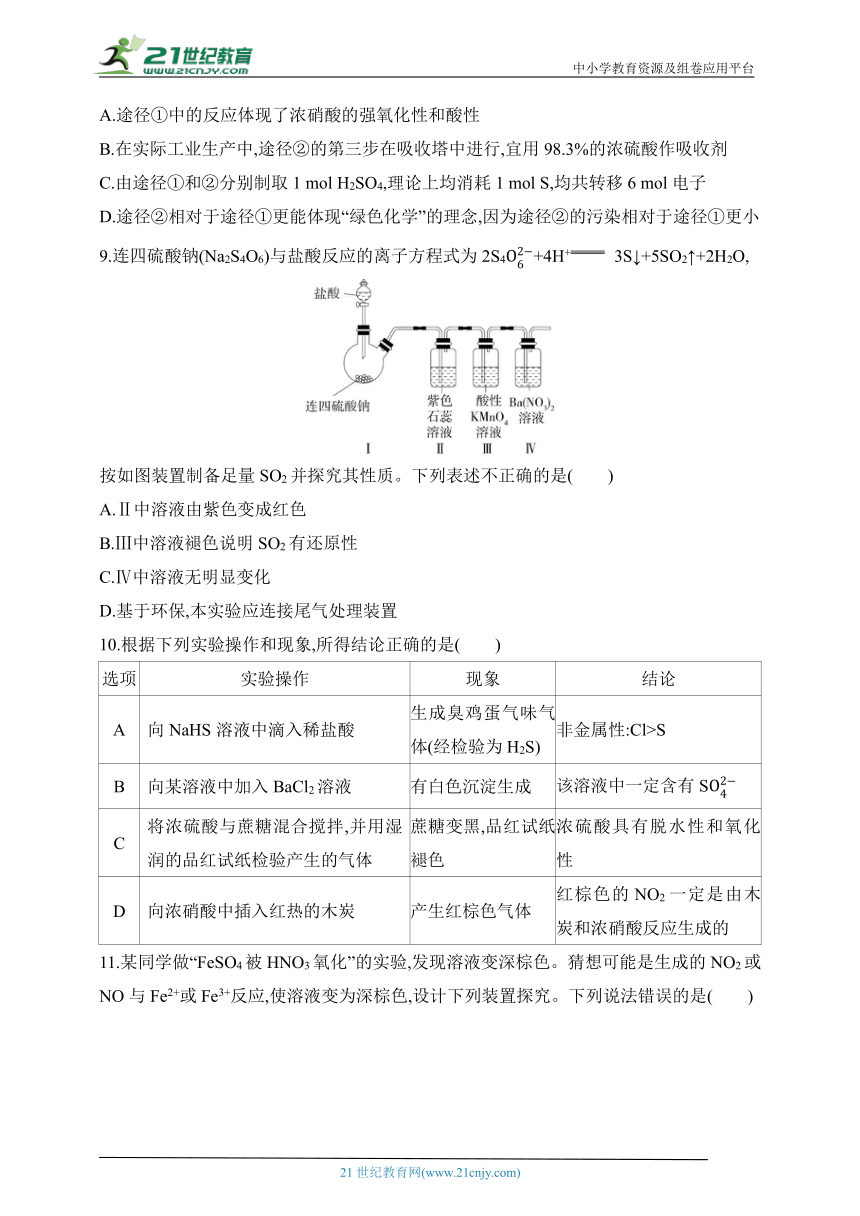
7.硫元素的“价—类”二维图如图所示,下列说法错误的是( )
A.a与c、d、e都有可能反应生成b
B.d溶液久置于空气中会生成e,溶液的pH减小
C.盐g与盐f之间一定能发生氧化还原反应
D.将气体c通入BaCl2溶液中,无明显现象
8.用下列两种途径制取H2SO4(某些反应条件和产物已省略),下列有关说法错误的是( )
途径①:SH2SO4;途径②:SSO2SO3H2SO4
A.途径①中的反应体现了浓硝酸的强氧化性和酸性
B.在实际工业生产中,途径②的第三步在吸收塔中进行,宜用98.3%的浓硫酸作吸收剂
C.由途径①和②分别制取1 mol H2SO4,理论上均消耗1 mol S,均共转移6 mol电子
D.途径②相对于途径①更能体现“绿色化学”的理念,因为途径②的污染相对于途径①更小
9.连四硫酸钠(Na2S4O6)与盐酸反应的离子方程式为2S4+4H+ 3S↓+5SO2↑+2H2O,
按如图装置制备足量SO2并探究其性质。下列表述不正确的是( )
A.Ⅱ中溶液由紫色变成红色
B.Ⅲ中溶液褪色说明SO2有还原性
C.Ⅳ中溶液无明显变化
D.基于环保,本实验应连接尾气处理装置
10.根据下列实验操作和现象,所得结论正确的是( )
选项 实验操作 现象 结论
A 向NaHS溶液中滴入稀盐酸 生成臭鸡蛋气味气体(经检验为H2S) 非金属性:Cl>S
B 向某溶液中加入BaCl2溶液 有白色沉淀生成 该溶液中一定含有S
C 将浓硫酸与蔗糖混合搅拌,并用湿润的品红试纸检验产生的气体 蔗糖变黑,品红试纸褪色 浓硫酸具有脱水性和氧化性
D 向浓硝酸中插入红热的木炭 产生红棕色气体 红棕色的NO2一定是由木炭和浓硝酸反应生成的
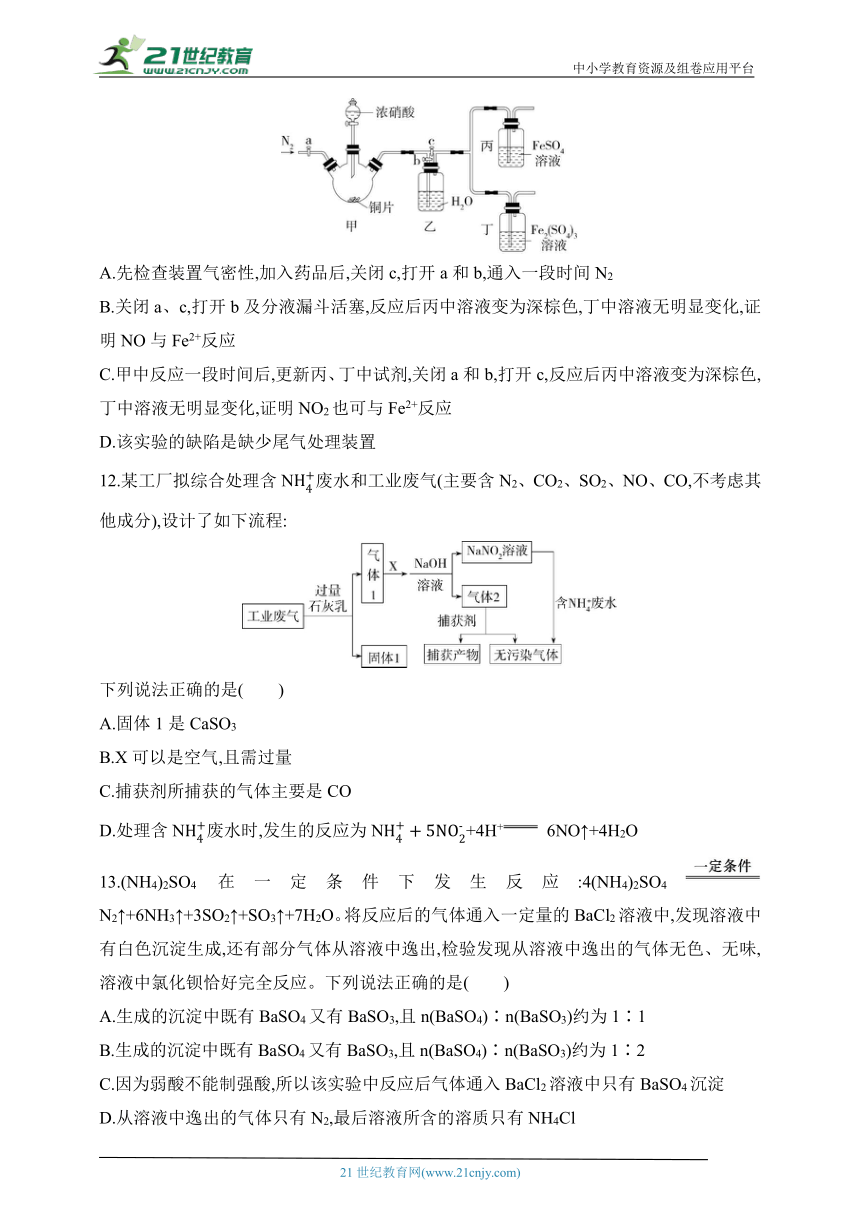
11.某同学做“FeSO4被HNO3氧化”的实验,发现溶液变深棕色。猜想可能是生成的NO2或NO与Fe2+或Fe3+反应,使溶液变为深棕色,设计下列装置探究。下列说法错误的是( )
A.先检查装置气密性,加入药品后,关闭c,打开a和b,通入一段时间N2
B.关闭a、c,打开b及分液漏斗活塞,反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO与Fe2+反应
C.甲中反应一段时间后,更新丙、丁中试剂,关闭a和b,打开c,反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO2也可与Fe2+反应
D.该实验的缺陷是缺少尾气处理装置
12.某工厂拟综合处理含N废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法正确的是( )
A.固体1是CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含N废水时,发生的反应为N+4H+ 6NO↑+4H2O
13.(NH4)2SO4在一定条件下发生反应:4(NH4)2SO4 N2↑+6NH3↑+3SO2↑+SO3↑+7H2O。将反应后的气体通入一定量的BaCl2溶液中,发现溶液中有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是( )
A.生成的沉淀中既有BaSO4又有BaSO3,且n(BaSO4)∶n(BaSO3)约为1∶1
B.生成的沉淀中既有BaSO4又有BaSO3,且n(BaSO4)∶n(BaSO3)约为1∶2
C.因为弱酸不能制强酸,所以该实验中反应后气体通入BaCl2溶液中只有BaSO4沉淀
D.从溶液中逸出的气体只有N2,最后溶液所含的溶质只有NH4Cl
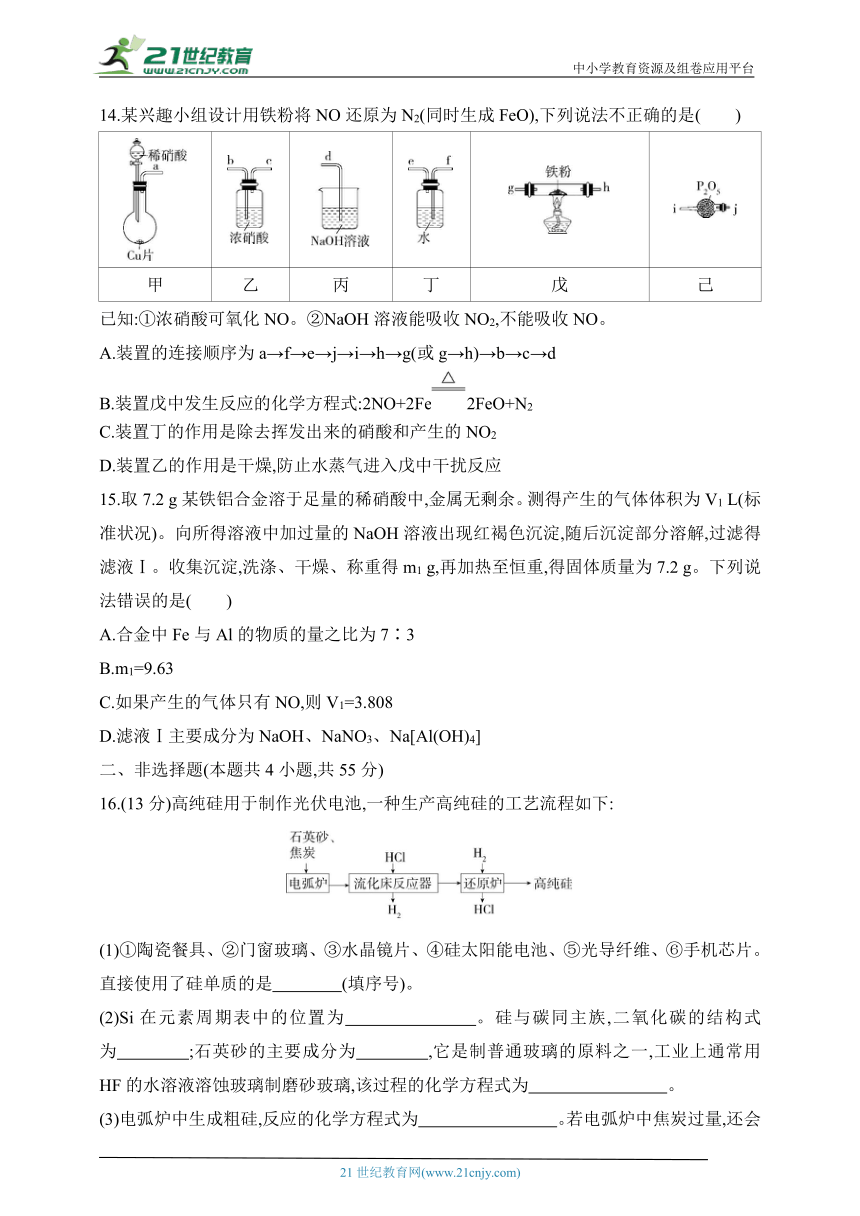
14.某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO),下列说法不正确的是( )
甲 乙 丙 丁 戊 己
已知:①浓硝酸可氧化NO。②NaOH溶液能吸收NO2,不能吸收NO。
A.装置的连接顺序为a→f→e→j→i→h→g(或g→h)→b→c→d
B.装置戊中发生反应的化学方程式:2NO+2Fe2FeO+N2
C.装置丁的作用是除去挥发出来的硝酸和产生的NO2
D.装置乙的作用是干燥,防止水蒸气进入戊中干扰反应
15.取7.2 g某铁铝合金溶于足量的稀硝酸中,金属无剩余。测得产生的气体体积为V1 L(标准状况)。向所得溶液中加过量的NaOH溶液出现红褐色沉淀,随后沉淀部分溶解,过滤得滤液Ⅰ。收集沉淀,洗涤、干燥、称重得m1 g,再加热至恒重,得固体质量为7.2 g。下列说法错误的是( )
A.合金中Fe与Al的物质的量之比为7∶3
B.m1=9.63
C.如果产生的气体只有NO,则V1=3.808
D.滤液Ⅰ主要成分为NaOH、NaNO3、Na[Al(OH)4]
二、非选择题(本题共4小题,共55分)
16.(13分)高纯硅用于制作光伏电池,一种生产高纯硅的工艺流程如下:
(1)①陶瓷餐具、②门窗玻璃、③水晶镜片、④硅太阳能电池、⑤光导纤维、⑥手机芯片。直接使用了硅单质的是 (填序号)。
(2)Si在元素周期表中的位置为 。硅与碳同主族,二氧化碳的结构式为 ;石英砂的主要成分为 ,它是制普通玻璃的原料之一,工业上通常用HF的水溶液溶蚀玻璃制磨砂玻璃,该过程的化学方程式为 。
(3)电弧炉中生成粗硅,反应的化学方程式为 。若电弧炉中焦炭过量,还会有SiC生成,石英砂和焦炭生成SiC的反应中,氧化剂和还原剂的物质的量之比为 。
(4)还原炉中用SiHCl3与过量H2在1 100 ℃下反应,试写出反应的化学方程式: 。
17.(12分)某同学欲探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铁、铜反应的实验中的有关问题。
(1)在常温下,分别向盛有等量铁片的四支试管中加入等体积的①浓硫酸、②稀硫酸、③浓硝酸、④稀硝酸,能观察到明显现象的是 (填序号)。
(2)先将铜与浓硫酸共热反应产生的气体X持续通入如图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括 (填字母)。
a.通入X气体后先产生白色沉淀后溶解
b.通入X气体后溶液中无明显现象
c.通入Y气体后有沉淀产生
d.通入Y气体后沉淀溶解
e.通入Y气体后溶液中无明显现象
(3)若将(2)的Ba(OH)2换为氢硫酸,则通入X气体后,反应的化学方程式为 。
(4)将过量的铜加入一定量的浓硝酸中,充分反应。
①反应一段时间后的离子方程式为 。
②生成的NO2可与水发生反应,反应的化学方程式为 ;若该反应有0.6NA个电子转移,则被氧化的NO2的物质的量为 。(NA为阿伏加德罗常数的值)
18.(16分)Ⅰ.用黄铜矿(主要成分为CuFeS2,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
已知:CuFeS2+O2 SO2+FeS+Cu。
(1)将黄铜矿粉碎成粉末的目的是 。高温焙烧反应的还原产物是 。
(2)滤液A中通入Cl2,反应的离子方程式为 。
(3)操作b后检验滤渣已经洗涤干净的实验操作为 。
Ⅱ.化合物M是某种新型电子材料的主要成分,由两种常见元素组成。为了研究其组成,设计如下实验:
(4)M的化学式为 。
(5)白色沉淀乙在空气中变成红褐色沉淀丙的原因是 (用化学方程式表示)。
(6)高温条件下,丁与NH3反应生成两种单质和水,该反应的化学方程式为 。
19.(14分)(1)将H2S转化为可再利用的资源是能源研究领域的重要课题。H2S的转化目前主要有以下两种方法:
方法Ⅰ 克劳斯燃烧法 H2SS
方法Ⅱ 铁盐、铜盐氧化法 H2SS
①方法Ⅰ的化学方程式是 。
②方法Ⅱ,将H2S和O2的混合气体通入FeCl3、CuCl2的混合溶液中反应回收S,物质转化如图1所示。下列说法不正确的是 (填字母)。
A.Cu2+和H2S反应的离子方程式为S2-+Cu2+CuS↓
B.O2在转化过程中发生的反应为O2+4Fe2++4H+4Fe3++2H2O
C.整个反应过程中溶液的pH变小(不考虑产生的H2O对溶液的稀释)
D.提高混合气体中O2的比例可防止生成的硫单质中混有CuS
(2)Pt-BaO双催化剂处理大气中的NO和H2S,工作原理如图2所示。
①NO和O2在催化剂Pt表面发生反应的化学方程式为 。
②通过BaO和Ba(NO3)2的相互转化实现NO2的储存和还原,储存NO2的物质是 (填化学式)。
③NO2协同处理H2S过程中,NO2与H2S按物质的量之比1∶2通入,每处理0.2mol H2S时,转移电子数为0.4NA,则产物X的化学式为 。
(3)某同学结合HNO3受热分解的规律,采用图3所示装置加热Ba固体探究Ba分解规律。加热过程中发现装置②中有气泡产生,但在上升的过程中消失;紫色石蕊溶液逐渐变为红色;②中溶液几乎不被压至装置③中。写出Ba受热分解的化学方程式: 。
图3
加热前称重为m g(含试管),反应结束后,冷却,再次称重为n g(含试管),反应结束后装置②中溶液的物质的量浓度为 mol·L-1(用含m和n的式子表示,溶液体积视为100 mL)。
答案与解析
1.D “落红不是无情物,化作春泥更护花”蕴含着自然界中的物质循环,其中包括碳、氮循环,A正确;氮气和氧气在放电条件下反应生成一氧化氮,B正确;矾指的是金属的硫酸盐,C正确;《天工开物》中“凡火药,硫为纯阳”,其硫指的是硫黄,D错误。
2.C 玻璃钢属于复合材料,压电陶瓷属于新型无机非金属材料,A错误;CaO可吸收SO2最终生成CaSO4,从而可以减少酸雨的形成,但高温下CaO不能吸收CO2,B错误;葡萄酒中添加适量的二氧化硫可以起到杀菌的作用,C正确;氮的固定是将游离态的氮转化为化合态的氮的过程,植物不能直接吸收利用空气中的NO和NO2作为肥料,D错误。
3.A 液氨汽化时吸收大量热,能使环境温度降低,具有制冷作用,可用作制冷剂,A正确;NH4HCO3含有植物生长所需的营养元素N,则NH4HCO3可用作化学肥料,B错误;SO2能与某些有色物质结合生成无色物质,表现出漂白性,可用作纸浆漂白剂,C错误;浓硫酸可用作气体干燥剂,是因为其具有吸水性,D错误。
4.A A项,能使pH试纸变红的溶液显酸性,N、Na+、S、Fe3+、N之间互不反应,且均不与H+反应,可以大量共存;B项,H+、Fe2+、N会发生氧化还原反应,不能大量共存;C项,Fe3+、Mg2+分别与OH-反应产生Fe(OH)3、Mg(OH)2沉淀,不能大量共存;D项,加入铁粉后产生大量氢气的溶液显酸性,H+与C反应,不能大量共存。
5.C N2的电子式为··NN··,A正确;根据题图可知,N2、H2O发生反应得到NH3、O2,该反应的化学方程式为2N2+6H2O 4NH3+3O2,B正确;根据化学方程式2N2+6H2O 4NH3+3O2,反应消耗28 g N2,转移电子的数目为N6A,C错误;该过程实现了在常温、常压下氮的固定,太阳能向化学能转化,比工业上合成氨能耗小,对设备要求低,D正确。
6.C A项,若X是NH3,Y是水,将水滴入锥形瓶中,NH3极易溶于水,锥形瓶内压强减小,小气球a鼓起;B项,若X是SO2,Y是NaOH浓溶液,将NaOH浓溶液滴入锥形瓶中,SO2与NaOH反应,锥形瓶内压强减小,小气球a鼓起;C项,若X是CO2,Y是稀硫酸,将稀硫酸滴入锥形瓶中,CO2与H2SO4不反应,且CO2在水中的溶解度不大,锥形瓶中的压强变化不大,小气球a变化不明显;D项,若X是HCl,Y是NaNO3稀溶液,将NaNO3稀溶液滴入锥形瓶中,HCl极易溶于水,锥形瓶内压强减小,小气球a鼓起;故选C。
7.C 根据化合价以及物质的类别可知a为H2S,b为S,c为SO2,d为H2SO3,e为H2SO4,f中可能含S、HS等,g中可能含S、HS等。a为H2S,可以和SO2、H2SO3、H2SO4(浓)发生反应生成硫单质,A正确;H2SO3具有较强的还原性,在空气中久置会被氧气氧化成H2SO4,相同条件下,H2SO4酸性更强,pH更小,B正确;g中可能含S、HS等,f中可能含S、HS等,g、f之间不一定能发生氧化还原反应,C错误;SO2与BaCl2溶液不反应,所以SO2通入BaCl2溶液中没有明显现象,D正确。
8.A S与浓HNO3反应生成H2SO4、NO2和H2O,该反应中只体现了浓硝酸的强氧化性,A项错误;吸收塔中用98.3%的浓硫酸吸收SO3,能防止产生酸雾,B项正确;途径①和②都是利用S制备H2SO4,制取1 mol H2SO4,理论上各消耗1 mol S,均转移6 mol e-,C项正确;途径①产生污染大气的NO2,途径②与途径①相比更能体现“绿色化学”的理念,D项正确。
9.C Na2S4O6和盐酸反应有SO2生成,SO2和水反应生成H2SO3,H2SO3能使紫色石蕊溶液变红,A正确;SO2具有还原性,能使酸性高锰酸钾溶液褪色,B正确;SO2和水反应生成H2SO3,酸性条件下N具有强氧化性,能将+4价的硫氧化成+6价,所以Ⅳ中有BaSO4白色沉淀生成,C错误;SO2有毒,会污染环境,本实验应连接尾气处理装置,D正确。
10.C 向NaHS溶液中滴入稀盐酸,生成H2S,说明酸性HCl>H2S,但无法比较Cl、S的非金属性,A错误;白色沉淀可能为AgCl,因此不能说明题述溶液中一定含有,B错误;根据C项的实验现象可知,浓硫酸具有脱水性和氧化性,C正确;NO2不一定是由木炭和浓硝酸反应生成的,也可能是浓硝酸受热分解生成的,D错误。
11.C 先检查装置气密性,加入药品后,为防止装置中的氧气影响实验结果,需关闭c,打开a和b,通入一段时间氮气,将装置内的空气排尽,A正确;关闭a、c,打开b及分液漏斗活塞,浓硝酸与Cu反应生成NO2,NO2通入水中,与水反应生成NO,NO进入丙和丁后,丙中含Fe2+的溶液变为深棕色,而丁中无明显变化,说明NO与Fe2+反应,B正确;甲中反应一段时间后浓硝酸变稀,生成的气体中有NO,所以该操作无法证明NO2是否与Fe2+反应,C错误;NO2和NO会污染空气,需要进行尾气处理,D正确。
12.C 该工业废气通过过量的石灰乳,CO2、SO2被吸收,生成CaCO3和CaSO3,A项错误;剩余的气体中含有N2、NO和CO,从后面产物有NaNO2知,通入的X可能是空气,将NO氧化为NO2,但不能过量,B项错误;气体2为N2、CO,N2为无污染气体,所以捕获的气体主要是CO,C项正确;处理含N废水时,生成的是无污染气体,故不可能生成NO,D项错误。
13.A (NH4)2SO4分解的化学方程式为4(NH4)2SO4 N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,设分解了4 mol (NH4)2SO4,则生成的N2、NH3、SO2、SO3的物质的量分别为1 mol、6 mol、3 mol、1 mol,分解产生的气体通入BaCl2溶液中,发生反应2NH3+SO3+H2O (NH4)2SO4、(NH4)2SO4+BaCl2 BaSO4↓+2NH4Cl,此过程中消耗1 mol SO3、2 mol NH3生成1 mol BaSO4沉淀;还剩余4 mol NH3,最终从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应,说明3 mol SO2全部反应,则发生的反应为4NH3+3SO2+3H2O (NH4)2SO3+2NH4HSO3、(NH4)2SO3+BaCl2 BaSO3↓+2NH4Cl,此过程将4 mol NH3、3 mol SO2全部消耗,生成1 mol BaSO3沉淀;根据上述分析,生成的沉淀中既有BaSO4又有BaSO3,且n(BaSO4)∶n(BaSO3)为1∶1,从溶液中逸出的气体只有N2,最后溶液所含的溶质有NH4Cl、NH4HSO3等,故选A。
14.D 装置甲用于制备NO气体,NO能与空气中的氧气反应生成NO2,因此制备出的NO气体中混有水蒸气、硝酸蒸气和NO2,水蒸气能与铁反应,干扰实验,需利用装置己除去;NO2与水反应生成硝酸和NO,硝酸蒸气可被水吸收,NO有毒,需要有尾气处理装置,结合题中已知可知,应先将反应后剩余的NO通过浓硝酸进行氧化,再通过NaOH溶液进行吸收,因此装置的连接顺序是a→f→e→j→i→h→g(或g→h)→b→c→d,A正确;NO与铁粉反应生成N2和FeO,其反应的化学方程式为2NO+2Fe2FeO+N2,B正确;装置丁的作用是除去挥发出来的硝酸和产生的NO2,C正确;浓硝酸的作用是将NO氧化成NO2,D错误。
15.A 由题意可知铁铝合金质量与最终所得固体(Fe2O3)质量相等,其流程中Fe元素无损失,即合金中铝的质量等于Fe2O3中氧元素的质量,则m(Fe)∶m(Al)=(2×56)∶(3×16)=7∶3,而n(Fe)∶n(Al)==9∶8,A项错误;合金中n(Fe)=×2=0.09 mol,即所得m[Fe(OH)3]=0.09 mol×107 g/mol=9.63 g,B项正确;根据得失电子守恒,Fe、Al失去电子共3×(0.09+0.08) mol=3×0.17 mol,则3×n(NO)=3×0.17 mol,解得n(NO)=0.17 mol,故V1=3.808,C项正确;依据题意可知滤液Ⅰ主要成分为Na[Al(OH)4]、NaNO3和NaOH,Fe3+已全部转化为Fe(OH)3沉淀,D项正确。
16.答案 (除标注外,每空2分)
(1)④⑥ (2)第三周期第ⅣA族(1分) OCO(1分) SiO2(1分) SiO2+4HF SiF4↑+2H2O (3)SiO2+2C 2CO↑+Si 1∶2 (4)SiHCl3+H2 Si+3HCl
解析 (1)①陶瓷餐具为硅酸盐制品,②门窗玻璃为硅酸盐制品,③水晶镜片为二氧化硅制品,④硅太阳能电池为硅制品,⑤光导纤维为二氧化硅制品,⑥手机芯片为硅制品,直接使用了硅单质的是④⑥。
(2)Si是14号元素,在元素周期表中位于第三周期第ⅣA族;二氧化碳为共价化合物,结构式为OCO;石英砂的主要成分为SiO2,其能溶于HF的水溶液,反应产生SiF4气体和H2O,化学方程式为SiO2+4HF SiF4↑+2H2O。
(3)电弧炉中二氧化硅和碳反应生成一氧化碳和粗硅,反应的化学方程式为SiO2+2C 2CO↑+Si。若电弧炉中焦炭过量,还会有SiC生成,石英砂和焦炭生成SiC的反应方程式为SiO2+3C 2CO↑+SiC,该反应中C既是氧化剂,又是还原剂,氧化剂和还原剂的物质的量之比为1∶2。
(4)SiHCl3与过量H2在1 100 ℃下反应,生成高纯硅和HCl,化学方程式为SiHCl3+H2 Si+3HCl。
17.答案 (每空2分)
(1)②④
(2)ac
(3)2H2S+SO2 3S↓+2H2O
(4)①3Cu+8H++2N 3Cu2++2NO↑+4H2O ②3NO2+H2O 2HNO3+NO 0.6 mol
解析 (1)常温下,Fe遇浓硫酸、浓硝酸发生钝化,无明显现象;Fe与稀硫酸反应生成硫酸亚铁和氢气,产生气泡,溶液变为浅绿色;Fe和稀硝酸反应生成硝酸铁(Fe过量时生成硝酸亚铁)、水和NO,溶液变为棕黄色(或浅绿色),产生无色气泡,逸出液面后迅速变为红棕色;所以能观察到明显现象的是②④,无明显现象的是①③。
(2)铜与浓硫酸共热反应产生的气体X为SO2,与Ba(OH)2反应先生成BaSO3白色沉淀,然后BaSO3与SO2、H2O反应生成Ba(HSO3)2,沉淀溶解;铜与浓硝酸反应产生的气体Y为NO2,通入题图装置中,NO2与H2O反应生成HNO3,HNO3与Ba(HSO3)2反应生成BaSO4沉淀,故a、c正确。
(3)SO2与H2S溶液反应生成S单质和水,化学方程式为2H2S+SO2 3S↓+2H2O。
(4)①随着反应的进行,浓硝酸浓度减小,Cu与稀硝酸反应的离子方程式为3Cu+8H++2N 3Cu2++2NO↑+4H2O。②NO2可与水发生反应生成硝酸和NO,化学方程式为3NO2+H2O 2HNO3+NO,该反应中3 mol NO2参与反应时,2 mol NO2被氧化,转移2 mol电子,所以若该反应有0.6NA个电子转移,被氧化的NO2的物质的量为0.6 mol。
18.答案 (除标注外,每空2分)
(1)增大固体接触面积,加快反应速率,提高原料利用率(3分) SO2、Cu (2)2Fe2++Cl2 2Fe3++2Cl- (3)取最后一次洗涤液,先加入稀硝酸,再加入硝酸银溶液,若没有生成白色沉淀,说明洗涤干净(3分) (4)Fe4N (5)4Fe(OH)2+2H2O+O2 4Fe(OH)3 (6)Fe2O3+2NH3 2Fe+N2+3H2O
解析 (1)将黄铜矿粉碎成粉末的目的是增大固体接触面积,加快反应速率,提高原料利用率;高温焙烧时,根据已知信息可知,CuFeS2转化为SO2、FeS、Cu,铜元素的化合价由+2价降低为0价,被还原,氧气中氧元素的化合价由0价降低为-2价,被还原为SO2,所以还原产物是SO2、Cu。(2)用6 mol·L-1的盐酸溶解,滤液A中含有氯化亚铁,通入氯气,把氯化亚铁氧化成氯化铁,反应的离子方程式为2Fe2++Cl2 2Fe3++2Cl-。(3)通入氨气生成氢氧化铁沉淀,过滤得到氢氧化铁,焙烧氢氧化铁得氧化铁;检验滤渣已经洗涤干净,可以通过检验最后一次洗涤液中不含氯离子,其实验操作为取最后一次洗涤液,先加入稀硝酸,再加入硝酸银溶液,若没有生成白色沉淀,说明滤渣已洗涤干净。(4)根据流程图可知,反应液加足量NaOH溶液并加热,产生氨气,说明化合物M中含有氮元素;白色沉淀乙→红褐色沉淀丙,说明化合物M中含有铁元素;红褐色沉淀丙 固体丁(14.40 g),固体丁为氧化铁,则铁元素的质量为 g=10.08 g,氮元素质量为10.71 g-10.08 g=0.63 g,铁、氮两种原子的物质的量之比为=4∶1,所以M的化学式为Fe4N。(5)白色沉淀乙是氢氧化亚铁,在空气中被氧气氧化为红褐色氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O 4Fe(OH)3。(6)在高温条件下,氧化铁与氨气反应生成铁、氮气和水,化学方程式为Fe2O3+2NH3 2Fe+N2+3H2O。
19.答案 (每空2分)
(1)①2H2S+O22S+2H2O ②AC
(2)①2NO+O22NO2 ②BaO ③S
(3)2Ba2BaO+4NO2↑+O2↑
解析 (1)①方法Ⅰ中H2S和O2反应生成S和H2O。②Cu2+和H2S反应生成CuS和H+,离子方程式为Cu2++H2SCuS↓+2H+,A错误;由图1可以看出,Fe2+在O2作用下变成Fe3+,发生反应的离子方程式为O2+4Fe2++4H++2H2O,B正确;若不考虑产生的水的稀释,由总反应2H2S+O22S↓+2H2O可知,反应过程中溶液的pH不变,C错误;提高混合气体中O2的比例,O2充足时,反应过程中的Fe2+能被充分氧化为Fe3+,而充足的Fe3+可将CuS氧化为S,从而防止生成的硫单质中混有CuS,D正确。
(2)①由图2可知,NO和O2在催化剂Pt表面发生反应生成NO2,反应的化学方程式为2NO+O22NO2;②由图2可以看出,NO2在BaO中储存;③NO2和H2S发生氧化还原反应,NO2为氧化剂,还原产物为N2,处理0.2 mol H2S,转移0.4 mol电子,消耗0.1 mol NO2,根据得失电子守恒,硫元素化合价应从-2价升高到0价,故氧化产物X的化学式应为S。
(3)装置②中有气泡产生,但在上升的过程中消失,紫色石蕊溶液逐渐变为红色,液体几乎不被压至装置③中,说明产生的气体和水完全反应,Ba(NO3)2受热分解的化学方程式为2Ba(NO3)22BaO+4NO2↑+O2↑,由质量守恒定律可知,NO2、O2的总质量为(m-n)g,设NO2的物质的量为n1 mol,O2的物质的量为n2 mol,则,解得n1=,装置②中发生的反应为4NO2+O2+2H2O4HNO3,溶质为HNO3,由反应可知n(HNO3)=n(NO2)= mol,所以装置②中溶液的物质的量浓度为 mol·L-1。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学必修第二册
第五章 化工生产中的重要非金属元素
注意事项
1.全卷满分100分。考试用时75分钟。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 Si-28 S-32 Fe-56 Ba-137。
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.中华传统文化中蕴含着很多化学知识,下列说法错误的是( )
A.“落红不是无情物,化作春泥更护花”蕴含着自然界中的碳、氮循环
B.《元丰行示德逢》里“雷蟠电掣云滔滔,夜半载雨输亭皋”涉及化学反应N2+O22NO
C.《天工开物》中有“至于矾现五色之形,硫为群石之将,皆变化于烈火”,其矾指的是金属硫酸盐
D.《天工开物》中“凡火药,硫为纯阳”,其硫指的是浓硫酸
2.下列说法正确的是( )
A.玻璃钢和压电陶瓷都属于新型无机非金属材料
B.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
C.二氧化硫可用于杀菌,是一种食品添加剂
D.植物直接吸收利用空气中的NO和NO2作为肥料,实现氮的固定
3.氮和硫是化工生产中的重要元素。下列相关物质的性质与用途具有对应关系的是( )
A.液氨汽化时吸收大量热,可用作制冷剂
B.碳酸氢铵受热易分解,可用作化学肥料
C.二氧化硫易溶于水,可用作纸浆漂白剂
D.浓硫酸具有脱水性,可用作气体干燥剂
4.下列离子组在指定条件下的溶液中,一定能大量共存的是( )
A.能使pH试纸变红的溶液:N、Na+、S、Fe3+、N
B.含有大量N的溶液:H+、Fe2+、S、Cl-
C.含有大量Cl-的溶液:Fe3+、Mg2+、S、OH-
D.加入铁粉后产生大量氢气的溶液:N、Na+、C、S
5.我国科研团队借助一种固体催化剂(LDH),在常温、常压和可见光条件下合成了氨,其过程如图所示。下列有关说法不正确的是( )
A.N2的电子式是··NN··
B.反应的化学方程式为2N2+6H2O 4NH3+3O2
C.反应消耗28 g N2,转移电子的数目为3NA
D.该方法比工业上合成氨能耗小,对设备要求低
6.锥形瓶内盛有气体X,胶头滴管内盛有液体Y。若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿可见小气球a有很明显鼓起现象。气体X和液体Y不可能是( )
A.X是NH3,Y是水
B.X是SO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
7.硫元素的“价—类”二维图如图所示,下列说法错误的是( )
A.a与c、d、e都有可能反应生成b
B.d溶液久置于空气中会生成e,溶液的pH减小
C.盐g与盐f之间一定能发生氧化还原反应
D.将气体c通入BaCl2溶液中,无明显现象
8.用下列两种途径制取H2SO4(某些反应条件和产物已省略),下列有关说法错误的是( )
途径①:SH2SO4;途径②:SSO2SO3H2SO4
A.途径①中的反应体现了浓硝酸的强氧化性和酸性
B.在实际工业生产中,途径②的第三步在吸收塔中进行,宜用98.3%的浓硫酸作吸收剂
C.由途径①和②分别制取1 mol H2SO4,理论上均消耗1 mol S,均共转移6 mol电子
D.途径②相对于途径①更能体现“绿色化学”的理念,因为途径②的污染相对于途径①更小
9.连四硫酸钠(Na2S4O6)与盐酸反应的离子方程式为2S4+4H+ 3S↓+5SO2↑+2H2O,
按如图装置制备足量SO2并探究其性质。下列表述不正确的是( )
A.Ⅱ中溶液由紫色变成红色
B.Ⅲ中溶液褪色说明SO2有还原性
C.Ⅳ中溶液无明显变化
D.基于环保,本实验应连接尾气处理装置
10.根据下列实验操作和现象,所得结论正确的是( )
选项 实验操作 现象 结论
A 向NaHS溶液中滴入稀盐酸 生成臭鸡蛋气味气体(经检验为H2S) 非金属性:Cl>S
B 向某溶液中加入BaCl2溶液 有白色沉淀生成 该溶液中一定含有S
C 将浓硫酸与蔗糖混合搅拌,并用湿润的品红试纸检验产生的气体 蔗糖变黑,品红试纸褪色 浓硫酸具有脱水性和氧化性
D 向浓硝酸中插入红热的木炭 产生红棕色气体 红棕色的NO2一定是由木炭和浓硝酸反应生成的
11.某同学做“FeSO4被HNO3氧化”的实验,发现溶液变深棕色。猜想可能是生成的NO2或NO与Fe2+或Fe3+反应,使溶液变为深棕色,设计下列装置探究。下列说法错误的是( )
A.先检查装置气密性,加入药品后,关闭c,打开a和b,通入一段时间N2
B.关闭a、c,打开b及分液漏斗活塞,反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO与Fe2+反应
C.甲中反应一段时间后,更新丙、丁中试剂,关闭a和b,打开c,反应后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO2也可与Fe2+反应
D.该实验的缺陷是缺少尾气处理装置
12.某工厂拟综合处理含N废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法正确的是( )
A.固体1是CaSO3
B.X可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含N废水时,发生的反应为N+4H+ 6NO↑+4H2O
13.(NH4)2SO4在一定条件下发生反应:4(NH4)2SO4 N2↑+6NH3↑+3SO2↑+SO3↑+7H2O。将反应后的气体通入一定量的BaCl2溶液中,发现溶液中有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是( )
A.生成的沉淀中既有BaSO4又有BaSO3,且n(BaSO4)∶n(BaSO3)约为1∶1
B.生成的沉淀中既有BaSO4又有BaSO3,且n(BaSO4)∶n(BaSO3)约为1∶2
C.因为弱酸不能制强酸,所以该实验中反应后气体通入BaCl2溶液中只有BaSO4沉淀
D.从溶液中逸出的气体只有N2,最后溶液所含的溶质只有NH4Cl
14.某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO),下列说法不正确的是( )
甲 乙 丙 丁 戊 己
已知:①浓硝酸可氧化NO。②NaOH溶液能吸收NO2,不能吸收NO。
A.装置的连接顺序为a→f→e→j→i→h→g(或g→h)→b→c→d
B.装置戊中发生反应的化学方程式:2NO+2Fe2FeO+N2
C.装置丁的作用是除去挥发出来的硝酸和产生的NO2
D.装置乙的作用是干燥,防止水蒸气进入戊中干扰反应
15.取7.2 g某铁铝合金溶于足量的稀硝酸中,金属无剩余。测得产生的气体体积为V1 L(标准状况)。向所得溶液中加过量的NaOH溶液出现红褐色沉淀,随后沉淀部分溶解,过滤得滤液Ⅰ。收集沉淀,洗涤、干燥、称重得m1 g,再加热至恒重,得固体质量为7.2 g。下列说法错误的是( )
A.合金中Fe与Al的物质的量之比为7∶3
B.m1=9.63
C.如果产生的气体只有NO,则V1=3.808
D.滤液Ⅰ主要成分为NaOH、NaNO3、Na[Al(OH)4]
二、非选择题(本题共4小题,共55分)
16.(13分)高纯硅用于制作光伏电池,一种生产高纯硅的工艺流程如下:
(1)①陶瓷餐具、②门窗玻璃、③水晶镜片、④硅太阳能电池、⑤光导纤维、⑥手机芯片。直接使用了硅单质的是 (填序号)。
(2)Si在元素周期表中的位置为 。硅与碳同主族,二氧化碳的结构式为 ;石英砂的主要成分为 ,它是制普通玻璃的原料之一,工业上通常用HF的水溶液溶蚀玻璃制磨砂玻璃,该过程的化学方程式为 。
(3)电弧炉中生成粗硅,反应的化学方程式为 。若电弧炉中焦炭过量,还会有SiC生成,石英砂和焦炭生成SiC的反应中,氧化剂和还原剂的物质的量之比为 。
(4)还原炉中用SiHCl3与过量H2在1 100 ℃下反应,试写出反应的化学方程式: 。
17.(12分)某同学欲探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铁、铜反应的实验中的有关问题。
(1)在常温下,分别向盛有等量铁片的四支试管中加入等体积的①浓硫酸、②稀硫酸、③浓硝酸、④稀硝酸,能观察到明显现象的是 (填序号)。
(2)先将铜与浓硫酸共热反应产生的气体X持续通入如图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括 (填字母)。
a.通入X气体后先产生白色沉淀后溶解
b.通入X气体后溶液中无明显现象
c.通入Y气体后有沉淀产生
d.通入Y气体后沉淀溶解
e.通入Y气体后溶液中无明显现象
(3)若将(2)的Ba(OH)2换为氢硫酸,则通入X气体后,反应的化学方程式为 。
(4)将过量的铜加入一定量的浓硝酸中,充分反应。
①反应一段时间后的离子方程式为 。
②生成的NO2可与水发生反应,反应的化学方程式为 ;若该反应有0.6NA个电子转移,则被氧化的NO2的物质的量为 。(NA为阿伏加德罗常数的值)
18.(16分)Ⅰ.用黄铜矿(主要成分为CuFeS2,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
已知:CuFeS2+O2 SO2+FeS+Cu。
(1)将黄铜矿粉碎成粉末的目的是 。高温焙烧反应的还原产物是 。
(2)滤液A中通入Cl2,反应的离子方程式为 。
(3)操作b后检验滤渣已经洗涤干净的实验操作为 。
Ⅱ.化合物M是某种新型电子材料的主要成分,由两种常见元素组成。为了研究其组成,设计如下实验:
(4)M的化学式为 。
(5)白色沉淀乙在空气中变成红褐色沉淀丙的原因是 (用化学方程式表示)。
(6)高温条件下,丁与NH3反应生成两种单质和水,该反应的化学方程式为 。
19.(14分)(1)将H2S转化为可再利用的资源是能源研究领域的重要课题。H2S的转化目前主要有以下两种方法:
方法Ⅰ 克劳斯燃烧法 H2SS
方法Ⅱ 铁盐、铜盐氧化法 H2SS
①方法Ⅰ的化学方程式是 。
②方法Ⅱ,将H2S和O2的混合气体通入FeCl3、CuCl2的混合溶液中反应回收S,物质转化如图1所示。下列说法不正确的是 (填字母)。
A.Cu2+和H2S反应的离子方程式为S2-+Cu2+CuS↓
B.O2在转化过程中发生的反应为O2+4Fe2++4H+4Fe3++2H2O
C.整个反应过程中溶液的pH变小(不考虑产生的H2O对溶液的稀释)
D.提高混合气体中O2的比例可防止生成的硫单质中混有CuS
(2)Pt-BaO双催化剂处理大气中的NO和H2S,工作原理如图2所示。
①NO和O2在催化剂Pt表面发生反应的化学方程式为 。
②通过BaO和Ba(NO3)2的相互转化实现NO2的储存和还原,储存NO2的物质是 (填化学式)。
③NO2协同处理H2S过程中,NO2与H2S按物质的量之比1∶2通入,每处理0.2mol H2S时,转移电子数为0.4NA,则产物X的化学式为 。
(3)某同学结合HNO3受热分解的规律,采用图3所示装置加热Ba固体探究Ba分解规律。加热过程中发现装置②中有气泡产生,但在上升的过程中消失;紫色石蕊溶液逐渐变为红色;②中溶液几乎不被压至装置③中。写出Ba受热分解的化学方程式: 。
图3
加热前称重为m g(含试管),反应结束后,冷却,再次称重为n g(含试管),反应结束后装置②中溶液的物质的量浓度为 mol·L-1(用含m和n的式子表示,溶液体积视为100 mL)。
答案与解析
1.D “落红不是无情物,化作春泥更护花”蕴含着自然界中的物质循环,其中包括碳、氮循环,A正确;氮气和氧气在放电条件下反应生成一氧化氮,B正确;矾指的是金属的硫酸盐,C正确;《天工开物》中“凡火药,硫为纯阳”,其硫指的是硫黄,D错误。
2.C 玻璃钢属于复合材料,压电陶瓷属于新型无机非金属材料,A错误;CaO可吸收SO2最终生成CaSO4,从而可以减少酸雨的形成,但高温下CaO不能吸收CO2,B错误;葡萄酒中添加适量的二氧化硫可以起到杀菌的作用,C正确;氮的固定是将游离态的氮转化为化合态的氮的过程,植物不能直接吸收利用空气中的NO和NO2作为肥料,D错误。
3.A 液氨汽化时吸收大量热,能使环境温度降低,具有制冷作用,可用作制冷剂,A正确;NH4HCO3含有植物生长所需的营养元素N,则NH4HCO3可用作化学肥料,B错误;SO2能与某些有色物质结合生成无色物质,表现出漂白性,可用作纸浆漂白剂,C错误;浓硫酸可用作气体干燥剂,是因为其具有吸水性,D错误。
4.A A项,能使pH试纸变红的溶液显酸性,N、Na+、S、Fe3+、N之间互不反应,且均不与H+反应,可以大量共存;B项,H+、Fe2+、N会发生氧化还原反应,不能大量共存;C项,Fe3+、Mg2+分别与OH-反应产生Fe(OH)3、Mg(OH)2沉淀,不能大量共存;D项,加入铁粉后产生大量氢气的溶液显酸性,H+与C反应,不能大量共存。
5.C N2的电子式为··NN··,A正确;根据题图可知,N2、H2O发生反应得到NH3、O2,该反应的化学方程式为2N2+6H2O 4NH3+3O2,B正确;根据化学方程式2N2+6H2O 4NH3+3O2,反应消耗28 g N2,转移电子的数目为N6A,C错误;该过程实现了在常温、常压下氮的固定,太阳能向化学能转化,比工业上合成氨能耗小,对设备要求低,D正确。
6.C A项,若X是NH3,Y是水,将水滴入锥形瓶中,NH3极易溶于水,锥形瓶内压强减小,小气球a鼓起;B项,若X是SO2,Y是NaOH浓溶液,将NaOH浓溶液滴入锥形瓶中,SO2与NaOH反应,锥形瓶内压强减小,小气球a鼓起;C项,若X是CO2,Y是稀硫酸,将稀硫酸滴入锥形瓶中,CO2与H2SO4不反应,且CO2在水中的溶解度不大,锥形瓶中的压强变化不大,小气球a变化不明显;D项,若X是HCl,Y是NaNO3稀溶液,将NaNO3稀溶液滴入锥形瓶中,HCl极易溶于水,锥形瓶内压强减小,小气球a鼓起;故选C。
7.C 根据化合价以及物质的类别可知a为H2S,b为S,c为SO2,d为H2SO3,e为H2SO4,f中可能含S、HS等,g中可能含S、HS等。a为H2S,可以和SO2、H2SO3、H2SO4(浓)发生反应生成硫单质,A正确;H2SO3具有较强的还原性,在空气中久置会被氧气氧化成H2SO4,相同条件下,H2SO4酸性更强,pH更小,B正确;g中可能含S、HS等,f中可能含S、HS等,g、f之间不一定能发生氧化还原反应,C错误;SO2与BaCl2溶液不反应,所以SO2通入BaCl2溶液中没有明显现象,D正确。
8.A S与浓HNO3反应生成H2SO4、NO2和H2O,该反应中只体现了浓硝酸的强氧化性,A项错误;吸收塔中用98.3%的浓硫酸吸收SO3,能防止产生酸雾,B项正确;途径①和②都是利用S制备H2SO4,制取1 mol H2SO4,理论上各消耗1 mol S,均转移6 mol e-,C项正确;途径①产生污染大气的NO2,途径②与途径①相比更能体现“绿色化学”的理念,D项正确。
9.C Na2S4O6和盐酸反应有SO2生成,SO2和水反应生成H2SO3,H2SO3能使紫色石蕊溶液变红,A正确;SO2具有还原性,能使酸性高锰酸钾溶液褪色,B正确;SO2和水反应生成H2SO3,酸性条件下N具有强氧化性,能将+4价的硫氧化成+6价,所以Ⅳ中有BaSO4白色沉淀生成,C错误;SO2有毒,会污染环境,本实验应连接尾气处理装置,D正确。
10.C 向NaHS溶液中滴入稀盐酸,生成H2S,说明酸性HCl>H2S,但无法比较Cl、S的非金属性,A错误;白色沉淀可能为AgCl,因此不能说明题述溶液中一定含有,B错误;根据C项的实验现象可知,浓硫酸具有脱水性和氧化性,C正确;NO2不一定是由木炭和浓硝酸反应生成的,也可能是浓硝酸受热分解生成的,D错误。
11.C 先检查装置气密性,加入药品后,为防止装置中的氧气影响实验结果,需关闭c,打开a和b,通入一段时间氮气,将装置内的空气排尽,A正确;关闭a、c,打开b及分液漏斗活塞,浓硝酸与Cu反应生成NO2,NO2通入水中,与水反应生成NO,NO进入丙和丁后,丙中含Fe2+的溶液变为深棕色,而丁中无明显变化,说明NO与Fe2+反应,B正确;甲中反应一段时间后浓硝酸变稀,生成的气体中有NO,所以该操作无法证明NO2是否与Fe2+反应,C错误;NO2和NO会污染空气,需要进行尾气处理,D正确。
12.C 该工业废气通过过量的石灰乳,CO2、SO2被吸收,生成CaCO3和CaSO3,A项错误;剩余的气体中含有N2、NO和CO,从后面产物有NaNO2知,通入的X可能是空气,将NO氧化为NO2,但不能过量,B项错误;气体2为N2、CO,N2为无污染气体,所以捕获的气体主要是CO,C项正确;处理含N废水时,生成的是无污染气体,故不可能生成NO,D项错误。
13.A (NH4)2SO4分解的化学方程式为4(NH4)2SO4 N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,设分解了4 mol (NH4)2SO4,则生成的N2、NH3、SO2、SO3的物质的量分别为1 mol、6 mol、3 mol、1 mol,分解产生的气体通入BaCl2溶液中,发生反应2NH3+SO3+H2O (NH4)2SO4、(NH4)2SO4+BaCl2 BaSO4↓+2NH4Cl,此过程中消耗1 mol SO3、2 mol NH3生成1 mol BaSO4沉淀;还剩余4 mol NH3,最终从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应,说明3 mol SO2全部反应,则发生的反应为4NH3+3SO2+3H2O (NH4)2SO3+2NH4HSO3、(NH4)2SO3+BaCl2 BaSO3↓+2NH4Cl,此过程将4 mol NH3、3 mol SO2全部消耗,生成1 mol BaSO3沉淀;根据上述分析,生成的沉淀中既有BaSO4又有BaSO3,且n(BaSO4)∶n(BaSO3)为1∶1,从溶液中逸出的气体只有N2,最后溶液所含的溶质有NH4Cl、NH4HSO3等,故选A。
14.D 装置甲用于制备NO气体,NO能与空气中的氧气反应生成NO2,因此制备出的NO气体中混有水蒸气、硝酸蒸气和NO2,水蒸气能与铁反应,干扰实验,需利用装置己除去;NO2与水反应生成硝酸和NO,硝酸蒸气可被水吸收,NO有毒,需要有尾气处理装置,结合题中已知可知,应先将反应后剩余的NO通过浓硝酸进行氧化,再通过NaOH溶液进行吸收,因此装置的连接顺序是a→f→e→j→i→h→g(或g→h)→b→c→d,A正确;NO与铁粉反应生成N2和FeO,其反应的化学方程式为2NO+2Fe2FeO+N2,B正确;装置丁的作用是除去挥发出来的硝酸和产生的NO2,C正确;浓硝酸的作用是将NO氧化成NO2,D错误。
15.A 由题意可知铁铝合金质量与最终所得固体(Fe2O3)质量相等,其流程中Fe元素无损失,即合金中铝的质量等于Fe2O3中氧元素的质量,则m(Fe)∶m(Al)=(2×56)∶(3×16)=7∶3,而n(Fe)∶n(Al)==9∶8,A项错误;合金中n(Fe)=×2=0.09 mol,即所得m[Fe(OH)3]=0.09 mol×107 g/mol=9.63 g,B项正确;根据得失电子守恒,Fe、Al失去电子共3×(0.09+0.08) mol=3×0.17 mol,则3×n(NO)=3×0.17 mol,解得n(NO)=0.17 mol,故V1=3.808,C项正确;依据题意可知滤液Ⅰ主要成分为Na[Al(OH)4]、NaNO3和NaOH,Fe3+已全部转化为Fe(OH)3沉淀,D项正确。
16.答案 (除标注外,每空2分)
(1)④⑥ (2)第三周期第ⅣA族(1分) OCO(1分) SiO2(1分) SiO2+4HF SiF4↑+2H2O (3)SiO2+2C 2CO↑+Si 1∶2 (4)SiHCl3+H2 Si+3HCl
解析 (1)①陶瓷餐具为硅酸盐制品,②门窗玻璃为硅酸盐制品,③水晶镜片为二氧化硅制品,④硅太阳能电池为硅制品,⑤光导纤维为二氧化硅制品,⑥手机芯片为硅制品,直接使用了硅单质的是④⑥。
(2)Si是14号元素,在元素周期表中位于第三周期第ⅣA族;二氧化碳为共价化合物,结构式为OCO;石英砂的主要成分为SiO2,其能溶于HF的水溶液,反应产生SiF4气体和H2O,化学方程式为SiO2+4HF SiF4↑+2H2O。
(3)电弧炉中二氧化硅和碳反应生成一氧化碳和粗硅,反应的化学方程式为SiO2+2C 2CO↑+Si。若电弧炉中焦炭过量,还会有SiC生成,石英砂和焦炭生成SiC的反应方程式为SiO2+3C 2CO↑+SiC,该反应中C既是氧化剂,又是还原剂,氧化剂和还原剂的物质的量之比为1∶2。
(4)SiHCl3与过量H2在1 100 ℃下反应,生成高纯硅和HCl,化学方程式为SiHCl3+H2 Si+3HCl。
17.答案 (每空2分)
(1)②④
(2)ac
(3)2H2S+SO2 3S↓+2H2O
(4)①3Cu+8H++2N 3Cu2++2NO↑+4H2O ②3NO2+H2O 2HNO3+NO 0.6 mol
解析 (1)常温下,Fe遇浓硫酸、浓硝酸发生钝化,无明显现象;Fe与稀硫酸反应生成硫酸亚铁和氢气,产生气泡,溶液变为浅绿色;Fe和稀硝酸反应生成硝酸铁(Fe过量时生成硝酸亚铁)、水和NO,溶液变为棕黄色(或浅绿色),产生无色气泡,逸出液面后迅速变为红棕色;所以能观察到明显现象的是②④,无明显现象的是①③。
(2)铜与浓硫酸共热反应产生的气体X为SO2,与Ba(OH)2反应先生成BaSO3白色沉淀,然后BaSO3与SO2、H2O反应生成Ba(HSO3)2,沉淀溶解;铜与浓硝酸反应产生的气体Y为NO2,通入题图装置中,NO2与H2O反应生成HNO3,HNO3与Ba(HSO3)2反应生成BaSO4沉淀,故a、c正确。
(3)SO2与H2S溶液反应生成S单质和水,化学方程式为2H2S+SO2 3S↓+2H2O。
(4)①随着反应的进行,浓硝酸浓度减小,Cu与稀硝酸反应的离子方程式为3Cu+8H++2N 3Cu2++2NO↑+4H2O。②NO2可与水发生反应生成硝酸和NO,化学方程式为3NO2+H2O 2HNO3+NO,该反应中3 mol NO2参与反应时,2 mol NO2被氧化,转移2 mol电子,所以若该反应有0.6NA个电子转移,被氧化的NO2的物质的量为0.6 mol。
18.答案 (除标注外,每空2分)
(1)增大固体接触面积,加快反应速率,提高原料利用率(3分) SO2、Cu (2)2Fe2++Cl2 2Fe3++2Cl- (3)取最后一次洗涤液,先加入稀硝酸,再加入硝酸银溶液,若没有生成白色沉淀,说明洗涤干净(3分) (4)Fe4N (5)4Fe(OH)2+2H2O+O2 4Fe(OH)3 (6)Fe2O3+2NH3 2Fe+N2+3H2O
解析 (1)将黄铜矿粉碎成粉末的目的是增大固体接触面积,加快反应速率,提高原料利用率;高温焙烧时,根据已知信息可知,CuFeS2转化为SO2、FeS、Cu,铜元素的化合价由+2价降低为0价,被还原,氧气中氧元素的化合价由0价降低为-2价,被还原为SO2,所以还原产物是SO2、Cu。(2)用6 mol·L-1的盐酸溶解,滤液A中含有氯化亚铁,通入氯气,把氯化亚铁氧化成氯化铁,反应的离子方程式为2Fe2++Cl2 2Fe3++2Cl-。(3)通入氨气生成氢氧化铁沉淀,过滤得到氢氧化铁,焙烧氢氧化铁得氧化铁;检验滤渣已经洗涤干净,可以通过检验最后一次洗涤液中不含氯离子,其实验操作为取最后一次洗涤液,先加入稀硝酸,再加入硝酸银溶液,若没有生成白色沉淀,说明滤渣已洗涤干净。(4)根据流程图可知,反应液加足量NaOH溶液并加热,产生氨气,说明化合物M中含有氮元素;白色沉淀乙→红褐色沉淀丙,说明化合物M中含有铁元素;红褐色沉淀丙 固体丁(14.40 g),固体丁为氧化铁,则铁元素的质量为 g=10.08 g,氮元素质量为10.71 g-10.08 g=0.63 g,铁、氮两种原子的物质的量之比为=4∶1,所以M的化学式为Fe4N。(5)白色沉淀乙是氢氧化亚铁,在空气中被氧气氧化为红褐色氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O 4Fe(OH)3。(6)在高温条件下,氧化铁与氨气反应生成铁、氮气和水,化学方程式为Fe2O3+2NH3 2Fe+N2+3H2O。
19.答案 (每空2分)
(1)①2H2S+O22S+2H2O ②AC
(2)①2NO+O22NO2 ②BaO ③S
(3)2Ba2BaO+4NO2↑+O2↑
解析 (1)①方法Ⅰ中H2S和O2反应生成S和H2O。②Cu2+和H2S反应生成CuS和H+,离子方程式为Cu2++H2SCuS↓+2H+,A错误;由图1可以看出,Fe2+在O2作用下变成Fe3+,发生反应的离子方程式为O2+4Fe2++4H++2H2O,B正确;若不考虑产生的水的稀释,由总反应2H2S+O22S↓+2H2O可知,反应过程中溶液的pH不变,C错误;提高混合气体中O2的比例,O2充足时,反应过程中的Fe2+能被充分氧化为Fe3+,而充足的Fe3+可将CuS氧化为S,从而防止生成的硫单质中混有CuS,D正确。
(2)①由图2可知,NO和O2在催化剂Pt表面发生反应生成NO2,反应的化学方程式为2NO+O22NO2;②由图2可以看出,NO2在BaO中储存;③NO2和H2S发生氧化还原反应,NO2为氧化剂,还原产物为N2,处理0.2 mol H2S,转移0.4 mol电子,消耗0.1 mol NO2,根据得失电子守恒,硫元素化合价应从-2价升高到0价,故氧化产物X的化学式应为S。
(3)装置②中有气泡产生,但在上升的过程中消失,紫色石蕊溶液逐渐变为红色,液体几乎不被压至装置③中,说明产生的气体和水完全反应,Ba(NO3)2受热分解的化学方程式为2Ba(NO3)22BaO+4NO2↑+O2↑,由质量守恒定律可知,NO2、O2的总质量为(m-n)g,设NO2的物质的量为n1 mol,O2的物质的量为n2 mol,则,解得n1=,装置②中发生的反应为4NO2+O2+2H2O4HNO3,溶质为HNO3,由反应可知n(HNO3)=n(NO2)= mol,所以装置②中溶液的物质的量浓度为 mol·L-1。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
