2025人教版高中化学必修第二册强化练习题--期中学业水平检测(含解析)
文档属性
| 名称 | 2025人教版高中化学必修第二册强化练习题--期中学业水平检测(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 724.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-24 09:59:25 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学必修第二册
期中学业水平检测
注意事项
1.全卷满分100分。考试用时75分钟。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 Si-28 S-32 Cu-64 Fe-56 Cl-35.5 Pb-207。
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.能量变化是化学研究的重要内容之一。下列设备工作时将化学能转化为电能的是( )
A.铅酸蓄电池 B.氧炔焰焊接金属 C.硅太阳能电池 D.太阳能 热水器
2.工业上用洗净的废铜屑为原料来制备硝酸铜,从防治环境污染的角度考虑,宜采取的方法是( )
A.Cu+HNO3(浓) Cu(NO3)2
B.Cu+HNO3(稀) Cu(NO3)2
C.Cu CuO Cu(NO3)2
D.Cu CuSO4 Cu(NO3)2
3.下列数据中可表明反应N2(g)+3H2(g) 2NH3(g)已经达到平衡状态的是( )
A.3v正(N2)=v逆(H2) B.v正(N2)=v逆(NH3)
C.3v正(N2)=v正(H2) D.3v正(H2)=2v逆(NH3)
4.化学反应速率和限度的研究对日常生活和工业生产有着重要意义。下列有关说法错误的是( )
A.向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺
B.将肉类食品进行低温冷藏,能使其永远不会腐败变质
C.工业合成氨时,要同时考虑反应速率和反应限度两个方面
D.我国西周时期已发明用“酒曲”酿酒,原理是利用催化剂改变反应速率
5.氨广泛应用于化工、化肥、制药等领域,一种新型制备氨的方法如图。下列说法正确的是( )
A.反应③为放热反应
B.Mg是该反应的催化剂
C.图中生成目标产物NH3的反应②为氧化还原反应
D.若生成NH3的物质的量为2 mol,理论上消耗N2为22.4 L
6.某化学兴趣小组利用反应Cu+2FeCl3CuCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )
A.a极为负极,发生氧化反应
B.b极的电极反应式为Cu-2e-Cu2+
C.电子流动方向:a电极→FeCl3溶液→b电极
D.该装置能实现电能与化学能的相互转化
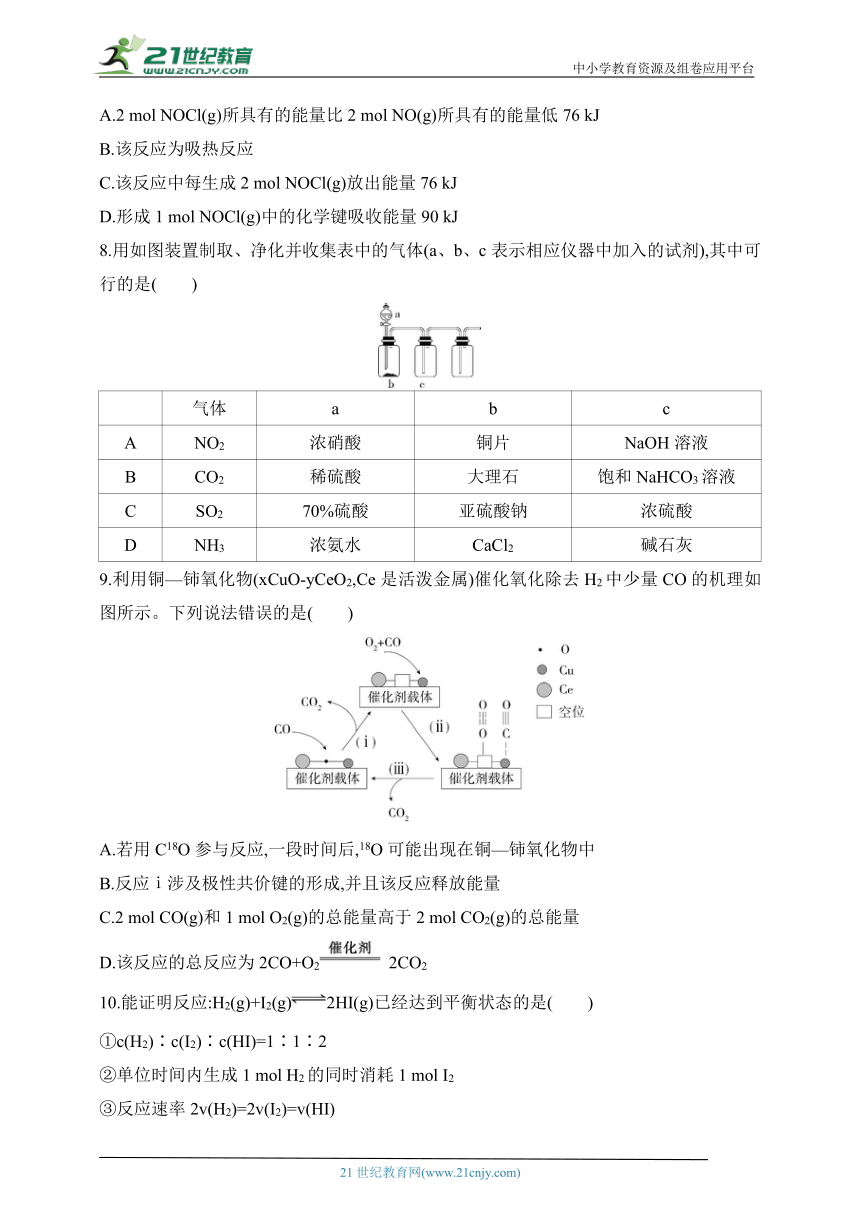
7.NOCl常用于有机合成,合成NOCl的原理为2NO(g)+Cl2(g)2NOCl(g),反应过程中的能量变化如图所示。下列有关说法正确的是( )
A.2 mol NOCl(g)所具有的能量比2 mol NO(g)所具有的能量低76 kJ
B.该反应为吸热反应
C.该反应中每生成2 mol NOCl(g)放出能量76 kJ
D.形成1 mol NOCl(g)中的化学键吸收能量90 kJ
8.用如图装置制取、净化并收集表中的气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
气体 a b c
A NO2 浓硝酸 铜片 NaOH溶液
B CO2 稀硫酸 大理石 饱和NaHCO3溶液
C SO2 70%硫酸 亚硫酸钠 浓硫酸
D NH3 浓氨水 CaCl2 碱石灰
9.利用铜—铈氧化物(xCuO-yCeO2,Ce是活泼金属)催化氧化除去H2中少量CO的机理如图所示。下列说法错误的是( )
A.若用C18O参与反应,一段时间后,18O可能出现在铜—铈氧化物中
B.反应ⅰ涉及极性共价键的形成,并且该反应释放能量
C.2 mol CO(g)和1 mol O2(g)的总能量高于2 mol CO2(g)的总能量
D.该反应的总反应为2CO+O2 2CO2
10.能证明反应:H2(g)+I2(g)2HI(g)已经达到平衡状态的是( )
①c(H2)∶c(I2)∶c(HI)=1∶1∶2
②单位时间内生成1 mol H2的同时消耗1 mol I2
③反应速率2v(H2)=2v(I2)=v(HI)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
⑥温度和体积一定时,混合气体的颜色不再变化
A.①③ B.②⑥ C.③⑥ D.④⑤
11.下列设计的实验方案能达到相应实验目的的是( )
实验目的 实验方案
A 探究化学反应的限度 取5 mL 0.1 mol/L KI溶液,滴加0.1 mol/L FeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应
B 比较Mg与Al的金属活动性 常温下,将Mg、Al与NaOH溶液组成原电池
C 探究催化剂对化学反应速率的影响 相同条件下,A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液
D 探究浓度对化学反应速率的影响 常温下,相同的铁片中分别加入足量的浓硝酸和稀硝酸
12.汽车尾气中含有CO、NO等有害气体,两者在恒容密闭容器中能发生反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)。为了验证温度对该反应速率的影响,某同学设计了两组实验,如表所示。已知在280 ℃的条件下,反应2 min后达到平衡,测得NO的浓度为6.0×10-4 mol/L。下列说法不正确的是( )
实验编号 T(℃) NO的初始浓度(mol/L) CO的初始浓度(mol/L)
Ⅰ 280 1.0×10-3 3.6×10-3
Ⅱ 350 a 3.6×10-3
A.表中a为1.0×10-3
B.当v逆(NO)=2v正(N2),说明该反应已达到平衡状态
C.280 ℃时,前2 min内用N2表示的平均反应速率为2×10-4 mol/(L·min)
D.280 ℃的条件下达到平衡时CO2的浓度为4.0×10-4 mol/L
13.中国海洋大学科学家发现海泥细菌电池的电压可以高达0.8V,在这种海水/海底沉积层界面存在的天然电压驱动下,海泥细菌产生的电子可以源源不断地传输出来,持续产生电能。下列说法错误的是( )
A.电势:A电极B.海底沉积层和海水层分别为负极和正极的导电介质
C.海底沉积层可发生反应:CH2O-4e-+H2O CO2+4H+
D.海底沉积层/海水天然界面作为“质子交换膜材料”,不需要任何人工膜材料
14.将2.56 g铜投入20 mL一定浓度的硝酸中,铜完全溶解,产生896 mL(已折算为标准状况下的体积)NO和NO2的混合气体,反应结束后向溶液中加入120 mL 1 mol·L-1NaOH溶液,恰好使溶液中的Cu2+全部转化为Cu(OH)2沉淀。若将盛有896 mL该混合气体的容器倒扣在水中,通入标准状况下一定体积的氧气,又可将气体完全转化为N。则下列说法错误的是( )
A.与铜反应中,起酸性作用的硝酸为0.08 mol
B.产生的混合气体中,NO和NO2的体积比为1∶1
C.通入标准状况下氧气的体积为448 mL
D.原硝酸浓度为6 mol·L-1
15.工业上可用次氯酸盐将氨氮废水转化为N2实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的NaClO混合(混合溶液体积为1 L),测得溶液中氨氮(氨、NH2Cl)和总氮(氨氮和N的总和)的去除率及NH2Cl的浓度与NaClO的加入量的关系,如图所示。
在此过程中发生的反应为:①NH3+ClO- NH2Cl+OH-;②2NH3+3ClO- N2+3Cl-+3H2O;③NH3+4ClO-+OH- N+4Cl-+2H2O。
已知:NH2Cl中氮元素为-3价。下列说法正确的是( )
A.当n(NaClO)=n1 mol时,反应①中转移电子的物质的量为0.002 mol
B.当n(NaClO)=0.001 2 mol时,c(NH2Cl)=30.9 mg·L-1
C.n2=0.001 5
D.当n(NaClO)>n2 mol时,c(Cl-)=4c(N)
二、非选择题(本题共4小题,共55分)
16.(12分)为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示:
实验1 实验2
MnO2的质量/g 0.5 0.5
5%H2O2溶液的体积/mL 40 待填
水浴温度/℃ 20 80
(1)实验2中应加入5%H2O2溶液 mL。
(2)在两次实验中,可通过 来比较H2O2分解反应速率的大小。
(3)实验2中水浴温度控制在80 ℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有 。
(4)实验结束后若要得到纯净干燥的MnO2,可采取的操作是 。
17.(13分)氨在人类的生产和生活中有着广泛的应用。某化学兴趣小组利用如图所示装置探究氨气的有关性质(已知:氨气不溶于CCl4,部分夹持装置省略)。
回答下列问题:
(1)实验室制取NH3的化学方程式为 ,装置B的作用是 。
(2)连接好装置并检验装置的气密性后,装入药品,然后应先进行的操作是 (填字母)。
a.加热装置A b.加热装置C
(3)实验中观察到装置C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则装置C中发生反应的化学方程式为 ,该反应证明氨气具有 性。
(4)该实验缺少尾气吸收装置,下图中能用来吸收尾气的装置是 (填序号)。
Ⅰ Ⅱ Ⅲ
(5)氨气极易溶于水,若将2.24 L(已折算为标准状况下的体积)的氨气溶于水配成0.5 L溶液,则所得溶液中溶质的物质的量浓度为 mol·L-1。
18.(12分)化学能在一定条件下能够转化为电能、热能、光能等。请按照要求解答相关问题。
(1)下列反应可以设计成原电池的是 (填字母)。
A.2FeBr2+3Cl22FeCl3+2Br2
B.Na2CO3+2HCl2NaCl+H2O+CO2↑
C.2H2O2H2↑+O2↑
D.Cu+2AgNO32Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。
图Ⅰ图Ⅱ
分析有关实验现象,下列说法正确的是 (填字母)。
A.图Ⅰ中气泡产生在锌棒表面,图Ⅱ中气泡产生在铜棒表面
B.两图中生成气体的速率几乎一样快
C.图Ⅱ中产生气体的速率比图Ⅰ快
D.图Ⅱ中温度计的示数高于图Ⅰ中温度计的示数
E.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
(3)铅酸蓄电池是最常见的二次电池。放电时的化学方程式为Pb+PbO2+2H2SO42PbSO4+2H2O,负极反应式为 ;一段时间后,负极增重48 g,转移电子 mol。
(4)下图是甲烷燃料电池工作原理示意图,回答下列问题:
①电池的负极反应式为 。
②电池工作一段时间后电解质溶液的pH (填“增大”“减小”或“不变”)。
19.(18分)某小组按如下步骤探究二氧化硫与铜单质、Cu2+的反应。
ⅰ.按图示连接好装置。
ⅱ.打开分液漏斗活塞b,将盐酸滴入三颈烧瓶中,无明显现象。
ⅲ.关闭活塞b,打开活塞a,光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕黄色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕黄色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为 ,该反应中硫酸体现出的化学性质为 ;装置C的作用是 ,试剂m可选用 (填字母)。
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为 ;步骤ⅳ中发生反应的离子方程式为[CuCl3]2- CuCl↓+2Cl-,下列有关该反应的说法正确的是 (填字母)。
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
(3)在通风橱中利用如图装置进一步探究SO2与Cu2+的反应,盐桥(离子可在盐桥中移动)用于连接两电极的电解质溶液。
实验 试剂X 实验现象
电流表 C1附近溶液
① 0.1 mol·L-1 CuSO4溶液 指针几乎不偏转 无明显现象
② 0.1 mol·L-1 NaCl和0.1 mol· L-1CuSO4的混合溶液(足量) 指针明显偏转 溶液变棕黄色
实验②中,闭合K后,C2电极上发生的电极反应为 ;不考虑其他副反应及Cu2+进入盐桥,实验②中,电路中转移0.02 mol e-时,左侧烧杯溶液中Cu2+的质量减少 g。
答案与解析
1.A 化学电池工作时将化学能转化为电能。
2.C 从防治环境污染的角度考虑,即不产生对环境有污染的物质,A、B、D项中分别产生NO2、NO、SO2,它们均会污染环境,故选C。
3.A 反应达到平衡状态时,同种物质的正、逆反应速率相等。当3v正(N2)=v逆(H2)时,即v正(N2)∶v逆(H2)=1∶3,则v正(H2)=v逆(H2),说明反应已经达到平衡状态,A正确;当v正(N2)=v逆(NH3)时,v逆(N2)≠v正(N2),说明反应未达平衡状态,B错误;C项描述的都是正反应,不能确定反应是否达到平衡状态,C错误;当3v正(H2)=2v逆(NH3)时,即v正(H2)∶v逆(NH3)=2∶3,则v正(NH3)≠v逆(NH3),说明反应未达平衡状态,D错误。
4.B 用煤粉代替煤块可增大燃料与空气的接触面积,可加快反应速率,使炉火更旺,A项正确;低温冷藏只能减慢肉类食品的变质速率,B项错误;工业合成氨是可逆的放热反应,为提高产率,需同时考虑反应速率和反应限度,C项正确;酿酒过程中酒曲作催化剂,可以改变反应速率,D项正确。
5.B 反应③为氯化镁的分解反应,该反应是吸热反应,A错误;该过程的总反应为N2和水反应生成NH3和O2,Mg是反应的催化剂,B正确;反应②为Mg3N2与NH4Cl反应生成MgCl2和NH3,反应前后各元素的化合价均没有变化,不是氧化还原反应,C错误;没有指明气体所处状况,气体体积无法计算,D错误。
6.B 由Cl-的移动方向可知,b极为负极,发生氧化反应,根据总反应可知,Cu发生失电子的氧化反应,即b极的电极反应式为Cu-2e-Cu2+,A错误、B正确;电子不经过溶液,电子的流动方向为b电极→导线→a电极,C错误;该装置是原电池,只能将化学能转化为电能,D错误。
7.C 根据题图可知,2 mol NOCl(g)所具有的能量比2 mol NO(g)和1 mol Cl2(g)所具有的总能量低(180-104)kJ=76 kJ,A错误;反应物的能量总和大于生成物的能量总和,为放热反应,B错误;2 mol NO(g)和1 mol Cl2(g)完全反应生成2 mol NOCl(g)放出能量(180-104)kJ=76 kJ,C正确;断裂化学键吸收能量,形成化学键放出能量,D错误。
8.C NO2能与NaOH溶液反应而被吸收,不能用NaOH溶液净化,A项错误;大理石主要成分为CaCO3,与稀硫酸反应生成微溶于水的CaSO4覆盖在其表面,会阻止反应进行,B项错误;硫酸与亚硫酸钠反应生成SO2,SO2可用浓硫酸干燥,并用向上排空气法收集,C项正确;CaCl2能与NH3反应,应用CaO或碱石灰等和浓氨水制备NH3,且NH3应用向下排空气法收集,D项错误。
9.A 由题图可知,用C18O参与反应,一段时间后,18O会出现在二氧化碳中,A错误;反应ⅰ中CO转化为CO2有极性共价键的形成,且CO与O2反应生成CO2为放热反应,B正确;2 mol CO(g)和1 mol O2(g)反应生成2 mol CO2(g),该反应为放热反应,则2 mol CO(g)和1 mol O2(g)的总能量高于2 mol CO2(g)的总能量,C正确;该反应的总反应为2CO+O2 2CO2,D正确。
10.B ①c(H2)∶c(I2)∶c(HI)=1∶1∶2,可能是反应进行过程中的某一阶段,不一定是平衡状态;②单位时间内生成1 mol H2的同时消耗1 mol I2,反应进行的方向相反,且物质的量的变化量之比等于化学计量数之比,此时反应达平衡状态;③在反应达平衡前,存在反应速率2v(H2)=2v(I2)=v(HI),则反应速率2v(H2)=2v(I2)=v(HI)时,反应不一定达平衡状态;④反应前后气体的分子数相等,温度和体积一定时,容器内压强始终不变,所以压强不变反应不一定达平衡状态;⑤温度和压强一定时,混合气体的体积不变,则密度始终不变,反应不一定达平衡状态;⑥温度和体积一定时,混合气体的颜色不再变化,则表明c(I2)不变,反应达平衡状态。
11.C A项,KI过量,充分反应后溶液中既含I2又含I-,无法确定该反应是否为可逆反应,错误;B项,该电池中Al为负极、Mg为正极,即根据该装置不能比较Mg与Al的金属活动性,错误;C项,根据两支试管中产生气体的快慢,可探究催化剂对反应速率的影响,正确;D项,常温下,铁片遇浓硝酸发生钝化,应是稀硝酸中铁片先溶解完,不能达到实验目的,错误。
12.C 由题干信息可知,该实验的目的为验证温度对反应速率的影响,即除温度外其他条件需完全相同,则表中a为1.0×10-3,A正确;根据反应速率之比等于化学计量数之比可知,v正(NO)=2v正(N2),当v逆(NO)=2v正(N2)时,有v逆(NO)=v正(NO),说明该反应已达到平衡状态,B正确;由题干数据可知,280 ℃时,前2 min内用NO表示的平均反应速率为=2×10-4 mol/(L·min),根据反应速率之比等于化学计量数之比可知,用N2表示的平均反应速率为1×10-4 mol/(L·min),C错误;由三段式分析:
2NO(g) + 2CO(g) 2CO2(g) + N2(g)
起始量(mol/L) 1.0×10-3 3.6×10-3 0 0
转化量(mol/L) 4.0×10-4 4.0×10-4 4.0×10-4 2.0×10-4
平衡量(mol/L) 6.0×10-4 3.2×10-3 4.0×10-4 2.0×10-4
故280 ℃的条件下达到平衡时CO2的浓度为4.0×10-4 mol/L,D正确。
13.A 由题图可知,A电极上氧气转化成水,氧元素化合价降低,发生还原反应,即A电极为正极,则B电极为负极,正极电势高于负极电势,所以电势为A电极>B电极,A错误;A电极为正极,B电极为负极,海底沉积层和海水层分别为负极和正极的导电介质,B正确;在海底沉积层CH2O转化为CO2,所以海底沉积层可发生反应CH2O-4e-+H2O CO2+4H+,C正确;负极电极反应式为HS--2e- S+H+,生成的H+向正极移动,即H+从海底沉积层通过交界面向海水层移动,所以海底沉积层/海水天然界面作为“质子交换膜材料”,不需要任何人工膜材料,D正确。
14.D 2.56 g铜的物质的量为0.04 mol,铜和硝酸反应生成硝酸铜、氮的氧化物和水,因此与铜反应中,起酸性作用的硝酸为0.08 mol,故A正确;产生的混合气体的物质的量为0.04 mol,设NO和NO2的物质的量分别为x mol和y mol,则x+y=0.04,3x+y=0.04×2,解得x=0.02,y=0.02,则体积比为1∶1,故B正确;根据得失电子守恒,铜失去的电子等于氧气得到的电子,因此氧气的物质的量为=0.02 mol,标准状况下的体积为448 mL,故C正确;反应结束后向溶液中加入120 mL 1 mol·L-1NaOH溶液,恰好使溶液中的Cu2+全部转化为Cu(OH)2沉淀,则硝酸的物质的量为1 mol·L-1×0.12 L+0.04 mol=0.16 mol,原硝酸浓度为=8 mol·L-1,故D错误。
15.B 当n(NaClO)=n1 mol时,氨氮和总氮去除率都是0,说明只发生反应①,此时NH2Cl的物质的量为=0.001 mol,反应前后各元素均无化合价变化,反应①为非氧化还原反应,无电子转移,A错误;根据A项分析可知,当加入的NaClO的物质的量小于等于1×10-3 mol时,氨气全部转化为NH2Cl,再加入0.000 2 mol NaClO,根据题中信息可推知应发生2NH2Cl+ClO-+2OH- N2+3Cl-+3H2O,此时NH2Cl的物质的量为(1×10-3-0.000 4) mol=0.000 6 mol,NH2Cl的浓度为=30.9 mg·L-1,B正确;观察题图n2 mol NaClO时,c(NH2Cl)=0,根据“工业上可用次氯酸盐将氨氮废水转化为N2实现绿色处理”,结合反应2NH3+3ClO- N2+3Cl-+3H2O可知,n(NH2Cl)=n(NH3)=0.001 mol,0.001 mol NH3完全反应生成N2需要0.001 5 mol的NaClO,n2 mol NaClO时氨氮去除率接近100%,但总氮去除率小于100%,说明部分氨发生反应③,则n2>0.001 5,C错误;当次氯酸钠的物质的量大于n2 mol时,反应②③都发生,c(Cl-)>4c(N),D错误。
16.答案 (每空3分)
(1)40
(2)相同的时间内注射器内气体的体积多少(合理即可)
(3)温度较高时水蒸发成水蒸气
(4)过滤、洗涤、干燥
解析 (1)实验探究温度对H2O2分解反应速率的影响时,变量应是温度,其他的量应相同,所以实验2中应加入5%H2O2溶液40 mL。
(2)在两次实验中,可通过相同的时间内注射器内气体的体积多少来比较H2O2分解反应速率的大小。
(3)实验2中水浴温度控制在80 ℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有温度较高时水蒸发成水蒸气的速率加快,注射器内进入了较多水蒸气。
(4)实验结束后若要得到纯净、干燥的MnO2,可采取的操作是过滤、洗涤、干燥。
17.答案 (除标注外,每空2分)
(1)Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O 干燥氨气
(2)a(1分)
(3)3CuO+2NH3 3Cu+N2+3H2O 还原
(4)Ⅱ、Ⅲ
(5)0.2
解析 (1)实验室利用NH4Cl和Ca(OH)2加热可制备NH3,其化学方程式为Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O;装置B中用碱石灰干燥NH3。
(2)NH3与CuO反应,应先通入NH3排出装置中的空气,故应先进行的操作是加热装置A制备NH3,a正确。
(3)根据题中描述可知,收集到的气体单质为N2,该反应的化学方程式为3CuO+2NH3 3Cu+N2+3H2O,该反应中NH3作还原剂,表现出还原性。
(4)NH3极易溶于水,吸收NH3需防倒吸,Ⅰ中NH3直接通入水中,易倒吸;Ⅱ中NH3通入CCl4中,NH3从CCl4中逸出遇水被吸收,能防止倒吸;Ⅲ中球形干燥管可防止倒吸;故装置Ⅱ、Ⅲ均能用于吸收NH3。
(5)所得溶液中NH3的物质的量浓度为=0.2 mol·L-1。
18.答案 (每空2分)
(1)AD (2)AC (3)Pb+S-2e-PbSO4 1 (4)①CH4-8e-+10OH-C+7H2O ②减小
解析 (1)自发进行的氧化还原反应在理论上可以设计成原电池,2FeBr2+3Cl22FeCl3+2Br2为自发进行的氧化还原反应,A符合题意;Na2CO3+2HCl2NaCl+H2O+CO2↑不是氧化还原反应,B不符合题意;2H2O2H2↑+O2↑不是自发进行的氧化还原反应,C不符合题意;Cu+2AgNO32Ag+Cu(NO3)2为自发进行的氧化还原反应,D符合题意。
(2)图Ⅰ中不能形成原电池,气泡产生在锌棒表面,图Ⅱ中形成原电池,锌为负极,铜为正极,气泡产生在铜棒表面,A正确;图Ⅱ中形成原电池,能加快反应速率,图Ⅱ中产生气体的速率比图Ⅰ快,B错误、C正确;图Ⅰ中将化学能转化为热能,图Ⅱ中形成原电池,主要将化学能转化为电能,所以图Ⅰ中温度计的示数高于图Ⅱ中温度计的示数,D、E错误。
(3)放电时铅失去电子生成PbSO4,所以负极反应式为Pb+S-2e-PbSO4;负极增重48 g,增加的为S的质量,则S的物质的量为0.5 mol,转移的电子的物质的量为0.5 mol×2=1 mol。
(4)甲烷燃料电池工作时,甲烷失去电子在负极发生氧化反应,氧气得到电子在正极发生还原反应。①甲烷失去电子在负极发生氧化反应,在碱性条件下生成C和水,所以电池的负极反应式为CH4-8e-+10OH-C+7H2O;②电池工作过程中OH-消耗的量大于产生的量,浓度逐渐减小,则电解质溶液的pH减小。
19.答案 (除标注外,每空2分)
(1)Na2SO3+H2SO4 Na2SO4+SO2↑+H2O 酸性 吸收SO2和HCl,防止污染空气 c (2)SO2+12Cl-+4H++6Cu Cu2S+4[CuCl3]2-+2H2O(3分) CD (3)SO2+2H2O-2e- 4H++S(3分) 1.28
解析 装置A用亚硫酸钠与70%硫酸制备二氧化硫,装置B中二氧化硫和铜片、盐酸反应生成Cu2S、[CuCl3]2-和H2O,装置C为尾气处理装置。(1)装置A中亚硫酸钠与70%硫酸反应生成硫酸钠、二氧化硫和水,反应的化学方程式为Na2SO3+H2SO4 Na2SO4+SO2↑+H2O;该反应中硫酸体现酸性。装置C的作用是吸收SO2和HCl,防止污染空气;浓硫酸、氯化钠均不与SO2和HCl反应,而氢氧化钠可与SO2和HCl反应,故试剂m为NaOH浓溶液,选c。
(2)根据题中信息可知,步骤ⅲ中SO2、HCl、Cu反应生成Cu2S、[CuCl3]2-和H2O,离子方程式为SO2+12Cl-+4H++6Cu Cu2S+4[CuCl3]2-+2H2O;步骤ⅳ中发生反应的离子方程式为[CuCl3]2- CuCl↓+2Cl-,该反应为非氧化还原反应,没有电子的转移,A错误;该反应为可逆反应,[CuCl3]2-中的Cu元素不能全部沉淀,B错误;该反应为可逆反应,反应物和生成物能同时存在,C正确;当溶液的颜色不再变化时,说明反应达到平衡,即该条件下达到最大限度,D正确。
(3)未加氯化钠时,电流表指针基本不偏转,说明基本不反应;当加入氯化钠之后,电流表指针发生偏转且溶液变为棕黄色,说明发生了氧化还原反应且生成了[CuCl3]2-,[CuCl3]2-在C1电极生成,C1电极的电极反应为3Cl-+Cu2++e- [CuCl3]2-,则C2电极上应是SO2发生失电子的氧化反应,电极反应为SO2+2H2O-2e- 4H++S;当电路中转移0.02 mol e-时,左侧烧杯溶液中Cu2+减少0.02 mol,减少的质量为1.28 g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学必修第二册
期中学业水平检测
注意事项
1.全卷满分100分。考试用时75分钟。
2.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 Si-28 S-32 Cu-64 Fe-56 Cl-35.5 Pb-207。
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.能量变化是化学研究的重要内容之一。下列设备工作时将化学能转化为电能的是( )
A.铅酸蓄电池 B.氧炔焰焊接金属 C.硅太阳能电池 D.太阳能 热水器
2.工业上用洗净的废铜屑为原料来制备硝酸铜,从防治环境污染的角度考虑,宜采取的方法是( )
A.Cu+HNO3(浓) Cu(NO3)2
B.Cu+HNO3(稀) Cu(NO3)2
C.Cu CuO Cu(NO3)2
D.Cu CuSO4 Cu(NO3)2
3.下列数据中可表明反应N2(g)+3H2(g) 2NH3(g)已经达到平衡状态的是( )
A.3v正(N2)=v逆(H2) B.v正(N2)=v逆(NH3)
C.3v正(N2)=v正(H2) D.3v正(H2)=2v逆(NH3)
4.化学反应速率和限度的研究对日常生活和工业生产有着重要意义。下列有关说法错误的是( )
A.向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺
B.将肉类食品进行低温冷藏,能使其永远不会腐败变质
C.工业合成氨时,要同时考虑反应速率和反应限度两个方面
D.我国西周时期已发明用“酒曲”酿酒,原理是利用催化剂改变反应速率
5.氨广泛应用于化工、化肥、制药等领域,一种新型制备氨的方法如图。下列说法正确的是( )
A.反应③为放热反应
B.Mg是该反应的催化剂
C.图中生成目标产物NH3的反应②为氧化还原反应
D.若生成NH3的物质的量为2 mol,理论上消耗N2为22.4 L
6.某化学兴趣小组利用反应Cu+2FeCl3CuCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )
A.a极为负极,发生氧化反应
B.b极的电极反应式为Cu-2e-Cu2+
C.电子流动方向:a电极→FeCl3溶液→b电极
D.该装置能实现电能与化学能的相互转化
7.NOCl常用于有机合成,合成NOCl的原理为2NO(g)+Cl2(g)2NOCl(g),反应过程中的能量变化如图所示。下列有关说法正确的是( )
A.2 mol NOCl(g)所具有的能量比2 mol NO(g)所具有的能量低76 kJ
B.该反应为吸热反应
C.该反应中每生成2 mol NOCl(g)放出能量76 kJ
D.形成1 mol NOCl(g)中的化学键吸收能量90 kJ
8.用如图装置制取、净化并收集表中的气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
气体 a b c
A NO2 浓硝酸 铜片 NaOH溶液
B CO2 稀硫酸 大理石 饱和NaHCO3溶液
C SO2 70%硫酸 亚硫酸钠 浓硫酸
D NH3 浓氨水 CaCl2 碱石灰
9.利用铜—铈氧化物(xCuO-yCeO2,Ce是活泼金属)催化氧化除去H2中少量CO的机理如图所示。下列说法错误的是( )
A.若用C18O参与反应,一段时间后,18O可能出现在铜—铈氧化物中
B.反应ⅰ涉及极性共价键的形成,并且该反应释放能量
C.2 mol CO(g)和1 mol O2(g)的总能量高于2 mol CO2(g)的总能量
D.该反应的总反应为2CO+O2 2CO2
10.能证明反应:H2(g)+I2(g)2HI(g)已经达到平衡状态的是( )
①c(H2)∶c(I2)∶c(HI)=1∶1∶2
②单位时间内生成1 mol H2的同时消耗1 mol I2
③反应速率2v(H2)=2v(I2)=v(HI)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
⑥温度和体积一定时,混合气体的颜色不再变化
A.①③ B.②⑥ C.③⑥ D.④⑤
11.下列设计的实验方案能达到相应实验目的的是( )
实验目的 实验方案
A 探究化学反应的限度 取5 mL 0.1 mol/L KI溶液,滴加0.1 mol/L FeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应
B 比较Mg与Al的金属活动性 常温下,将Mg、Al与NaOH溶液组成原电池
C 探究催化剂对化学反应速率的影响 相同条件下,A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液
D 探究浓度对化学反应速率的影响 常温下,相同的铁片中分别加入足量的浓硝酸和稀硝酸
12.汽车尾气中含有CO、NO等有害气体,两者在恒容密闭容器中能发生反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)。为了验证温度对该反应速率的影响,某同学设计了两组实验,如表所示。已知在280 ℃的条件下,反应2 min后达到平衡,测得NO的浓度为6.0×10-4 mol/L。下列说法不正确的是( )
实验编号 T(℃) NO的初始浓度(mol/L) CO的初始浓度(mol/L)
Ⅰ 280 1.0×10-3 3.6×10-3
Ⅱ 350 a 3.6×10-3
A.表中a为1.0×10-3
B.当v逆(NO)=2v正(N2),说明该反应已达到平衡状态
C.280 ℃时,前2 min内用N2表示的平均反应速率为2×10-4 mol/(L·min)
D.280 ℃的条件下达到平衡时CO2的浓度为4.0×10-4 mol/L
13.中国海洋大学科学家发现海泥细菌电池的电压可以高达0.8V,在这种海水/海底沉积层界面存在的天然电压驱动下,海泥细菌产生的电子可以源源不断地传输出来,持续产生电能。下列说法错误的是( )
A.电势:A电极
C.海底沉积层可发生反应:CH2O-4e-+H2O CO2+4H+
D.海底沉积层/海水天然界面作为“质子交换膜材料”,不需要任何人工膜材料
14.将2.56 g铜投入20 mL一定浓度的硝酸中,铜完全溶解,产生896 mL(已折算为标准状况下的体积)NO和NO2的混合气体,反应结束后向溶液中加入120 mL 1 mol·L-1NaOH溶液,恰好使溶液中的Cu2+全部转化为Cu(OH)2沉淀。若将盛有896 mL该混合气体的容器倒扣在水中,通入标准状况下一定体积的氧气,又可将气体完全转化为N。则下列说法错误的是( )
A.与铜反应中,起酸性作用的硝酸为0.08 mol
B.产生的混合气体中,NO和NO2的体积比为1∶1
C.通入标准状况下氧气的体积为448 mL
D.原硝酸浓度为6 mol·L-1
15.工业上可用次氯酸盐将氨氮废水转化为N2实现绿色处理。实验室模拟如下:取等量氨水分别和不同量的NaClO混合(混合溶液体积为1 L),测得溶液中氨氮(氨、NH2Cl)和总氮(氨氮和N的总和)的去除率及NH2Cl的浓度与NaClO的加入量的关系,如图所示。
在此过程中发生的反应为:①NH3+ClO- NH2Cl+OH-;②2NH3+3ClO- N2+3Cl-+3H2O;③NH3+4ClO-+OH- N+4Cl-+2H2O。
已知:NH2Cl中氮元素为-3价。下列说法正确的是( )
A.当n(NaClO)=n1 mol时,反应①中转移电子的物质的量为0.002 mol
B.当n(NaClO)=0.001 2 mol时,c(NH2Cl)=30.9 mg·L-1
C.n2=0.001 5
D.当n(NaClO)>n2 mol时,c(Cl-)=4c(N)
二、非选择题(本题共4小题,共55分)
16.(12分)为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示:
实验1 实验2
MnO2的质量/g 0.5 0.5
5%H2O2溶液的体积/mL 40 待填
水浴温度/℃ 20 80
(1)实验2中应加入5%H2O2溶液 mL。
(2)在两次实验中,可通过 来比较H2O2分解反应速率的大小。
(3)实验2中水浴温度控制在80 ℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有 。
(4)实验结束后若要得到纯净干燥的MnO2,可采取的操作是 。
17.(13分)氨在人类的生产和生活中有着广泛的应用。某化学兴趣小组利用如图所示装置探究氨气的有关性质(已知:氨气不溶于CCl4,部分夹持装置省略)。
回答下列问题:
(1)实验室制取NH3的化学方程式为 ,装置B的作用是 。
(2)连接好装置并检验装置的气密性后,装入药品,然后应先进行的操作是 (填字母)。
a.加热装置A b.加热装置C
(3)实验中观察到装置C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则装置C中发生反应的化学方程式为 ,该反应证明氨气具有 性。
(4)该实验缺少尾气吸收装置,下图中能用来吸收尾气的装置是 (填序号)。
Ⅰ Ⅱ Ⅲ
(5)氨气极易溶于水,若将2.24 L(已折算为标准状况下的体积)的氨气溶于水配成0.5 L溶液,则所得溶液中溶质的物质的量浓度为 mol·L-1。
18.(12分)化学能在一定条件下能够转化为电能、热能、光能等。请按照要求解答相关问题。
(1)下列反应可以设计成原电池的是 (填字母)。
A.2FeBr2+3Cl22FeCl3+2Br2
B.Na2CO3+2HCl2NaCl+H2O+CO2↑
C.2H2O2H2↑+O2↑
D.Cu+2AgNO32Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验。
图Ⅰ图Ⅱ
分析有关实验现象,下列说法正确的是 (填字母)。
A.图Ⅰ中气泡产生在锌棒表面,图Ⅱ中气泡产生在铜棒表面
B.两图中生成气体的速率几乎一样快
C.图Ⅱ中产生气体的速率比图Ⅰ快
D.图Ⅱ中温度计的示数高于图Ⅰ中温度计的示数
E.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温
(3)铅酸蓄电池是最常见的二次电池。放电时的化学方程式为Pb+PbO2+2H2SO42PbSO4+2H2O,负极反应式为 ;一段时间后,负极增重48 g,转移电子 mol。
(4)下图是甲烷燃料电池工作原理示意图,回答下列问题:
①电池的负极反应式为 。
②电池工作一段时间后电解质溶液的pH (填“增大”“减小”或“不变”)。
19.(18分)某小组按如下步骤探究二氧化硫与铜单质、Cu2+的反应。
ⅰ.按图示连接好装置。
ⅱ.打开分液漏斗活塞b,将盐酸滴入三颈烧瓶中,无明显现象。
ⅲ.关闭活塞b,打开活塞a,光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕黄色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕黄色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为 ,该反应中硫酸体现出的化学性质为 ;装置C的作用是 ,试剂m可选用 (填字母)。
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为 ;步骤ⅳ中发生反应的离子方程式为[CuCl3]2- CuCl↓+2Cl-,下列有关该反应的说法正确的是 (填字母)。
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
(3)在通风橱中利用如图装置进一步探究SO2与Cu2+的反应,盐桥(离子可在盐桥中移动)用于连接两电极的电解质溶液。
实验 试剂X 实验现象
电流表 C1附近溶液
① 0.1 mol·L-1 CuSO4溶液 指针几乎不偏转 无明显现象
② 0.1 mol·L-1 NaCl和0.1 mol· L-1CuSO4的混合溶液(足量) 指针明显偏转 溶液变棕黄色
实验②中,闭合K后,C2电极上发生的电极反应为 ;不考虑其他副反应及Cu2+进入盐桥,实验②中,电路中转移0.02 mol e-时,左侧烧杯溶液中Cu2+的质量减少 g。
答案与解析
1.A 化学电池工作时将化学能转化为电能。
2.C 从防治环境污染的角度考虑,即不产生对环境有污染的物质,A、B、D项中分别产生NO2、NO、SO2,它们均会污染环境,故选C。
3.A 反应达到平衡状态时,同种物质的正、逆反应速率相等。当3v正(N2)=v逆(H2)时,即v正(N2)∶v逆(H2)=1∶3,则v正(H2)=v逆(H2),说明反应已经达到平衡状态,A正确;当v正(N2)=v逆(NH3)时,v逆(N2)≠v正(N2),说明反应未达平衡状态,B错误;C项描述的都是正反应,不能确定反应是否达到平衡状态,C错误;当3v正(H2)=2v逆(NH3)时,即v正(H2)∶v逆(NH3)=2∶3,则v正(NH3)≠v逆(NH3),说明反应未达平衡状态,D错误。
4.B 用煤粉代替煤块可增大燃料与空气的接触面积,可加快反应速率,使炉火更旺,A项正确;低温冷藏只能减慢肉类食品的变质速率,B项错误;工业合成氨是可逆的放热反应,为提高产率,需同时考虑反应速率和反应限度,C项正确;酿酒过程中酒曲作催化剂,可以改变反应速率,D项正确。
5.B 反应③为氯化镁的分解反应,该反应是吸热反应,A错误;该过程的总反应为N2和水反应生成NH3和O2,Mg是反应的催化剂,B正确;反应②为Mg3N2与NH4Cl反应生成MgCl2和NH3,反应前后各元素的化合价均没有变化,不是氧化还原反应,C错误;没有指明气体所处状况,气体体积无法计算,D错误。
6.B 由Cl-的移动方向可知,b极为负极,发生氧化反应,根据总反应可知,Cu发生失电子的氧化反应,即b极的电极反应式为Cu-2e-Cu2+,A错误、B正确;电子不经过溶液,电子的流动方向为b电极→导线→a电极,C错误;该装置是原电池,只能将化学能转化为电能,D错误。
7.C 根据题图可知,2 mol NOCl(g)所具有的能量比2 mol NO(g)和1 mol Cl2(g)所具有的总能量低(180-104)kJ=76 kJ,A错误;反应物的能量总和大于生成物的能量总和,为放热反应,B错误;2 mol NO(g)和1 mol Cl2(g)完全反应生成2 mol NOCl(g)放出能量(180-104)kJ=76 kJ,C正确;断裂化学键吸收能量,形成化学键放出能量,D错误。
8.C NO2能与NaOH溶液反应而被吸收,不能用NaOH溶液净化,A项错误;大理石主要成分为CaCO3,与稀硫酸反应生成微溶于水的CaSO4覆盖在其表面,会阻止反应进行,B项错误;硫酸与亚硫酸钠反应生成SO2,SO2可用浓硫酸干燥,并用向上排空气法收集,C项正确;CaCl2能与NH3反应,应用CaO或碱石灰等和浓氨水制备NH3,且NH3应用向下排空气法收集,D项错误。
9.A 由题图可知,用C18O参与反应,一段时间后,18O会出现在二氧化碳中,A错误;反应ⅰ中CO转化为CO2有极性共价键的形成,且CO与O2反应生成CO2为放热反应,B正确;2 mol CO(g)和1 mol O2(g)反应生成2 mol CO2(g),该反应为放热反应,则2 mol CO(g)和1 mol O2(g)的总能量高于2 mol CO2(g)的总能量,C正确;该反应的总反应为2CO+O2 2CO2,D正确。
10.B ①c(H2)∶c(I2)∶c(HI)=1∶1∶2,可能是反应进行过程中的某一阶段,不一定是平衡状态;②单位时间内生成1 mol H2的同时消耗1 mol I2,反应进行的方向相反,且物质的量的变化量之比等于化学计量数之比,此时反应达平衡状态;③在反应达平衡前,存在反应速率2v(H2)=2v(I2)=v(HI),则反应速率2v(H2)=2v(I2)=v(HI)时,反应不一定达平衡状态;④反应前后气体的分子数相等,温度和体积一定时,容器内压强始终不变,所以压强不变反应不一定达平衡状态;⑤温度和压强一定时,混合气体的体积不变,则密度始终不变,反应不一定达平衡状态;⑥温度和体积一定时,混合气体的颜色不再变化,则表明c(I2)不变,反应达平衡状态。
11.C A项,KI过量,充分反应后溶液中既含I2又含I-,无法确定该反应是否为可逆反应,错误;B项,该电池中Al为负极、Mg为正极,即根据该装置不能比较Mg与Al的金属活动性,错误;C项,根据两支试管中产生气体的快慢,可探究催化剂对反应速率的影响,正确;D项,常温下,铁片遇浓硝酸发生钝化,应是稀硝酸中铁片先溶解完,不能达到实验目的,错误。
12.C 由题干信息可知,该实验的目的为验证温度对反应速率的影响,即除温度外其他条件需完全相同,则表中a为1.0×10-3,A正确;根据反应速率之比等于化学计量数之比可知,v正(NO)=2v正(N2),当v逆(NO)=2v正(N2)时,有v逆(NO)=v正(NO),说明该反应已达到平衡状态,B正确;由题干数据可知,280 ℃时,前2 min内用NO表示的平均反应速率为=2×10-4 mol/(L·min),根据反应速率之比等于化学计量数之比可知,用N2表示的平均反应速率为1×10-4 mol/(L·min),C错误;由三段式分析:
2NO(g) + 2CO(g) 2CO2(g) + N2(g)
起始量(mol/L) 1.0×10-3 3.6×10-3 0 0
转化量(mol/L) 4.0×10-4 4.0×10-4 4.0×10-4 2.0×10-4
平衡量(mol/L) 6.0×10-4 3.2×10-3 4.0×10-4 2.0×10-4
故280 ℃的条件下达到平衡时CO2的浓度为4.0×10-4 mol/L,D正确。
13.A 由题图可知,A电极上氧气转化成水,氧元素化合价降低,发生还原反应,即A电极为正极,则B电极为负极,正极电势高于负极电势,所以电势为A电极>B电极,A错误;A电极为正极,B电极为负极,海底沉积层和海水层分别为负极和正极的导电介质,B正确;在海底沉积层CH2O转化为CO2,所以海底沉积层可发生反应CH2O-4e-+H2O CO2+4H+,C正确;负极电极反应式为HS--2e- S+H+,生成的H+向正极移动,即H+从海底沉积层通过交界面向海水层移动,所以海底沉积层/海水天然界面作为“质子交换膜材料”,不需要任何人工膜材料,D正确。
14.D 2.56 g铜的物质的量为0.04 mol,铜和硝酸反应生成硝酸铜、氮的氧化物和水,因此与铜反应中,起酸性作用的硝酸为0.08 mol,故A正确;产生的混合气体的物质的量为0.04 mol,设NO和NO2的物质的量分别为x mol和y mol,则x+y=0.04,3x+y=0.04×2,解得x=0.02,y=0.02,则体积比为1∶1,故B正确;根据得失电子守恒,铜失去的电子等于氧气得到的电子,因此氧气的物质的量为=0.02 mol,标准状况下的体积为448 mL,故C正确;反应结束后向溶液中加入120 mL 1 mol·L-1NaOH溶液,恰好使溶液中的Cu2+全部转化为Cu(OH)2沉淀,则硝酸的物质的量为1 mol·L-1×0.12 L+0.04 mol=0.16 mol,原硝酸浓度为=8 mol·L-1,故D错误。
15.B 当n(NaClO)=n1 mol时,氨氮和总氮去除率都是0,说明只发生反应①,此时NH2Cl的物质的量为=0.001 mol,反应前后各元素均无化合价变化,反应①为非氧化还原反应,无电子转移,A错误;根据A项分析可知,当加入的NaClO的物质的量小于等于1×10-3 mol时,氨气全部转化为NH2Cl,再加入0.000 2 mol NaClO,根据题中信息可推知应发生2NH2Cl+ClO-+2OH- N2+3Cl-+3H2O,此时NH2Cl的物质的量为(1×10-3-0.000 4) mol=0.000 6 mol,NH2Cl的浓度为=30.9 mg·L-1,B正确;观察题图n2 mol NaClO时,c(NH2Cl)=0,根据“工业上可用次氯酸盐将氨氮废水转化为N2实现绿色处理”,结合反应2NH3+3ClO- N2+3Cl-+3H2O可知,n(NH2Cl)=n(NH3)=0.001 mol,0.001 mol NH3完全反应生成N2需要0.001 5 mol的NaClO,n2 mol NaClO时氨氮去除率接近100%,但总氮去除率小于100%,说明部分氨发生反应③,则n2>0.001 5,C错误;当次氯酸钠的物质的量大于n2 mol时,反应②③都发生,c(Cl-)>4c(N),D错误。
16.答案 (每空3分)
(1)40
(2)相同的时间内注射器内气体的体积多少(合理即可)
(3)温度较高时水蒸发成水蒸气
(4)过滤、洗涤、干燥
解析 (1)实验探究温度对H2O2分解反应速率的影响时,变量应是温度,其他的量应相同,所以实验2中应加入5%H2O2溶液40 mL。
(2)在两次实验中,可通过相同的时间内注射器内气体的体积多少来比较H2O2分解反应速率的大小。
(3)实验2中水浴温度控制在80 ℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有温度较高时水蒸发成水蒸气的速率加快,注射器内进入了较多水蒸气。
(4)实验结束后若要得到纯净、干燥的MnO2,可采取的操作是过滤、洗涤、干燥。
17.答案 (除标注外,每空2分)
(1)Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O 干燥氨气
(2)a(1分)
(3)3CuO+2NH3 3Cu+N2+3H2O 还原
(4)Ⅱ、Ⅲ
(5)0.2
解析 (1)实验室利用NH4Cl和Ca(OH)2加热可制备NH3,其化学方程式为Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O;装置B中用碱石灰干燥NH3。
(2)NH3与CuO反应,应先通入NH3排出装置中的空气,故应先进行的操作是加热装置A制备NH3,a正确。
(3)根据题中描述可知,收集到的气体单质为N2,该反应的化学方程式为3CuO+2NH3 3Cu+N2+3H2O,该反应中NH3作还原剂,表现出还原性。
(4)NH3极易溶于水,吸收NH3需防倒吸,Ⅰ中NH3直接通入水中,易倒吸;Ⅱ中NH3通入CCl4中,NH3从CCl4中逸出遇水被吸收,能防止倒吸;Ⅲ中球形干燥管可防止倒吸;故装置Ⅱ、Ⅲ均能用于吸收NH3。
(5)所得溶液中NH3的物质的量浓度为=0.2 mol·L-1。
18.答案 (每空2分)
(1)AD (2)AC (3)Pb+S-2e-PbSO4 1 (4)①CH4-8e-+10OH-C+7H2O ②减小
解析 (1)自发进行的氧化还原反应在理论上可以设计成原电池,2FeBr2+3Cl22FeCl3+2Br2为自发进行的氧化还原反应,A符合题意;Na2CO3+2HCl2NaCl+H2O+CO2↑不是氧化还原反应,B不符合题意;2H2O2H2↑+O2↑不是自发进行的氧化还原反应,C不符合题意;Cu+2AgNO32Ag+Cu(NO3)2为自发进行的氧化还原反应,D符合题意。
(2)图Ⅰ中不能形成原电池,气泡产生在锌棒表面,图Ⅱ中形成原电池,锌为负极,铜为正极,气泡产生在铜棒表面,A正确;图Ⅱ中形成原电池,能加快反应速率,图Ⅱ中产生气体的速率比图Ⅰ快,B错误、C正确;图Ⅰ中将化学能转化为热能,图Ⅱ中形成原电池,主要将化学能转化为电能,所以图Ⅰ中温度计的示数高于图Ⅱ中温度计的示数,D、E错误。
(3)放电时铅失去电子生成PbSO4,所以负极反应式为Pb+S-2e-PbSO4;负极增重48 g,增加的为S的质量,则S的物质的量为0.5 mol,转移的电子的物质的量为0.5 mol×2=1 mol。
(4)甲烷燃料电池工作时,甲烷失去电子在负极发生氧化反应,氧气得到电子在正极发生还原反应。①甲烷失去电子在负极发生氧化反应,在碱性条件下生成C和水,所以电池的负极反应式为CH4-8e-+10OH-C+7H2O;②电池工作过程中OH-消耗的量大于产生的量,浓度逐渐减小,则电解质溶液的pH减小。
19.答案 (除标注外,每空2分)
(1)Na2SO3+H2SO4 Na2SO4+SO2↑+H2O 酸性 吸收SO2和HCl,防止污染空气 c (2)SO2+12Cl-+4H++6Cu Cu2S+4[CuCl3]2-+2H2O(3分) CD (3)SO2+2H2O-2e- 4H++S(3分) 1.28
解析 装置A用亚硫酸钠与70%硫酸制备二氧化硫,装置B中二氧化硫和铜片、盐酸反应生成Cu2S、[CuCl3]2-和H2O,装置C为尾气处理装置。(1)装置A中亚硫酸钠与70%硫酸反应生成硫酸钠、二氧化硫和水,反应的化学方程式为Na2SO3+H2SO4 Na2SO4+SO2↑+H2O;该反应中硫酸体现酸性。装置C的作用是吸收SO2和HCl,防止污染空气;浓硫酸、氯化钠均不与SO2和HCl反应,而氢氧化钠可与SO2和HCl反应,故试剂m为NaOH浓溶液,选c。
(2)根据题中信息可知,步骤ⅲ中SO2、HCl、Cu反应生成Cu2S、[CuCl3]2-和H2O,离子方程式为SO2+12Cl-+4H++6Cu Cu2S+4[CuCl3]2-+2H2O;步骤ⅳ中发生反应的离子方程式为[CuCl3]2- CuCl↓+2Cl-,该反应为非氧化还原反应,没有电子的转移,A错误;该反应为可逆反应,[CuCl3]2-中的Cu元素不能全部沉淀,B错误;该反应为可逆反应,反应物和生成物能同时存在,C正确;当溶液的颜色不再变化时,说明反应达到平衡,即该条件下达到最大限度,D正确。
(3)未加氯化钠时,电流表指针基本不偏转,说明基本不反应;当加入氯化钠之后,电流表指针发生偏转且溶液变为棕黄色,说明发生了氧化还原反应且生成了[CuCl3]2-,[CuCl3]2-在C1电极生成,C1电极的电极反应为3Cl-+Cu2++e- [CuCl3]2-,则C2电极上应是SO2发生失电子的氧化反应,电极反应为SO2+2H2O-2e- 4H++S;当电路中转移0.02 mol e-时,左侧烧杯溶液中Cu2+减少0.02 mol,减少的质量为1.28 g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
