2025人教版高中化学必修第二册强化练习题--实验整合练 常见非金属及其化合物的相关实验(含解析)
文档属性
| 名称 | 2025人教版高中化学必修第二册强化练习题--实验整合练 常见非金属及其化合物的相关实验(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 540.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-24 10:00:28 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学必修第二册
实验整合练 常见非金属及其化合物的相关实验
实验1 实验装置分析及试剂的选择
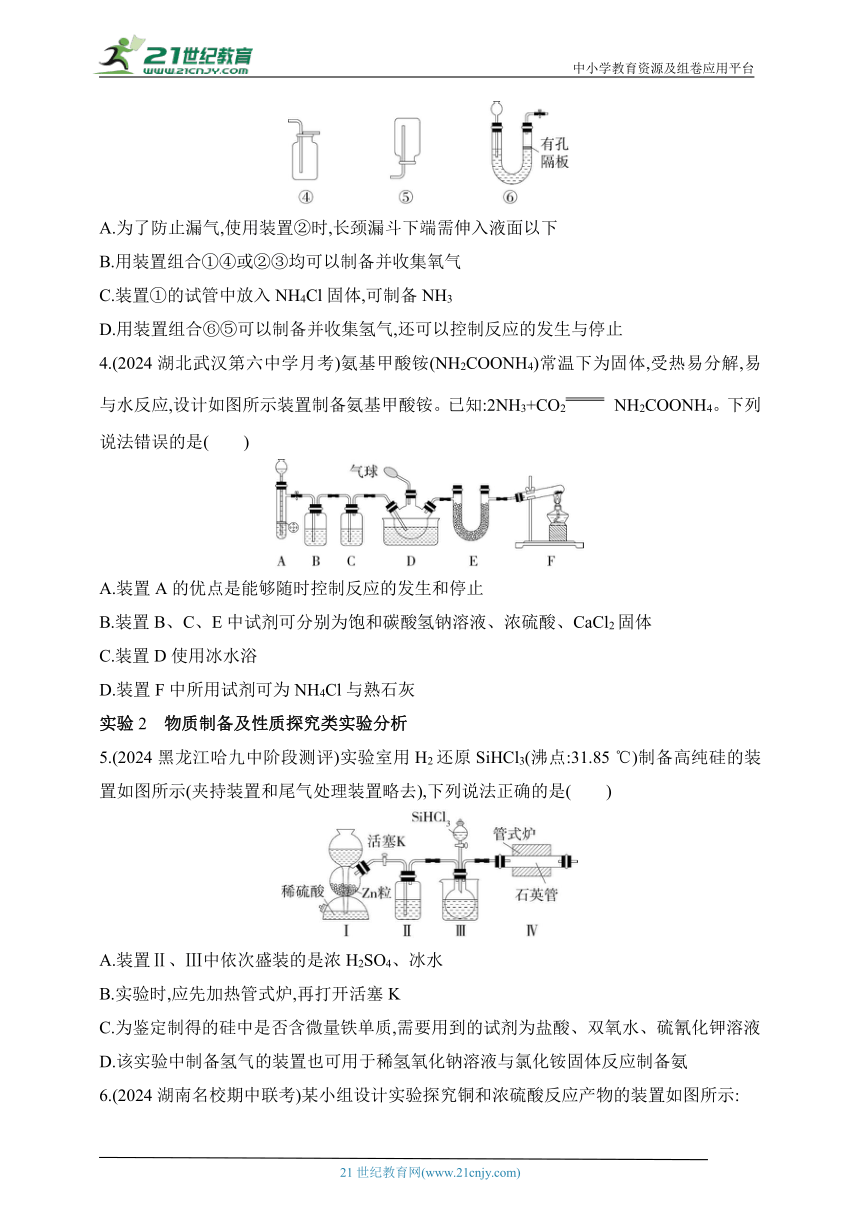
1.(2024山东潍坊期末)利用下列装置(夹持装置略)进行实验,能达到实验目的的是( )
甲 乙 丙 丁
A.装置甲:配制溶液时转移溶液
B.装置乙:制取并收集纯净NH3
C.装置丙:检验SO2的漂白性
D.装置丁:除去Cl2中的HCl
2.(2024湖北荆、荆、襄、宜四地七校期中联考)下图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
选项 试剂X 收集气体 试剂Y
A 碱石灰 氯化氢 水
B 碱石灰 氨气 水
C 五氧化二磷 二氧化硫 氢氧化钠溶液
D 氯化钙 一氧化氮 氢氧化钠溶液
3.(2024浙江浙南名校联考)实验室制取某些气体的装置如图。下列说法不正确的是( )
A.为了防止漏气,使用装置②时,长颈漏斗下端需伸入液面以下
B.用装置组合①④或②③均可以制备并收集氧气
C.装置①的试管中放入NH4Cl固体,可制备NH3
D.用装置组合⑥⑤可以制备并收集氢气,还可以控制反应的发生与停止
4.(2024湖北武汉第六中学月考)氨基甲酸铵(NH2COONH4)常温下为固体,受热易分解,易与水反应,设计如图所示装置制备氨基甲酸铵。已知:2NH3+CO2 NH2COONH4。下列说法错误的是( )
A.装置A的优点是能够随时控制反应的发生和停止
B.装置B、C、E中试剂可分别为饱和碳酸氢钠溶液、浓硫酸、CaCl2固体
C.装置D使用冰水浴
D.装置F中所用试剂可为NH4Cl与熟石灰
实验2 物质制备及性质探究类实验分析
5.(2024黑龙江哈九中阶段测评)实验室用H2还原SiHCl3(沸点:31.85 ℃)制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是( )
A.装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、冰水
B.实验时,应先加热管式炉,再打开活塞K
C.为鉴定制得的硅中是否含微量铁单质,需要用到的试剂为盐酸、双氧水、硫氰化钾溶液
D.该实验中制备氢气的装置也可用于稀氢氧化钠溶液与氯化铵固体反应制备氨
6.(2024湖南名校期中联考)某小组设计实验探究铜和浓硫酸反应产物的装置如图所示:
记录实验现象如表所示:
试管 ① ② ③
实验 现象 铜完全溶解后,溶液仍为无色,有白雾、灰白掺杂的黑色固体产生 有大量白色沉淀产生 有少量白色沉淀产生
已知:浓硫酸的沸点约为338 ℃;实验中可能有CuS、Cu2S生成,都是难溶于水、难溶于稀硫酸的黑色固体。
下列叙述正确的是( )
A.为防止实验时压强过大,可将玻璃管拉出液面以上
B.为了检验试管①中的固体成分,实验结束后,取下试管①并向其中加入适量的水
C.试管②和③中白色沉淀的主要成分都是BaSO4
D.用浓氨水吸收尾气防污染
7.(2024福建龙岩期中联考)某实验小组欲通过加热蒸发硝酸钾(KNO3)溶液的方法获得KNO3固体。已知KNO3固体在一定温度下能发生反应:2KNO3 KNO2+O2↑。为了探究加热蒸发所得固体X中是否含有亚硝酸钾(KNO2),小组同学设计并完成了以下实验。
【查阅资料】
ⅰ.AgNO2是微溶于水的白色(略带黄色)固体;
ⅱ.KNO3、KNO2能在酸性条件下与KI反应,生成I2。
【实验过程】
【分析解释】
(1)KNO2中N的化合价是 价,从化合价的角度预测,KNO2具有的性质是 (填字母)。
A.只有氧化性
B.只有还原性
C.既有氧化性,又有还原性
(2)试管①中,观察到有少量白色沉淀生成,该白色沉淀是 (填化学式)。
(3)试管②中,观察到的现象是 ;KI发生 (填“氧化”或“还原”)反应。
(4)试管③中,观察到新制氯水褪色,利用对比实验排除了稀释对溶液颜色变化的影响。该反应的离子方程式为N+Cl2+H2O N+2Cl-+2H+。该实验选择新制氯水的原因有两个:一是具有强氧化性,二是 。
【反思评价】
(5)综合上述实验,甲同学得出以下结论。你认为甲同学所得结论正确的是 (填字母)。
a.从试管②中的现象可得出酸性条件下,氧化性:N>I2
b.试管①和③中的实验现象均可以证明固体X中含有KNO2
答案与分层梯度式解析
实验整合练 常见非金属及其化合物的相关实验
1.D 转移溶液时需要用玻璃棒引流,A错误;采用向下排空气法收集氨气时导气管应该伸入试管底部,且不能用无水CaCl2干燥NH3,B错误;SO2通入酸性高锰酸钾溶液中能证明二氧化硫具有还原性,不能证明二氧化硫具有漂白性,C错误;HCl极易溶于水,饱和食盐水抑制Cl2溶解,所以可用饱和食盐水除去Cl2中的HCl,D正确。
2.C HCl是酸性气体,碱石灰是CaO、NaOH的混合物,能与HCl反应,不能用来干燥HCl气体,A不正确;NH3的密度比空气小,收集NH3时,集气瓶内导管应短进长出〗,B不正确;P2O5、SO2都为酸性氧化物,P2O5能干燥SO2,SO2能与NaOH溶液反应,因此多余的SO2可用NaOH溶液吸收,且能防止倒吸,C正确;CaCl2能干燥NO,但NO易与O2反应,不能用排空气法收集NO,D不正确。
3.C 为了防止漏气,使用装置②时,长颈漏斗下端需伸入液面以下,起到液封的作用,A正确。实验室中常用加热高锰酸钾或加热氯酸钾与二氧化锰混合物制备氧气,可选择装置①为制备装置;也可用过氧化氢在二氧化锰的催化作用下制备氧气,可选择装置②为制备装置;氧气的密度比空气大,可用向上排空气法来收集,氧气不易溶于水,也可用排水法来收集,因此用装置组合①④或②③均可以制备并收集氧气,B正确。氯化铵加热产生气体HCl和NH3,两者在试管口遇冷重新生成氯化铵,C错误。实验室中可用锌粒与稀硫酸反应来制备氢气,所以可用装置⑥,装置⑥中的弹簧夹关闭,固液分离反应停止,弹簧夹打开,固液接触反应进行,能控制反应的发生与停止;氢气的密度比空气小且常温下不与空气反应,可用⑤收集,D正确。
方法点拨 有关气体的制备、净化与收集需要考虑以下几个方面:
(1)一般根据反应物的状态和反应条件等选择合适的制备装置。
(2)根据气体的性质选取洗气装置。除杂试剂选择的依据:被净化的气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性等。除杂原则:①不损失被净化的气体;②不引入新的杂质气体;③操作简单,易于分离。
(3)根据气体的密度和水溶性选取收集装置。
4.B 装置A制备CO2,装置B除CO2中的HCl,装置C干燥CO2;装置F制备NH3,装置E干燥NH3;干燥的CO2和NH3在装置D中反应生成NH2COONH4。关闭止水夹,装置A中反应停止,打开止水夹,装置A中反应发生,A正确;装置E干燥NH3,NH3不能用CaCl2固体干燥,B错误;NH2COONH4受热易分解,故装置D使用冰水浴,C正确;装置F制备NH3,所用试剂可为NH4Cl与熟石灰,D正确。
5.C 本题制备高纯硅,反应H2+SiHCl3 Si+3HCl应在装置Ⅳ中进行,装置Ⅰ的目的是制备氢气,氢气中含有水蒸气,对后续实验产生干扰,必须除去,因此装置Ⅱ的作用是除去氢气中的水蒸气,即装置Ⅱ中盛放浓硫酸,装置Ⅲ的作用是提供SiHCl3气体,因此应在水浴中加热,A错误;实验时应先打开活塞K,通一段时间H2,目的是排出装置中的空气,防止发生危险,B错误;硅单质不与盐酸反应,Fe与盐酸反应生成Fe2+,Fe2+被H2O2氧化成Fe3+,Fe3+与KSCN反应使溶液变红色,用题述试剂可鉴定制得的硅中是否含有铁单质,C正确;铵盐与浓NaOH溶液加热可制备NH3,装置Ⅰ不能进行加热,D错误。
6.C 浓硫酸和Cu在加热条件下反应有SO2生成,将玻璃管拉出液面以上会使生成的SO2逸出,从而污染环境,A错误;检验试管①中固体成分时,应该将反应后并冷却的试管①里的物质慢慢倒入水中,B错误;SO2和BaCl2不反应,硫酸酸雾进入试管②中生成硫酸钡沉淀,③中少量白色沉淀是水溶液中SO2被O2氧化最终生成的硫酸钡沉淀〗,②和③中白色沉淀的主要成分都是BaSO4,C正确;浓氨水具有挥发性,也会产生污染,D错误。
7.答案 (1)+3 C (2)AgNO2 (3)溶液变成蓝色 氧化 (4)氯水呈浅黄绿色 (5)b
解析 (1)KNO2中N元素的化合价是+3价,处于中间价态,因此KNO2既有氧化性,又有还原性。(2)试管①中,加入AgNO3溶液,观察到有少量白色沉淀生成,该白色沉淀是AgNO2。(3)试管②中,加入含稀硫酸和淀粉的碘化钾溶液,KNO3、KNO2能在酸性条件下与KI反应,生成碘单质,碘单质遇淀粉变蓝色,则观察到的现象是溶液变成蓝色。(4)该实验选择新制氯水的原因,一是具有强氧化性,二是氯水呈浅黄绿色,通过观察反应过程中溶液颜色的变化,可证明固体X中含有KNO2。(5)试管①中生成AgNO2,证明固体X中含有KNO2;试管③中,根据N+Cl2+H2O N+2Cl-+2H+,新制氯水褪色,证明固体X中含有KNO2,b正确。从试管②中的现象,无法比较酸性条件下,N与N的氧化性强弱,a不正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学必修第二册
实验整合练 常见非金属及其化合物的相关实验
实验1 实验装置分析及试剂的选择
1.(2024山东潍坊期末)利用下列装置(夹持装置略)进行实验,能达到实验目的的是( )
甲 乙 丙 丁
A.装置甲:配制溶液时转移溶液
B.装置乙:制取并收集纯净NH3
C.装置丙:检验SO2的漂白性
D.装置丁:除去Cl2中的HCl
2.(2024湖北荆、荆、襄、宜四地七校期中联考)下图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
选项 试剂X 收集气体 试剂Y
A 碱石灰 氯化氢 水
B 碱石灰 氨气 水
C 五氧化二磷 二氧化硫 氢氧化钠溶液
D 氯化钙 一氧化氮 氢氧化钠溶液
3.(2024浙江浙南名校联考)实验室制取某些气体的装置如图。下列说法不正确的是( )
A.为了防止漏气,使用装置②时,长颈漏斗下端需伸入液面以下
B.用装置组合①④或②③均可以制备并收集氧气
C.装置①的试管中放入NH4Cl固体,可制备NH3
D.用装置组合⑥⑤可以制备并收集氢气,还可以控制反应的发生与停止
4.(2024湖北武汉第六中学月考)氨基甲酸铵(NH2COONH4)常温下为固体,受热易分解,易与水反应,设计如图所示装置制备氨基甲酸铵。已知:2NH3+CO2 NH2COONH4。下列说法错误的是( )
A.装置A的优点是能够随时控制反应的发生和停止
B.装置B、C、E中试剂可分别为饱和碳酸氢钠溶液、浓硫酸、CaCl2固体
C.装置D使用冰水浴
D.装置F中所用试剂可为NH4Cl与熟石灰
实验2 物质制备及性质探究类实验分析
5.(2024黑龙江哈九中阶段测评)实验室用H2还原SiHCl3(沸点:31.85 ℃)制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是( )
A.装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、冰水
B.实验时,应先加热管式炉,再打开活塞K
C.为鉴定制得的硅中是否含微量铁单质,需要用到的试剂为盐酸、双氧水、硫氰化钾溶液
D.该实验中制备氢气的装置也可用于稀氢氧化钠溶液与氯化铵固体反应制备氨
6.(2024湖南名校期中联考)某小组设计实验探究铜和浓硫酸反应产物的装置如图所示:
记录实验现象如表所示:
试管 ① ② ③
实验 现象 铜完全溶解后,溶液仍为无色,有白雾、灰白掺杂的黑色固体产生 有大量白色沉淀产生 有少量白色沉淀产生
已知:浓硫酸的沸点约为338 ℃;实验中可能有CuS、Cu2S生成,都是难溶于水、难溶于稀硫酸的黑色固体。
下列叙述正确的是( )
A.为防止实验时压强过大,可将玻璃管拉出液面以上
B.为了检验试管①中的固体成分,实验结束后,取下试管①并向其中加入适量的水
C.试管②和③中白色沉淀的主要成分都是BaSO4
D.用浓氨水吸收尾气防污染
7.(2024福建龙岩期中联考)某实验小组欲通过加热蒸发硝酸钾(KNO3)溶液的方法获得KNO3固体。已知KNO3固体在一定温度下能发生反应:2KNO3 KNO2+O2↑。为了探究加热蒸发所得固体X中是否含有亚硝酸钾(KNO2),小组同学设计并完成了以下实验。
【查阅资料】
ⅰ.AgNO2是微溶于水的白色(略带黄色)固体;
ⅱ.KNO3、KNO2能在酸性条件下与KI反应,生成I2。
【实验过程】
【分析解释】
(1)KNO2中N的化合价是 价,从化合价的角度预测,KNO2具有的性质是 (填字母)。
A.只有氧化性
B.只有还原性
C.既有氧化性,又有还原性
(2)试管①中,观察到有少量白色沉淀生成,该白色沉淀是 (填化学式)。
(3)试管②中,观察到的现象是 ;KI发生 (填“氧化”或“还原”)反应。
(4)试管③中,观察到新制氯水褪色,利用对比实验排除了稀释对溶液颜色变化的影响。该反应的离子方程式为N+Cl2+H2O N+2Cl-+2H+。该实验选择新制氯水的原因有两个:一是具有强氧化性,二是 。
【反思评价】
(5)综合上述实验,甲同学得出以下结论。你认为甲同学所得结论正确的是 (填字母)。
a.从试管②中的现象可得出酸性条件下,氧化性:N>I2
b.试管①和③中的实验现象均可以证明固体X中含有KNO2
答案与分层梯度式解析
实验整合练 常见非金属及其化合物的相关实验
1.D 转移溶液时需要用玻璃棒引流,A错误;采用向下排空气法收集氨气时导气管应该伸入试管底部,且不能用无水CaCl2干燥NH3,B错误;SO2通入酸性高锰酸钾溶液中能证明二氧化硫具有还原性,不能证明二氧化硫具有漂白性,C错误;HCl极易溶于水,饱和食盐水抑制Cl2溶解,所以可用饱和食盐水除去Cl2中的HCl,D正确。
2.C HCl是酸性气体,碱石灰是CaO、NaOH的混合物,能与HCl反应,不能用来干燥HCl气体,A不正确;NH3的密度比空气小,收集NH3时,集气瓶内导管应短进长出〗,B不正确;P2O5、SO2都为酸性氧化物,P2O5能干燥SO2,SO2能与NaOH溶液反应,因此多余的SO2可用NaOH溶液吸收,且能防止倒吸,C正确;CaCl2能干燥NO,但NO易与O2反应,不能用排空气法收集NO,D不正确。
3.C 为了防止漏气,使用装置②时,长颈漏斗下端需伸入液面以下,起到液封的作用,A正确。实验室中常用加热高锰酸钾或加热氯酸钾与二氧化锰混合物制备氧气,可选择装置①为制备装置;也可用过氧化氢在二氧化锰的催化作用下制备氧气,可选择装置②为制备装置;氧气的密度比空气大,可用向上排空气法来收集,氧气不易溶于水,也可用排水法来收集,因此用装置组合①④或②③均可以制备并收集氧气,B正确。氯化铵加热产生气体HCl和NH3,两者在试管口遇冷重新生成氯化铵,C错误。实验室中可用锌粒与稀硫酸反应来制备氢气,所以可用装置⑥,装置⑥中的弹簧夹关闭,固液分离反应停止,弹簧夹打开,固液接触反应进行,能控制反应的发生与停止;氢气的密度比空气小且常温下不与空气反应,可用⑤收集,D正确。
方法点拨 有关气体的制备、净化与收集需要考虑以下几个方面:
(1)一般根据反应物的状态和反应条件等选择合适的制备装置。
(2)根据气体的性质选取洗气装置。除杂试剂选择的依据:被净化的气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性等。除杂原则:①不损失被净化的气体;②不引入新的杂质气体;③操作简单,易于分离。
(3)根据气体的密度和水溶性选取收集装置。
4.B 装置A制备CO2,装置B除CO2中的HCl,装置C干燥CO2;装置F制备NH3,装置E干燥NH3;干燥的CO2和NH3在装置D中反应生成NH2COONH4。关闭止水夹,装置A中反应停止,打开止水夹,装置A中反应发生,A正确;装置E干燥NH3,NH3不能用CaCl2固体干燥,B错误;NH2COONH4受热易分解,故装置D使用冰水浴,C正确;装置F制备NH3,所用试剂可为NH4Cl与熟石灰,D正确。
5.C 本题制备高纯硅,反应H2+SiHCl3 Si+3HCl应在装置Ⅳ中进行,装置Ⅰ的目的是制备氢气,氢气中含有水蒸气,对后续实验产生干扰,必须除去,因此装置Ⅱ的作用是除去氢气中的水蒸气,即装置Ⅱ中盛放浓硫酸,装置Ⅲ的作用是提供SiHCl3气体,因此应在水浴中加热,A错误;实验时应先打开活塞K,通一段时间H2,目的是排出装置中的空气,防止发生危险,B错误;硅单质不与盐酸反应,Fe与盐酸反应生成Fe2+,Fe2+被H2O2氧化成Fe3+,Fe3+与KSCN反应使溶液变红色,用题述试剂可鉴定制得的硅中是否含有铁单质,C正确;铵盐与浓NaOH溶液加热可制备NH3,装置Ⅰ不能进行加热,D错误。
6.C 浓硫酸和Cu在加热条件下反应有SO2生成,将玻璃管拉出液面以上会使生成的SO2逸出,从而污染环境,A错误;检验试管①中固体成分时,应该将反应后并冷却的试管①里的物质慢慢倒入水中,B错误;SO2和BaCl2不反应,硫酸酸雾进入试管②中生成硫酸钡沉淀,③中少量白色沉淀是水溶液中SO2被O2氧化最终生成的硫酸钡沉淀〗,②和③中白色沉淀的主要成分都是BaSO4,C正确;浓氨水具有挥发性,也会产生污染,D错误。
7.答案 (1)+3 C (2)AgNO2 (3)溶液变成蓝色 氧化 (4)氯水呈浅黄绿色 (5)b
解析 (1)KNO2中N元素的化合价是+3价,处于中间价态,因此KNO2既有氧化性,又有还原性。(2)试管①中,加入AgNO3溶液,观察到有少量白色沉淀生成,该白色沉淀是AgNO2。(3)试管②中,加入含稀硫酸和淀粉的碘化钾溶液,KNO3、KNO2能在酸性条件下与KI反应,生成碘单质,碘单质遇淀粉变蓝色,则观察到的现象是溶液变成蓝色。(4)该实验选择新制氯水的原因,一是具有强氧化性,二是氯水呈浅黄绿色,通过观察反应过程中溶液颜色的变化,可证明固体X中含有KNO2。(5)试管①中生成AgNO2,证明固体X中含有KNO2;试管③中,根据N+Cl2+H2O N+2Cl-+2H+,新制氯水褪色,证明固体X中含有KNO2,b正确。从试管②中的现象,无法比较酸性条件下,N与N的氧化性强弱,a不正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
