专题02 常见的化学反应【考点串讲】-2024-2025学年九年级科学上学期期末考点大串讲(浙教版)
文档属性
| 名称 | 专题02 常见的化学反应【考点串讲】-2024-2025学年九年级科学上学期期末考点大串讲(浙教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-12-25 09:23:36 | ||
图片预览








文档简介
(共44张PPT)
专题02 常见的化学反应
期末复习·考点串讲
九年级科学上册·浙教版
模块一 知识清单
模块二 方法模型归纳
模块三 巩固提升
模块一 知识清单
模块二 方法模型归纳
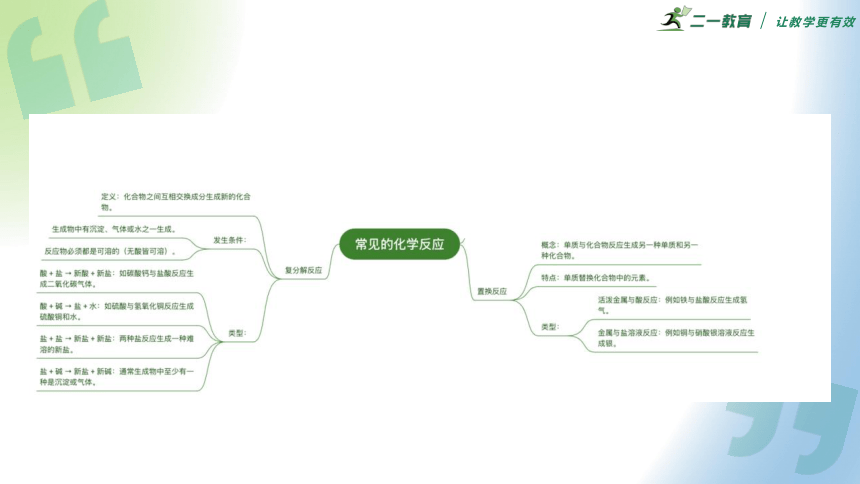
(1)置换反应
①概念:由一种单质跟一种化合物发生反应生成另一种单质和另一种化合物的反应。
②形式: A+BC → AC+B
③特点:单换单
④置换反应类型
a.活泼金属与酸反应,如Fe+2HCl = FeCl2+H2 ↑
b.金属与盐溶液反应,如Cu+2AgNO3 = Cu(NO3)2+2Ag
一、置换反应
(2)四大基本反应类型
一、置换反应
反应类型 概念 特点 形式
化合反应 由两种或两种以上物质生成一种物质的反应 多变一 A+B+...→ C
分解反应 由一种物质生成两种或两种以上物质的反应 一变多 A → B+C+...
置换反应 由一种单质跟一种化合物发生反应生成另一种单质和另一种化合物反应 单换单 AB+C → A+CB
复分解反应 两种化合物互相交换成分生成两种新化合物反应 两交换、价不变 AB+CD → AD+CB
例1.(2023秋 温州期末)如图为一种引火方式,用铁球甲撞击包裹铝箔的生锈铁球乙,铁球乙上的木屑就会被引燃。其原因是撞击使生锈铁球乙温度升高,引发氧化铁与铝箔发生反应放出大量热,引燃木屑。据此回答下面小题。铝与氧化铁反应的化学方程式为:2Al+Fe2O3高温 2Fe+Al2O3,该反应属于置换反应,其判断依据是( )
A.一种物质变化生成多种物质
B.多种物质反应生成一种物质
C.单质与化合物反应生成新的单质与新的化合物
D.两种化合物相互交换成分生成新的两种化合物
C
(1)概念:两种化合物互相交换成分生成两种新化合物的反应(通式表示为AB+CD → AD+CB )。
(2)特点:复分解反应交换成分,但反应前后各元素的化合价不变。
(3)复分解反应发生的条件
二、复分解反应
反应类型 反应物条件 生成物条件
酸+碱 至少一种可溶 需具备下列三个条件中至少-一个:
①有沉淀生成
②有气体生成
③有水生成
碱+盐 二者都可溶 盐+盐 二者都可溶 盐+酸 酸必须可溶 (4)复分解反应实质:发生复分解反应的两种物质在水溶液中相互交换离子,结合成难电离的物质——沉淀、气体和水。
二、复分解反应
例3.(2024秋 西湖区校级月考)向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液。反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法不正确的是( )
A.图中0a段表示生成气体的过程
B.b点溶液中溶质有2种
C.c点溶液的pH>7
D.x值为106.0
B
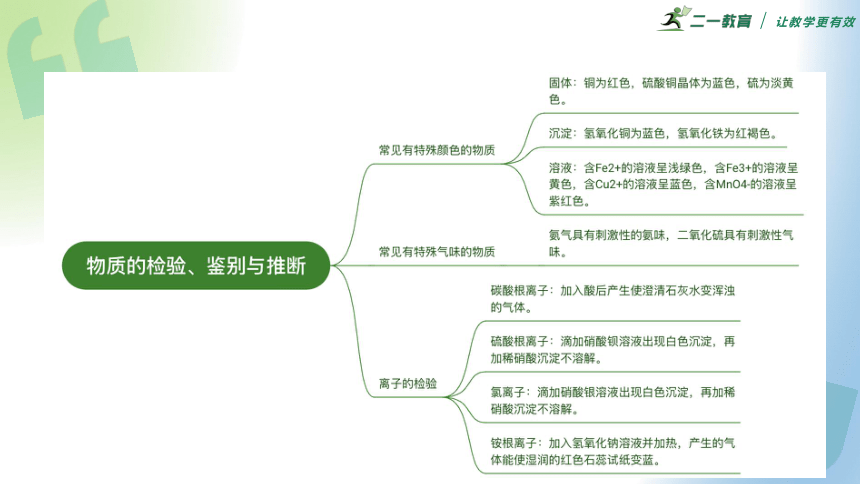
1.原理:根据物质具有不同的特性,利用这种特性上的差异,选择适当的、实际的方法,将物质检验出来,要求现象明显。
2.检验方法
(1)物理方法:根据物质的特殊物理性质,如颜色、气味、水溶性等,通过观察、分析、判断、得出结论。
(2)化学方法:利用物质的特殊化学性质,反应时产生的特征现象,对所给物质进行检验。
三、物质的检验
3.物理方法
(1)常见有特殊颜色的物质(离子代表含有这种离子的溶液)
①固体物质:Cu:红(或紫红)色;CuSO4·5H2O:蓝色;S:淡黄色。
②沉淀:Cu(OH)2:蓝色;Fe(OH)3:红褐色。
③溶液:Fe2+:浅绿色;Fe3+:黄色;Cu2+:蓝色;MnO4-:紫红色。
(2)常见有特殊气味的物质
氨气:刺激性的氨味气体;SO2:刺激性气味气体。
三、物质的检验
(3)常见气体的检验
三、物质的检验
气体 检验方法 实验现象
O2 将带火星的木条伸入集气瓶内 木条复燃
CO2 将气体通入澄清石灰水中 澄清石灰水变浑浊
H2 点燃,在火焰上方罩一个干冷的烧杯 烧杯内壁有水雾(或水珠)生成
CH4 点燃,在火焰上方罩一个干冷的烧杯;一段时间后,迅速倒转烧杯,向烧杯中加入澄清石灰水,振荡 烧杯内壁有水雾(或水珠)生成;澄清石灰水变浑浊
CO 点燃,在火焰上方罩一个涂有澄清石灰水的烧杯 澄清石灰水变浑浊
NH3 将湿润的红色石蕊试纸放在试管口 红色石蕊试纸变为蓝色
水蒸气 通过无水硫酸铜 无水硫酸铜由白色变成蓝色
HCl 先通入硝酸银溶液,再滴加稀HNO3 有白色沉淀生成,且沉淀不溶解
(4)常见离子的检验
三、物质的检验
离子 检验方法 实验现象
H+ ①取少量试剂滴加紫色石蕊溶液 石蕊溶液变红
②用玻璃棒蘸取少量试剂滴在pH试纸上 与标准比色卡对照pH<7
③取少量试剂加入Zn粒 有气泡产生
④取少量试剂加入碳酸钠 有气泡产生
OH- ①取少量试剂滴加紫色石蕊溶液 石蕊溶液变蓝
②取少量试剂滴加无色酚酞溶液 酚酞溶液变红
③用玻璃棒蘸取少量试剂滴在pH试纸上 与标准比色卡对照pH>7
④取少量试剂加入可溶性铜盐 有蓝色絮状沉淀生成
Cl- 取少量试剂滴加少量AgNO3溶液和稀HNO3 产生白色沉淀,且沉淀不消失
SO42- 取少量试剂滴加少量Ba(NO3)2溶液和稀HNO3 产生白色沉淀,且沉淀不消失
CO32- 取少量试剂滴加稀盐酸,将产生的气体通入澄清石灰水中 产生气泡,澄清石灰水变浑浊
三、物质的检验
离子 检验方法 实验现象
Cu2+ 取少量试剂滴加可溶性碱 有蓝色絮状沉淀生成
Fe3+ 取少量试剂滴加可溶性碱 有红褐色沉淀生成
NH4+ 取少量试剂滴加可溶性碱,加热,将湿润的红色石蕊试纸放在试管口 产生有刺激性气味的气体,红色石蕊试纸变蓝
Ag+ 取少量试剂滴加少量NaCl溶液和稀HNO3 产生白色沉淀,且沉淀不消失
Ba2+ 取少量试剂滴加少量Na2SO4和稀HNO3 产生白色沉淀,且沉淀不消失
Ca2+ 取少量试剂滴加可溶性碳酸盐溶液 有白色沉淀生成
实验步骤 实验现象 结论
1、向盛放溶液的试管中加入足量 。 有气泡产生 证明有。
2、继续向试管中加入足量 溶液。 有白色沉淀生成 证明有 。
3、过滤,向滤液中加适量的 溶液。 有白色沉淀生成 证明有 。
例4.(2023秋 江干区校级月考)某溶液中只含有Na2SO4、Na2CO3和NaCl三种溶质。欲证明其中SO42-、CO32-、Cl-三种阴离子确实存在,我们设计了如下实验,请你认真填写下面的实验报告。
稀HNO3
Ba(NO3)2
SO42-
AgNO3
Cl﹣
1.物质的鉴别原则:操作简单、试剂种类少、现象明显。
2.物质鉴别的方法:应先简后繁,先用物理方法后用化学方法。
(1)物理方法:依据物质特殊的物理性质(如颜色、状态、气味、溶解性、溶解时的吸放热现象)进行观察、分析、判断,得出结论。
(2)化学方法:依据物质间反应时所产生的特殊反应现象(如变色、放出气体、生成沉淀、放热等)进行鉴别。
四、物质的鉴别
3.物质鉴别的形式
(1)一种试剂鉴别:选择一种试剂,分别加入待测物质中,观察实验现象。
(2)多种试剂鉴别:选择多种试剂,依次加入待测物质中,会出现明显不同现象。
(3)无试剂鉴别:先利用物质物理性质不同或物质间的相互反应(包括与生成物反应)而产生不同现象把物质鉴别出来。
四、物质的鉴别
例5.(2024秋 西湖区校级月考)下列鉴别物质的方法中,切实可行的是( )
①用酚酞试液鉴别NaCl溶液和盐酸
②用氯化钡溶液鉴别稀盐酸和稀硫酸
③用氯化钙溶液鉴别烧碱溶液和纯碱溶液
④用水鉴别NH4NO3和NaOH固体
A.①②③④ B.②③ C.②③④ D.③④
C
1.以物质特征颜色为突破口
⑴ 固体颜色:Fe、C、CuO、MnO2、Fe3O4(黑色);Cu、Fe2O3(红色);Cu2(OH)2CO3(绿色);CuSO4·5H2O(蓝色)。
⑵ 溶液颜色:CuCl2、CuSO4(蓝色);FeCl2、FeSO4(浅绿色);FeCl3、Fe2(SO4)3(黄色)。
⑶ 火焰颜色:S在O2中燃烧(蓝紫色);S、H2在空气中燃烧(淡蓝色);CO、CH4在空气中燃烧(蓝色)。
⑷ 沉淀颜色:BaSO4、AgCl、CaCO3、BaCO3(白色);Cu(OH)2(蓝色);Fe(OH)3(红褐色)。
五、物质的推断
2.以物质特征状态为突破口
常见固体单质有Fe、Cu、C、S;
气体单质有H2、N2、O2;
无色气体有H2、N2、O2、CO、CO2、CH4、SO2;
常温下呈液态的物质有H2O。
五、物质的推断
3.以物质特征反应条件为突破口
点燃(有O2参加的反应); 通电(电解H2O); 催化剂(KClO3分解制O2);
高温(CaCO3分解,C、CO还原CuO、Fe2O3);
加热(KCIO3、KMnO4、Cu2(OH)2CO3等的分解,H2还原CuO、Fe2O3)。
五、物质的推断
4.以物质特征现象为突破口
⑴ 能使澄清石灰水变浑浊的无色无味气体是CO2。
⑵ 能使黑色CuO变红(或红色Fe2O3变黑)的气体是H2或CO,固体是C。
⑶ 能使燃烧着的木条正常燃烧的气体是空气,燃烧得更旺的气体是O2,熄灭的气体是CO2或N2;能使带火星的木条复燃的气体O2。
⑷ 能使白色无水CuSO4粉末变蓝的气体是水蒸气。
五、物质的推断
⑸ 在O2中燃烧火星四射的物质是Fe。
⑹ 在空气中燃烧生成CO2和H2O的物质是有机物,如CH4、C2H5OH等。
⑺ 能溶于盐酸或稀HNO3的白色沉淀有CaCO3、BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4。
五、物质的推断
5.以元素或物质之最为突破口
⑴ 地壳中含量最多的元素是O,含量最多的金属元素是AI。
⑵ 人体中含量最多的元素是O。 ⑶ 空气中含量最多的元素是N。
⑷ 形成化合物最多的元素是C。 ⑸ 质子数最少的元素是H。
⑹ 相对分子质量最小、密度也最小的气体是H2。
⑺ 相对分子质量最小的氧化物是H2O。
⑻ 自然界中硬度最大的物质是金刚石。
⑼ 空气中含量最多的气体是N2。 ⑽ 最简单的有机物是CH4。
⑾ 最常用的溶剂是H2O。 ⑿ 人体中含量最多的物质是H2O。
五、物质的推断
化学推断题解题技巧和思路
1.审题:认真审读原理,弄清文意和图意,理出题给条件,深挖细找,反复推敲。
2.分析:抓住关键,找准解题的突破口,突破口也称为“题眼”,指的是关键词、特殊现象、物质都特征等等,然后从突破口出发,探求知识间的内在联系,应用多种思维方式,进行严密的分析和逻辑推理,推出符合题意的结果。
五、物质的推断
化学推断题解题技巧和思路
3.解答:根据题目的要求,按照分析和推理的结果,认真而全面地解答。
4.检验:得出结论后切勿忘记验证。其方法是将所得答案放回原题中检验,若完全符合,则说明答案正确。若出现不符,则说明答案有误,需要另行思考,推出正确答案。
五、物质的推断
例6.(2024秋 萧山区月考)如图所示,奥运五环图形中,已知A、B、C、D、E各为稀硫酸、氢氧化钠溶液、二氧化碳、氧化铁、水中的一种,且相连环内的两种物质能发生化学反应,E是常见的溶剂。下列说法不正确的是( )
A.B的化学式是H2SO4
B.D可以造成“温室效应”加剧
C.A与B的反应可用于除铁锈
D.C的固体溶解在E中,温度会降低
D
六、离子共存
离子检验的常用试剂
H+和OH-:紫色石蕊试液或pH试纸。
OH-:无色酚酞试液(可鉴别碱性溶液)——变红。
Cl-:AgNO3溶液和稀HNO3——有白色沉淀。
SO42-:BaCl2溶液和稀HNO3——有白色沉淀。
CO32-:稀HCl和石灰水——有CO2↑。
PO43-:AgNO3溶液——有黄色沉淀。
NH4+:强碱溶液(NaOH)——有NH3↑。使湿润红色石蕊试纸变蓝。
也就是上述两者离子相遇即会发生复分解反应不能共存。也要注意题目中的隐含条件,如pH<7,表示溶液中存在很多氢离子
例7.(2024秋 上城区期中)甲、乙两化工厂分布如图所示,箭头代表水流方向。如果在a处取得水样,经检测含有的阴离子是OH﹣、SO42-。在c处取得水样,经检测pH=7,且只含有少量NaCl。若已知b处水中含有的物质是BaCl2、HCl,则a处水样含有的阳离子是( )
A.Mg2+ B.Na+ C.H+ D.Ba2+
B
模块三 巩固提升
1.图像是一种表示方法,也是了解化学反应的“窗口”,我们可通过建立图像来表示化学反应过程中物质间量的相互关系。现一烧杯中含有HCl和CaCl2的混合液,将一定质量分数的Na2CO3溶液加入到混合液中直至过量,则在该反程中各个量的关系图正确的是( )
B.
C.
D.
B
A.
2.小科利用如图甲所示的装置对盐酸和氢氧化钠溶液反应进行探究,测量结果如图乙和图丙所示。下列说法正确的是( )
A.图甲中仪器A盛放的是NaOH溶液
B.图乙中a→d所示溶液中NaCl的质量不断增加
C.图丙中V的数值最接近12
D.图丙中从f→g温度变化趋势可说明该反应是吸热反应
C
3.向100g质量分数分别为14.6%HCl和12%MgSO4的混合溶液中,滴加Ba(OH)2溶液至过量.下列图象中,产生的沉淀量与滴入Ba(OH)2相符的是( )
A. B.
C.
D.
B
4.如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A.甲实验试管口向下倾斜可防止氢气逸出
B.乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生
C.甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸
D.甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应
C
5.中国科学家已实现由CO2到淀粉的全人工合成,其中一步重要反应的物质转化如图所示(反应a中,各物质分子个数比为1:1:1:1)。下列说法不正确的是( )
A.O2是反应a、b中可循环利用的物质
B.反应a、b中均有元素化合价的改变
C.由反应a可推测甲醛中含氢量高于甲醇
D.为使甲醇持续转化为甲醛,反应b需补充H2O2
C
6.如图中,甲、乙、丙是初中化学中常见的物质,图中“—”表示相连的物质之闻可以在溶液中发生化学反应,“→”表示由某种物质可转化为另一种物质(部分反应物、生成物及反应条件已略去)。下列说法中不正确的是( )
A.甲、乙、丙可能依次为Fe、NaOH、CO2
B.当甲为一种碱时,它与硫酸铜溶液的反应可能产生两种沉淀
C.当乙为NaOH时,它可由Ca(OH)2与Na2CO3反应生成
D.丙物质只能是氧化物或盐
D
7.(2024 宁波模拟)有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成,为检验其中的成分,按以下流程进行实验:
(1)根据实验现象,白色粉末中一定有 。
(2)加入足量稀HNO3,后沉淀全部溶解的化学方程式为
。
(3)实验中不能用BaCl2溶液代替Ba(NO3)2溶液的理由是
。
氯化钠、碳酸钠
BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑
氯化钡引入氯离子会影响对氯化钠的推断
8.某实验废液中可能含有Cl﹣、CO32﹣、SO42﹣、Na+、Mg2+、Fe3+六种离子中的几种。为确定废液中存在的离子,进行了下面实验:
①取少量废液,向废液中滴加NaOH溶液,有白色沉淀生成;
②另取少量废液,向其中滴加BaCl2溶液,无明显现象;
③再取少量废液,滴加AgNO3溶液,产生白色沉淀,加稀硝酸后沉淀不溶解。
请分析实验后回答:
(1)废液中一定含有的离子是 ,可能含有的离子是 ;
(2)有同学认为实验③可以省略,理由是
。
Mg2+和Cl﹣
Na+
步骤②向废液中加入BaCl2溶液无明显现象,说明溶液中一定没有SO42﹣和CO32﹣,故溶液中一定含有Cl﹣
9.(2023秋 黄岩区期末)酸和碱反应是一类重要的化学反应。某科学兴趣小组利用图1装置研究稀盐酸与氢氧化钠溶液反应过程中溶液的pH,得到溶液pH(如图2)和溶液中Na+、OH﹣数量随加入甲溶液体积的变化图像(如图3),请结合图像回答下列问题:
(1)根据图1和图2可知甲溶液是 。
(2)结合图2、3,该兴趣小组同学推断图3中当所加甲溶液体积为V1时,溶液中OH﹣恰好被反应完,则V1的值为 mL。
12
稀盐酸
专题02 常见的化学反应
期末复习·考点串讲
九年级科学上册·浙教版
模块一 知识清单
模块二 方法模型归纳
模块三 巩固提升
模块一 知识清单
模块二 方法模型归纳
(1)置换反应
①概念:由一种单质跟一种化合物发生反应生成另一种单质和另一种化合物的反应。
②形式: A+BC → AC+B
③特点:单换单
④置换反应类型
a.活泼金属与酸反应,如Fe+2HCl = FeCl2+H2 ↑
b.金属与盐溶液反应,如Cu+2AgNO3 = Cu(NO3)2+2Ag
一、置换反应
(2)四大基本反应类型
一、置换反应
反应类型 概念 特点 形式
化合反应 由两种或两种以上物质生成一种物质的反应 多变一 A+B+...→ C
分解反应 由一种物质生成两种或两种以上物质的反应 一变多 A → B+C+...
置换反应 由一种单质跟一种化合物发生反应生成另一种单质和另一种化合物反应 单换单 AB+C → A+CB
复分解反应 两种化合物互相交换成分生成两种新化合物反应 两交换、价不变 AB+CD → AD+CB
例1.(2023秋 温州期末)如图为一种引火方式,用铁球甲撞击包裹铝箔的生锈铁球乙,铁球乙上的木屑就会被引燃。其原因是撞击使生锈铁球乙温度升高,引发氧化铁与铝箔发生反应放出大量热,引燃木屑。据此回答下面小题。铝与氧化铁反应的化学方程式为:2Al+Fe2O3高温 2Fe+Al2O3,该反应属于置换反应,其判断依据是( )
A.一种物质变化生成多种物质
B.多种物质反应生成一种物质
C.单质与化合物反应生成新的单质与新的化合物
D.两种化合物相互交换成分生成新的两种化合物
C
(1)概念:两种化合物互相交换成分生成两种新化合物的反应(通式表示为AB+CD → AD+CB )。
(2)特点:复分解反应交换成分,但反应前后各元素的化合价不变。
(3)复分解反应发生的条件
二、复分解反应
反应类型 反应物条件 生成物条件
酸+碱 至少一种可溶 需具备下列三个条件中至少-一个:
①有沉淀生成
②有气体生成
③有水生成
碱+盐 二者都可溶 盐+盐 二者都可溶 盐+酸 酸必须可溶 (4)复分解反应实质:发生复分解反应的两种物质在水溶液中相互交换离子,结合成难电离的物质——沉淀、气体和水。
二、复分解反应
例3.(2024秋 西湖区校级月考)向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液。反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法不正确的是( )
A.图中0a段表示生成气体的过程
B.b点溶液中溶质有2种
C.c点溶液的pH>7
D.x值为106.0
B
1.原理:根据物质具有不同的特性,利用这种特性上的差异,选择适当的、实际的方法,将物质检验出来,要求现象明显。
2.检验方法
(1)物理方法:根据物质的特殊物理性质,如颜色、气味、水溶性等,通过观察、分析、判断、得出结论。
(2)化学方法:利用物质的特殊化学性质,反应时产生的特征现象,对所给物质进行检验。
三、物质的检验
3.物理方法
(1)常见有特殊颜色的物质(离子代表含有这种离子的溶液)
①固体物质:Cu:红(或紫红)色;CuSO4·5H2O:蓝色;S:淡黄色。
②沉淀:Cu(OH)2:蓝色;Fe(OH)3:红褐色。
③溶液:Fe2+:浅绿色;Fe3+:黄色;Cu2+:蓝色;MnO4-:紫红色。
(2)常见有特殊气味的物质
氨气:刺激性的氨味气体;SO2:刺激性气味气体。
三、物质的检验
(3)常见气体的检验
三、物质的检验
气体 检验方法 实验现象
O2 将带火星的木条伸入集气瓶内 木条复燃
CO2 将气体通入澄清石灰水中 澄清石灰水变浑浊
H2 点燃,在火焰上方罩一个干冷的烧杯 烧杯内壁有水雾(或水珠)生成
CH4 点燃,在火焰上方罩一个干冷的烧杯;一段时间后,迅速倒转烧杯,向烧杯中加入澄清石灰水,振荡 烧杯内壁有水雾(或水珠)生成;澄清石灰水变浑浊
CO 点燃,在火焰上方罩一个涂有澄清石灰水的烧杯 澄清石灰水变浑浊
NH3 将湿润的红色石蕊试纸放在试管口 红色石蕊试纸变为蓝色
水蒸气 通过无水硫酸铜 无水硫酸铜由白色变成蓝色
HCl 先通入硝酸银溶液,再滴加稀HNO3 有白色沉淀生成,且沉淀不溶解
(4)常见离子的检验
三、物质的检验
离子 检验方法 实验现象
H+ ①取少量试剂滴加紫色石蕊溶液 石蕊溶液变红
②用玻璃棒蘸取少量试剂滴在pH试纸上 与标准比色卡对照pH<7
③取少量试剂加入Zn粒 有气泡产生
④取少量试剂加入碳酸钠 有气泡产生
OH- ①取少量试剂滴加紫色石蕊溶液 石蕊溶液变蓝
②取少量试剂滴加无色酚酞溶液 酚酞溶液变红
③用玻璃棒蘸取少量试剂滴在pH试纸上 与标准比色卡对照pH>7
④取少量试剂加入可溶性铜盐 有蓝色絮状沉淀生成
Cl- 取少量试剂滴加少量AgNO3溶液和稀HNO3 产生白色沉淀,且沉淀不消失
SO42- 取少量试剂滴加少量Ba(NO3)2溶液和稀HNO3 产生白色沉淀,且沉淀不消失
CO32- 取少量试剂滴加稀盐酸,将产生的气体通入澄清石灰水中 产生气泡,澄清石灰水变浑浊
三、物质的检验
离子 检验方法 实验现象
Cu2+ 取少量试剂滴加可溶性碱 有蓝色絮状沉淀生成
Fe3+ 取少量试剂滴加可溶性碱 有红褐色沉淀生成
NH4+ 取少量试剂滴加可溶性碱,加热,将湿润的红色石蕊试纸放在试管口 产生有刺激性气味的气体,红色石蕊试纸变蓝
Ag+ 取少量试剂滴加少量NaCl溶液和稀HNO3 产生白色沉淀,且沉淀不消失
Ba2+ 取少量试剂滴加少量Na2SO4和稀HNO3 产生白色沉淀,且沉淀不消失
Ca2+ 取少量试剂滴加可溶性碳酸盐溶液 有白色沉淀生成
实验步骤 实验现象 结论
1、向盛放溶液的试管中加入足量 。 有气泡产生 证明有。
2、继续向试管中加入足量 溶液。 有白色沉淀生成 证明有 。
3、过滤,向滤液中加适量的 溶液。 有白色沉淀生成 证明有 。
例4.(2023秋 江干区校级月考)某溶液中只含有Na2SO4、Na2CO3和NaCl三种溶质。欲证明其中SO42-、CO32-、Cl-三种阴离子确实存在,我们设计了如下实验,请你认真填写下面的实验报告。
稀HNO3
Ba(NO3)2
SO42-
AgNO3
Cl﹣
1.物质的鉴别原则:操作简单、试剂种类少、现象明显。
2.物质鉴别的方法:应先简后繁,先用物理方法后用化学方法。
(1)物理方法:依据物质特殊的物理性质(如颜色、状态、气味、溶解性、溶解时的吸放热现象)进行观察、分析、判断,得出结论。
(2)化学方法:依据物质间反应时所产生的特殊反应现象(如变色、放出气体、生成沉淀、放热等)进行鉴别。
四、物质的鉴别
3.物质鉴别的形式
(1)一种试剂鉴别:选择一种试剂,分别加入待测物质中,观察实验现象。
(2)多种试剂鉴别:选择多种试剂,依次加入待测物质中,会出现明显不同现象。
(3)无试剂鉴别:先利用物质物理性质不同或物质间的相互反应(包括与生成物反应)而产生不同现象把物质鉴别出来。
四、物质的鉴别
例5.(2024秋 西湖区校级月考)下列鉴别物质的方法中,切实可行的是( )
①用酚酞试液鉴别NaCl溶液和盐酸
②用氯化钡溶液鉴别稀盐酸和稀硫酸
③用氯化钙溶液鉴别烧碱溶液和纯碱溶液
④用水鉴别NH4NO3和NaOH固体
A.①②③④ B.②③ C.②③④ D.③④
C
1.以物质特征颜色为突破口
⑴ 固体颜色:Fe、C、CuO、MnO2、Fe3O4(黑色);Cu、Fe2O3(红色);Cu2(OH)2CO3(绿色);CuSO4·5H2O(蓝色)。
⑵ 溶液颜色:CuCl2、CuSO4(蓝色);FeCl2、FeSO4(浅绿色);FeCl3、Fe2(SO4)3(黄色)。
⑶ 火焰颜色:S在O2中燃烧(蓝紫色);S、H2在空气中燃烧(淡蓝色);CO、CH4在空气中燃烧(蓝色)。
⑷ 沉淀颜色:BaSO4、AgCl、CaCO3、BaCO3(白色);Cu(OH)2(蓝色);Fe(OH)3(红褐色)。
五、物质的推断
2.以物质特征状态为突破口
常见固体单质有Fe、Cu、C、S;
气体单质有H2、N2、O2;
无色气体有H2、N2、O2、CO、CO2、CH4、SO2;
常温下呈液态的物质有H2O。
五、物质的推断
3.以物质特征反应条件为突破口
点燃(有O2参加的反应); 通电(电解H2O); 催化剂(KClO3分解制O2);
高温(CaCO3分解,C、CO还原CuO、Fe2O3);
加热(KCIO3、KMnO4、Cu2(OH)2CO3等的分解,H2还原CuO、Fe2O3)。
五、物质的推断
4.以物质特征现象为突破口
⑴ 能使澄清石灰水变浑浊的无色无味气体是CO2。
⑵ 能使黑色CuO变红(或红色Fe2O3变黑)的气体是H2或CO,固体是C。
⑶ 能使燃烧着的木条正常燃烧的气体是空气,燃烧得更旺的气体是O2,熄灭的气体是CO2或N2;能使带火星的木条复燃的气体O2。
⑷ 能使白色无水CuSO4粉末变蓝的气体是水蒸气。
五、物质的推断
⑸ 在O2中燃烧火星四射的物质是Fe。
⑹ 在空气中燃烧生成CO2和H2O的物质是有机物,如CH4、C2H5OH等。
⑺ 能溶于盐酸或稀HNO3的白色沉淀有CaCO3、BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4。
五、物质的推断
5.以元素或物质之最为突破口
⑴ 地壳中含量最多的元素是O,含量最多的金属元素是AI。
⑵ 人体中含量最多的元素是O。 ⑶ 空气中含量最多的元素是N。
⑷ 形成化合物最多的元素是C。 ⑸ 质子数最少的元素是H。
⑹ 相对分子质量最小、密度也最小的气体是H2。
⑺ 相对分子质量最小的氧化物是H2O。
⑻ 自然界中硬度最大的物质是金刚石。
⑼ 空气中含量最多的气体是N2。 ⑽ 最简单的有机物是CH4。
⑾ 最常用的溶剂是H2O。 ⑿ 人体中含量最多的物质是H2O。
五、物质的推断
化学推断题解题技巧和思路
1.审题:认真审读原理,弄清文意和图意,理出题给条件,深挖细找,反复推敲。
2.分析:抓住关键,找准解题的突破口,突破口也称为“题眼”,指的是关键词、特殊现象、物质都特征等等,然后从突破口出发,探求知识间的内在联系,应用多种思维方式,进行严密的分析和逻辑推理,推出符合题意的结果。
五、物质的推断
化学推断题解题技巧和思路
3.解答:根据题目的要求,按照分析和推理的结果,认真而全面地解答。
4.检验:得出结论后切勿忘记验证。其方法是将所得答案放回原题中检验,若完全符合,则说明答案正确。若出现不符,则说明答案有误,需要另行思考,推出正确答案。
五、物质的推断
例6.(2024秋 萧山区月考)如图所示,奥运五环图形中,已知A、B、C、D、E各为稀硫酸、氢氧化钠溶液、二氧化碳、氧化铁、水中的一种,且相连环内的两种物质能发生化学反应,E是常见的溶剂。下列说法不正确的是( )
A.B的化学式是H2SO4
B.D可以造成“温室效应”加剧
C.A与B的反应可用于除铁锈
D.C的固体溶解在E中,温度会降低
D
六、离子共存
离子检验的常用试剂
H+和OH-:紫色石蕊试液或pH试纸。
OH-:无色酚酞试液(可鉴别碱性溶液)——变红。
Cl-:AgNO3溶液和稀HNO3——有白色沉淀。
SO42-:BaCl2溶液和稀HNO3——有白色沉淀。
CO32-:稀HCl和石灰水——有CO2↑。
PO43-:AgNO3溶液——有黄色沉淀。
NH4+:强碱溶液(NaOH)——有NH3↑。使湿润红色石蕊试纸变蓝。
也就是上述两者离子相遇即会发生复分解反应不能共存。也要注意题目中的隐含条件,如pH<7,表示溶液中存在很多氢离子
例7.(2024秋 上城区期中)甲、乙两化工厂分布如图所示,箭头代表水流方向。如果在a处取得水样,经检测含有的阴离子是OH﹣、SO42-。在c处取得水样,经检测pH=7,且只含有少量NaCl。若已知b处水中含有的物质是BaCl2、HCl,则a处水样含有的阳离子是( )
A.Mg2+ B.Na+ C.H+ D.Ba2+
B
模块三 巩固提升
1.图像是一种表示方法,也是了解化学反应的“窗口”,我们可通过建立图像来表示化学反应过程中物质间量的相互关系。现一烧杯中含有HCl和CaCl2的混合液,将一定质量分数的Na2CO3溶液加入到混合液中直至过量,则在该反程中各个量的关系图正确的是( )
B.
C.
D.
B
A.
2.小科利用如图甲所示的装置对盐酸和氢氧化钠溶液反应进行探究,测量结果如图乙和图丙所示。下列说法正确的是( )
A.图甲中仪器A盛放的是NaOH溶液
B.图乙中a→d所示溶液中NaCl的质量不断增加
C.图丙中V的数值最接近12
D.图丙中从f→g温度变化趋势可说明该反应是吸热反应
C
3.向100g质量分数分别为14.6%HCl和12%MgSO4的混合溶液中,滴加Ba(OH)2溶液至过量.下列图象中,产生的沉淀量与滴入Ba(OH)2相符的是( )
A. B.
C.
D.
B
4.如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A.甲实验试管口向下倾斜可防止氢气逸出
B.乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生
C.甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸
D.甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应
C
5.中国科学家已实现由CO2到淀粉的全人工合成,其中一步重要反应的物质转化如图所示(反应a中,各物质分子个数比为1:1:1:1)。下列说法不正确的是( )
A.O2是反应a、b中可循环利用的物质
B.反应a、b中均有元素化合价的改变
C.由反应a可推测甲醛中含氢量高于甲醇
D.为使甲醇持续转化为甲醛,反应b需补充H2O2
C
6.如图中,甲、乙、丙是初中化学中常见的物质,图中“—”表示相连的物质之闻可以在溶液中发生化学反应,“→”表示由某种物质可转化为另一种物质(部分反应物、生成物及反应条件已略去)。下列说法中不正确的是( )
A.甲、乙、丙可能依次为Fe、NaOH、CO2
B.当甲为一种碱时,它与硫酸铜溶液的反应可能产生两种沉淀
C.当乙为NaOH时,它可由Ca(OH)2与Na2CO3反应生成
D.丙物质只能是氧化物或盐
D
7.(2024 宁波模拟)有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成,为检验其中的成分,按以下流程进行实验:
(1)根据实验现象,白色粉末中一定有 。
(2)加入足量稀HNO3,后沉淀全部溶解的化学方程式为
。
(3)实验中不能用BaCl2溶液代替Ba(NO3)2溶液的理由是
。
氯化钠、碳酸钠
BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑
氯化钡引入氯离子会影响对氯化钠的推断
8.某实验废液中可能含有Cl﹣、CO32﹣、SO42﹣、Na+、Mg2+、Fe3+六种离子中的几种。为确定废液中存在的离子,进行了下面实验:
①取少量废液,向废液中滴加NaOH溶液,有白色沉淀生成;
②另取少量废液,向其中滴加BaCl2溶液,无明显现象;
③再取少量废液,滴加AgNO3溶液,产生白色沉淀,加稀硝酸后沉淀不溶解。
请分析实验后回答:
(1)废液中一定含有的离子是 ,可能含有的离子是 ;
(2)有同学认为实验③可以省略,理由是
。
Mg2+和Cl﹣
Na+
步骤②向废液中加入BaCl2溶液无明显现象,说明溶液中一定没有SO42﹣和CO32﹣,故溶液中一定含有Cl﹣
9.(2023秋 黄岩区期末)酸和碱反应是一类重要的化学反应。某科学兴趣小组利用图1装置研究稀盐酸与氢氧化钠溶液反应过程中溶液的pH,得到溶液pH(如图2)和溶液中Na+、OH﹣数量随加入甲溶液体积的变化图像(如图3),请结合图像回答下列问题:
(1)根据图1和图2可知甲溶液是 。
(2)结合图2、3,该兴趣小组同学推断图3中当所加甲溶液体积为V1时,溶液中OH﹣恰好被反应完,则V1的值为 mL。
12
稀盐酸
同课章节目录
