4.1.4原子结构与元素的性质 课件(共22张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.4原子结构与元素的性质 课件(共22张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-24 21:23:42 | ||
图片预览








文档简介
(共22张PPT)
课 时 4 原子结构与元素的性质
第四章 第一节
原子结构与元素周期表
四、原子结构与元素的性质
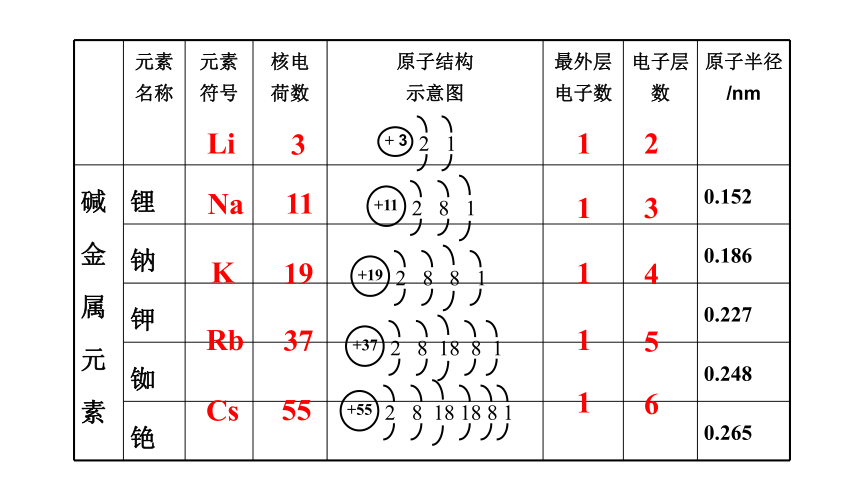
我们把ⅠA 称为碱金属族,为什么要把它们编在一个族呢?请同学们填写下表的信息,并思考和讨论下列问题。
(一)、碱金属元素
元素名称 元素 符号 核电 荷数 原子结构 示意图 最外层电子数 电子层数 原子半径/nm
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
+ 3
2 1
+11
2 8 1
+19
2 8 8 1
+37
2 8 18 8 1
+55
2 8 18 18 8 1
原子半径变化有什么特点?
从Li到Cs,碱金属元素的原子核电荷数依次增大,
原子结构中电子层数依次增多,原子半径依次增大。
碱金属元素原子结构的最外层电子数相同,都为1个。
最外层上都只有1个电子,化学反应中易失去1个电子,形成+1价的阳离子,单质体现还原性。
电子排布有什么特点?
2Na + 2H2O = 2NaOH + H2 ↑
2Na+O2 = Na2O2
钠 钾
与氧气反应 剧烈燃烧,火焰呈 色,生成 色的固体 燃烧更剧烈,火焰呈 色
钠、钾化学性质比较
黄
淡黄
2Na+O2 = Na2O2
紫
2K + O2 = K2O2
(过氧化钾)
K + O2 = KO2
(超氧化钾)
与水反应 在水面上、 成银白色小球、在水面上四处 、滴入酚酞溶液呈 色 在水面上、 成银白色、在水面上四处 、滴入酚酞溶液呈 色,有微弱爆炸
钠 钾
浮
熔
游动
红
钠、钾与水的反应
浮
熔
游动
红
Na与K 比较
理论分析:
相同点:
递变性:
实验证明:
相同点:
递变性:
都容易被氧化(燃烧),可以和水剧烈反应。
和氧气反应K比Na剧烈,产物更复杂。
和水反应K更加剧烈,甚至发生爆炸。
都易失去电子,表现强还原性。
钾比钠更易于失去电子,更活泼。
锂与水会反应,但比Na与水的反应缓慢
1、碱金属单质化学性质
元素 条件 现象 产物 结论
Li
Na 加热 燃烧,剧烈 Na2O2 K 稍加热 燃烧, 更剧烈 更复杂的氧化物 Rb Cs 与非金属的反应(以O2为例)
从Li—Cs,随电子层数的递增,还原性(金属性)逐渐增强。
加热
燃烧,较不剧烈
Li2O
接触空气不加热
剧烈
更复杂的氧化物
接触空气不加热
剧烈
更复杂的氧化物
元素 现象 产物 结论
Li
Na K Rb Cs 从Li—Cs,随电子层数的递增,还原性(金属性)逐渐增强。
会反应,比Na缓慢
遇水燃烧,甚至爆炸
对应的碱和氢气
剧烈反应,有“浮、熔、游、红、鸣”现象
更剧烈,气体会燃烧,轻微爆炸
与水的反应
产物碱性:
LiOH <NaOH <KOH < RbOH < CsOH
逐渐剧烈
2Li + 2H2O = 2LiOH + H2 ↑(较 慢)
2Na + 2H2O = 2NaOH + H2 ↑(剧烈)
2K + 2H2O = 2KOH + H2 ↑ (很剧烈)
通式: 2M + 2H2O = 2MOH + H2 ↑
碱金属元素从上到下(Li 、Na、K、Rb、Cs),随着核电荷数的增加,碱金属元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对 的引力逐渐减弱,原子失电子的能力逐渐 。
增多
最外层电子
增强
元素的金属性逐渐 ,金属单质的还原性逐渐 ,与水和氧气的反应越来越 ,生成的氧化物越来越 。最高价氧化物对应水化物的碱性越来越 。
增强
剧烈
复杂
强
增大
增强
结论
小结:碱金属单质化学性质
(学生齐读课本内容)
2.碱金属的物理性质
碱金属的物理性质的比较
相
似
点
递变性
颜色
硬度
密度
熔沸点
导电导热性
密度变化
熔沸点变化
Li Na K Rb Cs
柔软
较小
较低
强
逐渐增大(K特殊)
单质的熔沸点逐渐降低
均为银白色(Cs略带金色)
(1)锂电池是一种高能电池; 锂是优质的高能燃料(已经用于宇宙飞船、人造卫星和超声速飞机);有机化学中重要的催化剂。
(4)铷铯主要用于制备光电管、真空管。铯原子钟是目前最准确的计时仪器。
(3)钾的化合物最大用途是做钾肥。硝酸钾还用于做火药。
3.碱金属元素的用途:
(2)液态钠可作为核反应堆的传热介质。
课堂练习:
1、碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是( )
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成Fr2O
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸.
C
2.下列关于钾、钠、铷、铯的说法中,不正确的是: ( )
A.原子半径随核电荷数的增大而增大
B.单质的密度均小于1
C.其氢氧化物中,碱性最强的CsOH
D.氧化能力最强的是钠离子
B D
单质的还原性:Na < K < Rb < Cs
离子的氧化性:Na+ > K+ > Rb+ > Cs+
课 时 4 原子结构与元素的性质
第四章 第一节
原子结构与元素周期表
四、原子结构与元素的性质
我们把ⅠA 称为碱金属族,为什么要把它们编在一个族呢?请同学们填写下表的信息,并思考和讨论下列问题。
(一)、碱金属元素
元素名称 元素 符号 核电 荷数 原子结构 示意图 最外层电子数 电子层数 原子半径/nm
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
+ 3
2 1
+11
2 8 1
+19
2 8 8 1
+37
2 8 18 8 1
+55
2 8 18 18 8 1
原子半径变化有什么特点?
从Li到Cs,碱金属元素的原子核电荷数依次增大,
原子结构中电子层数依次增多,原子半径依次增大。
碱金属元素原子结构的最外层电子数相同,都为1个。
最外层上都只有1个电子,化学反应中易失去1个电子,形成+1价的阳离子,单质体现还原性。
电子排布有什么特点?
2Na + 2H2O = 2NaOH + H2 ↑
2Na+O2 = Na2O2
钠 钾
与氧气反应 剧烈燃烧,火焰呈 色,生成 色的固体 燃烧更剧烈,火焰呈 色
钠、钾化学性质比较
黄
淡黄
2Na+O2 = Na2O2
紫
2K + O2 = K2O2
(过氧化钾)
K + O2 = KO2
(超氧化钾)
与水反应 在水面上、 成银白色小球、在水面上四处 、滴入酚酞溶液呈 色 在水面上、 成银白色、在水面上四处 、滴入酚酞溶液呈 色,有微弱爆炸
钠 钾
浮
熔
游动
红
钠、钾与水的反应
浮
熔
游动
红
Na与K 比较
理论分析:
相同点:
递变性:
实验证明:
相同点:
递变性:
都容易被氧化(燃烧),可以和水剧烈反应。
和氧气反应K比Na剧烈,产物更复杂。
和水反应K更加剧烈,甚至发生爆炸。
都易失去电子,表现强还原性。
钾比钠更易于失去电子,更活泼。
锂与水会反应,但比Na与水的反应缓慢
1、碱金属单质化学性质
元素 条件 现象 产物 结论
Li
Na 加热 燃烧,剧烈 Na2O2 K 稍加热 燃烧, 更剧烈 更复杂的氧化物 Rb Cs 与非金属的反应(以O2为例)
从Li—Cs,随电子层数的递增,还原性(金属性)逐渐增强。
加热
燃烧,较不剧烈
Li2O
接触空气不加热
剧烈
更复杂的氧化物
接触空气不加热
剧烈
更复杂的氧化物
元素 现象 产物 结论
Li
Na K Rb Cs 从Li—Cs,随电子层数的递增,还原性(金属性)逐渐增强。
会反应,比Na缓慢
遇水燃烧,甚至爆炸
对应的碱和氢气
剧烈反应,有“浮、熔、游、红、鸣”现象
更剧烈,气体会燃烧,轻微爆炸
与水的反应
产物碱性:
LiOH <NaOH <KOH < RbOH < CsOH
逐渐剧烈
2Li + 2H2O = 2LiOH + H2 ↑(较 慢)
2Na + 2H2O = 2NaOH + H2 ↑(剧烈)
2K + 2H2O = 2KOH + H2 ↑ (很剧烈)
通式: 2M + 2H2O = 2MOH + H2 ↑
碱金属元素从上到下(Li 、Na、K、Rb、Cs),随着核电荷数的增加,碱金属元素原子的电子层数逐渐 ,原子半径逐渐 ,原子核对 的引力逐渐减弱,原子失电子的能力逐渐 。
增多
最外层电子
增强
元素的金属性逐渐 ,金属单质的还原性逐渐 ,与水和氧气的反应越来越 ,生成的氧化物越来越 。最高价氧化物对应水化物的碱性越来越 。
增强
剧烈
复杂
强
增大
增强
结论
小结:碱金属单质化学性质
(学生齐读课本内容)
2.碱金属的物理性质
碱金属的物理性质的比较
相
似
点
递变性
颜色
硬度
密度
熔沸点
导电导热性
密度变化
熔沸点变化
Li Na K Rb Cs
柔软
较小
较低
强
逐渐增大(K特殊)
单质的熔沸点逐渐降低
均为银白色(Cs略带金色)
(1)锂电池是一种高能电池; 锂是优质的高能燃料(已经用于宇宙飞船、人造卫星和超声速飞机);有机化学中重要的催化剂。
(4)铷铯主要用于制备光电管、真空管。铯原子钟是目前最准确的计时仪器。
(3)钾的化合物最大用途是做钾肥。硝酸钾还用于做火药。
3.碱金属元素的用途:
(2)液态钠可作为核反应堆的传热介质。
课堂练习:
1、碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列预言错误的是( )
A.在碱金属中它具有最大的原子半径
B.它的氢氧化物化学式为FrOH,是一种极强的碱
C.钫在空气中燃烧时,只生成Fr2O
D.它能跟水反应生成相应的碱和氢气,由于反应剧烈而发生爆炸.
C
2.下列关于钾、钠、铷、铯的说法中,不正确的是: ( )
A.原子半径随核电荷数的增大而增大
B.单质的密度均小于1
C.其氢氧化物中,碱性最强的CsOH
D.氧化能力最强的是钠离子
B D
单质的还原性:Na < K < Rb < Cs
离子的氧化性:Na+ > K+ > Rb+ > Cs+
