6.1.2化学反应与电能(共21张PPT) 高中化学人教版(2019)必修二
文档属性
| 名称 | 6.1.2化学反应与电能(共21张PPT) 高中化学人教版(2019)必修二 |  | |
| 格式 | pptx | ||
| 文件大小 | 905.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-24 22:44:44 | ||
图片预览





文档简介
(共21张PPT)
化学反应与能量
第六章
第一节 化学反应与能量变化
第2课时 化学反应与电能
第二节 化学反应与电能
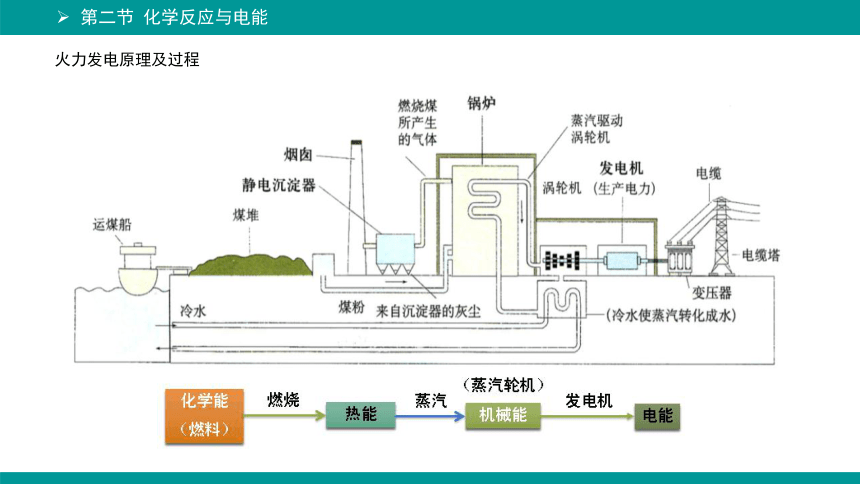
火力发电原理及过程
第二节 化学反应与电能
氧化还原反应
氧化剂:化合价降低,得电子,
被还原,发生还原反应,得到还原产物
还原剂:化合价升高,失电子,
被氧化,发生氧化反应,得到氧化产物
火力发电:燃烧
燃烧的本质是氧化还原反应,而氧化还原反应的本质是电子转移。
化学能 电能
直接
第二节 化学反应与电能
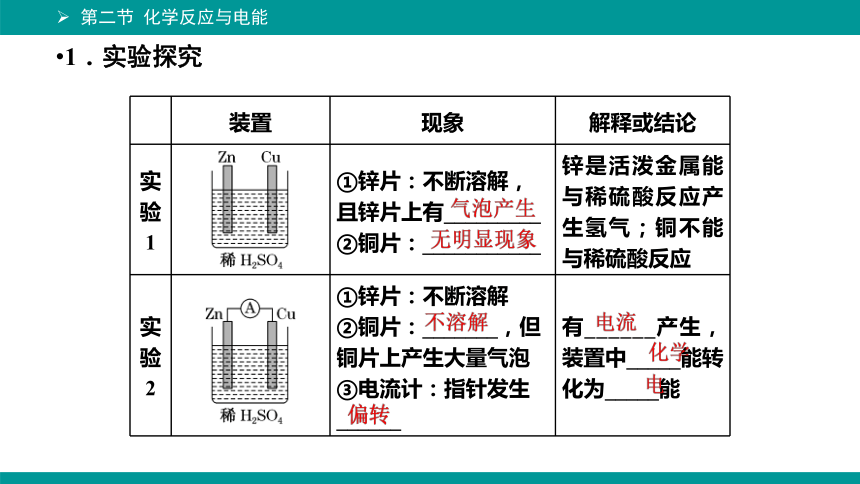
1.实验探究
装置 现象 解释或结论
实验1 ①锌片:不断溶解,且锌片上有_________ ②铜片:___________ 锌是活泼金属能与稀硫酸反应产生氢气;铜不能与稀硫酸反应
实验2 ①锌片:不断溶解 ②铜片:_______,但铜片上产生大量气泡 ③电流计:指针发生______ 有______产生,装置中_____能转化为_____能
第二节 化学反应与电能
1.原电池
(1)定义:将化学能转变成电能的装置叫做原电池。
(2)电极:
正极:
负极:
电子流入的电极
电子流出的电极
通常是不活泼金属或石墨电极
通常是活泼金属
得电子,化合价降低,发生还原反应
失电子,化合价升高,发生氧化反应
第二节 化学反应与电能
铜-锌原电池:
铜片上有气泡产生,锌片不断溶解,电流表的指针发生偏转。
Zn极:
Zn – 2e- = Zn2+ 氧化反应
Cu极:
2H+ +2e- = H2↑ 还原反应
负
正
负极 : Zn – 2e- = Zn2+
正极: 2H+ +2e- = H2↑
总反应式:Zn + 2H+ = Zn2+ + H2↑
原电池反应的本质是:氧化还原反应
第二节 化学反应与电能
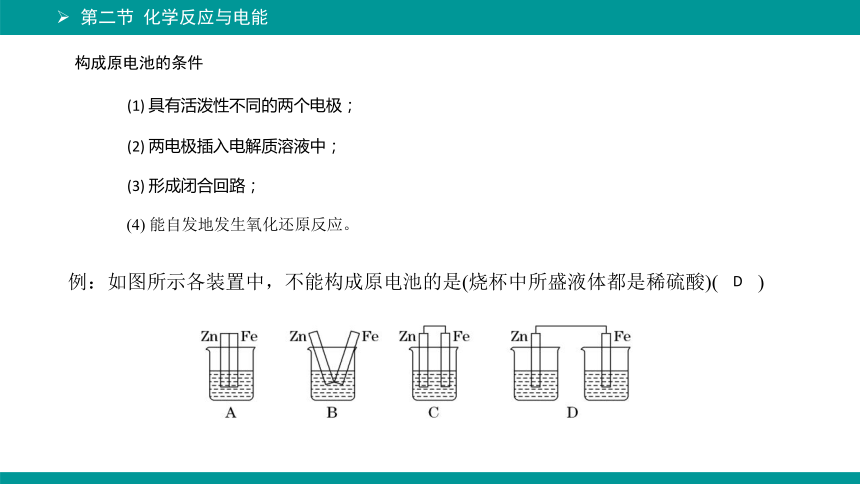
构成原电池的条件
(4) 能自发地发生氧化还原反应。
(1) 具有活泼性不同的两个电极;
(2) 两电极插入电解质溶液中;
(3) 形成闭合回路;
例:如图所示各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)( )
D
第二节 化学反应与电能
第二节 化学反应与电能
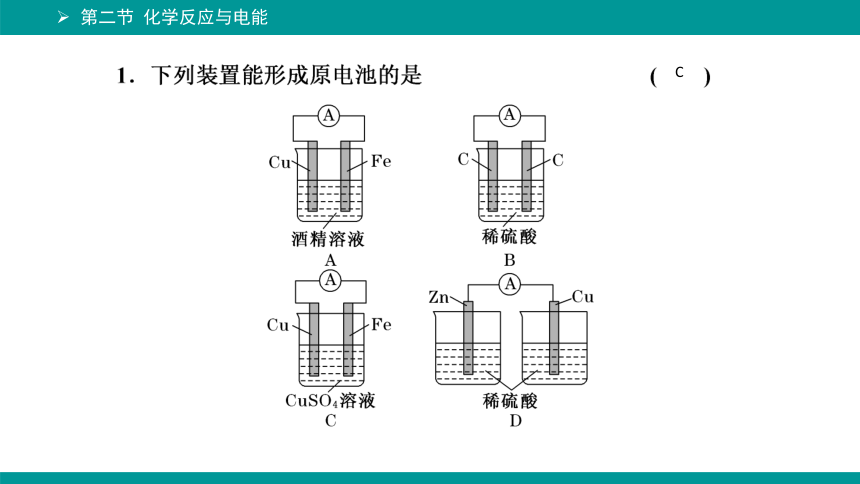
C
第二节 化学反应与电能
C
第二节 化学反应与电能
C
第二节 化学反应与电能
D
第二节 化学反应与电能
2.化学电池
第二节 化学反应与电能
例:铅蓄电池、锂电池、镍氢电池
第二节 化学反应与电能
(1)铅蓄电池
负极材料:Pb
正极材料: PbO2
电解质溶液:H2SO4
总反应:Pb+PbO2+2H2SO4 = 2PbSO4+2H2O
负极:Pb - 2e-+SO42- = PbSO4↓
正极:PbO2+ 2e- + 4H+ + SO42- = PbSO4↓ + 2H2O
第二节 化学反应与电能
第二节 化学反应与电能
B
第二节 化学反应与电能
B
第二节 化学反应与电能
3.已知空气-锌电池的电极反应式为
锌片:Zn + 2OH- - 2e- = ZnO + H2O
碳棒:
据此判断,锌片为( )
A. 正极,被还原 B. 正极,被氧化
C. 负极,被还原 D. 负极,被氧化
D
第二节 化学反应与电能
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作时,电能转化成化学能
D.氢氧燃料电池是一种具有应用前景的绿色电源
C
4. 下面是几种常见的化学电源示意图,有关说法不正确的是( )
第二节 化学反应与电能
5. 有一种新型的碱性锌锰电池,它是在酸性锌锰电池的基础上改进的。
下列对于碱性锌锰电池的叙述中不正确的是( )
A.碱性锌锰电池工作时,电子由Zn极经外电路流向碳极
B.这种电池较酸性锌锰电池使用寿命长
C.碱性锌锰电池可以实现化学能向电能的转化和电能向化学能的转化
D.这种电池的电解质由传统的NH4Cl换成湿的KOH
C
化学反应与能量
第六章
第一节 化学反应与能量变化
第2课时 化学反应与电能
第二节 化学反应与电能
火力发电原理及过程
第二节 化学反应与电能
氧化还原反应
氧化剂:化合价降低,得电子,
被还原,发生还原反应,得到还原产物
还原剂:化合价升高,失电子,
被氧化,发生氧化反应,得到氧化产物
火力发电:燃烧
燃烧的本质是氧化还原反应,而氧化还原反应的本质是电子转移。
化学能 电能
直接
第二节 化学反应与电能
1.实验探究
装置 现象 解释或结论
实验1 ①锌片:不断溶解,且锌片上有_________ ②铜片:___________ 锌是活泼金属能与稀硫酸反应产生氢气;铜不能与稀硫酸反应
实验2 ①锌片:不断溶解 ②铜片:_______,但铜片上产生大量气泡 ③电流计:指针发生______ 有______产生,装置中_____能转化为_____能
第二节 化学反应与电能
1.原电池
(1)定义:将化学能转变成电能的装置叫做原电池。
(2)电极:
正极:
负极:
电子流入的电极
电子流出的电极
通常是不活泼金属或石墨电极
通常是活泼金属
得电子,化合价降低,发生还原反应
失电子,化合价升高,发生氧化反应
第二节 化学反应与电能
铜-锌原电池:
铜片上有气泡产生,锌片不断溶解,电流表的指针发生偏转。
Zn极:
Zn – 2e- = Zn2+ 氧化反应
Cu极:
2H+ +2e- = H2↑ 还原反应
负
正
负极 : Zn – 2e- = Zn2+
正极: 2H+ +2e- = H2↑
总反应式:Zn + 2H+ = Zn2+ + H2↑
原电池反应的本质是:氧化还原反应
第二节 化学反应与电能
构成原电池的条件
(4) 能自发地发生氧化还原反应。
(1) 具有活泼性不同的两个电极;
(2) 两电极插入电解质溶液中;
(3) 形成闭合回路;
例:如图所示各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)( )
D
第二节 化学反应与电能
第二节 化学反应与电能
C
第二节 化学反应与电能
C
第二节 化学反应与电能
C
第二节 化学反应与电能
D
第二节 化学反应与电能
2.化学电池
第二节 化学反应与电能
例:铅蓄电池、锂电池、镍氢电池
第二节 化学反应与电能
(1)铅蓄电池
负极材料:Pb
正极材料: PbO2
电解质溶液:H2SO4
总反应:Pb+PbO2+2H2SO4 = 2PbSO4+2H2O
负极:Pb - 2e-+SO42- = PbSO4↓
正极:PbO2+ 2e- + 4H+ + SO42- = PbSO4↓ + 2H2O
第二节 化学反应与电能
第二节 化学反应与电能
B
第二节 化学反应与电能
B
第二节 化学反应与电能
3.已知空气-锌电池的电极反应式为
锌片:Zn + 2OH- - 2e- = ZnO + H2O
碳棒:
据此判断,锌片为( )
A. 正极,被还原 B. 正极,被氧化
C. 负极,被还原 D. 负极,被氧化
D
第二节 化学反应与电能
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作时,电能转化成化学能
D.氢氧燃料电池是一种具有应用前景的绿色电源
C
4. 下面是几种常见的化学电源示意图,有关说法不正确的是( )
第二节 化学反应与电能
5. 有一种新型的碱性锌锰电池,它是在酸性锌锰电池的基础上改进的。
下列对于碱性锌锰电池的叙述中不正确的是( )
A.碱性锌锰电池工作时,电子由Zn极经外电路流向碳极
B.这种电池较酸性锌锰电池使用寿命长
C.碱性锌锰电池可以实现化学能向电能的转化和电能向化学能的转化
D.这种电池的电解质由传统的NH4Cl换成湿的KOH
C
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
