化学人教版(2019)选择性必修2 第二章第二节分子的空间结构第一课时(26张)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 第二章第二节分子的空间结构第一课时(26张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 09:09:35 | ||
图片预览







文档简介
(共26张PPT)
第二节 分子的空间结构
第二章 分子结构与性质
第1课时 多样分子的空间结构及测定
学习目标
1、知道分子的结构是可以测定的,红外光谱技术是测定物质结构的基本方法;能说明红外光谱等实验手段在物质结构研究中的应用。
2、结合实例了解共价分子具有特定的空间结构,体会共价分子的多样性和复杂性。能借助实物模型等建立对分子的空间结构的直观认识。
美丽的化学结构
——换一种方式打开化学世界
腺嘌呤晶体
五叶结分子
绿宝石晶体
准晶
DNA
病毒
DNA宇宙飞船
左翼尾翼右翼
分子的世界形形色色,异彩纷呈,美不胜收,常使人流连忘返。肉眼不能看到分子,那么,科学家是怎样知道分子的结构的呢?
1.分子结构的现代测定方法
化学方法:
物理方法:
依据官能团特征反应
红外光谱、质谱、晶体X射线衍射、紫外光谱、核磁共振氢谱等
困难:化合物结构复杂的,耗时
优势:微量、快速、准确、信息量大
一、分子结构的测定
测定化学键或官能团
测定相对分子质量
红外光谱仪
质谱仪
X射线衍射仪
测定键长、键角等
2.红外光谱
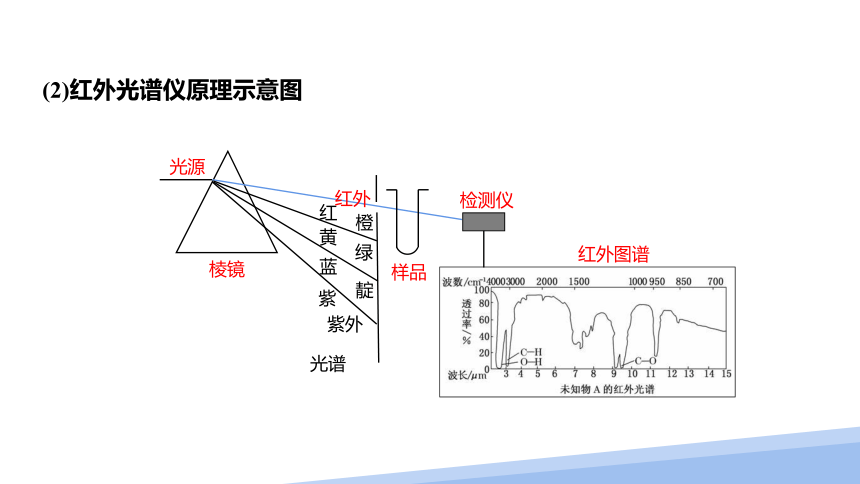
(1)原理
当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,记录到图谱上呈现吸收峰。
红外光谱仪
红外光谱图
(2)红外光谱仪原理示意图
光源
棱镜
红
黄
蓝
紫
光谱
橙
绿
靛
样品
检测仪
红外图谱
紫外
红外
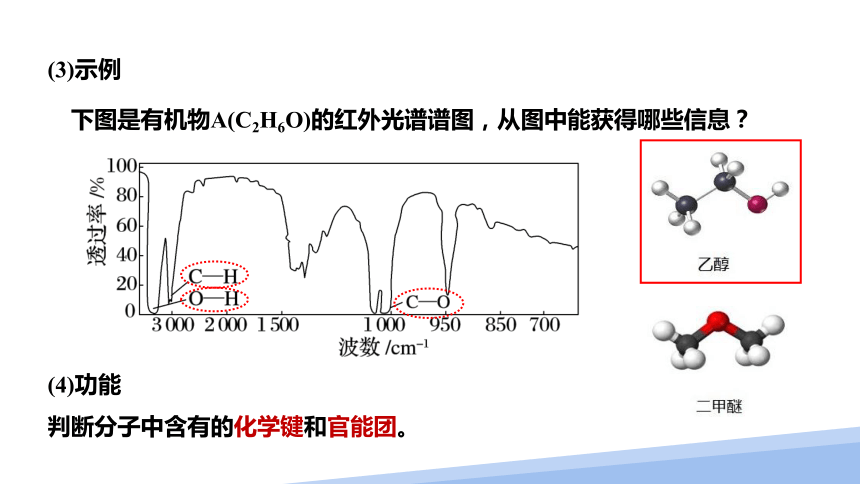
(3)示例
下图是有机物A(C2H6O)的红外光谱谱图,从图中能获得哪些信息?
(4)功能
判断分子中含有的化学键和官能团。
3.质谱法
(1)原理
待测物
分子离子碎片离子
电场加速
磁场偏转
质谱图
高能电子流轰击
质谱仪
(2)质谱仪原理示意图
(3)示例
甲苯分子的质谱图
确定相对分子质量
最大
质荷比
质谱图
质荷比:分子离子与碎片离子的相对质量与其电荷的比值
谱图中质荷比最大的就是该分子的相对分子质量。
分子离子
碎片离子
(4)功能
测定样品分子的相对分子质量。
课堂练习1:某有机物A的分子式为C4H10O,红外光谱图如图所示,则A的结构简式为( )
A.CH3CH2OCH2CH3
B.CH3OCH2CH2CH3
C.CH3CH2CH2CH2OH
D.(CH3)2CHOCH3
A
课堂练习2:如图是有机物A的质谱图,则A的相对分子质量是( )
A.29 B.43
C.57 D.72
D
最大质荷比
分子空间结构:在多原子分子中,原子的几何学关系和形状。
(1)双原子分子
O2
HCl
——直线形
1. 观察下列几种简单分子的空间结构模型。
二、多样的分子空间结构
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间充填模型 球棍模型 CO2
H2O
180°
直线形
V形(角形)
105°
(2)三原子分子的空间结构
——直线形和V形
O==C==O
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间充填模型 球棍模型 CH2O
NH3
120°
107°
平面三角形
三角锥形
(3)四原子分子的空间结构
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间充填模型 球棍模型 CH4
CCl4
(4)五原子分子的空间结构
最常见的是四面体形
109°28′
109°28′
正四面体形
正四面体形
【小结】
分子类型 键角 空间结构 实例
AB2 180 直线形 CO2、BeCl2、CS2
<180 V形 H2O、H2S
AB3 120 平面形 BF3、CH2O
<120 三角锥形 NH3、PH3
AB4 109 28′ 正四面体形 CH4、CCl4
2.多样的分子空间结构
P4O6
SF6
P4
P4O10
C60
S8
椅式C6H12
船式C6H12
分子空间结构与其稳定性
S8像顶皇冠,如果把其中一个向上的硫原子倒转向下,尽管也可以存在,却不如皇冠式稳定。
S—S键的键角为108°,8个S原子形成两层,每层4个S原子。
C6H12 椅式比 船式 稳定。
C6H12椅式
C6H12船式
1.H2O2、C2H2、白磷(P4)、BF3分子的空间结构如图所示,四原子分子都是平面三角形或三角锥形吗?
提示 不是。H2O2分子的空间结构类似于一本打开的书,两个氧原子在两页书的交接处,两个氢原子分别在翻开的书的两页上,称为二面角结构;而白磷(P4)分子是正四面体形;BF3分子是平面三角形;C2H2分子是直线形。
导思
C2H2
2.分子组成相似,其空间结构就相似吗?空间结构相同的分子,其键角完全相同吗?
提示 分子组成相似,其空间结构不一定相似,如BF3、NH3分子的空间结构不同;空间结构相同的分子,其键角也不一定完全相同,如白磷(P4)和CH4均为正四面体形,但P4的键角是60°,CH4的键角为109°28′。
导思
课堂练习3:正误判断
(1)在①P4、②NH3、③CCl4、④CH4、⑤SO2中,分子空间结构为正四面体形的有①③④( )
(2)正四面体形的键角均为109°28′( )
(3)SiCl4、SiH4、、CH3Cl均为正四面体形结构( )
(4)SF6分子的空间结构为正八面体形( )
√
×
×
√
课堂练习4:下列分子的空间结构模型正确的是( )
A.CO2的空间结构模型: B.H2O的空间结构模型:
C.NH3的空间结构模型: D.CH4的空间结构模型:
D
课堂练习5:(1)硫化氢(H2S)分子中,两个H—S的夹角接近90°,说明H2S分子的空间结构为______。
(2)二硫化碳(CS2)分子中,两个C==S的夹角是180°,说明CS2分子的空间结构为_______。
V形
直线形
(3)能说明CH4分子不是平面四边形,而是正四面体结构的是____(填字母)。
a.两个键之间的夹角为109°28′ b.C—H为极性共价键
c.4个C—H的键能、键长都相等
d.二氯甲烷(CH2Cl2)只有一种(不存在同分异构体)
ad
知 识 小 结
分子的空间结构
分子结构的测定
多样的分子空间结构
红外光谱:测定化学键或官能团
质谱:测定相对分子质量
两原子:直线形
三原子:直线形或V形
四原子:常见平面三角形、三角锥形等
五原子:常见四面体形
多原子:结构复杂
第二节 分子的空间结构
第二章 分子结构与性质
第1课时 多样分子的空间结构及测定
学习目标
1、知道分子的结构是可以测定的,红外光谱技术是测定物质结构的基本方法;能说明红外光谱等实验手段在物质结构研究中的应用。
2、结合实例了解共价分子具有特定的空间结构,体会共价分子的多样性和复杂性。能借助实物模型等建立对分子的空间结构的直观认识。
美丽的化学结构
——换一种方式打开化学世界
腺嘌呤晶体
五叶结分子
绿宝石晶体
准晶
DNA
病毒
DNA宇宙飞船
左翼尾翼右翼
分子的世界形形色色,异彩纷呈,美不胜收,常使人流连忘返。肉眼不能看到分子,那么,科学家是怎样知道分子的结构的呢?
1.分子结构的现代测定方法
化学方法:
物理方法:
依据官能团特征反应
红外光谱、质谱、晶体X射线衍射、紫外光谱、核磁共振氢谱等
困难:化合物结构复杂的,耗时
优势:微量、快速、准确、信息量大
一、分子结构的测定
测定化学键或官能团
测定相对分子质量
红外光谱仪
质谱仪
X射线衍射仪
测定键长、键角等
2.红外光谱
(1)原理
当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,记录到图谱上呈现吸收峰。
红外光谱仪
红外光谱图
(2)红外光谱仪原理示意图
光源
棱镜
红
黄
蓝
紫
光谱
橙
绿
靛
样品
检测仪
红外图谱
紫外
红外
(3)示例
下图是有机物A(C2H6O)的红外光谱谱图,从图中能获得哪些信息?
(4)功能
判断分子中含有的化学键和官能团。
3.质谱法
(1)原理
待测物
分子离子碎片离子
电场加速
磁场偏转
质谱图
高能电子流轰击
质谱仪
(2)质谱仪原理示意图
(3)示例
甲苯分子的质谱图
确定相对分子质量
最大
质荷比
质谱图
质荷比:分子离子与碎片离子的相对质量与其电荷的比值
谱图中质荷比最大的就是该分子的相对分子质量。
分子离子
碎片离子
(4)功能
测定样品分子的相对分子质量。
课堂练习1:某有机物A的分子式为C4H10O,红外光谱图如图所示,则A的结构简式为( )
A.CH3CH2OCH2CH3
B.CH3OCH2CH2CH3
C.CH3CH2CH2CH2OH
D.(CH3)2CHOCH3
A
课堂练习2:如图是有机物A的质谱图,则A的相对分子质量是( )
A.29 B.43
C.57 D.72
D
最大质荷比
分子空间结构:在多原子分子中,原子的几何学关系和形状。
(1)双原子分子
O2
HCl
——直线形
1. 观察下列几种简单分子的空间结构模型。
二、多样的分子空间结构
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间充填模型 球棍模型 CO2
H2O
180°
直线形
V形(角形)
105°
(2)三原子分子的空间结构
——直线形和V形
O==C==O
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间充填模型 球棍模型 CH2O
NH3
120°
107°
平面三角形
三角锥形
(3)四原子分子的空间结构
化学式 电子式 结构式 键角 分子的空间结构模型 空间结构
空间充填模型 球棍模型 CH4
CCl4
(4)五原子分子的空间结构
最常见的是四面体形
109°28′
109°28′
正四面体形
正四面体形
【小结】
分子类型 键角 空间结构 实例
AB2 180 直线形 CO2、BeCl2、CS2
<180 V形 H2O、H2S
AB3 120 平面形 BF3、CH2O
<120 三角锥形 NH3、PH3
AB4 109 28′ 正四面体形 CH4、CCl4
2.多样的分子空间结构
P4O6
SF6
P4
P4O10
C60
S8
椅式C6H12
船式C6H12
分子空间结构与其稳定性
S8像顶皇冠,如果把其中一个向上的硫原子倒转向下,尽管也可以存在,却不如皇冠式稳定。
S—S键的键角为108°,8个S原子形成两层,每层4个S原子。
C6H12 椅式比 船式 稳定。
C6H12椅式
C6H12船式
1.H2O2、C2H2、白磷(P4)、BF3分子的空间结构如图所示,四原子分子都是平面三角形或三角锥形吗?
提示 不是。H2O2分子的空间结构类似于一本打开的书,两个氧原子在两页书的交接处,两个氢原子分别在翻开的书的两页上,称为二面角结构;而白磷(P4)分子是正四面体形;BF3分子是平面三角形;C2H2分子是直线形。
导思
C2H2
2.分子组成相似,其空间结构就相似吗?空间结构相同的分子,其键角完全相同吗?
提示 分子组成相似,其空间结构不一定相似,如BF3、NH3分子的空间结构不同;空间结构相同的分子,其键角也不一定完全相同,如白磷(P4)和CH4均为正四面体形,但P4的键角是60°,CH4的键角为109°28′。
导思
课堂练习3:正误判断
(1)在①P4、②NH3、③CCl4、④CH4、⑤SO2中,分子空间结构为正四面体形的有①③④( )
(2)正四面体形的键角均为109°28′( )
(3)SiCl4、SiH4、、CH3Cl均为正四面体形结构( )
(4)SF6分子的空间结构为正八面体形( )
√
×
×
√
课堂练习4:下列分子的空间结构模型正确的是( )
A.CO2的空间结构模型: B.H2O的空间结构模型:
C.NH3的空间结构模型: D.CH4的空间结构模型:
D
课堂练习5:(1)硫化氢(H2S)分子中,两个H—S的夹角接近90°,说明H2S分子的空间结构为______。
(2)二硫化碳(CS2)分子中,两个C==S的夹角是180°,说明CS2分子的空间结构为_______。
V形
直线形
(3)能说明CH4分子不是平面四边形,而是正四面体结构的是____(填字母)。
a.两个键之间的夹角为109°28′ b.C—H为极性共价键
c.4个C—H的键能、键长都相等
d.二氯甲烷(CH2Cl2)只有一种(不存在同分异构体)
ad
知 识 小 结
分子的空间结构
分子结构的测定
多样的分子空间结构
红外光谱:测定化学键或官能团
质谱:测定相对分子质量
两原子:直线形
三原子:直线形或V形
四原子:常见平面三角形、三角锥形等
五原子:常见四面体形
多原子:结构复杂
