化学人教版(2019)选择性必修2 第二章第一节第1课时共价键(39张)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 第二章第一节第1课时共价键(39张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 88.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 09:13:46 | ||
图片预览






文档简介
(共39张PPT)
第二章 第一节 第1课时 《共价键》
人教版 选择性必修2
假如发生了大灾难,人类全部的科学知识只能概括为一句话传诸后世,那么这句话应该是“万物皆原子构成”。
——1965年诺贝尔奖得主,理查德·费曼
理查德·费曼
2
3
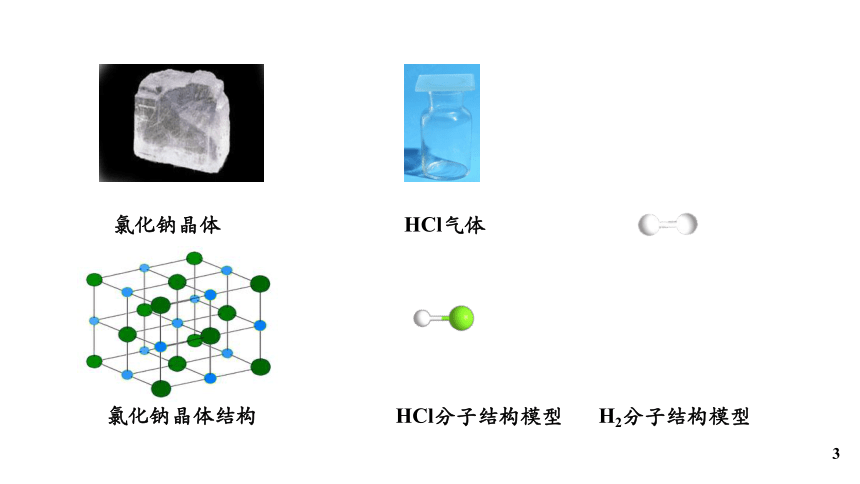
氯化钠晶体结构
氯化钠晶体
HCl气体
HCl分子结构模型
H2分子结构模型
思考讨论
NaCl和HCl的性质差异大,请用电子式描述NaCl和HCl的形成过程,从微粒间相互作用的角度解释NaCl和HCl性质差异大的原因。
NaCl晶体
HCl气体
4
分享交流
H
H
·
·
:
:
:
Cl
·
:
:
:
Cl
·
+
Na
Na+
·
·
:
:
:
Cl
·
:
:
:
Cl
·
+
[ ]-
NaCl和HCl的形成过程
微粒间的相互作用
共价键
离子键
5
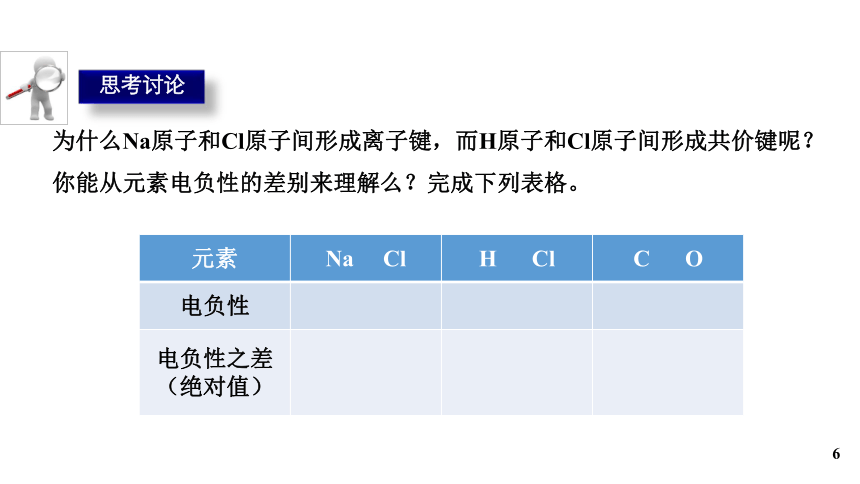
思考讨论
为什么Na原子和Cl原子间形成离子键,而H原子和Cl原子间形成共价键呢?你能从元素电负性的差别来理解么?完成下列表格。
元素 Na Cl H Cl C O
电负性
电负性之差(绝对值)
6
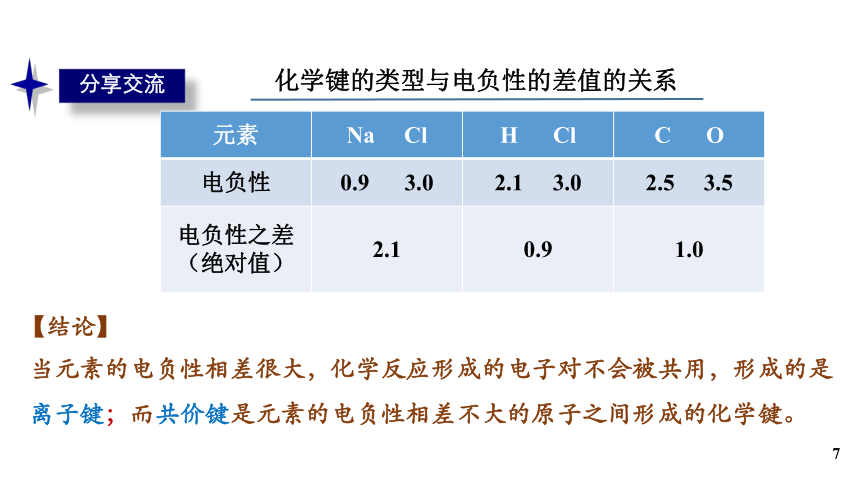
分享交流
【结论】
元素 Na Cl H Cl C O
电负性 0.9 3.0 2.1 3.0 2.5 3.5
电负性之差(绝对值) 2.1 0.9 1.0
当元素的电负性相差很大,化学反应形成的电子对不会被共用,形成的是离子键;而共价键是元素的电负性相差不大的原子之间形成的化学键。
化学键的类型与电负性的差值的关系
7
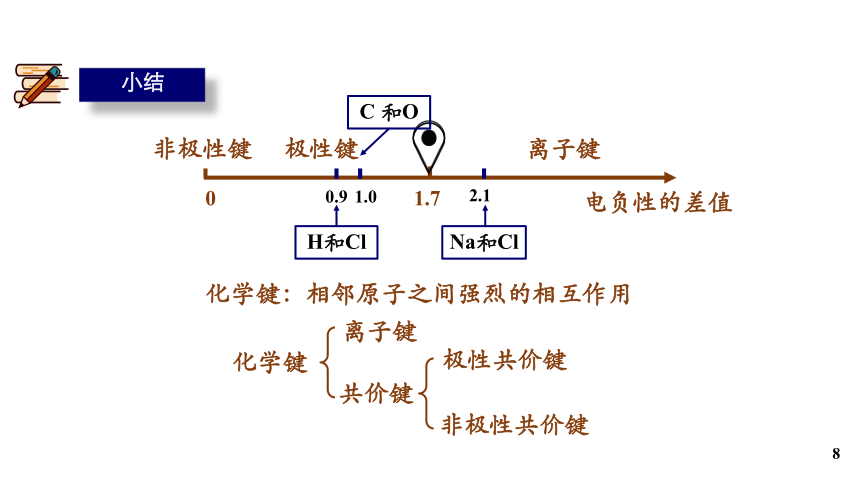
小结
化学键:相邻原子之间强烈的相互作用
化学键
共价键
离子键
极性共价键
非极性共价键
电负性的差值
0
非极性键
极性键
离子键
Na和Cl
H和Cl
0.9
2.1
1.7
C 和O
8
1.0
思考讨论
如何通过原子轨道进一步理解共价键的形成?
9
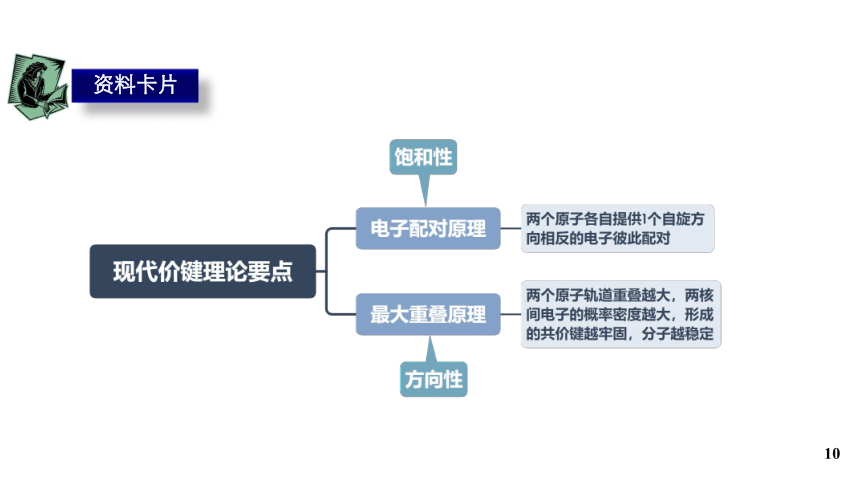
资料卡片
10
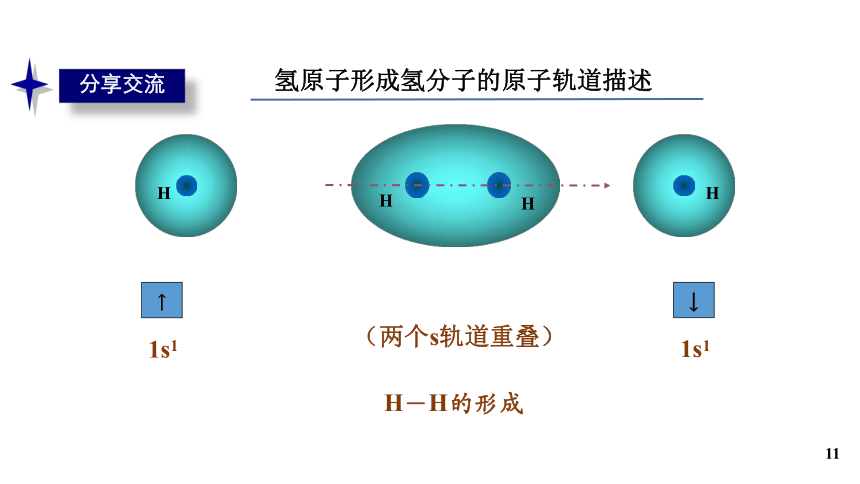
分享交流
共价键
离子键
氢原子形成氢分子的原子轨道描述
H
H
H
H
(两个s轨道重叠)
H-H的形成
↑
1s1
↓
1s1
11
视频资料
12
氢原子形成氢分子的过程
思考讨论
13
请同学们画出氢原子形成氢分子的过程示意图
分享交流
氢原子形成氢分子的过程示意
H
↑
1s1
H
↓
1s1
思考讨论
14
s轨道和p轨道,p轨道和p轨道重叠是否也能形成共价键呢?我们看一看HCl和Cl2中的共价键。
分享交流
H
Cl
H-Cl
↑
1s1
(s轨道和p轨道重叠)
H-Cl 的形成
氢原子和氯原子形成氯化氢分子的原子轨道描述
15
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s2
2s2
2p6
3s2
3p5
“头碰头”
视频资料
16
H-Cl的形成
视频资料
思考讨论
17
(1)请同学们画出氢原子和氯原子形成氯化氢分子的过程示意图。
(2)通过研究共价键的形成过程,你发现该共价键有什么特征?
H-Cl 的形成
H
↑
1s1
Cl
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成共价单键
共价键的饱和性
共价键的方向性
↑↓
↑↓
↑
↑↓
3s2
3p5
分享交流
Cl
Cl
Cl
Cl
氯原子形成氯气分子的原子轨道描述
18
(两个p轨道重叠)
Cl-Cl 的形成
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s2
2s2
2p6
3s2
3p5
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s2
2s2
2p6
3s2
3p5
视频资料
19
Cl-Cl 的形成
资料
思考讨论
20
请同学们画出氯原子形成氯气分子的过程示意图。
Cl-Cl 键的形成
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成共价单键
Cl
↑↓
↑↓
↑
↑↓
3s2
3p5
Cl
↑↓
↑↓
↑
↑↓
3s2
3p5
思考讨论
21
H-Cl
H-H
Cl-Cl
请归纳H-H、H-Cl和Cl-Cl的特点。
σ键
“头碰头”
原子轨道的重叠方式:
分享交流
22
轴对称
电子云的对称方式:
如果将σ键沿着键轴旋转,会发生什么情况呢?
思考讨论
23
p轨道和p轨道除了以“头碰头”的方式重叠以外,还有没有可能以其他的方式重叠成键?
24
“肩并肩”
p-p π键的形成
分享交流
思考讨论
25
请同学们画出p-p π键的形成的过程示意图。
p-p π键的形成
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的π键
(1)π键的电子云形状有何特征?
(2)如果将π键沿着键轴旋转,会发生什么情况呢?
观察思考
形成的π键
π键的特征
电子云为镜面对称:每个π键的电子云由两块组成,互为镜像
26
用电子式表示N2的形成过程,并用原子轨道重叠来解释其共价键的形成过程。
↑
↑
↑
↑↓
2s2
2p3
N
:
N
N
+
N
·
·
·
:
思考讨论
:
·
·
·
N
:
:
:
:
27
28
p-p σ键
p-p π键
p-p π键
N的2p轨道示意图
N2中共价三键的形成过程
分享交流
N2中共价三键的形成过程
资料
视频资料
29
通过氮气中氮氮三键形成过程的分析,如何判断共价键是σ键或是π键?
思考讨论
30
小结
单键 双键 三键
σ键 1个σ键、1个π键 1个σ键、2个π键
成键规律判断
31
1. 观察乙烷、乙烯和乙炔的分子结构,它们的分子中的共价键分别由几个σ键和几个π键构成?
乙烷
乙烯
乙炔
课堂练习
32
分享交流
物质 分子结构 共价键的类型和数量
乙烷
乙烯
乙炔
7个σ键
5个σ键+1个π键
3个σ键+2个π键
33
乙烯分子中σ键和π键的形成过程
资料
视频资料
34
乙炔分子中σ键和π键的形成过程
资料
视频资料
35
2. 为什么不可能有H3、H2Cl和Cl3?
原子形成的共价键数=未成对电子数
课堂练习
答: H
↑
1s1
Cl
↑↓
↑↓
↑
↑↓
3s2
3p5
36
答:并不是所有的共价键都有方向性,如s-s σ键就没有方向性。
3. 所有的共价键都有方向性吗?
课堂练习
37
38
课堂练习
4. 你能从分子结构的角度谈一谈为何N2非常稳定么?人工固氮是将氮气转化为含氮化合物的过程。从分子结构的角度谈一谈,在这一过程中,为什么往往需要用高温、高压、催化剂这样剧烈的条件?
答:N2分子中是共价三键,两氮原子相互作用非常强烈,故N2非常稳定。
人工固氮的主要途径之一让N2与H2反应生成NH3,在这一反应过程中,N2分子中的共价三键需要全部断开,故需要很强烈的条件。
小结
39
键类型 σ键 π键
常见类型 s-s 、s-p、p-p p-p
原子轨道重叠方式 “头碰头”重叠 “肩并肩”重叠
键的特征 轴对称,可旋转 镜面对称,不可旋转
原子轨道重叠程度 大 小
成键规律判断 单键:σ键; 双键:1个σ键、1个π键; 三键:1个σ键、2个π键
σ键与π键的比较
第二章 第一节 第1课时 《共价键》
人教版 选择性必修2
假如发生了大灾难,人类全部的科学知识只能概括为一句话传诸后世,那么这句话应该是“万物皆原子构成”。
——1965年诺贝尔奖得主,理查德·费曼
理查德·费曼
2
3
氯化钠晶体结构
氯化钠晶体
HCl气体
HCl分子结构模型
H2分子结构模型
思考讨论
NaCl和HCl的性质差异大,请用电子式描述NaCl和HCl的形成过程,从微粒间相互作用的角度解释NaCl和HCl性质差异大的原因。
NaCl晶体
HCl气体
4
分享交流
H
H
·
·
:
:
:
Cl
·
:
:
:
Cl
·
+
Na
Na+
·
·
:
:
:
Cl
·
:
:
:
Cl
·
+
[ ]-
NaCl和HCl的形成过程
微粒间的相互作用
共价键
离子键
5
思考讨论
为什么Na原子和Cl原子间形成离子键,而H原子和Cl原子间形成共价键呢?你能从元素电负性的差别来理解么?完成下列表格。
元素 Na Cl H Cl C O
电负性
电负性之差(绝对值)
6
分享交流
【结论】
元素 Na Cl H Cl C O
电负性 0.9 3.0 2.1 3.0 2.5 3.5
电负性之差(绝对值) 2.1 0.9 1.0
当元素的电负性相差很大,化学反应形成的电子对不会被共用,形成的是离子键;而共价键是元素的电负性相差不大的原子之间形成的化学键。
化学键的类型与电负性的差值的关系
7
小结
化学键:相邻原子之间强烈的相互作用
化学键
共价键
离子键
极性共价键
非极性共价键
电负性的差值
0
非极性键
极性键
离子键
Na和Cl
H和Cl
0.9
2.1
1.7
C 和O
8
1.0
思考讨论
如何通过原子轨道进一步理解共价键的形成?
9
资料卡片
10
分享交流
共价键
离子键
氢原子形成氢分子的原子轨道描述
H
H
H
H
(两个s轨道重叠)
H-H的形成
↑
1s1
↓
1s1
11
视频资料
12
氢原子形成氢分子的过程
思考讨论
13
请同学们画出氢原子形成氢分子的过程示意图
分享交流
氢原子形成氢分子的过程示意
H
↑
1s1
H
↓
1s1
思考讨论
14
s轨道和p轨道,p轨道和p轨道重叠是否也能形成共价键呢?我们看一看HCl和Cl2中的共价键。
分享交流
H
Cl
H-Cl
↑
1s1
(s轨道和p轨道重叠)
H-Cl 的形成
氢原子和氯原子形成氯化氢分子的原子轨道描述
15
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s2
2s2
2p6
3s2
3p5
“头碰头”
视频资料
16
H-Cl的形成
视频资料
思考讨论
17
(1)请同学们画出氢原子和氯原子形成氯化氢分子的过程示意图。
(2)通过研究共价键的形成过程,你发现该共价键有什么特征?
H-Cl 的形成
H
↑
1s1
Cl
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成共价单键
共价键的饱和性
共价键的方向性
↑↓
↑↓
↑
↑↓
3s2
3p5
分享交流
Cl
Cl
Cl
Cl
氯原子形成氯气分子的原子轨道描述
18
(两个p轨道重叠)
Cl-Cl 的形成
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s2
2s2
2p6
3s2
3p5
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s2
2s2
2p6
3s2
3p5
视频资料
19
Cl-Cl 的形成
资料
思考讨论
20
请同学们画出氯原子形成氯气分子的过程示意图。
Cl-Cl 键的形成
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成共价单键
Cl
↑↓
↑↓
↑
↑↓
3s2
3p5
Cl
↑↓
↑↓
↑
↑↓
3s2
3p5
思考讨论
21
H-Cl
H-H
Cl-Cl
请归纳H-H、H-Cl和Cl-Cl的特点。
σ键
“头碰头”
原子轨道的重叠方式:
分享交流
22
轴对称
电子云的对称方式:
如果将σ键沿着键轴旋转,会发生什么情况呢?
思考讨论
23
p轨道和p轨道除了以“头碰头”的方式重叠以外,还有没有可能以其他的方式重叠成键?
24
“肩并肩”
p-p π键的形成
分享交流
思考讨论
25
请同学们画出p-p π键的形成的过程示意图。
p-p π键的形成
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的π键
(1)π键的电子云形状有何特征?
(2)如果将π键沿着键轴旋转,会发生什么情况呢?
观察思考
形成的π键
π键的特征
电子云为镜面对称:每个π键的电子云由两块组成,互为镜像
26
用电子式表示N2的形成过程,并用原子轨道重叠来解释其共价键的形成过程。
↑
↑
↑
↑↓
2s2
2p3
N
:
N
N
+
N
·
·
·
:
思考讨论
:
·
·
·
N
:
:
:
:
27
28
p-p σ键
p-p π键
p-p π键
N的2p轨道示意图
N2中共价三键的形成过程
分享交流
N2中共价三键的形成过程
资料
视频资料
29
通过氮气中氮氮三键形成过程的分析,如何判断共价键是σ键或是π键?
思考讨论
30
小结
单键 双键 三键
σ键 1个σ键、1个π键 1个σ键、2个π键
成键规律判断
31
1. 观察乙烷、乙烯和乙炔的分子结构,它们的分子中的共价键分别由几个σ键和几个π键构成?
乙烷
乙烯
乙炔
课堂练习
32
分享交流
物质 分子结构 共价键的类型和数量
乙烷
乙烯
乙炔
7个σ键
5个σ键+1个π键
3个σ键+2个π键
33
乙烯分子中σ键和π键的形成过程
资料
视频资料
34
乙炔分子中σ键和π键的形成过程
资料
视频资料
35
2. 为什么不可能有H3、H2Cl和Cl3?
原子形成的共价键数=未成对电子数
课堂练习
答: H
↑
1s1
Cl
↑↓
↑↓
↑
↑↓
3s2
3p5
36
答:并不是所有的共价键都有方向性,如s-s σ键就没有方向性。
3. 所有的共价键都有方向性吗?
课堂练习
37
38
课堂练习
4. 你能从分子结构的角度谈一谈为何N2非常稳定么?人工固氮是将氮气转化为含氮化合物的过程。从分子结构的角度谈一谈,在这一过程中,为什么往往需要用高温、高压、催化剂这样剧烈的条件?
答:N2分子中是共价三键,两氮原子相互作用非常强烈,故N2非常稳定。
人工固氮的主要途径之一让N2与H2反应生成NH3,在这一反应过程中,N2分子中的共价三键需要全部断开,故需要很强烈的条件。
小结
39
键类型 σ键 π键
常见类型 s-s 、s-p、p-p p-p
原子轨道重叠方式 “头碰头”重叠 “肩并肩”重叠
键的特征 轴对称,可旋转 镜面对称,不可旋转
原子轨道重叠程度 大 小
成键规律判断 单键:σ键; 双键:1个σ键、1个π键; 三键:1个σ键、2个π键
σ键与π键的比较
