化学人教版(2019)选择性必修2 第二章第三节分子的性质第三课时(26张)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 第二章第三节分子的性质第三课时(26张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 136.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 09:14:11 | ||
图片预览








文档简介
(共26张PPT)
第三节 分子结构与物质性质
第二章 分子结构与性质
第3课时 溶解性 分子的手性
学习目标
1、知道物质的溶解性与分子结构的关系;了解“相似相溶”规律。
2、学会判断“手性分子”。
3、结合实例初步认识分子的手性对其性质的影响。
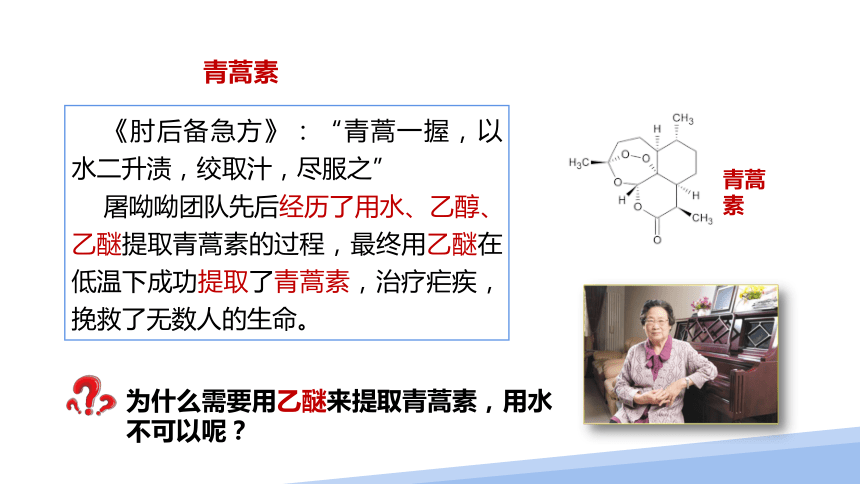
《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”
屠呦呦团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终用乙醚在低温下成功提取了青蒿素,治疗疟疾,挽救了无数人的生命。
青蒿素
为什么需要用乙醚来提取青蒿素,用水不可以呢?
青蒿素
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 二氧化硫 11.28
气体的溶解度(气体的压强为1.01×105 Pa,温度为293 K,在100 g水中的溶解度)
课本P60资料卡片:
分析表格,你能得到哪些影响气体的溶解度的因素?
2、水是极性分子,氢气、甲烷、氮气、氧气都是非极性分子。它们在水中的溶解度不大。
1、外界因素:如温度、压强
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 二氧化硫 11.28
气体的溶解度(气体的压强为1.01×105 Pa,温度为293 K,在100 g水中的溶解度)
课本P60资料卡片:
分析表格,你能得到哪些影响气体的溶解度的因素?
4、氨气、水都是极性分子,且能形成氢键,在水中的溶解度很大。
3、氯气,二氧化碳虽然也是非极性分子,但能与水反应,所以比其他非极性分子在水中的溶解度大一点。
一、溶解性
物质相互溶解的性质十分复杂,受许多因素影响。
(1)影响物质溶解性的外界因素:
①固体:
主要因素为温度,温度升高,大部分固体溶解度增加(氢氧化钙除外)。
②气体:
主要因素为温度和压强,温度升高,溶解度减小;压强增大,溶解度增大。
例:CCl4是非极性分子,是非极性溶剂;而H2O是极性分子,是极性溶剂。
a.萘、Br2、I2等都是非极性分子,所以易溶于CCl4、苯,而难溶于水。
b.蔗糖、氨、HCl、H2SO4是极性分子,易溶于水而难溶于CCl4。
c.盐类(NaCl等)这些离子化合物可看做是极性最强的,它们易溶于
水而不溶于CCl4、苯等非极性溶剂。
(2)影响物质溶解性的结构因素
①“相似相溶”——极性相似相溶
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
注意:有特例,如CO、NO为极性分子,却难溶于水。
乙醇CH3CH2OH分子中的-OH与水分子的-OH相近,因而乙醇与水能互溶;而戊醇CH3CH2CH2CH2CH2OH中的烃基较大,其中的-OH跟水分子的-OH相似因素小得多了,因而它大水中的溶解度明显减小。
②“相似相溶”——结构相似相溶:
溶质和溶剂的分子结构相似程度越大,其溶解性越好,
图2-30 相似相溶—水和甲醇的相互溶解(虚线表示氢键)
极性上:青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,在乙醚中的溶解度大。
结构上:青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
CH3CH2—O—CH2CH3
乙醚
青蒿素
问题1、为什么需要用乙醚来提取青蒿素,用水不可以呢?
碘单质的溶解性
2、碘单质参与发生反应 ,I2 在与I-反应生产I3- ,溶解度增大。
加入 CCl4
加入 KI 溶液
振荡
振荡
已知:I2 + I-I3-
实验现象:
实验结论:
1、I2 (非极性)在 CCl4 (非极性)中溶解性比在水(极性)中好。
I2 溶于水中
溶液呈黄色
溶液分层,
下层溶液呈紫红色
溶液分层,
下层溶液紫红色变浅
(3)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察碘在水中的溶解性;
在碘水溶液中加入约1 ml CCl4,振荡试管,观察碘被CCl4萃取;
再向试管里加入1 ml 浓碘化钾(KI)水溶液,振荡试管,观察溶液颜色变化。
碘单质的溶解性
思考与讨论
①氢键的作用:
当溶质分子和溶剂分子间能形成氢键时,溶质在该溶剂中溶解度更大。溶剂和溶质之间的氢键作用力越大,溶解性越好。
(3)其他因素:
②溶质与溶剂发生反应:
当溶质和溶剂间能发生反应时,溶解度更大。
二氧化硫分子有极性且能与水反应,所以也极易溶于水。
SO2+H2O H2SO3
如氨气极易溶于水、甲醇与水任意比互溶等
思考与讨论
1、比较NH3和CH4在水中的溶解度。怎样用“相似相溶”规律理解它们的溶解度不同?
NH3分子在水中的溶解:
相似相溶:NH3分子和H2O分子都是极性分子。
氢 键:NH3分子与H2O分子之间形成氢键,促进了NH3的溶解。
反 应:部分NH3分子与H2O分子反应生成NH3·H2O,促进了NH3的溶解。
CH4分子在水中的溶解:
相似相溶:CH4是非极性分子,难溶于极性溶剂水中。
2、为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
油漆的主要成分
乙酸乙酯、苯、甲苯等有机溶剂
非极性或极性很小分子
思考与讨论
课堂练习1:下列说法中正确的是 ( )
A.极性分子组成的溶质一定易溶于极性分子组成的溶剂之中,非极性分子组成的溶质一定易溶于非极性分子组成的溶剂中
B.溴分子和水分子是极性分子,四氯化碳分子是非极性分子,所以溴难溶于水而易溶于四氯化碳
C.白磷分子是非极性分子,水分子是极性分子,而二硫化碳是非极性分子,所以白磷难溶于水而易溶于二硫化碳
D.水分子是极性分子,二氧化碳可溶于水,因此二氧化碳是极性分子
C
课堂练习2:根据“相似相溶”规律和实际经验,下列叙述不正确的是( )
A、卤化氢易溶于水,也易溶于CCl4
B、白磷(P4)易溶于CS2,但难溶于水
C、碘易溶于苯,微溶于水
D、NaCl易溶于水,难溶于CCl4
A
Cl
H
H
Br
Cl
Br
H
H
Cl
H
H
Br
重叠的两个CH2ClBr的空间结构模型
如果将CH2ClBr中的一个H换成F,CHFClBr的球棍模型是否完全重叠?
CH2ClBr可能有几种结构?
模型探究
完全重叠,是同种分子。
Cl
H
H
Br
Cl
Br
H
F
Cl
Br
H
F
两个分子互为镜像,但不能相互叠合。
模型探究
CHFClBr的球棍模型是否完全重叠?
上述分子是不同种分子,它们之间是什么关系呢?
镜子
请每个同学重合自己的左、右手,体验是否可以完全重叠?
模型探究
左手和右手相似而不能重叠,它们是镜像关系。
二、分子的手性
三维空间里不能重叠。
完全相同的组成和原子排列
如同左右手一样互为镜像
有手性异构体的分子
2.手性分子
1.手性异构体(或对映异构)
Cl
Br
H
F
Cl
Br
H
F
3.手性碳原子的判断方法
①当碳原子连接4 个不同的原子或基团时,该碳原子称为手性碳原子,标记为﹡。
②手性碳原子一定是饱和碳原子。
课堂练习3:当一个碳原子连接四个不同的原子或基团时,该碳原子叫“手性碳原子”。下列化合物中含有2个手性碳原子的是( )
A
B
C
D
C
阅读课本P60—61,了解手性分子的发展和应用
4.手性分子的应用
手性合成、手性催化方面做出贡献的科学家
①合成手性药物
②合成手性催化剂
一对手性酒石酸盐晶体
巴斯德在研究酒石酸盐时,发现有两种互为手性异构的形式,并用镊子将这两种晶体分离出。这是人类首次发现分子的手性并成功地通过手工拆分出手性异构体。
显微镜观察晶体结构
【科学史话】
课堂练习4:已知 O3 的空间结构为 V 形,分子中正电中心和负电中心不重合,则下列关 于 O3 和 O2 在水中的溶解度叙述正确的是 ( )
A. O3 在水中的溶解度和 O2 一样 B. O3 在水中的溶解度比 O2 小
C. O3 在水中的溶解度比 O2 大 D. 无法比较
C
课堂练习5:下列物质不存在手性异构体的是( )
A.BrCH2CHOHCH2OH B.
C.CH3CHOHCOOH D.CH3COCH2CH3
D
第三节 分子结构与物质性质
第二章 分子结构与性质
第3课时 溶解性 分子的手性
学习目标
1、知道物质的溶解性与分子结构的关系;了解“相似相溶”规律。
2、学会判断“手性分子”。
3、结合实例初步认识分子的手性对其性质的影响。
《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”
屠呦呦团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终用乙醚在低温下成功提取了青蒿素,治疗疟疾,挽救了无数人的生命。
青蒿素
为什么需要用乙醚来提取青蒿素,用水不可以呢?
青蒿素
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 二氧化硫 11.28
气体的溶解度(气体的压强为1.01×105 Pa,温度为293 K,在100 g水中的溶解度)
课本P60资料卡片:
分析表格,你能得到哪些影响气体的溶解度的因素?
2、水是极性分子,氢气、甲烷、氮气、氧气都是非极性分子。它们在水中的溶解度不大。
1、外界因素:如温度、压强
气体 溶解度/g 气体 溶解度/g
乙炔 0.117 乙烯 0.0149
氨气 52.9 氢气 0.00016
二氧化碳 0.169 甲烷 0.0023
一氧化碳 0.0028 氮气 0.0019
氯气 0.729 氧气 0.0043
乙烷 0.0062 二氧化硫 11.28
气体的溶解度(气体的压强为1.01×105 Pa,温度为293 K,在100 g水中的溶解度)
课本P60资料卡片:
分析表格,你能得到哪些影响气体的溶解度的因素?
4、氨气、水都是极性分子,且能形成氢键,在水中的溶解度很大。
3、氯气,二氧化碳虽然也是非极性分子,但能与水反应,所以比其他非极性分子在水中的溶解度大一点。
一、溶解性
物质相互溶解的性质十分复杂,受许多因素影响。
(1)影响物质溶解性的外界因素:
①固体:
主要因素为温度,温度升高,大部分固体溶解度增加(氢氧化钙除外)。
②气体:
主要因素为温度和压强,温度升高,溶解度减小;压强增大,溶解度增大。
例:CCl4是非极性分子,是非极性溶剂;而H2O是极性分子,是极性溶剂。
a.萘、Br2、I2等都是非极性分子,所以易溶于CCl4、苯,而难溶于水。
b.蔗糖、氨、HCl、H2SO4是极性分子,易溶于水而难溶于CCl4。
c.盐类(NaCl等)这些离子化合物可看做是极性最强的,它们易溶于
水而不溶于CCl4、苯等非极性溶剂。
(2)影响物质溶解性的结构因素
①“相似相溶”——极性相似相溶
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
注意:有特例,如CO、NO为极性分子,却难溶于水。
乙醇CH3CH2OH分子中的-OH与水分子的-OH相近,因而乙醇与水能互溶;而戊醇CH3CH2CH2CH2CH2OH中的烃基较大,其中的-OH跟水分子的-OH相似因素小得多了,因而它大水中的溶解度明显减小。
②“相似相溶”——结构相似相溶:
溶质和溶剂的分子结构相似程度越大,其溶解性越好,
图2-30 相似相溶—水和甲醇的相互溶解(虚线表示氢键)
极性上:青蒿素和乙醚的极性小,所以青蒿素在水中的溶解度小,在乙醚中的溶解度大。
结构上:青蒿素中含有醚键,乙醚中也有醚键。 相似相溶!
CH3CH2—O—CH2CH3
乙醚
青蒿素
问题1、为什么需要用乙醚来提取青蒿素,用水不可以呢?
碘单质的溶解性
2、碘单质参与发生反应 ,I2 在与I-反应生产I3- ,溶解度增大。
加入 CCl4
加入 KI 溶液
振荡
振荡
已知:I2 + I-I3-
实验现象:
实验结论:
1、I2 (非极性)在 CCl4 (非极性)中溶解性比在水(极性)中好。
I2 溶于水中
溶液呈黄色
溶液分层,
下层溶液呈紫红色
溶液分层,
下层溶液紫红色变浅
(3)在一个小试管里放入一小粒碘晶体,加入约5 mL蒸馏水,观察碘在水中的溶解性;
在碘水溶液中加入约1 ml CCl4,振荡试管,观察碘被CCl4萃取;
再向试管里加入1 ml 浓碘化钾(KI)水溶液,振荡试管,观察溶液颜色变化。
碘单质的溶解性
思考与讨论
①氢键的作用:
当溶质分子和溶剂分子间能形成氢键时,溶质在该溶剂中溶解度更大。溶剂和溶质之间的氢键作用力越大,溶解性越好。
(3)其他因素:
②溶质与溶剂发生反应:
当溶质和溶剂间能发生反应时,溶解度更大。
二氧化硫分子有极性且能与水反应,所以也极易溶于水。
SO2+H2O H2SO3
如氨气极易溶于水、甲醇与水任意比互溶等
思考与讨论
1、比较NH3和CH4在水中的溶解度。怎样用“相似相溶”规律理解它们的溶解度不同?
NH3分子在水中的溶解:
相似相溶:NH3分子和H2O分子都是极性分子。
氢 键:NH3分子与H2O分子之间形成氢键,促进了NH3的溶解。
反 应:部分NH3分子与H2O分子反应生成NH3·H2O,促进了NH3的溶解。
CH4分子在水中的溶解:
相似相溶:CH4是非极性分子,难溶于极性溶剂水中。
2、为什么在日常生活中用有机溶剂(如乙酸乙酯)溶解油漆而不用水?
油漆的主要成分
乙酸乙酯、苯、甲苯等有机溶剂
非极性或极性很小分子
思考与讨论
课堂练习1:下列说法中正确的是 ( )
A.极性分子组成的溶质一定易溶于极性分子组成的溶剂之中,非极性分子组成的溶质一定易溶于非极性分子组成的溶剂中
B.溴分子和水分子是极性分子,四氯化碳分子是非极性分子,所以溴难溶于水而易溶于四氯化碳
C.白磷分子是非极性分子,水分子是极性分子,而二硫化碳是非极性分子,所以白磷难溶于水而易溶于二硫化碳
D.水分子是极性分子,二氧化碳可溶于水,因此二氧化碳是极性分子
C
课堂练习2:根据“相似相溶”规律和实际经验,下列叙述不正确的是( )
A、卤化氢易溶于水,也易溶于CCl4
B、白磷(P4)易溶于CS2,但难溶于水
C、碘易溶于苯,微溶于水
D、NaCl易溶于水,难溶于CCl4
A
Cl
H
H
Br
Cl
Br
H
H
Cl
H
H
Br
重叠的两个CH2ClBr的空间结构模型
如果将CH2ClBr中的一个H换成F,CHFClBr的球棍模型是否完全重叠?
CH2ClBr可能有几种结构?
模型探究
完全重叠,是同种分子。
Cl
H
H
Br
Cl
Br
H
F
Cl
Br
H
F
两个分子互为镜像,但不能相互叠合。
模型探究
CHFClBr的球棍模型是否完全重叠?
上述分子是不同种分子,它们之间是什么关系呢?
镜子
请每个同学重合自己的左、右手,体验是否可以完全重叠?
模型探究
左手和右手相似而不能重叠,它们是镜像关系。
二、分子的手性
三维空间里不能重叠。
完全相同的组成和原子排列
如同左右手一样互为镜像
有手性异构体的分子
2.手性分子
1.手性异构体(或对映异构)
Cl
Br
H
F
Cl
Br
H
F
3.手性碳原子的判断方法
①当碳原子连接4 个不同的原子或基团时,该碳原子称为手性碳原子,标记为﹡。
②手性碳原子一定是饱和碳原子。
课堂练习3:当一个碳原子连接四个不同的原子或基团时,该碳原子叫“手性碳原子”。下列化合物中含有2个手性碳原子的是( )
A
B
C
D
C
阅读课本P60—61,了解手性分子的发展和应用
4.手性分子的应用
手性合成、手性催化方面做出贡献的科学家
①合成手性药物
②合成手性催化剂
一对手性酒石酸盐晶体
巴斯德在研究酒石酸盐时,发现有两种互为手性异构的形式,并用镊子将这两种晶体分离出。这是人类首次发现分子的手性并成功地通过手工拆分出手性异构体。
显微镜观察晶体结构
【科学史话】
课堂练习4:已知 O3 的空间结构为 V 形,分子中正电中心和负电中心不重合,则下列关 于 O3 和 O2 在水中的溶解度叙述正确的是 ( )
A. O3 在水中的溶解度和 O2 一样 B. O3 在水中的溶解度比 O2 小
C. O3 在水中的溶解度比 O2 大 D. 无法比较
C
课堂练习5:下列物质不存在手性异构体的是( )
A.BrCH2CHOHCH2OH B.
C.CH3CHOHCOOH D.CH3COCH2CH3
D
