2.3.3物质的量浓度(共26张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3.3物质的量浓度(共26张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 754.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 11:59:28 | ||
图片预览








文档简介
(共26张PPT)
第三节 物质的量
第3课时 物质的量浓度
导入
实验中总会接触到各种形态的化学物质。它们有的是固态的,
有的是气态的,有的是液态的。
氯化钠固体
盐酸溶液
氨气
导入
在实验中,根据需求不同,我们会选用不同浓度的溶液。例如:用浓硫酸充当吸水剂,用稀硫酸作反应物。
怎么区分溶液的“浓”和“稀”呢?
通常用溶液中溶质的质量分数来表示溶液的浓度,它以溶质的质量与溶液的质量之比来表示溶液中溶质与溶液的质量关系。
新课讲解
取用溶液时,更多的是量取溶液的体积。如果知道
每升溶液里所含溶质的物质的量,就可以快速的知道任
意体积溶液中溶质的物质的量了。
思考·讨论
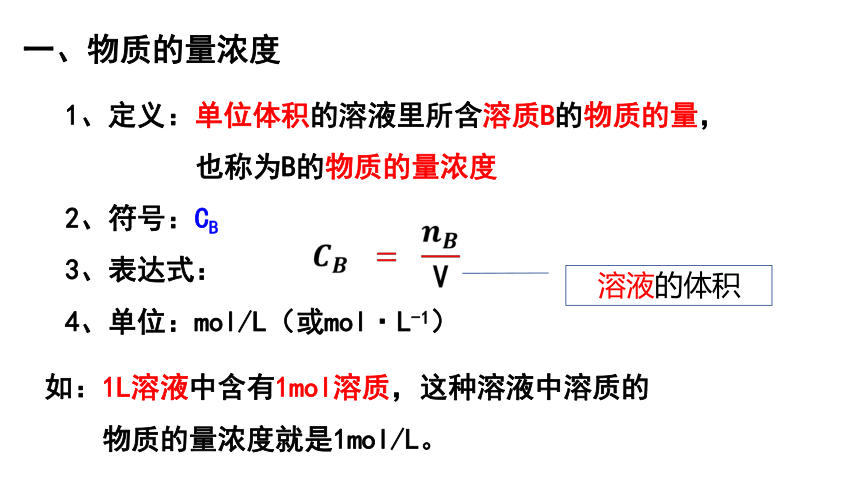
1、定义:单位体积的溶液里所含溶质B的物质的量,
也称为B的物质的量浓度
2、符号:CB
3、表达式:
4、单位:mol/L(或mol·L-1)
如:1L溶液中含有1mol溶质,这种溶液中溶质的
物质的量浓度就是1mol/L。
一、物质的量浓度
溶液的体积
思维启迪
序号 项目名称 英文缩写 检查结果 单位 参考范围
12 *钾 K 4.1 mmol/L 3.5-5.5
13 *钠 Na 140 mmol/L 135-145
14 *氯 Cl 103 mmol/L 96-111
15 *钙 Ca 2.43 mmol/L 2.13-2.70
16 胱抑素C CysC 0.78 mg/L 0.59-1.03
17 *肌酐(酶法) Cr(E) 71 μmol/L 59-104
18 *尿素 Urea 4.18 mmol/L 2.78-7.14
19 *葡萄糖 Glu 5.1 mmol/L 3.9-6.1
体检的一些指标常用物质的量浓度表示
【例题1】配制500mL0.1mol/L的NaOH溶液,
需要NaOH的质量是多少?
解:500mL0.1mol/LNaOH溶液中的NaOH的物质的量为:
n(NaOH) = c(NaOH)· V[NaOH(aq)]
= 0.1mol/L×0.5L
= 0.05mol
第一步:求NaOH的物质的量
aq表示某种物质的水溶液,
如NaOH(aq)表示NaOH的水溶液。
思考·讨论
0.05molNaOH的质量为:
m(NaOH) = n(NaOH)· M(NaOH)
= 0.05mol×40g/mol
= 2g
答:需要NaOH的质量是2g。
第二步:求NaOH的质量
思维启迪
题型:已知溶液的体积和物质的量浓度,
求解溶质的质量。
解题步骤:
① nB = cB·V,求解溶液中溶质物质的量;
② m = n·M,求解溶液中溶质的质量。
对物质的量浓度的理解
(1)体积是溶液的体积,不是溶剂的体积。
(2)溶质用物质的量表示,不是用质量表示。
(3)溶液的物质的量浓度是个定值,不受体积影响。从某浓度的溶液中取出任意体积,其浓度不变。
1.判断下列说法是否正确
(1)将1gNaCl溶于水制成1L溶液 ,则c=1mol/L ; ( )
(2)将1molNaCl溶于1L水中,则c=1mol/L; ( )
(3)若从1L 1 mol/L的NaOH溶液中取出20mL,则取出的
NaOH溶液c=1mol/L;( )
(4)同体积 、同物质的量浓度的不同溶液中,含溶质的物
质的量相等;( )
×
√
√
注意:1L是溶液的体积,不是水的体积。
×
(1)将40gNaOH配成2L溶液,其物质的量浓度为____mol/L
0.5
(2)标况下,22.4LHCl配成0.5L盐酸,其物质的量浓度为 mol/L。
2
(3)物质的量浓度为2mol/L的硫酸溶液500mL,
含硫酸的物质的量为 mol 。
(4)10 mol HCl能配成 L 物质的量浓度为2mol/L的盐酸。
5
1
2、填空
二、配制一定物质的量浓度的溶液
1、实验仪器
托盘天平
量筒
烧杯 玻璃棒
容量瓶
胶头滴管
容量瓶简介
形状: 细颈,梨形,平底的玻璃瓶;
构造: 瓶上标有容积,温度,颈部标有刻度线;
100ml
20℃
容量瓶
规格:50mL , 100mL,250mL,500mL,1000mL;
2、配制100 ml 1.0 mol/L的NaCl溶液
(1)、计算
计算所需NaCl的质量
=1.0mol/L×0.1L×58.5g/mol=5.85g
m(NaCl)=n(NaCl) M(NaCl)
计算
溶解
称量
转移
洗涤
定容
摇匀
装瓶
5.85g
玻璃棒下端伸到刻度线以下
一定物质的量浓度溶液的配制
5.9g
冷却至室温
使用容量瓶时的注意事项:
②不能在其中进行溶解稀释
等实验操作
③不能当作反应的容器
①不能加热容量瓶
不能长期存放溶液
只能用来配制溶液
3、配制一定物质的量浓度溶液的误差分析(P49)
原理依据
=
m
M*V
定容时俯视刻度
定容时仰视刻度
仰视
俯视
CB=
nB
V
误差分析
1、实验需要1 mol·L-1的氢氧化钠溶液240mL,完
成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中加 蒸
馏水将其溶解,待 后将溶液沿 移入
ml的容量瓶中。
10.0
烧杯
少量
冷却
玻璃棒
250
练习
已知溶质的质量分数w,溶液的密度为ρ g·cm-3,溶质的摩尔质量为M g·mol-1,求物质的量浓度c。
c= mol·L-1。
2.下列溶液中,跟200mL0.5mol/L的Na2SO4溶液所含的Na+物质的量浓度相同的是( )
A.200mL0.25mol/LNaCl溶液
B.200mL1mol/LNaCl溶液
C.100mL 0.5mol/LNaOH溶液
D.100mL1mol/LNa2CO3溶液
B
同一溶液中,
不同粒子的浓度之比 = 粒子个数之比
N2
N1
C2
C1
==
3.从1L物质的量浓度为1mol·L-1的氢氧化钠溶液中取出100mL,下面关于这100mL溶液的叙述中错误的是( )
A.物质的量浓度为0.1mol L-1
B.物质的量浓度为1mol L-1
C.含氢氧化钠4g
D.含氢氧化钠0.1mol
A
溶液的物质的量浓度是个定值,
不受体积影响。从某浓度的溶液中取出任意体积,其浓度不变。
4.下列各溶液中氯离子(Cl-)的物质的量浓度最大的是( )
A.200mL,0.5mol L-1的FeCl3溶液
B.100mL,0.5mol L-1的MgCl2溶液
C.150mL,1mol L-1的NaCl溶液
D.50mL,0.5mol L-1的CuCl2溶液
A
物质的量浓度
课堂小结
物质的量浓度
概念:单位体积的溶液里所含溶质B的物质的量,也称B的物质的量浓度
符号:CB
常用单位:mol/L(或 mol·L-1)
物质的量浓度的相关计算
已知溶液的体积和物质的量浓度,求解溶质的质量
第三节 物质的量
第3课时 物质的量浓度
导入
实验中总会接触到各种形态的化学物质。它们有的是固态的,
有的是气态的,有的是液态的。
氯化钠固体
盐酸溶液
氨气
导入
在实验中,根据需求不同,我们会选用不同浓度的溶液。例如:用浓硫酸充当吸水剂,用稀硫酸作反应物。
怎么区分溶液的“浓”和“稀”呢?
通常用溶液中溶质的质量分数来表示溶液的浓度,它以溶质的质量与溶液的质量之比来表示溶液中溶质与溶液的质量关系。
新课讲解
取用溶液时,更多的是量取溶液的体积。如果知道
每升溶液里所含溶质的物质的量,就可以快速的知道任
意体积溶液中溶质的物质的量了。
思考·讨论
1、定义:单位体积的溶液里所含溶质B的物质的量,
也称为B的物质的量浓度
2、符号:CB
3、表达式:
4、单位:mol/L(或mol·L-1)
如:1L溶液中含有1mol溶质,这种溶液中溶质的
物质的量浓度就是1mol/L。
一、物质的量浓度
溶液的体积
思维启迪
序号 项目名称 英文缩写 检查结果 单位 参考范围
12 *钾 K 4.1 mmol/L 3.5-5.5
13 *钠 Na 140 mmol/L 135-145
14 *氯 Cl 103 mmol/L 96-111
15 *钙 Ca 2.43 mmol/L 2.13-2.70
16 胱抑素C CysC 0.78 mg/L 0.59-1.03
17 *肌酐(酶法) Cr(E) 71 μmol/L 59-104
18 *尿素 Urea 4.18 mmol/L 2.78-7.14
19 *葡萄糖 Glu 5.1 mmol/L 3.9-6.1
体检的一些指标常用物质的量浓度表示
【例题1】配制500mL0.1mol/L的NaOH溶液,
需要NaOH的质量是多少?
解:500mL0.1mol/LNaOH溶液中的NaOH的物质的量为:
n(NaOH) = c(NaOH)· V[NaOH(aq)]
= 0.1mol/L×0.5L
= 0.05mol
第一步:求NaOH的物质的量
aq表示某种物质的水溶液,
如NaOH(aq)表示NaOH的水溶液。
思考·讨论
0.05molNaOH的质量为:
m(NaOH) = n(NaOH)· M(NaOH)
= 0.05mol×40g/mol
= 2g
答:需要NaOH的质量是2g。
第二步:求NaOH的质量
思维启迪
题型:已知溶液的体积和物质的量浓度,
求解溶质的质量。
解题步骤:
① nB = cB·V,求解溶液中溶质物质的量;
② m = n·M,求解溶液中溶质的质量。
对物质的量浓度的理解
(1)体积是溶液的体积,不是溶剂的体积。
(2)溶质用物质的量表示,不是用质量表示。
(3)溶液的物质的量浓度是个定值,不受体积影响。从某浓度的溶液中取出任意体积,其浓度不变。
1.判断下列说法是否正确
(1)将1gNaCl溶于水制成1L溶液 ,则c=1mol/L ; ( )
(2)将1molNaCl溶于1L水中,则c=1mol/L; ( )
(3)若从1L 1 mol/L的NaOH溶液中取出20mL,则取出的
NaOH溶液c=1mol/L;( )
(4)同体积 、同物质的量浓度的不同溶液中,含溶质的物
质的量相等;( )
×
√
√
注意:1L是溶液的体积,不是水的体积。
×
(1)将40gNaOH配成2L溶液,其物质的量浓度为____mol/L
0.5
(2)标况下,22.4LHCl配成0.5L盐酸,其物质的量浓度为 mol/L。
2
(3)物质的量浓度为2mol/L的硫酸溶液500mL,
含硫酸的物质的量为 mol 。
(4)10 mol HCl能配成 L 物质的量浓度为2mol/L的盐酸。
5
1
2、填空
二、配制一定物质的量浓度的溶液
1、实验仪器
托盘天平
量筒
烧杯 玻璃棒
容量瓶
胶头滴管
容量瓶简介
形状: 细颈,梨形,平底的玻璃瓶;
构造: 瓶上标有容积,温度,颈部标有刻度线;
100ml
20℃
容量瓶
规格:50mL , 100mL,250mL,500mL,1000mL;
2、配制100 ml 1.0 mol/L的NaCl溶液
(1)、计算
计算所需NaCl的质量
=1.0mol/L×0.1L×58.5g/mol=5.85g
m(NaCl)=n(NaCl) M(NaCl)
计算
溶解
称量
转移
洗涤
定容
摇匀
装瓶
5.85g
玻璃棒下端伸到刻度线以下
一定物质的量浓度溶液的配制
5.9g
冷却至室温
使用容量瓶时的注意事项:
②不能在其中进行溶解稀释
等实验操作
③不能当作反应的容器
①不能加热容量瓶
不能长期存放溶液
只能用来配制溶液
3、配制一定物质的量浓度溶液的误差分析(P49)
原理依据
=
m
M*V
定容时俯视刻度
定容时仰视刻度
仰视
俯视
CB=
nB
V
误差分析
1、实验需要1 mol·L-1的氢氧化钠溶液240mL,完
成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中加 蒸
馏水将其溶解,待 后将溶液沿 移入
ml的容量瓶中。
10.0
烧杯
少量
冷却
玻璃棒
250
练习
已知溶质的质量分数w,溶液的密度为ρ g·cm-3,溶质的摩尔质量为M g·mol-1,求物质的量浓度c。
c= mol·L-1。
2.下列溶液中,跟200mL0.5mol/L的Na2SO4溶液所含的Na+物质的量浓度相同的是( )
A.200mL0.25mol/LNaCl溶液
B.200mL1mol/LNaCl溶液
C.100mL 0.5mol/LNaOH溶液
D.100mL1mol/LNa2CO3溶液
B
同一溶液中,
不同粒子的浓度之比 = 粒子个数之比
N2
N1
C2
C1
==
3.从1L物质的量浓度为1mol·L-1的氢氧化钠溶液中取出100mL,下面关于这100mL溶液的叙述中错误的是( )
A.物质的量浓度为0.1mol L-1
B.物质的量浓度为1mol L-1
C.含氢氧化钠4g
D.含氢氧化钠0.1mol
A
溶液的物质的量浓度是个定值,
不受体积影响。从某浓度的溶液中取出任意体积,其浓度不变。
4.下列各溶液中氯离子(Cl-)的物质的量浓度最大的是( )
A.200mL,0.5mol L-1的FeCl3溶液
B.100mL,0.5mol L-1的MgCl2溶液
C.150mL,1mol L-1的NaCl溶液
D.50mL,0.5mol L-1的CuCl2溶液
A
物质的量浓度
课堂小结
物质的量浓度
概念:单位体积的溶液里所含溶质B的物质的量,也称B的物质的量浓度
符号:CB
常用单位:mol/L(或 mol·L-1)
物质的量浓度的相关计算
已知溶液的体积和物质的量浓度,求解溶质的质量
