化学人教版(2019)选择性必修2 第一章第二节第1课时原子结构与元素周期表(25张)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 第一章第二节第1课时原子结构与元素周期表(25张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 00:00:00 | ||
图片预览





文档简介
(共25张PPT)
人教版 选择性必修2
第一章 第二节 第1课时
原子结构与元素周期表
航天
药物
海洋
通讯
元素
元素周期律、元素周期系和元素周期表
思考
你还记得元素周期表的发展历程吗?
元素周期律、元素周期系和元素周期表
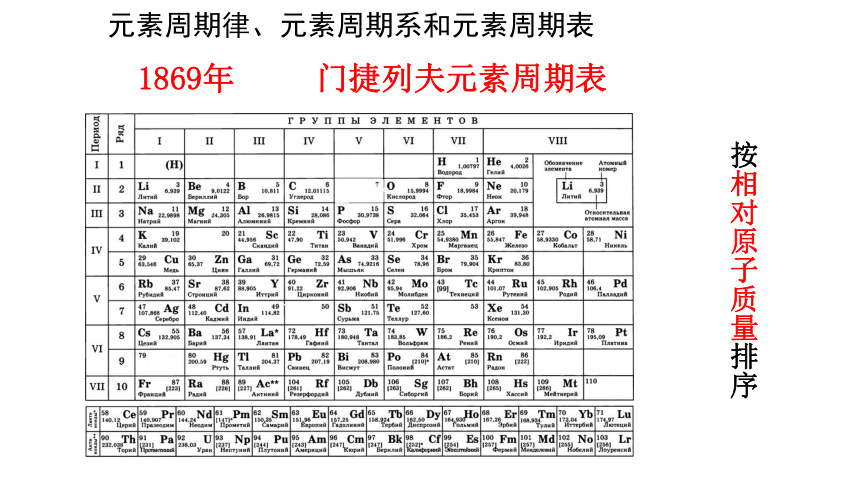
1869年 门捷列夫元素周期表
按相对原子质量排序
元素周期律、元素周期系和元素周期表
按相对原子质量从小到大的顺序将元素排列起来,得到一个元素序列,并从最轻的元素氢开始进行编号,称为原子序数。
1869年,门捷列夫发现,元素的性质随着元素原子序数的递增而呈周期性变化,这个规律叫作元素周期律。
门捷列夫
原子序数
核电荷数
=
元素周期律为元素的性质随着元素核电荷数的递增而呈周期性变化。
我们把元素按照其原子核电荷数递增排列的序列称为元素周期系。
莫塞莱
=
质子数
=
核外电子数
元素周期律、元素周期系和元素周期表
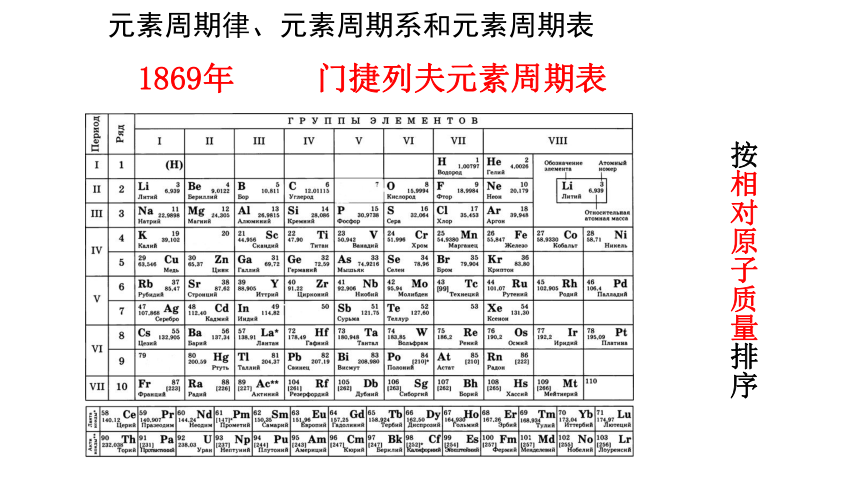
1869年 门捷列夫元素周期表
按相对原子质量排序
元素周期律、元素周期系和元素周期表
1905年 维尔纳特长式周期表
元素周期律、元素周期系和元素周期表
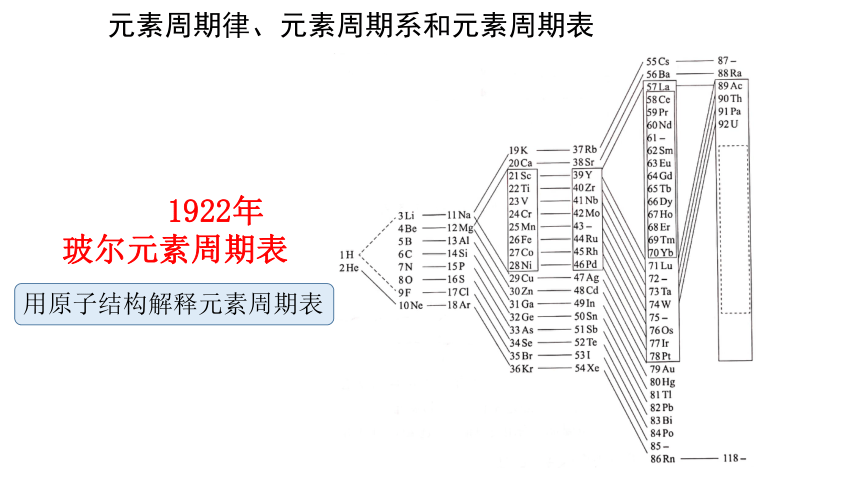
1922年
玻尔元素周期表
用原子结构解释元素周期表
元素周期律、元素周期系和元素周期表
构造原理与元素周期表
活动一
结合构造原理,请同学们写出1~36号元素的基态原子价电子排布式。
构造原理与元素周期表
1s1 1s2
2s1 2s2 2s2 2p1 2s2 2p2 2s2 2p3 2s2 2p4 2s2 2p5 2s2
2p6
3s1 3s2 3s2 3p1 3s2 3p2 3s2 3p3 3s2 3p4 3s2 3p5 3s2
3p6
4s1 4s2 3d14s2 3d24s2 3d34s2 3d44s2 3d54s2 3d64s2 3d74s2 3d84s2 3d94s2 3d104s2 4s2 4p1 4s2 4p2 4s2 4p3 4s2 4p4 4s2 4p5 4s2
4p6
3d54s1
3d104s1
Cr
Cu
构造原理与元素周期表
活动二
原子的核外电子排布与周期的划分有什么关系?
原子的核外电子排布与族的划分有什么关系?
构造原理与元素周期表
1s
2s
3s
4s
5s
6s
7s
2p
3p
4p
5p
6p
7p
3d
4d
5d
6d
4f
5f
2
8
8
18
18
32
32
2
14
10
6
活动二
原子的核外电子排布与周期的划分有什么关系?
原子的核外电子排布与族的划分有什么关系?
构造原理与元素周期表
构造原理与元素周期表
1s1
2s1
3s1
4s1
5s1
6s1
7s1
2s2
3s2
4s2
5s2
6s2
7s2
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
2s22p3
3s23p3
4s24p3
5s25p3
6s26p3
2s22p4
3s23p4
4s24p4
5s25p4
6s26p4
2s22p5
3s23p5
4s24p5
5s25p5
6s26p5
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
1s2
3d14s2
4d15s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
4d55s1
5d26s2
镧系
5d66s2
4d75s1
5d76s2
4d85s1
5d96s1
4d10
5d106s1
4d105s1
4d105s2
5d106s2
6d27s2
锕系
5d46s2
4d55s2
4d45s1
4d25s2
5d36s2
5d56s2
6d37s2
镧系
锕系
5d16s2
6d17s2
4f15d16s2
4f46s2
4f36s2
4f56s2
4f76s2
4f66s2
4f75d16s2
4f106s2
4f96s2
4f146s2
4f136s2
4f126s2
4f116s2
4f145d16s2
6d27s2
4f25d16s2
4f35d16s2
6d77s2
6d67s2
4f75d16s2
6d97s2
6d117s2
6d127s2
6d137s2
6d147s2
6d107s2
4f45d16s2
4f145d16s2
IA
VA
IVA
IIIA
IIB
IB
IVB
IIIB
VB
VIB
VIIB
VIIA
VIA
0
VIII
IIA
构造原理与元素周期表
1s1
2s1
3s1
4s1
5s1
6s1
7s1
2s2
3s2
4s2
5s2
6s2
7s2
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
2s22p3
3s23p3
4s24p3
5s25p3
6s26p3
2s22p4
3s23p4
4s24p4
5s25p4
6s26p4
2s22p5
3s23p5
4s24p5
5s25p5
6s26p5
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
1s2
3d14s2
4d15s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
4d55s1
5d26s2
镧系
5d66s2
4d75s1
5d76s2
4d85s1
5d96s1
4d10
5d106s1
4d105s1
4d105s2
5d106s2
6d27s2
锕系
5d46s2
4d55s2
4d45s1
4d25s2
5d36s2
5d56s2
6d37s2
镧系
锕系
5d16s2
6d17s2
4f15d16s2
4f46s2
4f36s2
4f56s2
4f76s2
4f66s2
4f75d16s2
4f106s2
4f96s2
4f146s2
4f136s2
4f126s2
4f116s2
4f145d16s2
6d27s2
4f25d16s2
4f35d16s2
6d77s2
6d67s2
4f75d16s2
6d97s2
6d117s2
6d127s2
6d137s2
6d147s2
6d107s2
4f45d16s2
4f145d16s2
IA
VA
IVA
IIIA
IIB
IB
IVB
IIIB
VB
VIB
VIIB
VIIA
VIA
0
VIII
IIA
构造原理与元素周期表
1s1
2s1
3s1
4s1
5s1
6s1
7s1
2s2
3s2
4s2
5s2
6s2
7s2
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
2s22p3
3s23p3
4s24p3
5s25p3
6s26p3
2s22p4
3s23p4
4s24p4
5s25p4
6s26p4
2s22p5
3s23p5
4s24p5
5s25p5
6s26p5
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
1s2
3d14s2
4d15s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
4d55s1
5d26s2
镧系
5d66s2
4d75s1
5d76s2
4d85s1
5d96s1
4d10
5d106s1
4d105s1
4d105s2
5d106s2
6d27s2
锕系
5d46s2
4d55s2
4d45s1
4d25s2
5d36s2
5d56s2
6d37s2
镧系
锕系
5d16s2
6d17s2
4f15d16s2
4f46s2
4f36s2
4f56s2
4f76s2
4f66s2
4f75d16s2
4f106s2
4f96s2
4f146s2
4f136s2
4f126s2
4f116s2
4f145d16s2
6d27s2
4f25d16s2
4f35d16s2
6d77s2
6d67s2
4f75d16s2
6d97s2
6d117s2
6d127s2
6d137s2
6d147s2
6d107s2
4f45d16s2
4f145d16s2
IA
IIA
VA
IVA
IIIA
IIB
IB
VIII
IVB
IIIB
VB
VIB
VIIB
VIIA
VIA
0
构造原理与元素周期表
1s1
2s1
3s1
4s1
5s1
6s1
7s1
2s2
3s2
4s2
5s2
6s2
7s2
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
2s22p3
3s23p3
4s24p3
5s25p3
6s26p3
2s22p4
3s23p4
4s24p4
5s25p4
6s26p4
2s22p5
3s23p5
4s24p5
5s25p5
6s26p5
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
1s2
3d14s2
4d15s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
4d55s1
5d26s2
镧系
5d66s2
4d75s1
5d76s2
4d85s1
5d96s1
4d10
5d106s1
4d105s1
4d105s2
5d106s2
6d27s2
锕系
5d46s2
4d55s2
4d45s1
4d25s2
5d36s2
5d56s2
6d37s2
镧系
锕系
5d16s2
6d17s2
4f15d16s2
4f46s2
4f36s2
4f56s2
4f76s2
4f66s2
4f75d16s2
4f106s2
4f96s2
4f146s2
4f136s2
4f126s2
4f116s2
4f145d16s2
6d27s2
4f25d16s2
4f35d16s2
6d77s2
6d67s2
4f75d16s2
6d97s2
6d117s2
6d127s2
6d137s2
6d147s2
6d107s2
4f45d16s2
4f145d16s2
IA
IIA
VA
IVA
IIIA
IIB
IB
VIII
IVB
IIIB
VB
VIB
VIIB
VIIA
VIA
0
S区
p区
d区
ds区
f区
以最后填入电子的能级的符号作为该区的符号
1s1
2s1
3s1
4s1
5s1
6s1
7s1
2s2
3s2
4s2
5s2
6s2
7s2
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
2s22p3
3s23p3
4s24p3
5s25p3
6s26p3
2s22p4
3s23p4
4s24p4
5s25p4
6s26p4
2s22p5
3s23p5
4s24p5
5s25p5
6s26p5
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
1s2
3d14s2
4d15s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
4d55s1
5d26s2
镧系
5d66s2
4d75s1
5d76s2
4d85s1
5d96s1
4d10
5d106s1
4d105s1
4d105s2
5d106s2
6d27s2
锕系
5d46s2
4d55s2
4d45s1
4d25s2
5d36s2
5d56s2
6d37s2
镧系
锕系
5d16s2
6d17s2
4f15d16s2
4f46s2
4f36s2
4f56s2
4f76s2
4f66s2
4f75d16s2
4f106s2
4f96s2
4f146s2
4f136s2
4f126s2
4f116s2
4f145d16s2
6d27s2
4f25d16s2
4f35d16s2
6d77s2
6d67s2
4f75d16s2
6d97s2
6d117s2
6d127s2
6d137s2
6d147s2
6d107s2
4f45d16s2
4f145d16s2
IA
IIA
VA
IVA
IIIA
IIB
IB
VIII
IVB
IIIB
VB
VIB
VIIB
VIIA
VIA
0
半金属或类金属
过渡元素
构造原理与元素周期表
某些主族元素与右下方的主族元素的某些性质是相似的,这种相似性称之为对角线规则。
2Al+6HCl = 2AlCl3+3H2↑
Be+2HCl = BeCl2+H2↑
2Al+2NaOH+2H2O = 2NaAlO2+3H2↑
Be+2NaOH = Na2BeO2+H2↑
Al2O3+6HCl = 2AlCl3+3H2O
BeO+2HCl = BeCl2+H2O
Al2O3+2NaOH = 2NaAlO2+H2O
Be(OH)2+2NaOH=Na2BeO2+ 2H2O
Al(OH)3+NaOH=NaAlO2+ 2H2O
Al(OH)3+3HCl = AlCl3+3H2O
Be(OH)2+2HCl = BeCl2+2H2O
BeO+2NaOH = Na2BeO2+H2O
构造原理与元素周期表
(1) 横行原则:把 相同的元素,按 的顺序从左到右排列。
(2) 纵行原则:把不同横行中 相同的元素,按 的顺序由上而下排列。
(3) 原子序数:按照元素 给元素编的序号。
(4) 原子序数与元素的原子结构之间的关系:
原子序数= = = 。
电子层数目
在周期表中的顺序
最外层电子数
核电荷数
原子序数递增
质子数
电子层数递增
核外电子数
元素周期表的编排原则
课堂练习
1.原子序数为83的元素位于:①第五周期;②第六周期;③ⅣA族;④ⅤA族;⑤ⅡB族,其中正确的组合是( )
A.①④ B.②③ C.②④ D.①⑤
C
课堂练习
2.下列关于原子核外电子排布与元素在周期表中位置关系的叙述中,正确的是( )
A. 原子价电子排布为ns2np1~6的元素一定是主族元素
B. 基态原子最外电子层的p能级上有5个电子的元素一定是第ⅦA族元素
C. 原子的价电子排布为(n-1)d6~8ns2的元素一定位于第ⅢB~ⅦB族
D. 基态原子N能层上只有1个电子的元素一定是主族元素
B
课堂练习
3.下列说法中正确的是( )
A. 所有金属元素都分布在d区和ds区
B. 原子最外层电子数为2的元素都分布在s区
C. 元素周期表中ⅢB族到ⅡB族10个纵列的元素都是金属元素
D. s区均为金属元素
C
课堂练习
4.已知某元素基态原子的价电子排布为(n-1)dansb(a、b均为大于0的正整数),下列有关说法正确的是( )
A. 该元素一定位于元素周期表中的d区
B. 该元素一定位于元素周期表中的ds区
C. 该元素的族序数为a+b
D. 该元素一定为金属元素
A
课堂练习
5.元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的外围电子排布式为nsn-1npn+1,则下列说法不正确的是 ( )
A. Y元素原子的价层电子排布式为4s24p4
B. Y元素在元素周期表的第三周期第ⅥA族
C. X元素所在周期中所含非金属元素种数最多
D. Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
A
人教版 选择性必修2
第一章 第二节 第1课时
原子结构与元素周期表
航天
药物
海洋
通讯
元素
元素周期律、元素周期系和元素周期表
思考
你还记得元素周期表的发展历程吗?
元素周期律、元素周期系和元素周期表
1869年 门捷列夫元素周期表
按相对原子质量排序
元素周期律、元素周期系和元素周期表
按相对原子质量从小到大的顺序将元素排列起来,得到一个元素序列,并从最轻的元素氢开始进行编号,称为原子序数。
1869年,门捷列夫发现,元素的性质随着元素原子序数的递增而呈周期性变化,这个规律叫作元素周期律。
门捷列夫
原子序数
核电荷数
=
元素周期律为元素的性质随着元素核电荷数的递增而呈周期性变化。
我们把元素按照其原子核电荷数递增排列的序列称为元素周期系。
莫塞莱
=
质子数
=
核外电子数
元素周期律、元素周期系和元素周期表
1869年 门捷列夫元素周期表
按相对原子质量排序
元素周期律、元素周期系和元素周期表
1905年 维尔纳特长式周期表
元素周期律、元素周期系和元素周期表
1922年
玻尔元素周期表
用原子结构解释元素周期表
元素周期律、元素周期系和元素周期表
构造原理与元素周期表
活动一
结合构造原理,请同学们写出1~36号元素的基态原子价电子排布式。
构造原理与元素周期表
1s1 1s2
2s1 2s2 2s2 2p1 2s2 2p2 2s2 2p3 2s2 2p4 2s2 2p5 2s2
2p6
3s1 3s2 3s2 3p1 3s2 3p2 3s2 3p3 3s2 3p4 3s2 3p5 3s2
3p6
4s1 4s2 3d14s2 3d24s2 3d34s2 3d44s2 3d54s2 3d64s2 3d74s2 3d84s2 3d94s2 3d104s2 4s2 4p1 4s2 4p2 4s2 4p3 4s2 4p4 4s2 4p5 4s2
4p6
3d54s1
3d104s1
Cr
Cu
构造原理与元素周期表
活动二
原子的核外电子排布与周期的划分有什么关系?
原子的核外电子排布与族的划分有什么关系?
构造原理与元素周期表
1s
2s
3s
4s
5s
6s
7s
2p
3p
4p
5p
6p
7p
3d
4d
5d
6d
4f
5f
2
8
8
18
18
32
32
2
14
10
6
活动二
原子的核外电子排布与周期的划分有什么关系?
原子的核外电子排布与族的划分有什么关系?
构造原理与元素周期表
构造原理与元素周期表
1s1
2s1
3s1
4s1
5s1
6s1
7s1
2s2
3s2
4s2
5s2
6s2
7s2
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
2s22p3
3s23p3
4s24p3
5s25p3
6s26p3
2s22p4
3s23p4
4s24p4
5s25p4
6s26p4
2s22p5
3s23p5
4s24p5
5s25p5
6s26p5
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
1s2
3d14s2
4d15s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
4d55s1
5d26s2
镧系
5d66s2
4d75s1
5d76s2
4d85s1
5d96s1
4d10
5d106s1
4d105s1
4d105s2
5d106s2
6d27s2
锕系
5d46s2
4d55s2
4d45s1
4d25s2
5d36s2
5d56s2
6d37s2
镧系
锕系
5d16s2
6d17s2
4f15d16s2
4f46s2
4f36s2
4f56s2
4f76s2
4f66s2
4f75d16s2
4f106s2
4f96s2
4f146s2
4f136s2
4f126s2
4f116s2
4f145d16s2
6d27s2
4f25d16s2
4f35d16s2
6d77s2
6d67s2
4f75d16s2
6d97s2
6d117s2
6d127s2
6d137s2
6d147s2
6d107s2
4f45d16s2
4f145d16s2
IA
VA
IVA
IIIA
IIB
IB
IVB
IIIB
VB
VIB
VIIB
VIIA
VIA
0
VIII
IIA
构造原理与元素周期表
1s1
2s1
3s1
4s1
5s1
6s1
7s1
2s2
3s2
4s2
5s2
6s2
7s2
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
2s22p3
3s23p3
4s24p3
5s25p3
6s26p3
2s22p4
3s23p4
4s24p4
5s25p4
6s26p4
2s22p5
3s23p5
4s24p5
5s25p5
6s26p5
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
1s2
3d14s2
4d15s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
4d55s1
5d26s2
镧系
5d66s2
4d75s1
5d76s2
4d85s1
5d96s1
4d10
5d106s1
4d105s1
4d105s2
5d106s2
6d27s2
锕系
5d46s2
4d55s2
4d45s1
4d25s2
5d36s2
5d56s2
6d37s2
镧系
锕系
5d16s2
6d17s2
4f15d16s2
4f46s2
4f36s2
4f56s2
4f76s2
4f66s2
4f75d16s2
4f106s2
4f96s2
4f146s2
4f136s2
4f126s2
4f116s2
4f145d16s2
6d27s2
4f25d16s2
4f35d16s2
6d77s2
6d67s2
4f75d16s2
6d97s2
6d117s2
6d127s2
6d137s2
6d147s2
6d107s2
4f45d16s2
4f145d16s2
IA
VA
IVA
IIIA
IIB
IB
IVB
IIIB
VB
VIB
VIIB
VIIA
VIA
0
VIII
IIA
构造原理与元素周期表
1s1
2s1
3s1
4s1
5s1
6s1
7s1
2s2
3s2
4s2
5s2
6s2
7s2
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
2s22p3
3s23p3
4s24p3
5s25p3
6s26p3
2s22p4
3s23p4
4s24p4
5s25p4
6s26p4
2s22p5
3s23p5
4s24p5
5s25p5
6s26p5
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
1s2
3d14s2
4d15s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
4d55s1
5d26s2
镧系
5d66s2
4d75s1
5d76s2
4d85s1
5d96s1
4d10
5d106s1
4d105s1
4d105s2
5d106s2
6d27s2
锕系
5d46s2
4d55s2
4d45s1
4d25s2
5d36s2
5d56s2
6d37s2
镧系
锕系
5d16s2
6d17s2
4f15d16s2
4f46s2
4f36s2
4f56s2
4f76s2
4f66s2
4f75d16s2
4f106s2
4f96s2
4f146s2
4f136s2
4f126s2
4f116s2
4f145d16s2
6d27s2
4f25d16s2
4f35d16s2
6d77s2
6d67s2
4f75d16s2
6d97s2
6d117s2
6d127s2
6d137s2
6d147s2
6d107s2
4f45d16s2
4f145d16s2
IA
IIA
VA
IVA
IIIA
IIB
IB
VIII
IVB
IIIB
VB
VIB
VIIB
VIIA
VIA
0
构造原理与元素周期表
1s1
2s1
3s1
4s1
5s1
6s1
7s1
2s2
3s2
4s2
5s2
6s2
7s2
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
2s22p3
3s23p3
4s24p3
5s25p3
6s26p3
2s22p4
3s23p4
4s24p4
5s25p4
6s26p4
2s22p5
3s23p5
4s24p5
5s25p5
6s26p5
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
1s2
3d14s2
4d15s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
4d55s1
5d26s2
镧系
5d66s2
4d75s1
5d76s2
4d85s1
5d96s1
4d10
5d106s1
4d105s1
4d105s2
5d106s2
6d27s2
锕系
5d46s2
4d55s2
4d45s1
4d25s2
5d36s2
5d56s2
6d37s2
镧系
锕系
5d16s2
6d17s2
4f15d16s2
4f46s2
4f36s2
4f56s2
4f76s2
4f66s2
4f75d16s2
4f106s2
4f96s2
4f146s2
4f136s2
4f126s2
4f116s2
4f145d16s2
6d27s2
4f25d16s2
4f35d16s2
6d77s2
6d67s2
4f75d16s2
6d97s2
6d117s2
6d127s2
6d137s2
6d147s2
6d107s2
4f45d16s2
4f145d16s2
IA
IIA
VA
IVA
IIIA
IIB
IB
VIII
IVB
IIIB
VB
VIB
VIIB
VIIA
VIA
0
S区
p区
d区
ds区
f区
以最后填入电子的能级的符号作为该区的符号
1s1
2s1
3s1
4s1
5s1
6s1
7s1
2s2
3s2
4s2
5s2
6s2
7s2
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
2s22p3
3s23p3
4s24p3
5s25p3
6s26p3
2s22p4
3s23p4
4s24p4
5s25p4
6s26p4
2s22p5
3s23p5
4s24p5
5s25p5
6s26p5
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
1s2
3d14s2
4d15s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
4d55s1
5d26s2
镧系
5d66s2
4d75s1
5d76s2
4d85s1
5d96s1
4d10
5d106s1
4d105s1
4d105s2
5d106s2
6d27s2
锕系
5d46s2
4d55s2
4d45s1
4d25s2
5d36s2
5d56s2
6d37s2
镧系
锕系
5d16s2
6d17s2
4f15d16s2
4f46s2
4f36s2
4f56s2
4f76s2
4f66s2
4f75d16s2
4f106s2
4f96s2
4f146s2
4f136s2
4f126s2
4f116s2
4f145d16s2
6d27s2
4f25d16s2
4f35d16s2
6d77s2
6d67s2
4f75d16s2
6d97s2
6d117s2
6d127s2
6d137s2
6d147s2
6d107s2
4f45d16s2
4f145d16s2
IA
IIA
VA
IVA
IIIA
IIB
IB
VIII
IVB
IIIB
VB
VIB
VIIB
VIIA
VIA
0
半金属或类金属
过渡元素
构造原理与元素周期表
某些主族元素与右下方的主族元素的某些性质是相似的,这种相似性称之为对角线规则。
2Al+6HCl = 2AlCl3+3H2↑
Be+2HCl = BeCl2+H2↑
2Al+2NaOH+2H2O = 2NaAlO2+3H2↑
Be+2NaOH = Na2BeO2+H2↑
Al2O3+6HCl = 2AlCl3+3H2O
BeO+2HCl = BeCl2+H2O
Al2O3+2NaOH = 2NaAlO2+H2O
Be(OH)2+2NaOH=Na2BeO2+ 2H2O
Al(OH)3+NaOH=NaAlO2+ 2H2O
Al(OH)3+3HCl = AlCl3+3H2O
Be(OH)2+2HCl = BeCl2+2H2O
BeO+2NaOH = Na2BeO2+H2O
构造原理与元素周期表
(1) 横行原则:把 相同的元素,按 的顺序从左到右排列。
(2) 纵行原则:把不同横行中 相同的元素,按 的顺序由上而下排列。
(3) 原子序数:按照元素 给元素编的序号。
(4) 原子序数与元素的原子结构之间的关系:
原子序数= = = 。
电子层数目
在周期表中的顺序
最外层电子数
核电荷数
原子序数递增
质子数
电子层数递增
核外电子数
元素周期表的编排原则
课堂练习
1.原子序数为83的元素位于:①第五周期;②第六周期;③ⅣA族;④ⅤA族;⑤ⅡB族,其中正确的组合是( )
A.①④ B.②③ C.②④ D.①⑤
C
课堂练习
2.下列关于原子核外电子排布与元素在周期表中位置关系的叙述中,正确的是( )
A. 原子价电子排布为ns2np1~6的元素一定是主族元素
B. 基态原子最外电子层的p能级上有5个电子的元素一定是第ⅦA族元素
C. 原子的价电子排布为(n-1)d6~8ns2的元素一定位于第ⅢB~ⅦB族
D. 基态原子N能层上只有1个电子的元素一定是主族元素
B
课堂练习
3.下列说法中正确的是( )
A. 所有金属元素都分布在d区和ds区
B. 原子最外层电子数为2的元素都分布在s区
C. 元素周期表中ⅢB族到ⅡB族10个纵列的元素都是金属元素
D. s区均为金属元素
C
课堂练习
4.已知某元素基态原子的价电子排布为(n-1)dansb(a、b均为大于0的正整数),下列有关说法正确的是( )
A. 该元素一定位于元素周期表中的d区
B. 该元素一定位于元素周期表中的ds区
C. 该元素的族序数为a+b
D. 该元素一定为金属元素
A
课堂练习
5.元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的外围电子排布式为nsn-1npn+1,则下列说法不正确的是 ( )
A. Y元素原子的价层电子排布式为4s24p4
B. Y元素在元素周期表的第三周期第ⅥA族
C. X元素所在周期中所含非金属元素种数最多
D. Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
A
