化学人教版(2019)选择性必修2 第一章第二节第3课时元素周期律2(25张)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 第一章第二节第3课时元素周期律2(25张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 00:00:00 | ||
图片预览


文档简介
(共25张PPT)
人教版 选择性必修2
第一章 第二节 第3课时
原子结构与元素的性质
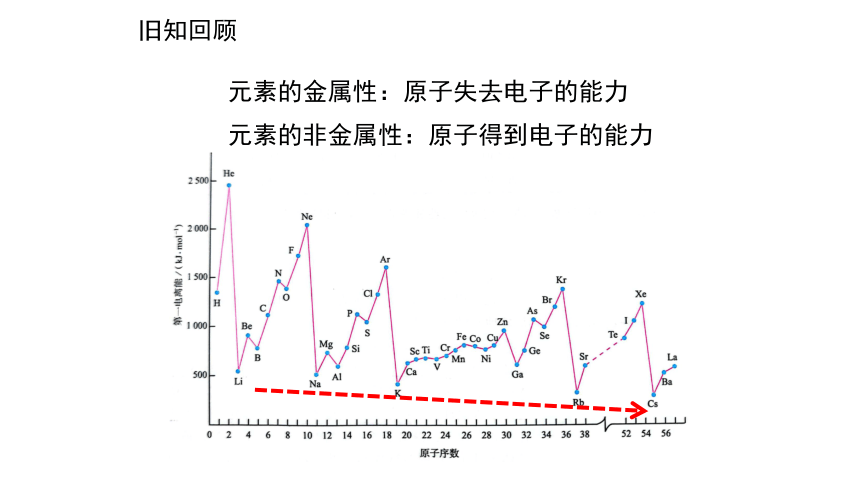
元素的金属性:原子失去电子的能力
旧知回顾
元素的非金属性:原子得到电子的能力
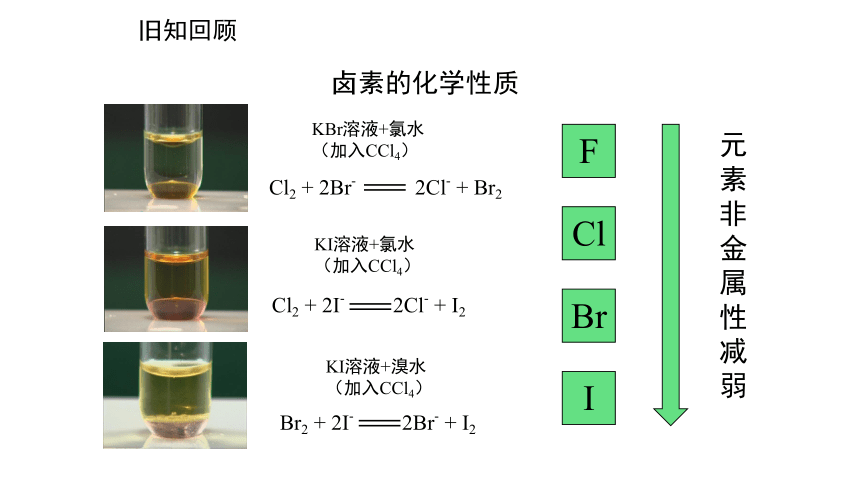
KBr溶液+氯水
(加入CCl4)
Cl2 + 2Br- 2Cl- + Br2
KI溶液+氯水
(加入CCl4)
Cl2 + 2I- 2Cl- + I2
KI溶液+溴水
(加入CCl4)
Br2 + 2I- 2Br- + I2
卤素的化学性质
F
Cl
Br
I
元素非金属性减弱
旧知回顾
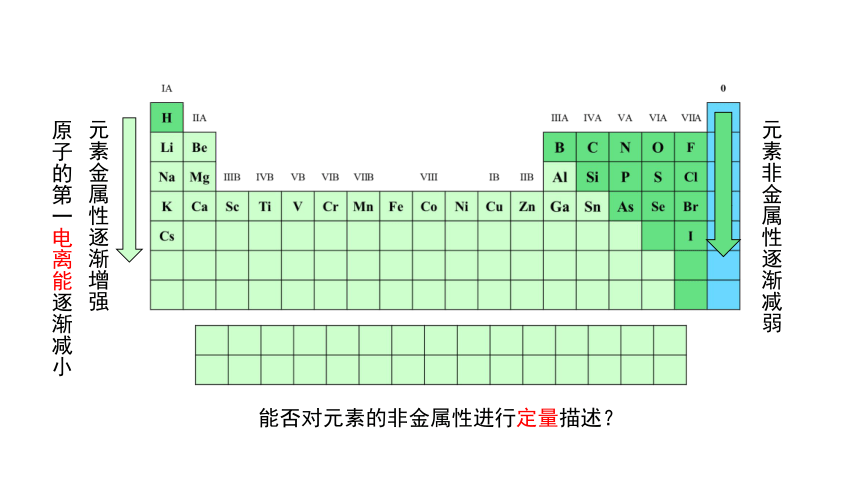
元素金属性逐渐增强
原子的第一电离能逐渐减小
元素非金属性逐渐减弱
能否对元素的非金属性进行定量描述?
电负性越大的原子,对键合电子的吸引力越大
鲍林
描述不同元素的原子对键合电子吸引力的大小
键合电子
原子中用于形成化学键的电子
电负性
键合电子
电负性
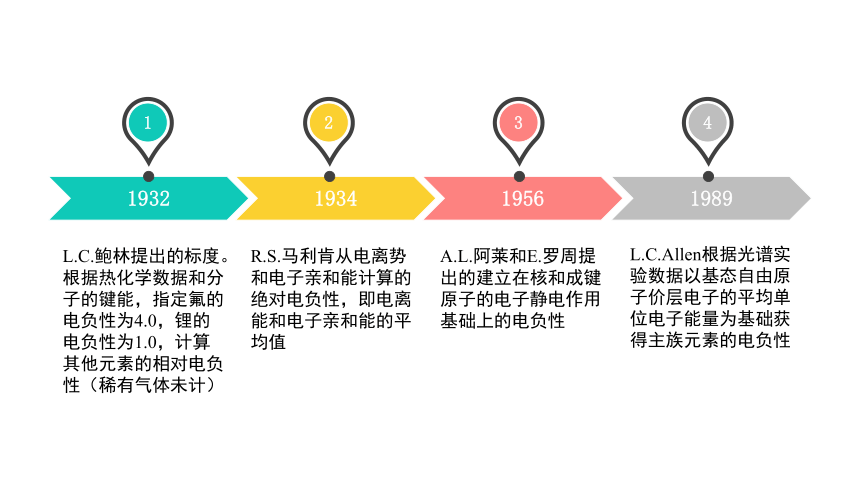
1932
1934
1956
1989
1
2
3
4
L.C.Allen根据光谱实验数据以基态自由原子价层电子的平均单位电子能量为基础获得主族元素的电负性
A.L.阿莱和E.罗周提出的建立在核和成键原子的电子静电作用基础上的电负性
R.S.马利肯从电离势和电子亲和能计算的绝对电负性,即电离能和电子亲和能的平均值
L.C.鲍林提出的标度。根据热化学数据和分子的键能,指定氟的电负性为4.0,锂的电负性为1.0,计算其他元素的相对电负性(稀有气体未计)
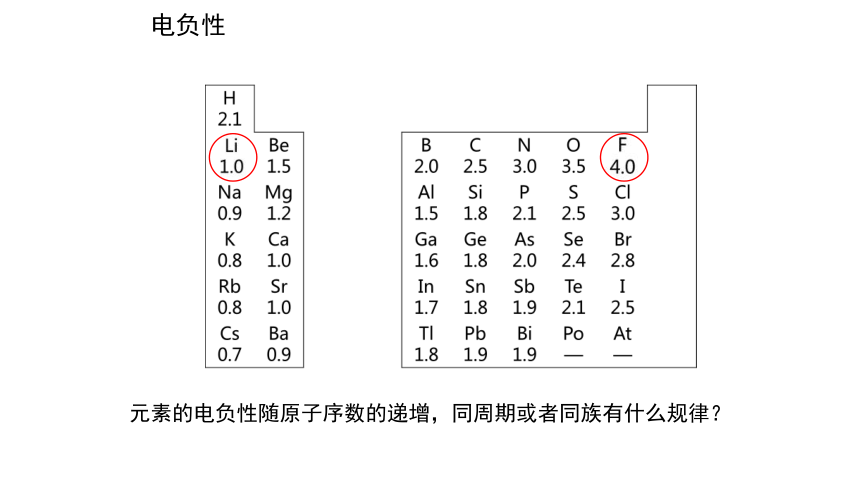
元素的电负性随原子序数的递增,同周期或者同族有什么规律?
电负性
第二周期
第三周期
第四周期
电负性
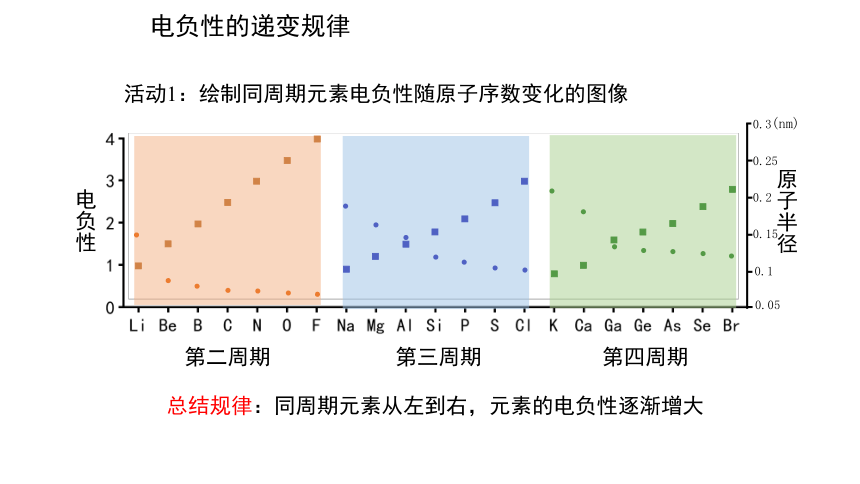
电负性的递变规律
活动1:绘制同周期元素电负性随原子序数变化的图像
总结规律:同周期元素从左到右,元素的电负性逐渐增大
原子半径
0.05
0.1
0.15
0.2
0.25
0.3
(nm)
电负性
第IA族
第VIA族
第VIIA族
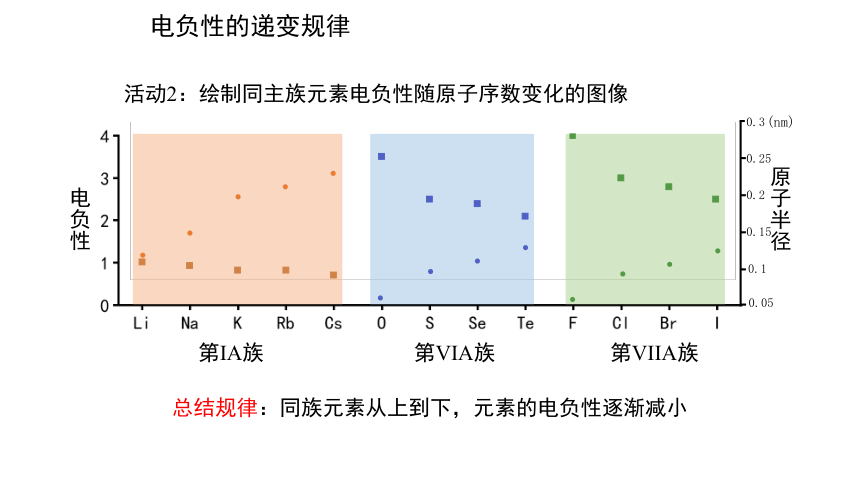
活动2:绘制同主族元素电负性随原子序数变化的图像
电负性的递变规律
总结规律:同族元素从上到下,元素的电负性逐渐减小
原子半径
0.05
0.1
0.15
0.2
0.25
0.3
(nm)
电负性
电负性呈现周期性递变
电负性
不同元素的原子对键合电子吸引力的大小
电负性的应用1:判断元素的金属性与非金属性
电负性 > 1.8 非金属元素
电负性 < 1.8 金属元素
电负性 ≈ 1.8 类金属元素
成键原子之间的电负性差值可作化学键类型的判断依据
电负性的应用2: 判断化学键的类型
Na
.
.
.
.
.
.
Cl
.
+
.
.
.
.
.
Cl
.
.
Na+
-
电负性差 2.1
电负性的差值较大 离子键
H
.
.
.
.
.
.
O
+
.
.
.
.
.
O
.
H
电负性差 0.4
+
H
H
电负性的差值较小 共价键
电负性的应用2: 判断化学键的类型
H
Cl
-1
+1
显负价
显正价
电负性的应用3:判断元素化合价的正负
H
C
H
H
H
H
Si
H
H
H
活动3 判断甲烷和甲硅烷中各元素的化合价的正负
SiH4
+4
-1
CH4
-4
+1
H
C
C
H
H
H
H
H
电负性的应用3:判断元素化合价的正负
活动3 判断乙烷中各元素的化合价
CH3CH3
-3
+1
-3
+1
原子半径/电离能/电负性呈现周期性的递变
总结
电负性
电离能
原子半径
大
大
小
小
大
小
大
小
电负性
不同元素的原子对键合电子吸引力的大小
概念:
应用:
金属性与非金属性/化学键类型/元素化合价
He
科学史话
Ne
Ar
Kr
Xe
Og
1868年
1898年
1892年
1898年
1898年
2006年
稀有气体发现史
稀有气体化学性质是惰性的吗?
Rn
1923年
课堂练习
下列元素电负性随原子序数的递增而增强的是
Na、K、Rb
N、P、As
O、S、Cl
Si、P、Cl
2. 下列关于电负性的叙述不正确的是
电负性越大的主族元素,其原子的第一电离能越大
电负性是以氟为 4.0 作为标准的相对值
元素的电负性越大,元素的非金属性越强
同一周期元素从左到右,电负性逐渐变大
课堂练习
3. 下列判断正确的是
第一电离能:B>Al>Ga
电负性:F>N>O
最高正化合价:F>S>Si
原子半径:P>N>C
课堂练习
4. A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:①原子半径AB, ③原子序数A>B, ④原子最外层电子数AB,其中正确的是
① ② ⑥
③ ④ ⑤
③ ⑥
③ ④ ⑤ ⑥
课堂练习
5. 已知元素的电负性和原子半径一样,也是元素的一种基本性质。下面给出了14 种元素的电负性:
课堂练习
元素 Al B Be C Cl F Li
电负性 1.5 2.0 1.5 2.5 3.0 4.0 1.0
元素 Mg N Na O P S Si
电负性 1.2 3.0 0.9 3.5 2.1 2.5 1.8
试结合元素周期律知识,回答下列问题:
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是 。
(2)由上述变化规律可推知,短周期主族元素中,电负性最大的元素是 ,
电负性最小的元素是 ,由这两种元素构成的化合物属于 (填“离子”或“共价”)化合物
课堂练习
6.W、X、Y、Z四种短周期元素的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,Y单质的化学性质活泼。Z不能形成双原子分子。根据以上叙述,下列说中正确的是
A. 上述四种元素中第一电离能最大的是Y
B. W、X、Y、Z原子的核外最外层电子数的总和为20
C. W与Y可形成既含极性共价键又含非极性共价键的化合物
D. 由W与X组成的化合物的沸点一定低于由W与Y组成的化合物的沸点
7. 现有四种元素的基态原子的电子排布式如下:①ls22s22p63s23p4;②1s2 2s2 2p6 3s2 3p3;③1s2 2s2 2p3;④1s2 2s2 2p5。则下列有关比较中正确的是
A. 第一电离能:④>③>②>①
B. 原子半径:④>③>②>①
C. 电负性:④>③>②>①
D. 最高正化合价:④>①>③=②
课堂练习
课堂练习
参考答案:
D 2. A 3. A 4. B
5. (1)元素的电负性随着原子序数的递增呈周期性的变化(或同周期主族元素,从左到右,电负性逐渐增大)
(2) F Na 离子
6.C
7.A
人教版 选择性必修2
第一章 第二节 第3课时
原子结构与元素的性质
元素的金属性:原子失去电子的能力
旧知回顾
元素的非金属性:原子得到电子的能力
KBr溶液+氯水
(加入CCl4)
Cl2 + 2Br- 2Cl- + Br2
KI溶液+氯水
(加入CCl4)
Cl2 + 2I- 2Cl- + I2
KI溶液+溴水
(加入CCl4)
Br2 + 2I- 2Br- + I2
卤素的化学性质
F
Cl
Br
I
元素非金属性减弱
旧知回顾
元素金属性逐渐增强
原子的第一电离能逐渐减小
元素非金属性逐渐减弱
能否对元素的非金属性进行定量描述?
电负性越大的原子,对键合电子的吸引力越大
鲍林
描述不同元素的原子对键合电子吸引力的大小
键合电子
原子中用于形成化学键的电子
电负性
键合电子
电负性
1932
1934
1956
1989
1
2
3
4
L.C.Allen根据光谱实验数据以基态自由原子价层电子的平均单位电子能量为基础获得主族元素的电负性
A.L.阿莱和E.罗周提出的建立在核和成键原子的电子静电作用基础上的电负性
R.S.马利肯从电离势和电子亲和能计算的绝对电负性,即电离能和电子亲和能的平均值
L.C.鲍林提出的标度。根据热化学数据和分子的键能,指定氟的电负性为4.0,锂的电负性为1.0,计算其他元素的相对电负性(稀有气体未计)
元素的电负性随原子序数的递增,同周期或者同族有什么规律?
电负性
第二周期
第三周期
第四周期
电负性
电负性的递变规律
活动1:绘制同周期元素电负性随原子序数变化的图像
总结规律:同周期元素从左到右,元素的电负性逐渐增大
原子半径
0.05
0.1
0.15
0.2
0.25
0.3
(nm)
电负性
第IA族
第VIA族
第VIIA族
活动2:绘制同主族元素电负性随原子序数变化的图像
电负性的递变规律
总结规律:同族元素从上到下,元素的电负性逐渐减小
原子半径
0.05
0.1
0.15
0.2
0.25
0.3
(nm)
电负性
电负性呈现周期性递变
电负性
不同元素的原子对键合电子吸引力的大小
电负性的应用1:判断元素的金属性与非金属性
电负性 > 1.8 非金属元素
电负性 < 1.8 金属元素
电负性 ≈ 1.8 类金属元素
成键原子之间的电负性差值可作化学键类型的判断依据
电负性的应用2: 判断化学键的类型
Na
.
.
.
.
.
.
Cl
.
+
.
.
.
.
.
Cl
.
.
Na+
-
电负性差 2.1
电负性的差值较大 离子键
H
.
.
.
.
.
.
O
+
.
.
.
.
.
O
.
H
电负性差 0.4
+
H
H
电负性的差值较小 共价键
电负性的应用2: 判断化学键的类型
H
Cl
-1
+1
显负价
显正价
电负性的应用3:判断元素化合价的正负
H
C
H
H
H
H
Si
H
H
H
活动3 判断甲烷和甲硅烷中各元素的化合价的正负
SiH4
+4
-1
CH4
-4
+1
H
C
C
H
H
H
H
H
电负性的应用3:判断元素化合价的正负
活动3 判断乙烷中各元素的化合价
CH3CH3
-3
+1
-3
+1
原子半径/电离能/电负性呈现周期性的递变
总结
电负性
电离能
原子半径
大
大
小
小
大
小
大
小
电负性
不同元素的原子对键合电子吸引力的大小
概念:
应用:
金属性与非金属性/化学键类型/元素化合价
He
科学史话
Ne
Ar
Kr
Xe
Og
1868年
1898年
1892年
1898年
1898年
2006年
稀有气体发现史
稀有气体化学性质是惰性的吗?
Rn
1923年
课堂练习
下列元素电负性随原子序数的递增而增强的是
Na、K、Rb
N、P、As
O、S、Cl
Si、P、Cl
2. 下列关于电负性的叙述不正确的是
电负性越大的主族元素,其原子的第一电离能越大
电负性是以氟为 4.0 作为标准的相对值
元素的电负性越大,元素的非金属性越强
同一周期元素从左到右,电负性逐渐变大
课堂练习
3. 下列判断正确的是
第一电离能:B>Al>Ga
电负性:F>N>O
最高正化合价:F>S>Si
原子半径:P>N>C
课堂练习
4. A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:①原子半径A
① ② ⑥
③ ④ ⑤
③ ⑥
③ ④ ⑤ ⑥
课堂练习
5. 已知元素的电负性和原子半径一样,也是元素的一种基本性质。下面给出了14 种元素的电负性:
课堂练习
元素 Al B Be C Cl F Li
电负性 1.5 2.0 1.5 2.5 3.0 4.0 1.0
元素 Mg N Na O P S Si
电负性 1.2 3.0 0.9 3.5 2.1 2.5 1.8
试结合元素周期律知识,回答下列问题:
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是 。
(2)由上述变化规律可推知,短周期主族元素中,电负性最大的元素是 ,
电负性最小的元素是 ,由这两种元素构成的化合物属于 (填“离子”或“共价”)化合物
课堂练习
6.W、X、Y、Z四种短周期元素的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,Y单质的化学性质活泼。Z不能形成双原子分子。根据以上叙述,下列说中正确的是
A. 上述四种元素中第一电离能最大的是Y
B. W、X、Y、Z原子的核外最外层电子数的总和为20
C. W与Y可形成既含极性共价键又含非极性共价键的化合物
D. 由W与X组成的化合物的沸点一定低于由W与Y组成的化合物的沸点
7. 现有四种元素的基态原子的电子排布式如下:①ls22s22p63s23p4;②1s2 2s2 2p6 3s2 3p3;③1s2 2s2 2p3;④1s2 2s2 2p5。则下列有关比较中正确的是
A. 第一电离能:④>③>②>①
B. 原子半径:④>③>②>①
C. 电负性:④>③>②>①
D. 最高正化合价:④>①>③=②
课堂练习
课堂练习
参考答案:
D 2. A 3. A 4. B
5. (1)元素的电负性随着原子序数的递增呈周期性的变化(或同周期主族元素,从左到右,电负性逐渐增大)
(2) F Na 离子
6.C
7.A
