化学人教版(2019)选择性必修2 第一章第一节第1课时能层与能级基态与激发态原子光谱(26张)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 第一章第一节第1课时能层与能级基态与激发态原子光谱(26张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 09:35:47 | ||
图片预览







文档简介
(共26张PPT)
人教版 选择性必修2(2019)
第一章 原子结构与性质
第一节 原子结构
——课时1 能层与能级 原子光谱
绚丽多彩的烟花
焰色试验:
某些金属及其化合物在无色火焰中灼烧使火焰呈现特征颜色,据此判断试样所含金属元素,化学上把这种定性分析操作称为焰色试验。
问题导入
1、关于原子,我们知道多少呢?
原子:
化学反应的实质:
是组成分子的原子间的重新组合。
原子结构:
原子
原子核
核外电子(-) Z
质子(+) Z
中子(不带电) A-Z
是化学变化中最小的粒子
2、那么,构成原子的粒子,它们的相对空间位置和大小关系如何呢?
问题导入
目 录
能层与能级
基态与激发态
原子光谱
01、
02、
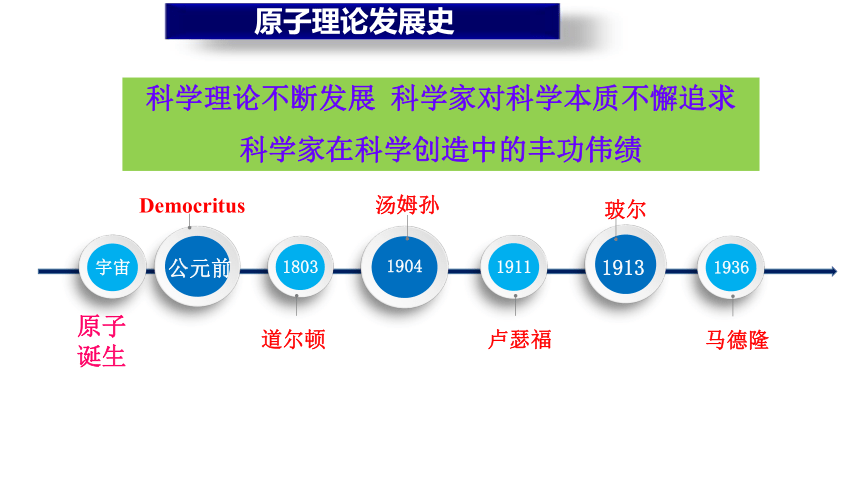
原子理论发展史
公元前
1803
1904
1911
1913
汤姆孙
玻尔
道尔顿
卢瑟福
宇宙爆炸理论
原子诞生
Democritus
1936
马德隆
原子光谱构造原理
原子理论发展史
公元前
1803
1904
1911
1913
汤姆孙
玻尔
道尔顿
卢瑟福
原子诞生
宇宙
Democritus
1936
马德隆
科学理论不断发展 科学家对科学本质不懈追求
科学家在科学创造中的丰功伟绩
1、划分依据:
2、能层序数:
3、符号表示:
4、能量关系:
能层
核外电子按能量不同分成能层,
分别1、2、3、4、5、6、7
分别用K、L、M、N、O、P、Q
能层越高,电子的能量越高,能量的高低顺序为E(K)3、那么,同一能层中电子的能量是否就相同的呢?
问题引入
能级
任一能层的能级总是从s能级开始,按s、p、d、f……排序,
1、划分依据:
2、种类代号:
3、表示方法:
4、能量关系:
5、最大容量:
同一能层,又按能量被分成不同能级。
s、p、d、f中每类能级最多可容纳的电子数依次为自然数1、3、5、7……的2倍。
同能层不同能级的能量顺序:E(ns)能层序号+能级代号,1s、2s、2p、3d、4f……
能级
各能层、能级中最多容纳的电子数
能层 一 二 三 四 五 …
K L M N O …
能级 2s 2p 3s 3p 3d 4d 4f 5s 5p … …
最多 电子 数 2 2 2 6 2 6 2 6 … …
…… …
1s
4s
4p
6
10
10
14
2
8
18
32
小结1
原子核外电子排布特点:
核外电子按照能量不同分不同的能层和能级。
每个能层最多能容纳2n2个电子
能层 一 二 三 四 五
符号 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 5..
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 10 14 18
最多 电子数2n2 2 8 18 32 50
1.下列能级符号表示正确的组合是( )
①5s ②2d ③3f ④6p
A.①④ B.②③ C.③④ D.①②
A
课堂练习
2.下列各能层不包含d能级的是( )
A.N B.M C.Q D.K
D
4、那么,电子的能量和所在能级是否就一成不变的呢?
问题引入
基态与激发态
原子光谱
基态原子与激发态原子
处于最低能量状态的原子叫做基态原子。
基态原子吸收能量,它的电子会跃迁到较高能级,变为激发态原子。相反.....
1、定义
基 态 原 子:
激发态原子:
2、关系
基态原子
吸收能量
激发态原子
释放能量
5、我们知道,化学反应中的能量变化通常以热、光的形式呈现,那么,电子发生跃迁时能量变化又以什么形式呈现呢?
问题引入
原子光谱与光谱分析
不同元素的原子,电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各元素原子的吸收光谱或发射光谱,总称原子光谱。
霓虹灯
发射光谱(高跃到低)
吸收光谱(低跃到高)
1、原子光谱
定 义:
成 因:
获取方法:
类 型:
生活实例:
光(辐射)是电子跃迁能量变化的重要形式。
现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。焰色试验。
激发态
基态
2、光谱分析
定义:
应用:
灼
烧
焰色试验
发射光谱
课堂小结
3.下列有关电子层的说法不正确的是( )
A.在量子力学理论中,用量子数n来描述电子离核的远近,称为能层(电子层)
B.n的取值为正整数1、2、3、4、5、6等,对应的符号分别为K、L、M、N、O、P等
C.n越大表示该电子层上的电子离核的平均距离越远、能量越高
D.当n相同时,电子所具有的能量也一定相同
课堂练习
D
4. 已知n为能层序数,下列有关认识正确的是( )
A.各能层含有的电子数为2n2
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能级最多容纳的电子数按s、p、d、f......的顺序依次为自然数1、3、5、7......的2倍
课堂练习
D
课堂练习
(1)< (2)< (3)> (4)> (5) < <
原子理论发展史
丹麦物理学家--玻尔
波尔原子模型(1913年)
电子在原子核外空间的一定轨道上绕核做圆周运动,且不辐射能量
不同轨道上的电子能量不同,且能量不连续的(能量的“量子化”)
氢原子光谱图
谢谢聆听
人教版 选择性必修2(2019)
第一章 原子结构与性质
第一节 原子结构
——课时1 能层与能级 原子光谱
绚丽多彩的烟花
焰色试验:
某些金属及其化合物在无色火焰中灼烧使火焰呈现特征颜色,据此判断试样所含金属元素,化学上把这种定性分析操作称为焰色试验。
问题导入
1、关于原子,我们知道多少呢?
原子:
化学反应的实质:
是组成分子的原子间的重新组合。
原子结构:
原子
原子核
核外电子(-) Z
质子(+) Z
中子(不带电) A-Z
是化学变化中最小的粒子
2、那么,构成原子的粒子,它们的相对空间位置和大小关系如何呢?
问题导入
目 录
能层与能级
基态与激发态
原子光谱
01、
02、
原子理论发展史
公元前
1803
1904
1911
1913
汤姆孙
玻尔
道尔顿
卢瑟福
宇宙爆炸理论
原子诞生
Democritus
1936
马德隆
原子光谱构造原理
原子理论发展史
公元前
1803
1904
1911
1913
汤姆孙
玻尔
道尔顿
卢瑟福
原子诞生
宇宙
Democritus
1936
马德隆
科学理论不断发展 科学家对科学本质不懈追求
科学家在科学创造中的丰功伟绩
1、划分依据:
2、能层序数:
3、符号表示:
4、能量关系:
能层
核外电子按能量不同分成能层,
分别1、2、3、4、5、6、7
分别用K、L、M、N、O、P、Q
能层越高,电子的能量越高,能量的高低顺序为E(K)
问题引入
能级
任一能层的能级总是从s能级开始,按s、p、d、f……排序,
1、划分依据:
2、种类代号:
3、表示方法:
4、能量关系:
5、最大容量:
同一能层,又按能量被分成不同能级。
s、p、d、f中每类能级最多可容纳的电子数依次为自然数1、3、5、7……的2倍。
同能层不同能级的能量顺序:E(ns)
能级
各能层、能级中最多容纳的电子数
能层 一 二 三 四 五 …
K L M N O …
能级 2s 2p 3s 3p 3d 4d 4f 5s 5p … …
最多 电子 数 2 2 2 6 2 6 2 6 … …
…… …
1s
4s
4p
6
10
10
14
2
8
18
32
小结1
原子核外电子排布特点:
核外电子按照能量不同分不同的能层和能级。
每个能层最多能容纳2n2个电子
能层 一 二 三 四 五
符号 K L M N O
能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 5..
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 10 14 18
最多 电子数2n2 2 8 18 32 50
1.下列能级符号表示正确的组合是( )
①5s ②2d ③3f ④6p
A.①④ B.②③ C.③④ D.①②
A
课堂练习
2.下列各能层不包含d能级的是( )
A.N B.M C.Q D.K
D
4、那么,电子的能量和所在能级是否就一成不变的呢?
问题引入
基态与激发态
原子光谱
基态原子与激发态原子
处于最低能量状态的原子叫做基态原子。
基态原子吸收能量,它的电子会跃迁到较高能级,变为激发态原子。相反.....
1、定义
基 态 原 子:
激发态原子:
2、关系
基态原子
吸收能量
激发态原子
释放能量
5、我们知道,化学反应中的能量变化通常以热、光的形式呈现,那么,电子发生跃迁时能量变化又以什么形式呈现呢?
问题引入
原子光谱与光谱分析
不同元素的原子,电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各元素原子的吸收光谱或发射光谱,总称原子光谱。
霓虹灯
发射光谱(高跃到低)
吸收光谱(低跃到高)
1、原子光谱
定 义:
成 因:
获取方法:
类 型:
生活实例:
光(辐射)是电子跃迁能量变化的重要形式。
现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。焰色试验。
激发态
基态
2、光谱分析
定义:
应用:
灼
烧
焰色试验
发射光谱
课堂小结
3.下列有关电子层的说法不正确的是( )
A.在量子力学理论中,用量子数n来描述电子离核的远近,称为能层(电子层)
B.n的取值为正整数1、2、3、4、5、6等,对应的符号分别为K、L、M、N、O、P等
C.n越大表示该电子层上的电子离核的平均距离越远、能量越高
D.当n相同时,电子所具有的能量也一定相同
课堂练习
D
4. 已知n为能层序数,下列有关认识正确的是( )
A.各能层含有的电子数为2n2
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n-1
D.各能级最多容纳的电子数按s、p、d、f......的顺序依次为自然数1、3、5、7......的2倍
课堂练习
D
课堂练习
(1)< (2)< (3)> (4)> (5) < <
原子理论发展史
丹麦物理学家--玻尔
波尔原子模型(1913年)
电子在原子核外空间的一定轨道上绕核做圆周运动,且不辐射能量
不同轨道上的电子能量不同,且能量不连续的(能量的“量子化”)
氢原子光谱图
谢谢聆听
