化学人教版(2019)选择性必修2 第一章第一节 第一课时 能层与能级、基态与激发态、原子光谱(共28张PPT)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 第一章第一节 第一课时 能层与能级、基态与激发态、原子光谱(共28张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 09:39:43 | ||
图片预览





文档简介
(共28张PPT)
第一节 原子结构
第一章 原子结构和性质
第一课时
能层与能级、基态与激发态、原子光谱
学习目标
1.了解原子的认知历史和科学史观。
2.理解能层与能级的概念及其区别,能从能层能级的角度了解原子结构特点。
3.了解原子的基态和激发态。了解原子光谱,能说明原子光谱在研究物质结构中的作用。
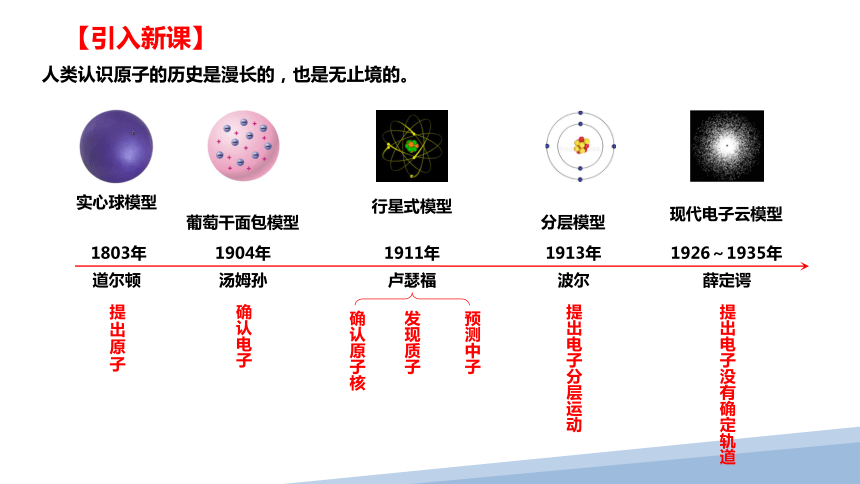
1803年
道尔顿
1904年
1911年
1913年
1926~1935年
汤姆孙
卢瑟福
波尔
薛定谔
提出原子
确认电子
实心球模型
葡萄干面包模型
行星式模型
分层模型
现代电子云模型
提出电子分层运动
提出电子没有确定轨道
确认原子核
发现质子
预测中子
人类认识原子的历史是漫长的,也是无止境的。
【引入新课】
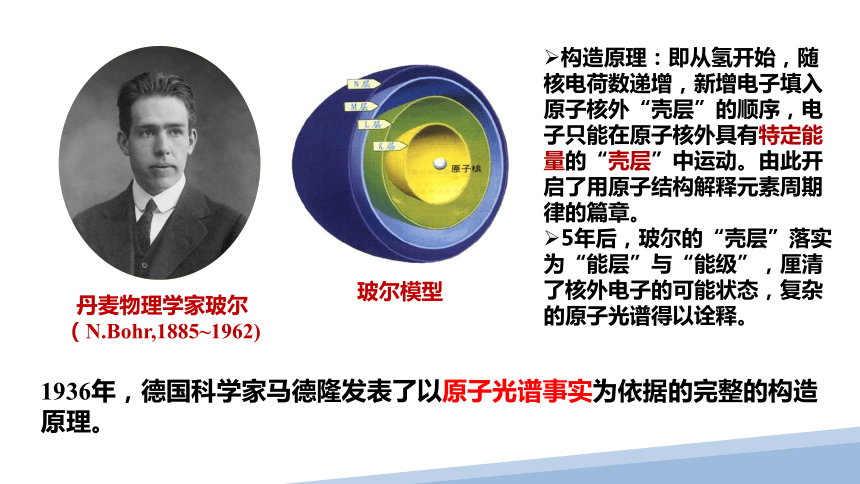
丹麦物理学家玻尔
(N.Bohr,1885~1962)
玻尔模型
构造原理:即从氢开始,随核电荷数递增,新增电子填入原子核外“壳层”的顺序,电子只能在原子核外具有特定能量的“壳层”中运动。由此开启了用原子结构解释元素周期律的篇章。
5年后,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子的可能状态,复杂的原子光谱得以诠释。
1936年,德国科学家马德隆发表了以原子光谱事实为依据的完整的构造原理。
【知识回顾】
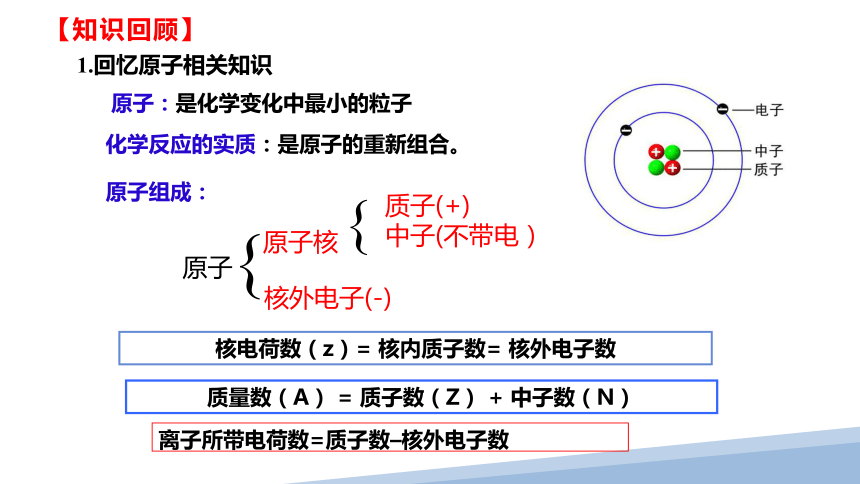
原子:是化学变化中最小的粒子
化学反应的实质:是原子的重新组合。
原子组成:
原子
原子核
核外电子(-)
质子(+)
中子(不带电)
核电荷数(z)= 核内质子数= 核外电子数
质量数(A) = 质子数(Z) + 中子数(N)
离子所带电荷数=质子数–核外电子数
1.回忆原子相关知识
3.核外电子运动特点和排布规律是什么?
核外电子是_______排布的;
离核较近的电子,能量_______;
离核较远的电子,能量_______。
分层
较低
较高
【知识回顾】
2.请画出1~18号元素的原子原子结构示意图。
(1)原子核外电子总是尽先由里向外(能量由低到高)排列。
(2)第n层最多能最多容纳2n2个电子。
(4)次外层最多能容纳18个电子,倒数第三层最多容纳32个电子。
(3)最外层最多容纳8个电子(K层为最外层时最多容纳2个)。
核外电子排布规律
一、能层与能级
1.能层
(1)概念:
多电子原子的核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。
电子层
能层
能层越高,电子的能量越高
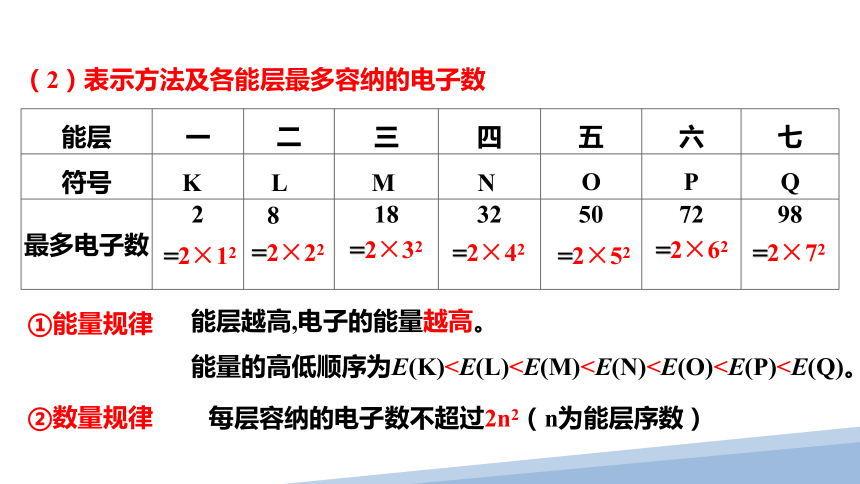
(2)表示方法及各能层最多容纳的电子数
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多电子数 2 8 18 32 50 72 98
能层越高,电子的能量越高。
能量的高低顺序为E(K)①能量规律
②数量规律
每层容纳的电子数不超过2n2(n为能层序数)
=2×12
=2×22
=2×32
=2×42
=2×52
=2×62
=2×72
2.能级
在多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成不同的能级。
(1)概念:
(2)表示方法
分别用相应能层的序数和字母 s、p、d、f 等表示,如n能层的能级按能量由低到高的顺序为E(ns)能层 K L M N O 能级 …
最多容纳电子 …
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
5p
2
2
6
2
6
10
2
6
14
10
2
6
2
8
18
32
2n2
s能级最多容纳的电子数为2
p能级最多容纳的电子数为6
d能级最多容纳的电子数为10
f能级最多容纳的电子数为14
即:以s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的二倍
(3)能层、能级与容纳的最多电子数
① 每一能层最多可容纳的电子数为______( 为能层序数)。
② 在每一个能层中,能级符号的顺序是_______________ ( 为能层序数)。
③ 任一能层的能级总是从 能级开始,而且能级数等于该___________,即第一能层只有1个能级____,第二能层有2个能级_________,第三能层有3个能级____________,依次类推。
能层序数
④ 以 、 、 、 排序的各能级可容纳的最多电子数依次为______________的2倍。
⑤ 英文字母相同的不同能级中所能容纳的最多电子数相同。例如, 、 、 、 能级最多都只能容纳____个电子。
2
小结:规律及注意事项
2n2
ns、np、nd、nf
2s、2p
3s、3p和3d
1s
1、3、5、7
⑥在相同能层各能级能量由低到高的顺序是_____________________________。不同能层中同一能级,能层数越大,能量越高。例如:______________________________
E(ns)E(1s)能层中的能级数=能层序数
能层最多容纳电子数=2n2
2、6、10、14
相同
能 级 5s 5p 5d 5f 5 总数
最多电子数
50
2 6 10 14 18 50
课本P7:思考与讨论
1.一个能层的能级与能层序数(n)间存在什么关系?一个能层最多可容纳的电子数与能层序数(n)间存在什么关系
2.以s、p、d、f、为符号的能级分别最多可容纳多少电子?3d、4d、5d能级所能容纳的最多电子数是否相同?
3.第五能层最多可容纳多少电子?它们分别容纳在几个能级中?各能级最多容纳多少个电子?(注:高于f的能级不用符号表示。)
②各能级(s、p、d、f ……)上所能容纳的电子数依次为1、3、 5 、7…… 的2倍。( )
①原子核外电子按能量不同分为不同的能层,同一能层又按能量不同分为不同的能级。( )
√
③能层离核越近能量越低。( )
④同一能层的电子能量一定相同。( )
×
⑤同一原子中,同一能层同一能级的电子能量一定相同。( )
⑥第 能层最多能容纳的电子数为 ,所以钠原子的第三能层填有18个电子( )
课堂练习1、判断正误
√
√
×
√
课堂练习2、下列说法正确的是 ( )
A.原子核外的每个能层最多可容纳的电子数为n2
B.任一能层的能级总是从s能级开始,而且能级数等于该能层序数C.同是s能级,在不同的能层中最多容纳的电子数是不相同的
D.不同能层中含有的能级数相同
B
课堂练习3、下列能级符号书写错误 的是( @45@ )。
A. B. C. D.
B
二、基态与激发态 原子光谱
2.激发态:基态原子 能量,它的电子会跃迁到 能级,变成激发态原子。
K
L
M
基态氢原子
1.基态:处于 状态的原子。
最低能量
K
L
M
激发态氢原子
吸收
较高
稳定
不稳定
吸收能量
电子跃迁
能量
K
L
M
激发态氢原子
K
L
M
基态氢原子
不稳定
稳定
释放能量
电子跃迁
光能
二、基态与激发态
光(辐射)是电子跃迁释放能量的重要形式。
一些生活中的光现象
霓虹灯
激光
霓虹灯管中装载的气体不同,在高压的激发下发出的光的颜色就不同。
基态Ne原子
激发态Ne原子
在电场的作用下
电子跃迁到较高能级
很快又会以光的形式释放能量
跃迁到较低能级
光的波长恰好位于可见光区域中的红色波段,所以看见红色光。
不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
稀有气体的不同颜色
请同学们解释钾与钠产生焰色及焰色不同的原因。
【思考与讨论】
当碱金属及化合物在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但是处于能量较高的的轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式释放,而释放的光的波长在可见光范围内,因而能使火焰呈现颜色。
钾和钠的原子结构不同,电子跃迁时能量的变化不同,则放出的光的波长不同,所以产生焰色也就不同。
3.原子光谱
不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称为原子光谱。
(1)概念:
基态原子
激发态原子
吸收能量
释放能量
形成吸收光谱
形成发射光谱
电子跃迁
特征:暗背景,彩色亮线,线状不连续
特征:亮背景,暗线,线状不连续
发射光谱
吸收光谱
Li
He
Hg
同种元素发射光谱中的彩色亮线与吸收光谱中的暗线处于相同位置。
某些波长的光被释放
来源于光源
某些波长的光被吸收
(2)发射光谱与吸收光谱对比
现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
(3)光谱分析
氢原子光谱测定示意图和氢原子的光谱图
科学史话
1814年,德国物理学家夫琅禾费发明了分光镜并用来观察太阳光,发现在太阳光谱中有570多条黑线(现知几千条),后人称之为夫琅禾费线。
1859年,德国科学家本生 和基尔霍夫发明了光谱仪,证实了夫琅禾费线实质上是原子的吸收光谱,并一一找到对应的元素。例如,被夫琅禾费标记为 D 的双线源自钠(如图),后人称为钠双线
科学史话
离散的谱线
项目一
科学史话
离散的谱线
原子光谱为什么是离散的谱线而不是连续的呢?
科学史话
1913年,玻尔创造性地假设,被束缚在原子核外的电子的能量是量子化的,只能取一定数值,称为定态,而原子光谱的谱线是不同定态的电子发生跃迁产生的,因而是离散的而不是连续的谱线。
1925年,德国科学家洪特解释了复杂光谱,得出了过渡元素(包括铬和铜等)的光谱学基态原子的电子排布,为构造原理的确立奠定了基础
课堂练习4、下列说法不正确 的是( @28@ )。
A.焰色试验是化学变化
B.在现代化学中,常利用光谱分析法来鉴定元素
C.同一原子处于激发态时的能量一定大于其处于基态时的能量
D.焰色试验中观察到的焰色是金属原子的电子从激发态跃迁到基态时产生的光的颜色
A
课堂练习5、电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取( )
A.电子的运动轨迹图像 B.原子的吸收光谱
C.电子体积大小的图像 D.原子的发射光谱
B
课堂练习6、用1~18号的元素符号填空。
(1) 基态原子1S 能级未充满电子的元素是____。
(2) 基态原子第二能层只有3个电子的元素是____。
(3) 基态原子有且只有三个能级填充电子的元素是
________________________。
(4) 基态原子第三能层电子数最多的元素是_____。
B、C、N、O、F、Ne
H
B
Ar
第一节 原子结构
第一章 原子结构和性质
第一课时
能层与能级、基态与激发态、原子光谱
学习目标
1.了解原子的认知历史和科学史观。
2.理解能层与能级的概念及其区别,能从能层能级的角度了解原子结构特点。
3.了解原子的基态和激发态。了解原子光谱,能说明原子光谱在研究物质结构中的作用。
1803年
道尔顿
1904年
1911年
1913年
1926~1935年
汤姆孙
卢瑟福
波尔
薛定谔
提出原子
确认电子
实心球模型
葡萄干面包模型
行星式模型
分层模型
现代电子云模型
提出电子分层运动
提出电子没有确定轨道
确认原子核
发现质子
预测中子
人类认识原子的历史是漫长的,也是无止境的。
【引入新课】
丹麦物理学家玻尔
(N.Bohr,1885~1962)
玻尔模型
构造原理:即从氢开始,随核电荷数递增,新增电子填入原子核外“壳层”的顺序,电子只能在原子核外具有特定能量的“壳层”中运动。由此开启了用原子结构解释元素周期律的篇章。
5年后,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子的可能状态,复杂的原子光谱得以诠释。
1936年,德国科学家马德隆发表了以原子光谱事实为依据的完整的构造原理。
【知识回顾】
原子:是化学变化中最小的粒子
化学反应的实质:是原子的重新组合。
原子组成:
原子
原子核
核外电子(-)
质子(+)
中子(不带电)
核电荷数(z)= 核内质子数= 核外电子数
质量数(A) = 质子数(Z) + 中子数(N)
离子所带电荷数=质子数–核外电子数
1.回忆原子相关知识
3.核外电子运动特点和排布规律是什么?
核外电子是_______排布的;
离核较近的电子,能量_______;
离核较远的电子,能量_______。
分层
较低
较高
【知识回顾】
2.请画出1~18号元素的原子原子结构示意图。
(1)原子核外电子总是尽先由里向外(能量由低到高)排列。
(2)第n层最多能最多容纳2n2个电子。
(4)次外层最多能容纳18个电子,倒数第三层最多容纳32个电子。
(3)最外层最多容纳8个电子(K层为最外层时最多容纳2个)。
核外电子排布规律
一、能层与能级
1.能层
(1)概念:
多电子原子的核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。
电子层
能层
能层越高,电子的能量越高
(2)表示方法及各能层最多容纳的电子数
能层 一 二 三 四 五 六 七
符号 K L M N O P Q
最多电子数 2 8 18 32 50 72 98
能层越高,电子的能量越高。
能量的高低顺序为E(K)
②数量规律
每层容纳的电子数不超过2n2(n为能层序数)
=2×12
=2×22
=2×32
=2×42
=2×52
=2×62
=2×72
2.能级
在多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成不同的能级。
(1)概念:
(2)表示方法
分别用相应能层的序数和字母 s、p、d、f 等表示,如n能层的能级按能量由低到高的顺序为E(ns)
最多容纳电子 …
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
5p
2
2
6
2
6
10
2
6
14
10
2
6
2
8
18
32
2n2
s能级最多容纳的电子数为2
p能级最多容纳的电子数为6
d能级最多容纳的电子数为10
f能级最多容纳的电子数为14
即:以s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的二倍
(3)能层、能级与容纳的最多电子数
① 每一能层最多可容纳的电子数为______( 为能层序数)。
② 在每一个能层中,能级符号的顺序是_______________ ( 为能层序数)。
③ 任一能层的能级总是从 能级开始,而且能级数等于该___________,即第一能层只有1个能级____,第二能层有2个能级_________,第三能层有3个能级____________,依次类推。
能层序数
④ 以 、 、 、 排序的各能级可容纳的最多电子数依次为______________的2倍。
⑤ 英文字母相同的不同能级中所能容纳的最多电子数相同。例如, 、 、 、 能级最多都只能容纳____个电子。
2
小结:规律及注意事项
2n2
ns、np、nd、nf
2s、2p
3s、3p和3d
1s
1、3、5、7
⑥在相同能层各能级能量由低到高的顺序是_____________________________。不同能层中同一能级,能层数越大,能量越高。例如:______________________________
E(ns)
能层最多容纳电子数=2n2
2、6、10、14
相同
能 级 5s 5p 5d 5f 5 总数
最多电子数
50
2 6 10 14 18 50
课本P7:思考与讨论
1.一个能层的能级与能层序数(n)间存在什么关系?一个能层最多可容纳的电子数与能层序数(n)间存在什么关系
2.以s、p、d、f、为符号的能级分别最多可容纳多少电子?3d、4d、5d能级所能容纳的最多电子数是否相同?
3.第五能层最多可容纳多少电子?它们分别容纳在几个能级中?各能级最多容纳多少个电子?(注:高于f的能级不用符号表示。)
②各能级(s、p、d、f ……)上所能容纳的电子数依次为1、3、 5 、7…… 的2倍。( )
①原子核外电子按能量不同分为不同的能层,同一能层又按能量不同分为不同的能级。( )
√
③能层离核越近能量越低。( )
④同一能层的电子能量一定相同。( )
×
⑤同一原子中,同一能层同一能级的电子能量一定相同。( )
⑥第 能层最多能容纳的电子数为 ,所以钠原子的第三能层填有18个电子( )
课堂练习1、判断正误
√
√
×
√
课堂练习2、下列说法正确的是 ( )
A.原子核外的每个能层最多可容纳的电子数为n2
B.任一能层的能级总是从s能级开始,而且能级数等于该能层序数C.同是s能级,在不同的能层中最多容纳的电子数是不相同的
D.不同能层中含有的能级数相同
B
课堂练习3、下列能级符号书写
A. B. C. D.
B
二、基态与激发态 原子光谱
2.激发态:基态原子 能量,它的电子会跃迁到 能级,变成激发态原子。
K
L
M
基态氢原子
1.基态:处于 状态的原子。
最低能量
K
L
M
激发态氢原子
吸收
较高
稳定
不稳定
吸收能量
电子跃迁
能量
K
L
M
激发态氢原子
K
L
M
基态氢原子
不稳定
稳定
释放能量
电子跃迁
光能
二、基态与激发态
光(辐射)是电子跃迁释放能量的重要形式。
一些生活中的光现象
霓虹灯
激光
霓虹灯管中装载的气体不同,在高压的激发下发出的光的颜色就不同。
基态Ne原子
激发态Ne原子
在电场的作用下
电子跃迁到较高能级
很快又会以光的形式释放能量
跃迁到较低能级
光的波长恰好位于可见光区域中的红色波段,所以看见红色光。
不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
稀有气体的不同颜色
请同学们解释钾与钠产生焰色及焰色不同的原因。
【思考与讨论】
当碱金属及化合物在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但是处于能量较高的的轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式释放,而释放的光的波长在可见光范围内,因而能使火焰呈现颜色。
钾和钠的原子结构不同,电子跃迁时能量的变化不同,则放出的光的波长不同,所以产生焰色也就不同。
3.原子光谱
不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称为原子光谱。
(1)概念:
基态原子
激发态原子
吸收能量
释放能量
形成吸收光谱
形成发射光谱
电子跃迁
特征:暗背景,彩色亮线,线状不连续
特征:亮背景,暗线,线状不连续
发射光谱
吸收光谱
Li
He
Hg
同种元素发射光谱中的彩色亮线与吸收光谱中的暗线处于相同位置。
某些波长的光被释放
来源于光源
某些波长的光被吸收
(2)发射光谱与吸收光谱对比
现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
(3)光谱分析
氢原子光谱测定示意图和氢原子的光谱图
科学史话
1814年,德国物理学家夫琅禾费发明了分光镜并用来观察太阳光,发现在太阳光谱中有570多条黑线(现知几千条),后人称之为夫琅禾费线。
1859年,德国科学家本生 和基尔霍夫发明了光谱仪,证实了夫琅禾费线实质上是原子的吸收光谱,并一一找到对应的元素。例如,被夫琅禾费标记为 D 的双线源自钠(如图),后人称为钠双线
科学史话
离散的谱线
项目一
科学史话
离散的谱线
原子光谱为什么是离散的谱线而不是连续的呢?
科学史话
1913年,玻尔创造性地假设,被束缚在原子核外的电子的能量是量子化的,只能取一定数值,称为定态,而原子光谱的谱线是不同定态的电子发生跃迁产生的,因而是离散的而不是连续的谱线。
1925年,德国科学家洪特解释了复杂光谱,得出了过渡元素(包括铬和铜等)的光谱学基态原子的电子排布,为构造原理的确立奠定了基础
课堂练习4、下列说法
A.焰色试验是化学变化
B.在现代化学中,常利用光谱分析法来鉴定元素
C.同一原子处于激发态时的能量一定大于其处于基态时的能量
D.焰色试验中观察到的焰色是金属原子的电子从激发态跃迁到基态时产生的光的颜色
A
课堂练习5、电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取( )
A.电子的运动轨迹图像 B.原子的吸收光谱
C.电子体积大小的图像 D.原子的发射光谱
B
课堂练习6、用1~18号的元素符号填空。
(1) 基态原子1S 能级未充满电子的元素是____。
(2) 基态原子第二能层只有3个电子的元素是____。
(3) 基态原子有且只有三个能级填充电子的元素是
________________________。
(4) 基态原子第三能层电子数最多的元素是_____。
B、C、N、O、F、Ne
H
B
Ar
