化学人教版(2019)选择性必修2 第一章第一节第三课时电子云与原子轨道(27张)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 第一章第一节第三课时电子云与原子轨道(27张) |  | |
| 格式 | ppt | ||
| 文件大小 | 38.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 09:40:40 | ||
图片预览




文档简介
(共27张PPT)
人教版 选择性必修2
第一章第一节原子结构
第三课时 电子云与原子轨道
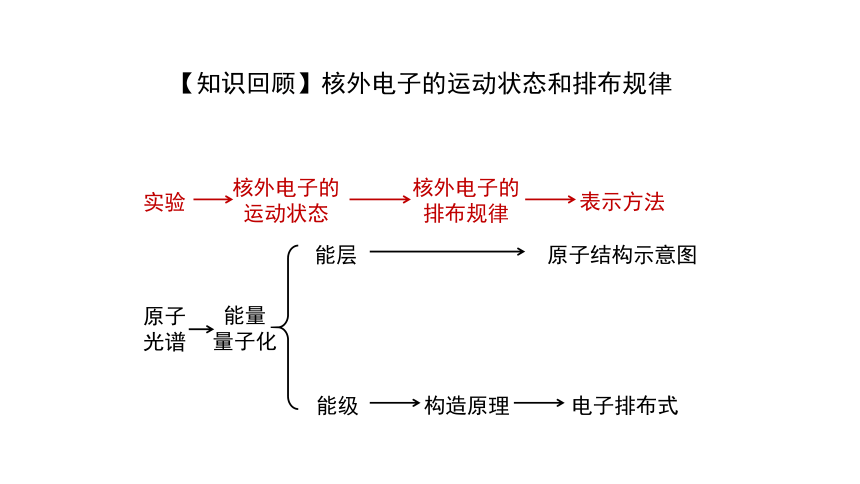
【知识回顾】核外电子的运动状态和排布规律
实验
核外电子的
运动状态
核外电子的
排布规律
表示方法
原子
光谱
能量
量子化
能层
能级
原子结构示意图
构造原理
电子排布式
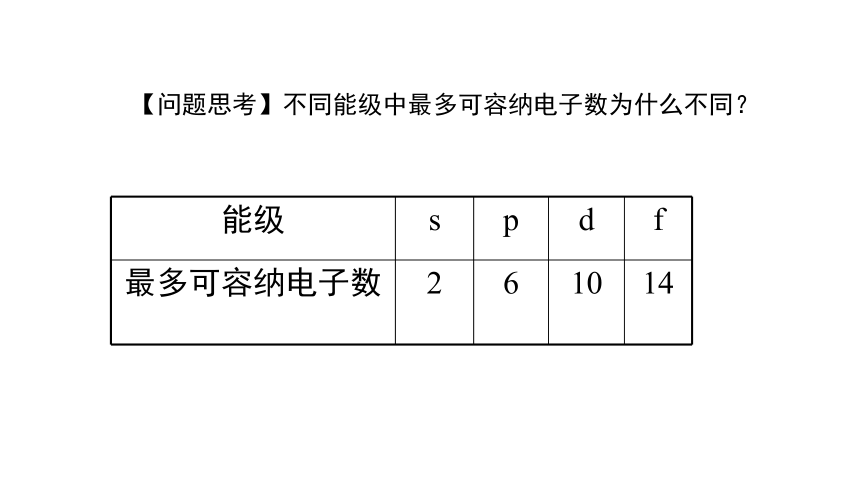
【问题思考】不同能级中最多可容纳电子数为什么不同?
能级 s p d f
最多可容纳电子数 2 6 10 14
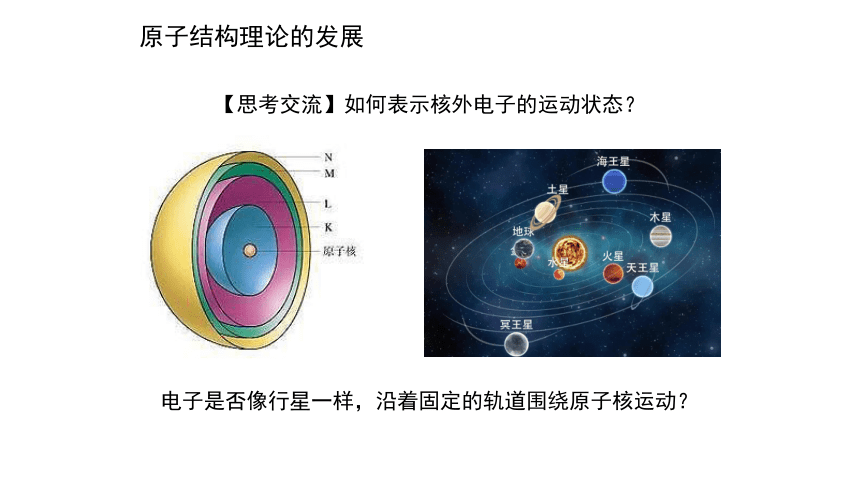
【思考交流】如何表示核外电子的运动状态?
原子结构理论的发展
电子是否像行星一样,沿着固定的轨道围绕原子核运动?
核外电子的运动特点
运动特点 宏观物体 核外电子
质量 很大 很小
位置 可测 不可以同时测定
速度 可测 轨迹 可以描述 不能准确描述
原子结构理论的发展
原子结构理论的发展
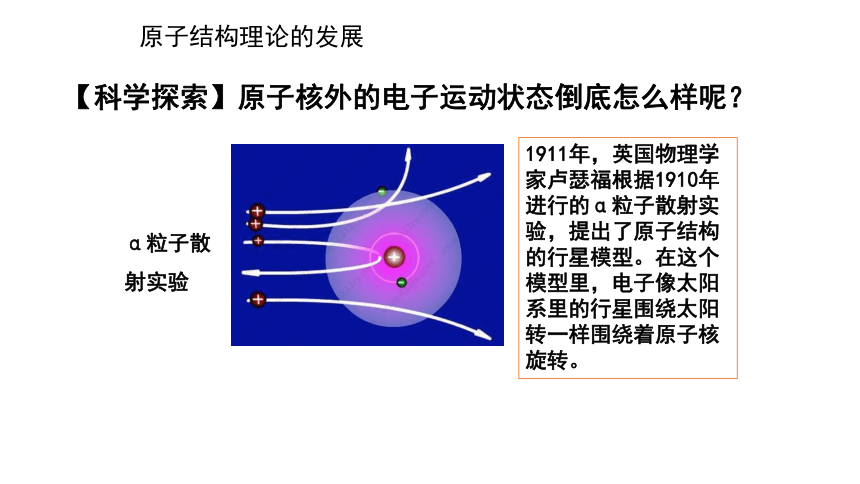
【科学探索】原子核外的电子运动状态倒底怎么样呢?
1911年,英国物理学家卢瑟福根据1910年进行的α粒子散射实验,提出了原子结构的行星模型。在这个模型里,电子像太阳系里的行星围绕太阳转一样围绕着原子核旋转。
α粒子散射实验
原子结构理论的发展
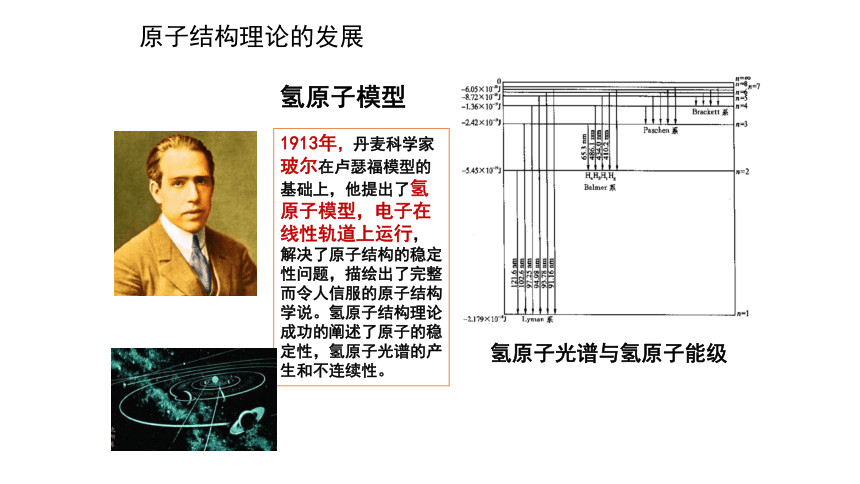
氢原子模型
1913年,丹麦科学家玻尔在卢瑟福模型的基础上,他提出了氢原子模型,电子在线性轨道上运行,解决了原子结构的稳定性问题,描绘出了完整而令人信服的原子结构学说。氢原子结构理论成功的阐述了原子的稳定性,氢原子光谱的产生和不连续性。
氢原子光谱与氢原子能级
薛定谔方程
1926年奥地利物理学家薛定谔提出:可以用一个数学方程描述核外电子的运动状态,为近代量子力学奠定了理论基础。量子力学推翻了玻尔的氢原子模型。
薛定谔
原子结构理论的发展
核外电子的运动特点
量子力学指出:一定空间运动状态的电子并不在玻尔假设的线性轨道上运动,而是在核外空间各处都可以出现,只是出现的概率不同。
原子结构理论的发展
出现在核外空间的具体位置
出现在核外某位置的概率
×
√
小点是1s电子在原子核外出现的概率密度的形象描述。
概率密度 = (P:电子在某处出现的概率,V:该处的体积)
左图是氢原子1s电子的概率密度分布图。
概率密度分布图与电子云图
电子出现的概率密度大
电子出现的概率密度小
概率密度分布图与电子云图
图1-7 氢原子1s电子在原子核外出现的概率密度分布图
小点是1s电子在原子核外出现的概率密度的形象描述。小点越密,表明概率密度越大。由于核外电子的概率密度分布看起来像一片云雾,因而被形象的称作“电子云”。
准备一张正方形纸,中央画上一个圆圈,在圆圈内随意
点上90个点,在圆圈外周边随机点上10个点。(注意离圆
心越近的地方点的分布越密集)
【学生活动】
将出现概率90%的空间圈出来
1s电子的电子云轮廓图绘制过程
电子云图与电子云轮廓图
相同原子的s电子的电子云轮廓图
你发现了什么规律?
不同能层s电子的电子云形状相同,均为球形。
能层越高,s电子的电子云半径越大。
电子云图与电子云轮廓图
2p 电子云
px、py、pz 的电子云轮廓图
p电子云有什么特点?
p电子的电子云形状相同,均为哑铃形,且px、py、pz 的电子云互相垂直。
电子云图与电子云轮廓图
s 电子有一种空间运动状态,p 电子有三种空间运动状态。
电子云图与电子云轮廓图
能级 s p d f
最多可容纳电子数 2 6 10 14
原子轨道数
每个轨道容纳电子数
不同能级中的原子轨道数量
请填写下表,并预测d、f能级中的原子轨道数量。
原子轨道
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
能级 s p d f
最多可容纳电子数 2 6 10 14
原子轨道数 1 3 5 7
每个轨道容纳电子数 2 2 2 2
不同能级中的原子轨道数量
请填写下表,并预测d、f能级中的原子轨道数量。
原子轨道
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
用身边的常用物品(如橡皮泥、粘土)自制原子轨道模型
【学生活动】
【课堂小结】
请整理能层、能级和原子轨道之间的关系,并填表。
能层 能级 原子 轨道数 原子轨道符号 电子云轮廓图 形状 取向
K 1s ——
L 2s ——
2p
M 3s ——
3p
3d —— —— ——
请整理能层、能级和原子轨道之间的关系,并填表。
能层 能级 原子 轨道数 原子轨道符号 电子云轮廓图 形状 取向
K 1s 1 1s 球形 ——
L 2s 1 2s 球形 ——
2p 3 2px、2py、2pz 哑铃形 相互垂直
M 3s 1 3s 球形 ——
3p 3 3px、3py、3pz 哑铃形 相互垂直
3d 5 —— —— ——
【课堂小结】
【课堂练习】
1. 下列对于电子的运动状态描述正确的是( D )
电子沿着固定的轨道围绕原子核运动
电子依次填入K、L、M、N、O、P、Q能层
能够同时测定核外电子的运动位置和速度
基态原子吸收能量后,电子会跃迁到较高能级
2. 下列能级中,轨道数为5的是( C )
A. 2s B. 2p
C. 4d D. 4f
【课堂练习】
3. 下列叙述中,正确的是( B )
s电子的电子云轮廓图为圆形
2p和3p轨道形状均为哑铃形
电子云图中的点代表电子
电子云图中的点代表电子的运动痕迹
【课堂练习】
4. 下列关于原子轨道的说法不正确的是( B )
2p、3p、4p能级的轨道数都为3
各电子层所含有的原子轨道数为2n2
2px、 2py 、 2pz轨道相互垂直,但能量相等
s、p、d能级所含有的原子轨道数分别为1、3、5
【课堂练习】
5.下列叙述中,正确的是( D )
3p2表示3p能级上有2个轨道
M层中的原子轨道数目为4
原子结构示意图为 的原子,核外电子云有3种不同形状
2p和3p轨道形状均为哑铃形,但2p轨道能量低于3p轨道能量
【课堂练习】
参考答案:
1. D 2. C 3. B 4. B 5. D
【课堂练习】
人教版 选择性必修2
第一章第一节原子结构
第三课时 电子云与原子轨道
【知识回顾】核外电子的运动状态和排布规律
实验
核外电子的
运动状态
核外电子的
排布规律
表示方法
原子
光谱
能量
量子化
能层
能级
原子结构示意图
构造原理
电子排布式
【问题思考】不同能级中最多可容纳电子数为什么不同?
能级 s p d f
最多可容纳电子数 2 6 10 14
【思考交流】如何表示核外电子的运动状态?
原子结构理论的发展
电子是否像行星一样,沿着固定的轨道围绕原子核运动?
核外电子的运动特点
运动特点 宏观物体 核外电子
质量 很大 很小
位置 可测 不可以同时测定
速度 可测 轨迹 可以描述 不能准确描述
原子结构理论的发展
原子结构理论的发展
【科学探索】原子核外的电子运动状态倒底怎么样呢?
1911年,英国物理学家卢瑟福根据1910年进行的α粒子散射实验,提出了原子结构的行星模型。在这个模型里,电子像太阳系里的行星围绕太阳转一样围绕着原子核旋转。
α粒子散射实验
原子结构理论的发展
氢原子模型
1913年,丹麦科学家玻尔在卢瑟福模型的基础上,他提出了氢原子模型,电子在线性轨道上运行,解决了原子结构的稳定性问题,描绘出了完整而令人信服的原子结构学说。氢原子结构理论成功的阐述了原子的稳定性,氢原子光谱的产生和不连续性。
氢原子光谱与氢原子能级
薛定谔方程
1926年奥地利物理学家薛定谔提出:可以用一个数学方程描述核外电子的运动状态,为近代量子力学奠定了理论基础。量子力学推翻了玻尔的氢原子模型。
薛定谔
原子结构理论的发展
核外电子的运动特点
量子力学指出:一定空间运动状态的电子并不在玻尔假设的线性轨道上运动,而是在核外空间各处都可以出现,只是出现的概率不同。
原子结构理论的发展
出现在核外空间的具体位置
出现在核外某位置的概率
×
√
小点是1s电子在原子核外出现的概率密度的形象描述。
概率密度 = (P:电子在某处出现的概率,V:该处的体积)
左图是氢原子1s电子的概率密度分布图。
概率密度分布图与电子云图
电子出现的概率密度大
电子出现的概率密度小
概率密度分布图与电子云图
图1-7 氢原子1s电子在原子核外出现的概率密度分布图
小点是1s电子在原子核外出现的概率密度的形象描述。小点越密,表明概率密度越大。由于核外电子的概率密度分布看起来像一片云雾,因而被形象的称作“电子云”。
准备一张正方形纸,中央画上一个圆圈,在圆圈内随意
点上90个点,在圆圈外周边随机点上10个点。(注意离圆
心越近的地方点的分布越密集)
【学生活动】
将出现概率90%的空间圈出来
1s电子的电子云轮廓图绘制过程
电子云图与电子云轮廓图
相同原子的s电子的电子云轮廓图
你发现了什么规律?
不同能层s电子的电子云形状相同,均为球形。
能层越高,s电子的电子云半径越大。
电子云图与电子云轮廓图
2p 电子云
px、py、pz 的电子云轮廓图
p电子云有什么特点?
p电子的电子云形状相同,均为哑铃形,且px、py、pz 的电子云互相垂直。
电子云图与电子云轮廓图
s 电子有一种空间运动状态,p 电子有三种空间运动状态。
电子云图与电子云轮廓图
能级 s p d f
最多可容纳电子数 2 6 10 14
原子轨道数
每个轨道容纳电子数
不同能级中的原子轨道数量
请填写下表,并预测d、f能级中的原子轨道数量。
原子轨道
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
能级 s p d f
最多可容纳电子数 2 6 10 14
原子轨道数 1 3 5 7
每个轨道容纳电子数 2 2 2 2
不同能级中的原子轨道数量
请填写下表,并预测d、f能级中的原子轨道数量。
原子轨道
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
用身边的常用物品(如橡皮泥、粘土)自制原子轨道模型
【学生活动】
【课堂小结】
请整理能层、能级和原子轨道之间的关系,并填表。
能层 能级 原子 轨道数 原子轨道符号 电子云轮廓图 形状 取向
K 1s ——
L 2s ——
2p
M 3s ——
3p
3d —— —— ——
请整理能层、能级和原子轨道之间的关系,并填表。
能层 能级 原子 轨道数 原子轨道符号 电子云轮廓图 形状 取向
K 1s 1 1s 球形 ——
L 2s 1 2s 球形 ——
2p 3 2px、2py、2pz 哑铃形 相互垂直
M 3s 1 3s 球形 ——
3p 3 3px、3py、3pz 哑铃形 相互垂直
3d 5 —— —— ——
【课堂小结】
【课堂练习】
1. 下列对于电子的运动状态描述正确的是( D )
电子沿着固定的轨道围绕原子核运动
电子依次填入K、L、M、N、O、P、Q能层
能够同时测定核外电子的运动位置和速度
基态原子吸收能量后,电子会跃迁到较高能级
2. 下列能级中,轨道数为5的是( C )
A. 2s B. 2p
C. 4d D. 4f
【课堂练习】
3. 下列叙述中,正确的是( B )
s电子的电子云轮廓图为圆形
2p和3p轨道形状均为哑铃形
电子云图中的点代表电子
电子云图中的点代表电子的运动痕迹
【课堂练习】
4. 下列关于原子轨道的说法不正确的是( B )
2p、3p、4p能级的轨道数都为3
各电子层所含有的原子轨道数为2n2
2px、 2py 、 2pz轨道相互垂直,但能量相等
s、p、d能级所含有的原子轨道数分别为1、3、5
【课堂练习】
5.下列叙述中,正确的是( D )
3p2表示3p能级上有2个轨道
M层中的原子轨道数目为4
原子结构示意图为 的原子,核外电子云有3种不同形状
2p和3p轨道形状均为哑铃形,但2p轨道能量低于3p轨道能量
【课堂练习】
参考答案:
1. D 2. C 3. B 4. B 5. D
【课堂练习】
