鲁科版2019必修第一册 1.3 气体摩尔体积(19张)
文档属性
| 名称 | 鲁科版2019必修第一册 1.3 气体摩尔体积(19张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 00:00:00 | ||
图片预览





文档简介
(共19张PPT)
第三节 化学中常用的物理量
——物质的量
鲁科版2019必修第一册
第一章 认识化学科学
第2课时 气体摩尔体积
学习目标
评价目标
1.能从宏观和微观相结合的角度理解影响物质体积大小的因素,知道气体摩尔体积的含义,能叙述阿伏加德罗定律的内容。
2.能基于物质的量认识物质的组成及变化,建立n、m、V、Vm之间计算的模型,熟悉阿伏加德罗定律的应用。
1、通过运用气体摩尔体积的概念和公式,培养逻辑推理和问题分析能力。
2、通过观察探究气体摩尔体积的影响因素,培养实验与探究能力。
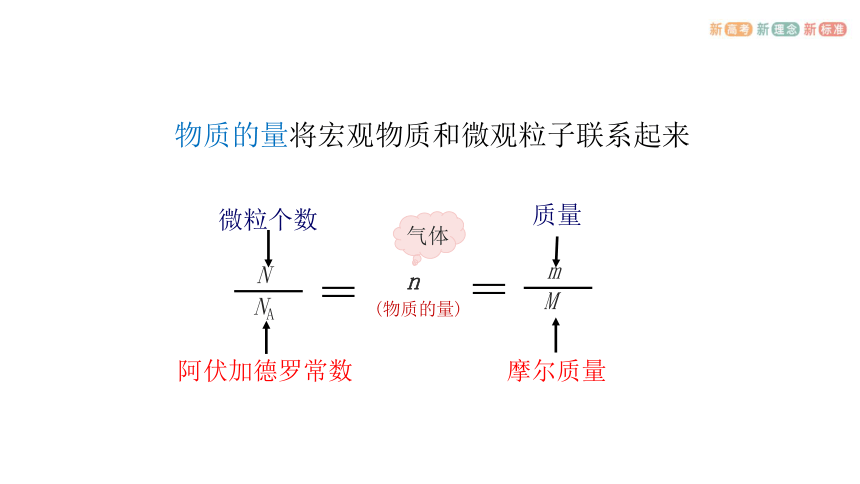
物质的量将宏观物质和微观粒子联系起来
n
m
M
质量
摩尔质量
N
NA
微粒个数
阿伏加德罗常数
(物质的量)
气体
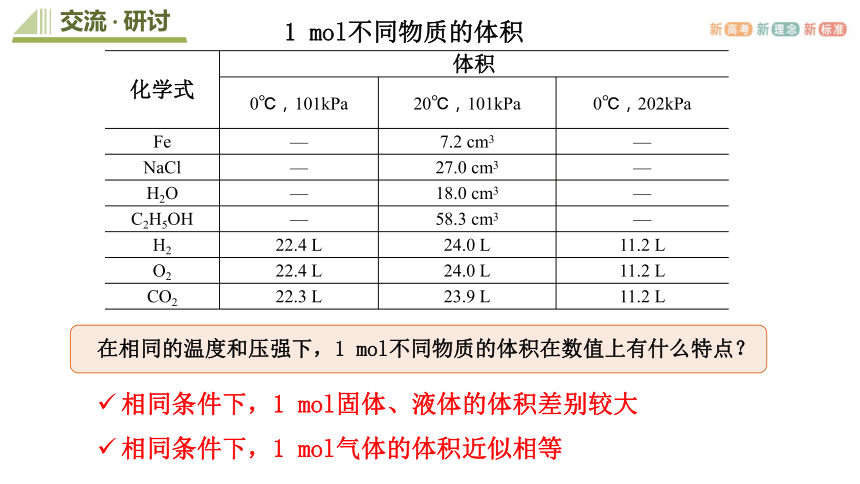
化学式 体积 0℃,101kPa 20℃,101kPa 0℃,202kPa
Fe — 7.2 cm3 —
NaCl — 27.0 cm3 —
H2O — 18.0 cm3 —
C2H5OH — 58.3 cm3 —
H2 22.4 L 24.0 L 11.2 L
O2 22.4 L 24.0 L 11.2 L
CO2 22.3 L 23.9 L 11.2 L
在相同的温度和压强下,1 mol不同物质的体积在数值上有什么特点?
1 mol不同物质的体积
相同条件下,1 mol固体、液体的体积差别较大
相同条件下,1 mol气体的体积近似相等
交流 · 研讨
为什么相同条件下,1mol不同固体和液体的体积不同,而1mol不同气体的体积几乎相同?物质的体积与什么因素有关?
思考与讨论
影响体积的因素有哪些?
分子数目
分子间的距离(分子间距)
分子直径
(1)分子直径
(2)分子数目
(3)分子之间的距离
决定气体的体积
一、影响气体体积大小的因素
相对于分子间距,可忽略
同温同压下,任何气体分子之间的平均距离近似相等
相同条件下,1 mol任何气体
①气体的微粒数相同
②气体分子之间的平均距离近似相等
故体积相等!
决定固体、液体的体积
二、气体摩尔体积
Vm
L·mol-1或 m3·mol-1
(1)定义:单位物质的量的气体所占有的体积
(2)符号:
(3)单位:
(4)数学表达式:
(5)影响因素:
气体所处的温度和压强
(6)标准状况下的气体摩尔体积
在0 ℃、101 kPa时,1 mol 任何气体的体积都约为22.4L。
条件
(标准状况,STP)
标准
(数目相同)
对象
(任何气体)
数值
(体积相同)
1.下列说法正确的是( )
A.在标准状况下,1mol水的体积是22.4L
B.1molH2所占的体积约为22.4L
C.在标准状况下,NA个分子所占的体积约为22.4L
D.在标准状况下,1molNH3和CO混合气体所占的体积约为22.4L
D
迁移 · 应用
想一想:气体摩尔体积为22.4 L·mol-1时,一定处于标准状况下吗?
注意事项
适用范围:气态物质,可以是单一气体,也可是混合气体,注意混合气体之间不能发生反应
物质在标准状况下为气体,若不是气体或非标准状况均不能用22.4 L·mol-1进行计算
1 mol气体在非标准状况下的体积,可能是22.4 L,也可能不是22.4 L
标况下不是气体的常见物质:H2O、SO3、酒精、CCl4
分子数:__________
1 mol Cl2
质量:______ g
体积:______ L(STP)
完成下图,结合该图说一说物质的量是如何把宏观量与所含微粒数量联系起来的,并试着画出思维导图。
71
6.02×1023
22.4
迁移 · 应用
物质的量的“桥梁”作用
÷22.4 L/mol
×22.4 L/mol
标况下气体体积
V(L)
物质的量
n (mol)
粒子数
N(个)
×摩尔质量(M)
÷摩尔质量(M)
÷阿伏加德罗常数(NA)
×阿伏加德罗常数(NA)
物质质量
m(g)
交流 · 研讨
同温同压下,如果气体的体积相同则气体的物质的量是否也相同呢 所含的分子数呢
相同温度
相同压强
相同体积
所含的分子数相同
物质的量相同
任何气体
三、阿伏加德罗定律及推论
1.阿伏加德罗定律: “三同”定“一同”。即同温、同压、同体积的任何气体,含有相同的分子数(或物质的量相同)。
想一想:
1. 同温同压下,气体的体积之比与其物质的量之比有什么关系?
2. 同温同压下,气体的密度之比与摩尔质量之比有什么关系?
P V = n R T
气体压强
气体体积
常数
温度
2.阿伏加德罗定律常用推论
条件 结论 语言叙述
T、p相同 同温同压下,气体的 与其 成正比
T、V相同 温度、体积相同的气体, 与其 成正比
T、p相同 同温同压下,气体的密度与其 成正比
体积
物质的量
压强
物质的量
摩尔质量
PV=nRT
三同定一同,两同成比例
迁移 · 应用
2.下列说法正确的是( )
A.同温同压下,N2和H2的密度之比为14∶1
B.同温下,等体积Cl2和O2的压强之比为1∶1
C.同温同压下,等质量NO2、N2O4中氧原子个数比为1∶2
D.同温同压下,等体积CH4和CO2的质量之比为11∶4
A
课 堂 小 结
n
×NA
÷NA
×M
÷ M
÷Vm
×Vm
N
V
m
宏观量
微观量
桥梁
阿伏加德罗定律及推论
课 堂 评 价
1、下列说法正确的是( )
A.32 g O2的体积为22.4 L
B.22.4 L N2含有阿伏加德罗常数个氮气分子
C.在标准状况下,22.4 L水的物质的量为1 mol
D.在0 ℃、1.01×105 Pa下,22 g CO2和16 g O2混合后的体积约为22.4 L
2、在标准状况下,与16 g O2的体积相等的N2( )
A.体积为22.4 L B.分子数为6.02×1024
C.质量为14 g D.物质的量为1 mol
C
D
3、如图为两瓶体积相同的气体,在同温同压下瓶内气体一定具有相同的_________。
①原子总数
②氧原子总数
③质量
④分子总数
N2和O2
NO
①④
第三节 化学中常用的物理量
——物质的量
鲁科版2019必修第一册
第一章 认识化学科学
第2课时 气体摩尔体积
学习目标
评价目标
1.能从宏观和微观相结合的角度理解影响物质体积大小的因素,知道气体摩尔体积的含义,能叙述阿伏加德罗定律的内容。
2.能基于物质的量认识物质的组成及变化,建立n、m、V、Vm之间计算的模型,熟悉阿伏加德罗定律的应用。
1、通过运用气体摩尔体积的概念和公式,培养逻辑推理和问题分析能力。
2、通过观察探究气体摩尔体积的影响因素,培养实验与探究能力。
物质的量将宏观物质和微观粒子联系起来
n
m
M
质量
摩尔质量
N
NA
微粒个数
阿伏加德罗常数
(物质的量)
气体
化学式 体积 0℃,101kPa 20℃,101kPa 0℃,202kPa
Fe — 7.2 cm3 —
NaCl — 27.0 cm3 —
H2O — 18.0 cm3 —
C2H5OH — 58.3 cm3 —
H2 22.4 L 24.0 L 11.2 L
O2 22.4 L 24.0 L 11.2 L
CO2 22.3 L 23.9 L 11.2 L
在相同的温度和压强下,1 mol不同物质的体积在数值上有什么特点?
1 mol不同物质的体积
相同条件下,1 mol固体、液体的体积差别较大
相同条件下,1 mol气体的体积近似相等
交流 · 研讨
为什么相同条件下,1mol不同固体和液体的体积不同,而1mol不同气体的体积几乎相同?物质的体积与什么因素有关?
思考与讨论
影响体积的因素有哪些?
分子数目
分子间的距离(分子间距)
分子直径
(1)分子直径
(2)分子数目
(3)分子之间的距离
决定气体的体积
一、影响气体体积大小的因素
相对于分子间距,可忽略
同温同压下,任何气体分子之间的平均距离近似相等
相同条件下,1 mol任何气体
①气体的微粒数相同
②气体分子之间的平均距离近似相等
故体积相等!
决定固体、液体的体积
二、气体摩尔体积
Vm
L·mol-1或 m3·mol-1
(1)定义:单位物质的量的气体所占有的体积
(2)符号:
(3)单位:
(4)数学表达式:
(5)影响因素:
气体所处的温度和压强
(6)标准状况下的气体摩尔体积
在0 ℃、101 kPa时,1 mol 任何气体的体积都约为22.4L。
条件
(标准状况,STP)
标准
(数目相同)
对象
(任何气体)
数值
(体积相同)
1.下列说法正确的是( )
A.在标准状况下,1mol水的体积是22.4L
B.1molH2所占的体积约为22.4L
C.在标准状况下,NA个分子所占的体积约为22.4L
D.在标准状况下,1molNH3和CO混合气体所占的体积约为22.4L
D
迁移 · 应用
想一想:气体摩尔体积为22.4 L·mol-1时,一定处于标准状况下吗?
注意事项
适用范围:气态物质,可以是单一气体,也可是混合气体,注意混合气体之间不能发生反应
物质在标准状况下为气体,若不是气体或非标准状况均不能用22.4 L·mol-1进行计算
1 mol气体在非标准状况下的体积,可能是22.4 L,也可能不是22.4 L
标况下不是气体的常见物质:H2O、SO3、酒精、CCl4
分子数:__________
1 mol Cl2
质量:______ g
体积:______ L(STP)
完成下图,结合该图说一说物质的量是如何把宏观量与所含微粒数量联系起来的,并试着画出思维导图。
71
6.02×1023
22.4
迁移 · 应用
物质的量的“桥梁”作用
÷22.4 L/mol
×22.4 L/mol
标况下气体体积
V(L)
物质的量
n (mol)
粒子数
N(个)
×摩尔质量(M)
÷摩尔质量(M)
÷阿伏加德罗常数(NA)
×阿伏加德罗常数(NA)
物质质量
m(g)
交流 · 研讨
同温同压下,如果气体的体积相同则气体的物质的量是否也相同呢 所含的分子数呢
相同温度
相同压强
相同体积
所含的分子数相同
物质的量相同
任何气体
三、阿伏加德罗定律及推论
1.阿伏加德罗定律: “三同”定“一同”。即同温、同压、同体积的任何气体,含有相同的分子数(或物质的量相同)。
想一想:
1. 同温同压下,气体的体积之比与其物质的量之比有什么关系?
2. 同温同压下,气体的密度之比与摩尔质量之比有什么关系?
P V = n R T
气体压强
气体体积
常数
温度
2.阿伏加德罗定律常用推论
条件 结论 语言叙述
T、p相同 同温同压下,气体的 与其 成正比
T、V相同 温度、体积相同的气体, 与其 成正比
T、p相同 同温同压下,气体的密度与其 成正比
体积
物质的量
压强
物质的量
摩尔质量
PV=nRT
三同定一同,两同成比例
迁移 · 应用
2.下列说法正确的是( )
A.同温同压下,N2和H2的密度之比为14∶1
B.同温下,等体积Cl2和O2的压强之比为1∶1
C.同温同压下,等质量NO2、N2O4中氧原子个数比为1∶2
D.同温同压下,等体积CH4和CO2的质量之比为11∶4
A
课 堂 小 结
n
×NA
÷NA
×M
÷ M
÷Vm
×Vm
N
V
m
宏观量
微观量
桥梁
阿伏加德罗定律及推论
课 堂 评 价
1、下列说法正确的是( )
A.32 g O2的体积为22.4 L
B.22.4 L N2含有阿伏加德罗常数个氮气分子
C.在标准状况下,22.4 L水的物质的量为1 mol
D.在0 ℃、1.01×105 Pa下,22 g CO2和16 g O2混合后的体积约为22.4 L
2、在标准状况下,与16 g O2的体积相等的N2( )
A.体积为22.4 L B.分子数为6.02×1024
C.质量为14 g D.物质的量为1 mol
C
D
3、如图为两瓶体积相同的气体,在同温同压下瓶内气体一定具有相同的_________。
①原子总数
②氧原子总数
③质量
④分子总数
N2和O2
NO
①④
