鲁科版2019必修第一册 1.3 物质的量 摩尔质量(20张)
文档属性
| 名称 | 鲁科版2019必修第一册 1.3 物质的量 摩尔质量(20张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 12:18:38 | ||
图片预览






文档简介
(共20张PPT)
第三节 化学中常用的物理量
——物质的量
鲁科版2019必修第一册
第一章 认识化学科学
第1课时 物质的量、摩尔质量
学习目标
评价目标
1.认识物质的量 n 及其单位——摩尔 mol
2.认识阿伏加德罗常数的含义与应用
3.知道物质的量 n 与微观粒子数 NA 、质量m之间的关系,并用于进行简单的化学计算
1.通过了解生产生活、科研中的多重计量方法,认识化学计量方法的选择取决于实际需要,发展定量研究的意识。
2.能实现物质的量、离子总数、质量之间的转化,培养宏观辨识与微观探析的学科核心素养。
水是由水分子构成的,一滴水(约0.05mL)中大约含有17万亿亿个水分子,这么多水分子如果让10亿人去数,每人每分钟数100个,需要3万多年才能数完。
微观粒子极小,数量极大,根本无法逐个数数。
怎样才能既科学又方便快捷地知道:
一定质量(或体积)的水中含有多
少个水分子呢?
联想 · 质疑
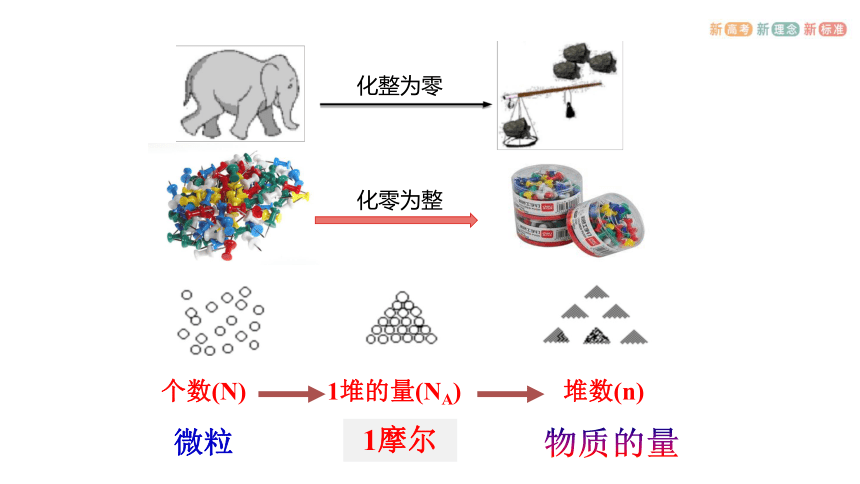
化零为整
化整为零
个数(N)
1堆的量(NA)
堆数(n)
微粒
1摩尔
物质的量
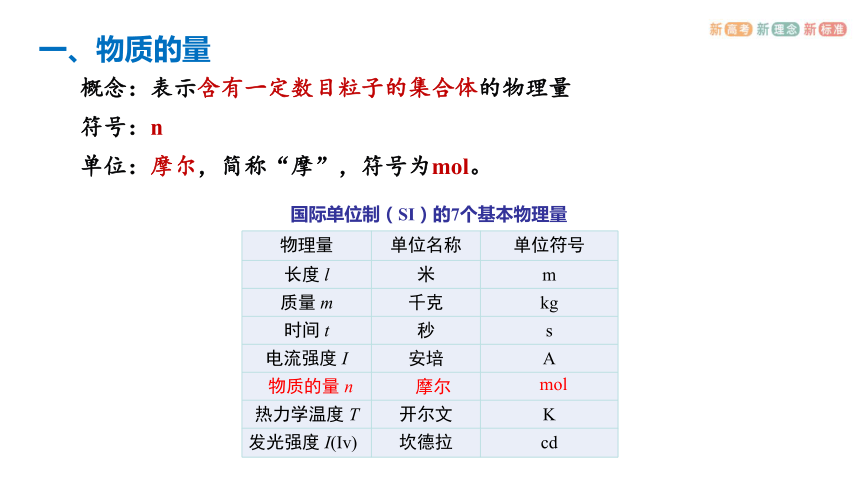
概念:表示含有一定数目粒子的集合体的物理量
符号:n
单位:摩尔,简称“摩”,符号为mol。
物理量 单位名称 单位符号
长度 l 米 m
质量 m 千克 kg
时间 t 秒 s
电流强度 I 安培 A
热力学温度 T 开尔文 K
发光强度 I(Iv) 坎德拉 cd
国际单位制(SI)的7个基本物理量
物质的量 n
摩尔
mol
一、物质的量
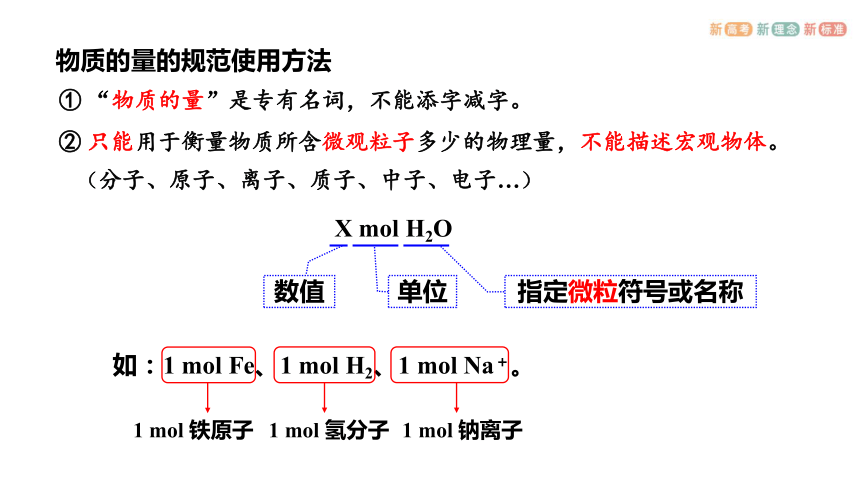
X mol H2O
指定微粒符号或名称
单位
数值
如:1 mol Fe、1 mol H2、1 mol Na+。
1 mol 铁原子
1 mol 氢分子
1 mol 钠离子
物质的量的规范使用方法
① “物质的量”是专有名词,不能添字减字。
(分子、原子、离子、质子、中子、电子…)
② 只能用于衡量物质所含微观粒子多少的物理量,不能描述宏观物体。
1、判断
(1)“物质的量”也就是“物质的数量”( )
(2)1mol小米 ( )
(3)5mol e- ( )
(4)1mol氧 ( )
(5)1molNa+ ( )
(6)摩尔和长度、质量一样,是七个基本物理量之一 ( )
“物质的量”是一个整体,不能拆分
或者增添任何字
“物质的量”描述对象的是微观粒子
使用“物质的量”时注明微粒名称
数字+mol+化学符号
×
×
×
√
√
×
迁移 · 应用
国际计量大会规定:1mol物质中包含阿伏伽德罗常数个基本单元,也即以0.012kg12C中所含的原子数目
1摩尔的微粒数量是多少呢?
二、阿伏伽德罗常数
0.012kg 12C中所含的微粒数为NA个
6.02×1023
NA
mol-1
NA≈6.02×1023mol-1
1mol任何微观粒子所含的微粒数为NA个
阿伏加德罗,意大利化学家。在化学上的重大贡献是建立分子学说。1摩尔粒子的粒子数已被测定为6.02214076×10 ,为了纪念阿伏加德罗的伟大功绩,被命名为阿伏加德罗常数。它是自然科学中的基本常数之一。
1.概念:
2.精确值:
3.近似值:
4.符号:
5.单位:
n(物质的量) N(粒子总数)
1mol H2O NA个H2O
2mol H2O 2× NA个H2O
……
……
n mol H2O
n× NA个H2O
n、NA、N之间的关系
物质的量(n) 微粒总数(N)
×NA
÷NA
N = n · NA
n = ——— 或
N
NA
( )H
O( )
( )氢原子
氧原子( )
微粒数
物质的量
6.02×1023×2 个
2 mol
1 mol
6.02×1023 个
6.02×1023 个水分子
迁移 · 应用
1mol H2O
原子的物质的量=分子(微粒)物质的量×1个分子(微粒)中所含这种原子个数
化学式中:
角标比=个数比=物质的量比
从新的角度认识物质组成:
1molH2O含有2molH和1molO
2、填空
①1 mol H2SO4中含有——————————————个硫酸分子。
②0.5 mol O2中含有氧分子————————————————个。
③0.5 mol CH4约含有___________________个甲烷分子,含有_________________个氢原子,所含原子总数为___________________个。
④1 mol K2SO4中含___mol 氧原子,___mol 原子。
6.02×1023 或 NA
3.01×1023或 0.5NA
3.01×1023或 0.5NA
1.204×1024或 2NA
1.505 ×1024 或 2.5NA
4
7
化学式 相对原子(分子)质量 每个粒子的质量(g/个) 1摩物质含有的粒子数(个) 1摩物质质量(g)
Fe 56 9.288×10-23
H2SO4 98 1.628×10-22
H2O 18 2.990×10-23
NA
NA
NA
56
98
18
1 mol 物质的质量在数值上有什么特点?
1 mol 任何物质的质量,以 g 为单位时,在数值上等于它的相对原子(分子)质量。
交流 · 研讨
三、摩尔质量
②符号:
①概念:
③数值:
④公式:
M =
m
n
单位物质的量的物质所具有的质量。
M
单位:
g· mol-1
kg· mol-1
等于该物质的相对原子质量或相对分子质量
物质的量为1mol的几种物质
32 g S
63.5 g Cu
27 g Al
65 g Zn
58.5 g NaCl
56 g Fe
18 g H2O
342 g 蔗糖
n = m / M
1.下列说法中正确的是( )
A.水的摩尔质量是18g
B.1molCO2的质量为44g·mol-1
C.2克氢气所含原子数目为NA
D.14g CO的物质的量为0.5mol
2.下列各组物质,所含原子数最多的是( )
A.0.4molO2 B.2g氢气
C.6.02×1023个硫酸分子 D.4℃时5.4mL水
D
C
迁移 · 应用
÷ M
× M
物质的质量m (g)
× NA
÷ NA
物质的量
n (mol)
微粒数
N (个)
n =
N
NA
=
m
M
物质的量是一个桥梁,可连接宏观质量m与微观粒子数N
课 堂 小 结
课 堂 评 价
1.下列说法正确的是( )
A.物质的量和摩尔是两个不同的物理量
B.摩尔是物质的量的单位,1摩尔任何物质约含有6.02×1023个原子
C.阿伏加德罗常数数值约为6.02×1023
D.2molNaOH的摩尔质量为1 molNaOH的摩尔质量的两倍
C
B
2.设 NA 代表阿伏加德罗常数的值,下列说法中正确的是( )
A.2.3 g 钠由原子变成离子时,失去的电子数为 0.2NA
B.0.2NA 个硫酸分子与19.6 g 磷酸含有相同的氧原子数
C.28 g 氮气所含的原子数为NA
D.NA 个氧分子与 NA 个氢分子的质量比为8∶1
3. 下列叙述错误的是( )
①摩尔是国际单位制中七个基本物理量之一
②1mol任何物质都含有约6.02×1023个原子
③6.02×1023就是阿伏加德罗常数
④氢原子的摩尔质量是1g
⑤HCl的摩尔质量等于1molHCl分子的质量
⑥1molCO2中含有1mol碳和2mol氧
A.①②③ B.②③④ C.②④⑥ D.全部
D
第三节 化学中常用的物理量
——物质的量
鲁科版2019必修第一册
第一章 认识化学科学
第1课时 物质的量、摩尔质量
学习目标
评价目标
1.认识物质的量 n 及其单位——摩尔 mol
2.认识阿伏加德罗常数的含义与应用
3.知道物质的量 n 与微观粒子数 NA 、质量m之间的关系,并用于进行简单的化学计算
1.通过了解生产生活、科研中的多重计量方法,认识化学计量方法的选择取决于实际需要,发展定量研究的意识。
2.能实现物质的量、离子总数、质量之间的转化,培养宏观辨识与微观探析的学科核心素养。
水是由水分子构成的,一滴水(约0.05mL)中大约含有17万亿亿个水分子,这么多水分子如果让10亿人去数,每人每分钟数100个,需要3万多年才能数完。
微观粒子极小,数量极大,根本无法逐个数数。
怎样才能既科学又方便快捷地知道:
一定质量(或体积)的水中含有多
少个水分子呢?
联想 · 质疑
化零为整
化整为零
个数(N)
1堆的量(NA)
堆数(n)
微粒
1摩尔
物质的量
概念:表示含有一定数目粒子的集合体的物理量
符号:n
单位:摩尔,简称“摩”,符号为mol。
物理量 单位名称 单位符号
长度 l 米 m
质量 m 千克 kg
时间 t 秒 s
电流强度 I 安培 A
热力学温度 T 开尔文 K
发光强度 I(Iv) 坎德拉 cd
国际单位制(SI)的7个基本物理量
物质的量 n
摩尔
mol
一、物质的量
X mol H2O
指定微粒符号或名称
单位
数值
如:1 mol Fe、1 mol H2、1 mol Na+。
1 mol 铁原子
1 mol 氢分子
1 mol 钠离子
物质的量的规范使用方法
① “物质的量”是专有名词,不能添字减字。
(分子、原子、离子、质子、中子、电子…)
② 只能用于衡量物质所含微观粒子多少的物理量,不能描述宏观物体。
1、判断
(1)“物质的量”也就是“物质的数量”( )
(2)1mol小米 ( )
(3)5mol e- ( )
(4)1mol氧 ( )
(5)1molNa+ ( )
(6)摩尔和长度、质量一样,是七个基本物理量之一 ( )
“物质的量”是一个整体,不能拆分
或者增添任何字
“物质的量”描述对象的是微观粒子
使用“物质的量”时注明微粒名称
数字+mol+化学符号
×
×
×
√
√
×
迁移 · 应用
国际计量大会规定:1mol物质中包含阿伏伽德罗常数个基本单元,也即以0.012kg12C中所含的原子数目
1摩尔的微粒数量是多少呢?
二、阿伏伽德罗常数
0.012kg 12C中所含的微粒数为NA个
6.02×1023
NA
mol-1
NA≈6.02×1023mol-1
1mol任何微观粒子所含的微粒数为NA个
阿伏加德罗,意大利化学家。在化学上的重大贡献是建立分子学说。1摩尔粒子的粒子数已被测定为6.02214076×10 ,为了纪念阿伏加德罗的伟大功绩,被命名为阿伏加德罗常数。它是自然科学中的基本常数之一。
1.概念:
2.精确值:
3.近似值:
4.符号:
5.单位:
n(物质的量) N(粒子总数)
1mol H2O NA个H2O
2mol H2O 2× NA个H2O
……
……
n mol H2O
n× NA个H2O
n、NA、N之间的关系
物质的量(n) 微粒总数(N)
×NA
÷NA
N = n · NA
n = ——— 或
N
NA
( )H
O( )
( )氢原子
氧原子( )
微粒数
物质的量
6.02×1023×2 个
2 mol
1 mol
6.02×1023 个
6.02×1023 个水分子
迁移 · 应用
1mol H2O
原子的物质的量=分子(微粒)物质的量×1个分子(微粒)中所含这种原子个数
化学式中:
角标比=个数比=物质的量比
从新的角度认识物质组成:
1molH2O含有2molH和1molO
2、填空
①1 mol H2SO4中含有——————————————个硫酸分子。
②0.5 mol O2中含有氧分子————————————————个。
③0.5 mol CH4约含有___________________个甲烷分子,含有_________________个氢原子,所含原子总数为___________________个。
④1 mol K2SO4中含___mol 氧原子,___mol 原子。
6.02×1023 或 NA
3.01×1023或 0.5NA
3.01×1023或 0.5NA
1.204×1024或 2NA
1.505 ×1024 或 2.5NA
4
7
化学式 相对原子(分子)质量 每个粒子的质量(g/个) 1摩物质含有的粒子数(个) 1摩物质质量(g)
Fe 56 9.288×10-23
H2SO4 98 1.628×10-22
H2O 18 2.990×10-23
NA
NA
NA
56
98
18
1 mol 物质的质量在数值上有什么特点?
1 mol 任何物质的质量,以 g 为单位时,在数值上等于它的相对原子(分子)质量。
交流 · 研讨
三、摩尔质量
②符号:
①概念:
③数值:
④公式:
M =
m
n
单位物质的量的物质所具有的质量。
M
单位:
g· mol-1
kg· mol-1
等于该物质的相对原子质量或相对分子质量
物质的量为1mol的几种物质
32 g S
63.5 g Cu
27 g Al
65 g Zn
58.5 g NaCl
56 g Fe
18 g H2O
342 g 蔗糖
n = m / M
1.下列说法中正确的是( )
A.水的摩尔质量是18g
B.1molCO2的质量为44g·mol-1
C.2克氢气所含原子数目为NA
D.14g CO的物质的量为0.5mol
2.下列各组物质,所含原子数最多的是( )
A.0.4molO2 B.2g氢气
C.6.02×1023个硫酸分子 D.4℃时5.4mL水
D
C
迁移 · 应用
÷ M
× M
物质的质量m (g)
× NA
÷ NA
物质的量
n (mol)
微粒数
N (个)
n =
N
NA
=
m
M
物质的量是一个桥梁,可连接宏观质量m与微观粒子数N
课 堂 小 结
课 堂 评 价
1.下列说法正确的是( )
A.物质的量和摩尔是两个不同的物理量
B.摩尔是物质的量的单位,1摩尔任何物质约含有6.02×1023个原子
C.阿伏加德罗常数数值约为6.02×1023
D.2molNaOH的摩尔质量为1 molNaOH的摩尔质量的两倍
C
B
2.设 NA 代表阿伏加德罗常数的值,下列说法中正确的是( )
A.2.3 g 钠由原子变成离子时,失去的电子数为 0.2NA
B.0.2NA 个硫酸分子与19.6 g 磷酸含有相同的氧原子数
C.28 g 氮气所含的原子数为NA
D.NA 个氧分子与 NA 个氢分子的质量比为8∶1
3. 下列叙述错误的是( )
①摩尔是国际单位制中七个基本物理量之一
②1mol任何物质都含有约6.02×1023个原子
③6.02×1023就是阿伏加德罗常数
④氢原子的摩尔质量是1g
⑤HCl的摩尔质量等于1molHCl分子的质量
⑥1molCO2中含有1mol碳和2mol氧
A.①②③ B.②③④ C.②④⑥ D.全部
D
