人教版 化学 选择性必修2 3.2 共价晶体与分子晶体(24张)
文档属性
| 名称 | 人教版 化学 选择性必修2 3.2 共价晶体与分子晶体(24张) |  | |
| 格式 | pptx | ||
| 文件大小 | 16.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 12:30:09 | ||
图片预览






文档简介
(共24张PPT)
第2节 共价晶体与分子晶体
【学习目标】
1.通过搭建和观察模型,认识共价晶体和分子晶体的结构特点,认识微粒的堆积方式和晶胞特征,发展学生感知和识别模型的能力,发展证据推理与模型认知的化学核心素养。
2.学会通过微粒种类和微粒间作用力判断晶体类型,推测晶体性质,发展宏观辨识与微观探析的化学核心素养。
meiyangyang8602
meiyangyang8602
科学研究表明,30 亿年前,在地壳下 200 km 左右的地幔中,处在高温、高压岩浆中的碳元素逐渐形成了具有正四面体结构的金刚石。火山爆发时,金刚石夹在岩浆中上升到接近地表时冷却,形成含有少量金刚石的原生矿床。金刚石具有诸多不同凡响的优良性质∶ 熔点高,不导电,硬度极高。这些性质显然是由金刚石的结构决定的。那么,金刚石具有怎样的结构呢
【情境导入】
没有金刚钻不敢揽瓷器活 钻石恒久远,一颗永流传
【问题组一】结合自己拼装制作的金刚石晶体模型,回答下列问题:
1. 在金刚石晶体中,C采取什么杂化方式?每个C与多少个C成键?最小碳环由多少个碳原子组成?它们是否在同一平面内?
2. 在金刚石晶体中,C原子个数与C—C键数之比为多少?
3. 12克金刚石中C—C键数为多少NA?
4. 金刚石的晶胞,与我们上节课学的是哪种晶胞相似?一个金刚石晶胞占有多少个碳原子?
1.概念:
【小结1】共价晶体的结构:
3、组成微粒:
4、微粒间作用力:
原子
共价键
相邻原子间以共价键相结合而形成空间立体网状结构的晶体.
2、共价晶体结构特点:
空间立体网状结构
共价晶体
构成粒子
原子
粒子间的作用力
共价键
共价晶体原子间以较强的共价键相结合。共价键具有方向性和饱和性。共价晶体中的微粒堆积不服从紧密堆积原理。
5、常见的共价晶体:
物质种类 实例
某些_____
某些______
某些___
非金属单质
非金属化合物
氧化物
晶体硼、金刚石、晶体硅、晶体锗等
碳化硅(SiC)、氮化硅(Si3N4)、氮化硼(BN)等
二氧化硅(SiO2)等
Si
O
【问题组二】
1.金刚石与晶体硅、碳化硅性质相似,你预测晶体硅和碳化硅的结构与晶胞是什么样的?
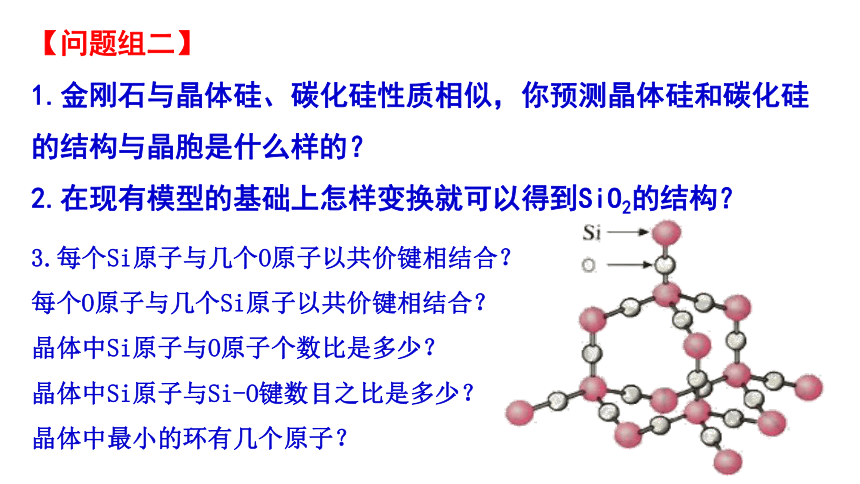
2.在现有模型的基础上怎样变换就可以得到SiO2的结构?
3.每个Si原子与几个O原子以共价键相结合?
每个O原子与几个Si原子以共价键相结合?
晶体中Si原子与O原子个数比是多少?
晶体中Si原子与Si-O键数目之比是多少?
晶体中最小的环有几个原子?
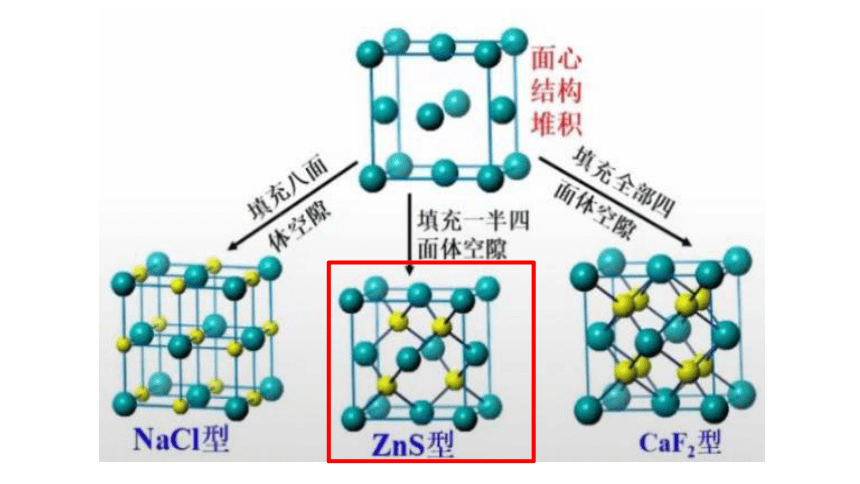
1. SiC晶体的结构类似于金刚石晶体结构,其中碳原子和硅原子的位置是交替的,所以在整个晶体中硅原子与碳原子个数比为1:1。
2. 每个Si原子与4个O原子紧邻成键,每个O原子与2个Si原子紧邻成键。Si原子数与O原子数之比为1:2。 晶体中Si原子与Si-O键数目之比是1:4。晶体中的最小环为十二元环,其中有6个Si原子和6个O原子 。
【小结2】
二氧化硅是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α -SiO2)。低温石英的结构中有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有手性。
氧硅四面体构成的螺旋链
石英的左、右型晶体
拓展视野
二氧化硅的用途
玻璃
单晶硅
水泥
硅光电池
芯片
光纤
1.碳化硅硬度大,具有耐热性、耐氧化性和耐腐蚀性,可用作耐磨料、耐火材料、电热元件等。结合此表总结共价晶体的性质。
【问题组三】
2.刚蒸熟的米饭中吃到一粒沙子,你能总结出二氧化硅有哪些性质
3. 结合课本的数据总结共价晶体的性质。
(1)熔沸点很高
(2)硬度很大
(3)一般不导电
(4)难溶于一些常见的溶剂
1.共价晶体的物理特性:
2.原子晶体硬度、熔沸点比较规律:
在共价键形成的共价晶体中,原子半径小的,键长短,键能大,晶体的熔、沸点高、硬度大。
【小结3】
共价晶体由于原子间以较强的共价键相结合,熔化时必需破坏共价键,而破坏它们需要很高的温度,所以共价晶体具有很高的熔点。
【问题组四】
1.找到干冰的晶胞模型,观察干冰与碘的晶体结构,思考回答下列问题:
构成碘、干冰晶体的微粒是什么?微粒间的作用力是什么?碘、干冰晶体属于哪种晶体类型?
2. 如图描述干冰和碘晶体的晶胞结构?
3. 计算一个干冰晶胞、碘晶胞中实际拥有几个分子?每个CO2分子周围有几个距它最近的分子?每个碘分子周围有几个距它最近的分子?
4. 分子晶体都服从紧密堆积吗,为什么?
【小结4】
1.碘晶体的晶胞是面心立方晶胞,每个晶胞中实际拥有的碘分子数为4;与一个碘分子相邻的碘分子的个数为12,距离最近的有4个。
2.干冰晶体中晶胞的类型是面心立方晶胞,平均每个晶胞占有CO2分子的个数为4,每个CO2分子周围有12个与之紧邻且等距的CO2分子。
C60
冰
【问题组五】请根据表中所列数据讨论:
(1)影响分子晶体的熔沸点高低的原因是什么?
哪些方法可比较分子晶体的熔沸点?
(2)依据分子晶体的结构特点,判断其物理性质有哪些特点?
(3)一般情况下,分子晶体的熔点为什么比离子晶体和原子晶体低?
【小结5】
1.分子晶体熔沸点比较的规律:
(1) 形成分子间氢键:熔沸点升高;形成分子内氢键:熔沸点降低。
(2) 组成和结构相似无氢键: 相对分子质量大,范德华力越强熔沸点越高。
(3)看状态:一般来说 固体>液体>气体
2.分子晶体物理性质的特点:
(1)熔点、沸点较低;
(2)较小的硬度;
(3)一般都是绝缘体,熔融状态也不导电。
分子晶体
构成粒子
分子
粒子间的作用力
分子间作用力
【问题组六】
常温下,c做无规则的运动。0 ℃以下,水凝结为冰,其中的水分子排列由杂乱无序变得十分有序。观察图,思考∶
1.冰晶体中存在着哪几种微粒间的相互作用 这对冰晶体的结构与性质产生了怎样的影响
2.利用冰晶体的结构模型认识分子晶体的结构特征每个H2O周围有几个紧密相邻的H2O?
3.为什么冰刚刚融化时,密度变大,4 ℃后密度又变小?
4.如何判断一种晶体为分子晶体?
冰晶体中的水分子的空间利用率不高,留有相当大的空隙,其密度比液态水的小。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,才由于热运动加剧,分子间距离加大,密度渐渐减小
【小结6】分子晶体的判断方法
1.依据物质的类别判断
部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物都是分子晶体。
2.依据组成晶体的粒子及粒子间作用判断
3.依据物质的性质判断
晶体结构复杂性的原因为:一方面,物质组成的复杂性导致晶体中存在多种不同微粒以及不同的微粒间作用,这也使这类晶体具有重要应用。另一方面,金属键、离子键、共价键、配位键等都是化学键的典型模型,但是,原子之间形成的化学键往往是介于典型模型之间的过渡状态。由于微粒间的作用存在键型过渡,即使组成简单的晶体,也可能是居于金属晶体、离子晶体、共价晶体、分子晶体之间的过渡状态,形成过渡晶体。
金属晶体、离子晶体、共价晶体、分子晶体等模型都是典型的晶体结构模型,大多数实际晶体结构要复杂得多,都是过渡型或混合型的。请大家根据前面所学内容,总结归纳四种晶体的类型的比较,完成表格。
【本课小结】
微粒种类
微粒间作用力
结构
性质
应用
晶体类型
晶体的熔沸点、硬度
第2节 共价晶体与分子晶体
【学习目标】
1.通过搭建和观察模型,认识共价晶体和分子晶体的结构特点,认识微粒的堆积方式和晶胞特征,发展学生感知和识别模型的能力,发展证据推理与模型认知的化学核心素养。
2.学会通过微粒种类和微粒间作用力判断晶体类型,推测晶体性质,发展宏观辨识与微观探析的化学核心素养。
meiyangyang8602
meiyangyang8602
科学研究表明,30 亿年前,在地壳下 200 km 左右的地幔中,处在高温、高压岩浆中的碳元素逐渐形成了具有正四面体结构的金刚石。火山爆发时,金刚石夹在岩浆中上升到接近地表时冷却,形成含有少量金刚石的原生矿床。金刚石具有诸多不同凡响的优良性质∶ 熔点高,不导电,硬度极高。这些性质显然是由金刚石的结构决定的。那么,金刚石具有怎样的结构呢
【情境导入】
没有金刚钻不敢揽瓷器活 钻石恒久远,一颗永流传
【问题组一】结合自己拼装制作的金刚石晶体模型,回答下列问题:
1. 在金刚石晶体中,C采取什么杂化方式?每个C与多少个C成键?最小碳环由多少个碳原子组成?它们是否在同一平面内?
2. 在金刚石晶体中,C原子个数与C—C键数之比为多少?
3. 12克金刚石中C—C键数为多少NA?
4. 金刚石的晶胞,与我们上节课学的是哪种晶胞相似?一个金刚石晶胞占有多少个碳原子?
1.概念:
【小结1】共价晶体的结构:
3、组成微粒:
4、微粒间作用力:
原子
共价键
相邻原子间以共价键相结合而形成空间立体网状结构的晶体.
2、共价晶体结构特点:
空间立体网状结构
共价晶体
构成粒子
原子
粒子间的作用力
共价键
共价晶体原子间以较强的共价键相结合。共价键具有方向性和饱和性。共价晶体中的微粒堆积不服从紧密堆积原理。
5、常见的共价晶体:
物质种类 实例
某些_____
某些______
某些___
非金属单质
非金属化合物
氧化物
晶体硼、金刚石、晶体硅、晶体锗等
碳化硅(SiC)、氮化硅(Si3N4)、氮化硼(BN)等
二氧化硅(SiO2)等
Si
O
【问题组二】
1.金刚石与晶体硅、碳化硅性质相似,你预测晶体硅和碳化硅的结构与晶胞是什么样的?
2.在现有模型的基础上怎样变换就可以得到SiO2的结构?
3.每个Si原子与几个O原子以共价键相结合?
每个O原子与几个Si原子以共价键相结合?
晶体中Si原子与O原子个数比是多少?
晶体中Si原子与Si-O键数目之比是多少?
晶体中最小的环有几个原子?
1. SiC晶体的结构类似于金刚石晶体结构,其中碳原子和硅原子的位置是交替的,所以在整个晶体中硅原子与碳原子个数比为1:1。
2. 每个Si原子与4个O原子紧邻成键,每个O原子与2个Si原子紧邻成键。Si原子数与O原子数之比为1:2。 晶体中Si原子与Si-O键数目之比是1:4。晶体中的最小环为十二元环,其中有6个Si原子和6个O原子 。
【小结2】
二氧化硅是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α -SiO2)。低温石英的结构中有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有手性。
氧硅四面体构成的螺旋链
石英的左、右型晶体
拓展视野
二氧化硅的用途
玻璃
单晶硅
水泥
硅光电池
芯片
光纤
1.碳化硅硬度大,具有耐热性、耐氧化性和耐腐蚀性,可用作耐磨料、耐火材料、电热元件等。结合此表总结共价晶体的性质。
【问题组三】
2.刚蒸熟的米饭中吃到一粒沙子,你能总结出二氧化硅有哪些性质
3. 结合课本的数据总结共价晶体的性质。
(1)熔沸点很高
(2)硬度很大
(3)一般不导电
(4)难溶于一些常见的溶剂
1.共价晶体的物理特性:
2.原子晶体硬度、熔沸点比较规律:
在共价键形成的共价晶体中,原子半径小的,键长短,键能大,晶体的熔、沸点高、硬度大。
【小结3】
共价晶体由于原子间以较强的共价键相结合,熔化时必需破坏共价键,而破坏它们需要很高的温度,所以共价晶体具有很高的熔点。
【问题组四】
1.找到干冰的晶胞模型,观察干冰与碘的晶体结构,思考回答下列问题:
构成碘、干冰晶体的微粒是什么?微粒间的作用力是什么?碘、干冰晶体属于哪种晶体类型?
2. 如图描述干冰和碘晶体的晶胞结构?
3. 计算一个干冰晶胞、碘晶胞中实际拥有几个分子?每个CO2分子周围有几个距它最近的分子?每个碘分子周围有几个距它最近的分子?
4. 分子晶体都服从紧密堆积吗,为什么?
【小结4】
1.碘晶体的晶胞是面心立方晶胞,每个晶胞中实际拥有的碘分子数为4;与一个碘分子相邻的碘分子的个数为12,距离最近的有4个。
2.干冰晶体中晶胞的类型是面心立方晶胞,平均每个晶胞占有CO2分子的个数为4,每个CO2分子周围有12个与之紧邻且等距的CO2分子。
C60
冰
【问题组五】请根据表中所列数据讨论:
(1)影响分子晶体的熔沸点高低的原因是什么?
哪些方法可比较分子晶体的熔沸点?
(2)依据分子晶体的结构特点,判断其物理性质有哪些特点?
(3)一般情况下,分子晶体的熔点为什么比离子晶体和原子晶体低?
【小结5】
1.分子晶体熔沸点比较的规律:
(1) 形成分子间氢键:熔沸点升高;形成分子内氢键:熔沸点降低。
(2) 组成和结构相似无氢键: 相对分子质量大,范德华力越强熔沸点越高。
(3)看状态:一般来说 固体>液体>气体
2.分子晶体物理性质的特点:
(1)熔点、沸点较低;
(2)较小的硬度;
(3)一般都是绝缘体,熔融状态也不导电。
分子晶体
构成粒子
分子
粒子间的作用力
分子间作用力
【问题组六】
常温下,c做无规则的运动。0 ℃以下,水凝结为冰,其中的水分子排列由杂乱无序变得十分有序。观察图,思考∶
1.冰晶体中存在着哪几种微粒间的相互作用 这对冰晶体的结构与性质产生了怎样的影响
2.利用冰晶体的结构模型认识分子晶体的结构特征每个H2O周围有几个紧密相邻的H2O?
3.为什么冰刚刚融化时,密度变大,4 ℃后密度又变小?
4.如何判断一种晶体为分子晶体?
冰晶体中的水分子的空间利用率不高,留有相当大的空隙,其密度比液态水的小。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,才由于热运动加剧,分子间距离加大,密度渐渐减小
【小结6】分子晶体的判断方法
1.依据物质的类别判断
部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物都是分子晶体。
2.依据组成晶体的粒子及粒子间作用判断
3.依据物质的性质判断
晶体结构复杂性的原因为:一方面,物质组成的复杂性导致晶体中存在多种不同微粒以及不同的微粒间作用,这也使这类晶体具有重要应用。另一方面,金属键、离子键、共价键、配位键等都是化学键的典型模型,但是,原子之间形成的化学键往往是介于典型模型之间的过渡状态。由于微粒间的作用存在键型过渡,即使组成简单的晶体,也可能是居于金属晶体、离子晶体、共价晶体、分子晶体之间的过渡状态,形成过渡晶体。
金属晶体、离子晶体、共价晶体、分子晶体等模型都是典型的晶体结构模型,大多数实际晶体结构要复杂得多,都是过渡型或混合型的。请大家根据前面所学内容,总结归纳四种晶体的类型的比较,完成表格。
【本课小结】
微粒种类
微粒间作用力
结构
性质
应用
晶体类型
晶体的熔沸点、硬度
