鲁科版化学必修第一册 3.2 《硫及其化合物》(23张)
文档属性
| 名称 | 鲁科版化学必修第一册 3.2 《硫及其化合物》(23张) |  | |
| 格式 | pptx | ||
| 文件大小 | 83.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 13:04:11 | ||
图片预览






文档简介
(共23张PPT)
硫的转化模型的应用
—建立一所硫酸工厂
《硫及其化合物》第三课时
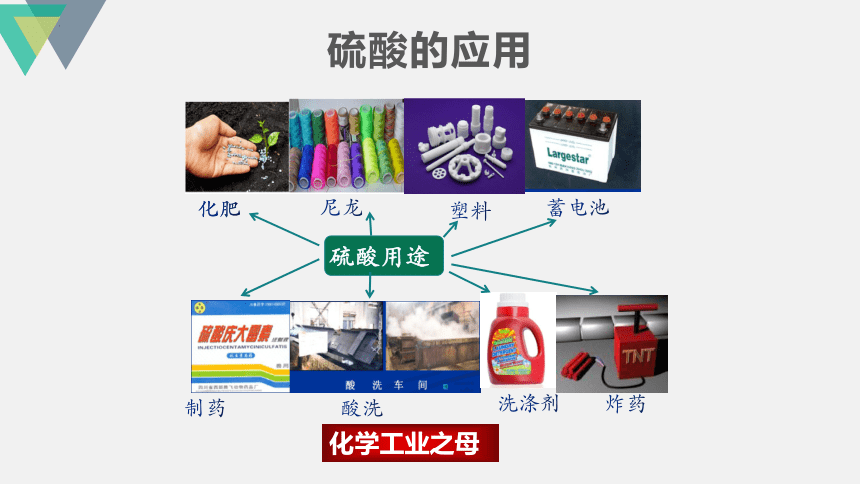
硫酸的应用
化学工业之母
制药
化肥
尼龙
塑料
酸洗
洗涤剂
化肥
蓄电池
炸药
硫酸用途
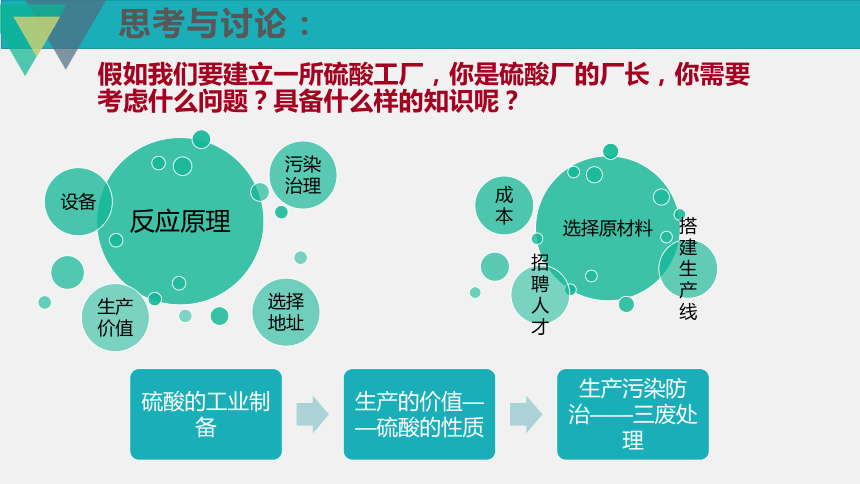
假如我们要建立一所硫酸工厂,你是硫酸厂的厂长,你需要考虑什么问题?具备什么样的知识呢?
思考与讨论:
课时目标
1.以建立一所硫酸工厂为例,能从物质类别和元素价态变化两个角度说明含硫物质的转化路径。
2.预测硫酸的化学性质及变化,设计实验进行初步验证,并能分析解释有关实验现象。
3.运用物质转化模型去解决生产、生活和环境保护中的实际问题,如工业处理废气、工业烟气脱硫,发展创新意识,培养社会责任感。
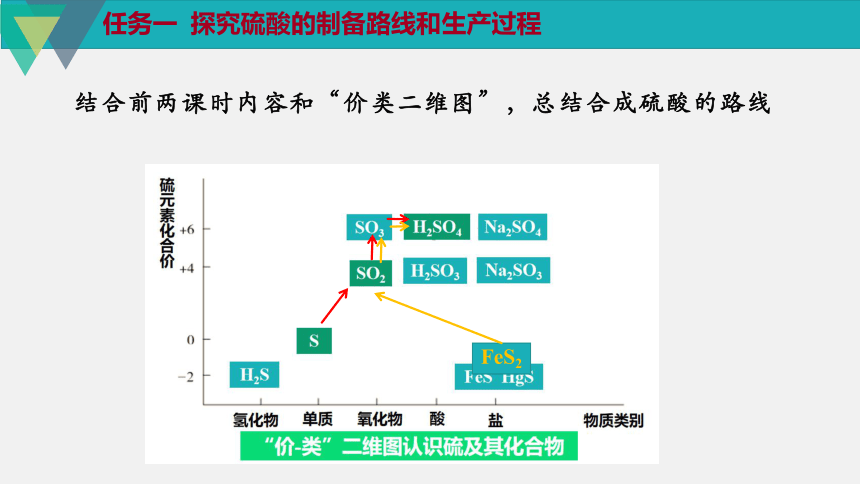
任务一 探究硫酸的制备路线和生产过程
FeS2
结合前两课时内容和“价类二维图”,总结合成硫酸的路线
问题
1.如何提高反应速率,提高
原料的利用率?
2.接触室为什么不能直接用
水吸收SO3?
工业接触法制备硫酸
将加入沸腾炉里的矿石提前粉碎
若用水吸收,会形成硫酸酸雾,而用98%的浓硫酸吸收SO3,可以避免产生大量的热和酸雾,提高吸收率,提高产量。
【任务二】探究硫酸工业生产的价值
浓硫酸的物理性质
粘稠油状液体,
密度比水 ,
沸点 ,难挥发。
能与水以任意比互溶,
溶解时放出大量的热
无色
大
高
质量分数为98%的浓硫酸
【任务二】探究硫酸工业生产的价值
活动1 预测硫酸的化学性质
浓硫酸
稀硫酸
结合“价类二维图”,预测硫酸的性质。将你的想法填写在学案上,组内交流
硫酸都可以转变成哪些含硫物质?如何实现变化?
【任务二】探究硫酸工业生产的价值
复习稀硫酸的化学性质
(1)与指示剂作用:
(2)与碱反应
(3)与碱性氧化物反应
(4)与金属反应(氢前)
(5)与某些盐反应
遇紫色石蕊试液变红
H2SO4+ 2NaOH = Na2SO4 + 2H2O
H2SO4 + CaO = CaSO4 + H2O
H2SO4 + Zn = ZnSO4 + H2↑
H2SO4 + BaCl2 = BaSO4↓+ HCl
酸的通性(H2SO4=2H++SO42-,二元强酸、强电解质)
【任务二】探究硫酸工业生产的价值
活动2 实验探究浓硫酸的吸水性和脱水性
用品:表面皿,药匙,火柴棒,浓硫酸,五水硫酸铜
实验编号 操作 现象 原因分析 结论
1
2
实验注意事项:
1.浓硫酸有腐蚀性,不可直接触摸!
2.一人操作,一人辅助,两人都需要带上橡胶手套!
3.熟悉实验内容,明确实验目的,记牢实验步骤,认真观察实验现象,做好记录!
4.按照提供的浓硫酸用量进行实验!
由蓝色变白色
浓硫酸有吸水性
火柴棒变黑
浓硫酸有脱水性
生成了碳单质,浓硫酸将火柴棍中的氢、氧元素按水的元素组成比脱去
取半勺五水硫酸铜,置于表面皿上,滴入5滴浓硫酸,静置片刻,观察现象
将火柴棒置于表面皿上,向火柴棒上滴加2滴浓硫酸,观察实验现象
【任务二】探究硫酸工业生产的价值
吸水性 脱水性
区别
变化
用途
如何正确理解浓硫酸的吸水性,脱水性?
①能干燥:O2、H2、CO2、CO、Cl2、HCl、SO2、CH4
②不能干燥碱性气体:NH3
有水则吸 无水则脱
吸收物质中本身含有的水,
包括结晶水
物质中不含水,将有机物中的氢、氧元素按水的组成比(2:1)脱去
去结晶水是化学变化,
干燥物质是物理变化
作干燥剂
化学变化
③不能干燥还原性气体:H2S、HI、HBr
【任务二】探究硫酸工业生产的价值
活动3 探究浓硫酸的强氧化性
【预测】浓硫酸与铜反应可能的产物什么,如何验证?
Cu + H2SO4(浓)
+6
0
??
【任务二】探究硫酸工业生产的价值
Cu + 2H2SO4(浓)== CuSO4 + SO2↑ + 2H2O
△
思考并交流:
1.浓硫酸表现出什么性质?
2.1molCu能否与2mol 浓硫酸产生1molSO2?
3.浓硫酸与足量锌反应产物是什么?
4.从微观角度分析,稀硫酸和浓硫酸性质表现差异性的原因是什么?
[现象]:
铜丝溶解,表面变黑,
生成能使紫色石蕊溶液变红,使品红溶液褪色的气体,
反应后生成物的水溶液呈蓝色。
[结论]:
浓硫酸与铜反应
【任务二】探究硫酸工业生产的价值
【思考】为什么可以用铁或铝容器储存浓硫酸,可以用铁罐车运输浓硫酸?
钝化:在常温下,浓H2SO4与铁、铝接触时,会使金属表面生成一层致密的氧化物薄膜而钝化,阻止了内部的金属继续与硫酸反应,因此,冷的浓H2SO4能用铁质或铝质容器储存。
化学反应
常温时,浓硫酸与铁、铝反生钝化
2Fe + 6H2SO4(浓) Fe2(SO4)3 + 3SO2↑+6H2O
【任务二】探究硫酸工业生产的价值
[反应]:
体现浓硫酸的
C12H22O11 12C + 11H2O
浓硫酸
1)蔗糖由白变黑
2)放出大量热
3)体积膨胀
4)蘸有品红溶液和酸性高锰酸钾溶液的棉花分别褪色
活动4 探究蔗糖与浓硫酸反应
C+2H2SO4 (浓) = CO2↑+2SO2↑+2H2O
△
操作:在废弃塑料瓶中放入少量蔗糖(C12H22O11 ),加入几滴水,然后加入5 mL浓硫酸,用玻璃棒迅速搅拌,(瓶口内部放有分别蘸取酸性高锰酸钾和品红溶液的棉花),将导管插入盛有氢氧化钠溶液的另一个塑料瓶中。
脱水性和氧化性.
脱水性
有气体生成
放热
生成SO2
[现象]:
[结论]:
黑面包实验
【任务二】探究硫酸工业生产的价值
活动4 探究蔗糖与浓硫酸反应
教材中的装置
改进后的装置
实验装置价廉易得,操作简单。
对SO2进行有效处理,绿色安全环保。
对生成的SO2进行性质检验
改进后的装置有哪些优点?
生产带来的污染问题 ... ...
【任务三】探究硫酸生产污染防治——三废处理
生产中“三废”的处理
Ca(OH)2中和
炼铁或者含铁系列产品
提高转化率
【任务三】探究硫酸生产污染防治——三废处理
请同学们结合“价类二维图”,思考如何解决SO2废气的污染?小组内交流想法
【任务三】探究硫酸生产污染防治——三废处理
FeS2
S
SO2
O2
SO3
H2O
H2SO4(尾气SO2少量)
CaSO3
SO2 + CaSO4
石灰乳
含量较高
再利用
CaSO4·2H2O
尾气的净化
【任务三】探究硫酸生产污染防治——三废处理
FeS2
S
SO2
O2
SO3
H2O
H2SO4(尾气SO2少量)
(NH4)2SO3
NH4HSO3
SO2+(NH4)2SO4
NH3
再利用
化肥
绿色化学... ...
重大科技创新成果是国之重器,国之利器,必须牢牢掌握在自己手上,必须依靠自力更生,自主创新。 ——习近平总书记的讲话
回顾总结
1.工业制备硫酸的思路?
H2SO4的工业制备
2.同价态和不同价态含硫物质之间的转化的分析模型?
生产的价值---硫酸的性质
生产污染防治——三废处理
谈谈你有哪些收获?
课后作业
查阅相关资料,简述硫在自然界的循环过程,思考人类活动对硫的循环有什么影响?
硫的转化模型的应用
—建立一所硫酸工厂
《硫及其化合物》第三课时
硫酸的应用
化学工业之母
制药
化肥
尼龙
塑料
酸洗
洗涤剂
化肥
蓄电池
炸药
硫酸用途
假如我们要建立一所硫酸工厂,你是硫酸厂的厂长,你需要考虑什么问题?具备什么样的知识呢?
思考与讨论:
课时目标
1.以建立一所硫酸工厂为例,能从物质类别和元素价态变化两个角度说明含硫物质的转化路径。
2.预测硫酸的化学性质及变化,设计实验进行初步验证,并能分析解释有关实验现象。
3.运用物质转化模型去解决生产、生活和环境保护中的实际问题,如工业处理废气、工业烟气脱硫,发展创新意识,培养社会责任感。
任务一 探究硫酸的制备路线和生产过程
FeS2
结合前两课时内容和“价类二维图”,总结合成硫酸的路线
问题
1.如何提高反应速率,提高
原料的利用率?
2.接触室为什么不能直接用
水吸收SO3?
工业接触法制备硫酸
将加入沸腾炉里的矿石提前粉碎
若用水吸收,会形成硫酸酸雾,而用98%的浓硫酸吸收SO3,可以避免产生大量的热和酸雾,提高吸收率,提高产量。
【任务二】探究硫酸工业生产的价值
浓硫酸的物理性质
粘稠油状液体,
密度比水 ,
沸点 ,难挥发。
能与水以任意比互溶,
溶解时放出大量的热
无色
大
高
质量分数为98%的浓硫酸
【任务二】探究硫酸工业生产的价值
活动1 预测硫酸的化学性质
浓硫酸
稀硫酸
结合“价类二维图”,预测硫酸的性质。将你的想法填写在学案上,组内交流
硫酸都可以转变成哪些含硫物质?如何实现变化?
【任务二】探究硫酸工业生产的价值
复习稀硫酸的化学性质
(1)与指示剂作用:
(2)与碱反应
(3)与碱性氧化物反应
(4)与金属反应(氢前)
(5)与某些盐反应
遇紫色石蕊试液变红
H2SO4+ 2NaOH = Na2SO4 + 2H2O
H2SO4 + CaO = CaSO4 + H2O
H2SO4 + Zn = ZnSO4 + H2↑
H2SO4 + BaCl2 = BaSO4↓+ HCl
酸的通性(H2SO4=2H++SO42-,二元强酸、强电解质)
【任务二】探究硫酸工业生产的价值
活动2 实验探究浓硫酸的吸水性和脱水性
用品:表面皿,药匙,火柴棒,浓硫酸,五水硫酸铜
实验编号 操作 现象 原因分析 结论
1
2
实验注意事项:
1.浓硫酸有腐蚀性,不可直接触摸!
2.一人操作,一人辅助,两人都需要带上橡胶手套!
3.熟悉实验内容,明确实验目的,记牢实验步骤,认真观察实验现象,做好记录!
4.按照提供的浓硫酸用量进行实验!
由蓝色变白色
浓硫酸有吸水性
火柴棒变黑
浓硫酸有脱水性
生成了碳单质,浓硫酸将火柴棍中的氢、氧元素按水的元素组成比脱去
取半勺五水硫酸铜,置于表面皿上,滴入5滴浓硫酸,静置片刻,观察现象
将火柴棒置于表面皿上,向火柴棒上滴加2滴浓硫酸,观察实验现象
【任务二】探究硫酸工业生产的价值
吸水性 脱水性
区别
变化
用途
如何正确理解浓硫酸的吸水性,脱水性?
①能干燥:O2、H2、CO2、CO、Cl2、HCl、SO2、CH4
②不能干燥碱性气体:NH3
有水则吸 无水则脱
吸收物质中本身含有的水,
包括结晶水
物质中不含水,将有机物中的氢、氧元素按水的组成比(2:1)脱去
去结晶水是化学变化,
干燥物质是物理变化
作干燥剂
化学变化
③不能干燥还原性气体:H2S、HI、HBr
【任务二】探究硫酸工业生产的价值
活动3 探究浓硫酸的强氧化性
【预测】浓硫酸与铜反应可能的产物什么,如何验证?
Cu + H2SO4(浓)
+6
0
??
【任务二】探究硫酸工业生产的价值
Cu + 2H2SO4(浓)== CuSO4 + SO2↑ + 2H2O
△
思考并交流:
1.浓硫酸表现出什么性质?
2.1molCu能否与2mol 浓硫酸产生1molSO2?
3.浓硫酸与足量锌反应产物是什么?
4.从微观角度分析,稀硫酸和浓硫酸性质表现差异性的原因是什么?
[现象]:
铜丝溶解,表面变黑,
生成能使紫色石蕊溶液变红,使品红溶液褪色的气体,
反应后生成物的水溶液呈蓝色。
[结论]:
浓硫酸与铜反应
【任务二】探究硫酸工业生产的价值
【思考】为什么可以用铁或铝容器储存浓硫酸,可以用铁罐车运输浓硫酸?
钝化:在常温下,浓H2SO4与铁、铝接触时,会使金属表面生成一层致密的氧化物薄膜而钝化,阻止了内部的金属继续与硫酸反应,因此,冷的浓H2SO4能用铁质或铝质容器储存。
化学反应
常温时,浓硫酸与铁、铝反生钝化
2Fe + 6H2SO4(浓) Fe2(SO4)3 + 3SO2↑+6H2O
【任务二】探究硫酸工业生产的价值
[反应]:
体现浓硫酸的
C12H22O11 12C + 11H2O
浓硫酸
1)蔗糖由白变黑
2)放出大量热
3)体积膨胀
4)蘸有品红溶液和酸性高锰酸钾溶液的棉花分别褪色
活动4 探究蔗糖与浓硫酸反应
C+2H2SO4 (浓) = CO2↑+2SO2↑+2H2O
△
操作:在废弃塑料瓶中放入少量蔗糖(C12H22O11 ),加入几滴水,然后加入5 mL浓硫酸,用玻璃棒迅速搅拌,(瓶口内部放有分别蘸取酸性高锰酸钾和品红溶液的棉花),将导管插入盛有氢氧化钠溶液的另一个塑料瓶中。
脱水性和氧化性.
脱水性
有气体生成
放热
生成SO2
[现象]:
[结论]:
黑面包实验
【任务二】探究硫酸工业生产的价值
活动4 探究蔗糖与浓硫酸反应
教材中的装置
改进后的装置
实验装置价廉易得,操作简单。
对SO2进行有效处理,绿色安全环保。
对生成的SO2进行性质检验
改进后的装置有哪些优点?
生产带来的污染问题 ... ...
【任务三】探究硫酸生产污染防治——三废处理
生产中“三废”的处理
Ca(OH)2中和
炼铁或者含铁系列产品
提高转化率
【任务三】探究硫酸生产污染防治——三废处理
请同学们结合“价类二维图”,思考如何解决SO2废气的污染?小组内交流想法
【任务三】探究硫酸生产污染防治——三废处理
FeS2
S
SO2
O2
SO3
H2O
H2SO4(尾气SO2少量)
CaSO3
SO2 + CaSO4
石灰乳
含量较高
再利用
CaSO4·2H2O
尾气的净化
【任务三】探究硫酸生产污染防治——三废处理
FeS2
S
SO2
O2
SO3
H2O
H2SO4(尾气SO2少量)
(NH4)2SO3
NH4HSO3
SO2+(NH4)2SO4
NH3
再利用
化肥
绿色化学... ...
重大科技创新成果是国之重器,国之利器,必须牢牢掌握在自己手上,必须依靠自力更生,自主创新。 ——习近平总书记的讲话
回顾总结
1.工业制备硫酸的思路?
H2SO4的工业制备
2.同价态和不同价态含硫物质之间的转化的分析模型?
生产的价值---硫酸的性质
生产污染防治——三废处理
谈谈你有哪些收获?
课后作业
查阅相关资料,简述硫在自然界的循环过程,思考人类活动对硫的循环有什么影响?
