2024 年各省市高考化学试题汇总(共22份 PDF版,含答案)
文档属性
| 名称 | 2024 年各省市高考化学试题汇总(共22份 PDF版,含答案) |  | |
| 格式 | |||
| 文件大小 | 14.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 12:36:08 | ||
图片预览



文档简介
2024 年各省市高考试题汇总
目录
01-2024 年 新课标卷 ......................................................................................................................... 1
02-2024 年 全国甲卷 ......................................................................................................................... 7
03-2024 年 北京卷 ........................................................................................................................... 15
04-2024 年 天津卷 ........................................................................................................................... 23
05-2024 年 山东卷 ........................................................................................................................... 27
06-2024 年 海南卷 ........................................................................................................................... 35
07-2024 年 浙江卷 1 月 ...................................................................................................................43
08-2024 年 浙江卷 6 月 ................................................................................................................... 53
09-2024 年 江苏卷 ........................................................................................................................... 63
10-2024 年 河北卷 ........................................................................................................................... 71
11-2024 年 广东卷 ........................................................................................................................... 81
12-2024 年 湖南卷 ........................................................................................................................... 89
13-2024 年 湖北卷 ........................................................................................................................... 97
14-2024 年 福建卷 ......................................................................................................................... 105
15-2024 年 重庆卷 ......................................................................................................................... 113
16-2024 年 黑吉辽卷 ..................................................................................................................... 121
17-2024 年 江西卷 ......................................................................................................................... 129
18-2024 年 安徽卷 ......................................................................................................................... 137
19-2024 年 广西卷 ......................................................................................................................... 145
20-2024 年 贵州卷 ......................................................................................................................... 153
21-2024 年 甘肃卷 ......................................................................................................................... 163
22-2024 年 上海卷 ......................................................................................................................... 171
2024 年 各省市高考试题参考答案 ...............................................................................................177
01-2024 年 新课标卷
一、选择题(本题共 7小题,每小题 6分,共 42分)。
7.(2024·全国·新课标卷)文房四宝是中华传统文化的瑰宝。下列有关叙述错误的是
A.羊毛可用于制毛笔,主要成分为蛋白质
B.松木可用于制墨,墨的主要成分是单质碳
C.竹子可用于造纸,纸的主要成分是纤维素
D.大理石可用于制砚台,主要成分为硅酸盐
8.(2024·全国·新课标卷)一种点击化学方法合成聚硫酸酯(W)的路线如下所示:
下列说法正确的是
A.双酚 A 是苯酚的同系物,可与甲醛发生聚合反应
B. 催化聚合也可生成 W
C.生成 W 的反应③为缩聚反应,同时生成
D.在碱性条件下,W 比聚苯乙烯更难降解
9.(2024·全国·新课标卷)实验室中利用下图装置验证铁与水蒸气反应。下列说法错误的是
高温
A.反应为 3Fe(s)+4H2O(g) ===== Fe3O4(s)+4H2(g)
B.酒精灯移至湿棉花下方实验效果更佳
C.用火柴点燃肥皂泡检验生成的氢气
D.使用硬质玻璃试管盛装还原铁粉
1
10.(2024·全国·新课标卷)对于下列过程中发生的化学反应,相应离子方程式正确的是
A -.试管壁上的银镜用稀硝酸清洗:Ag + 2H+ + NO3 = Ag+ + NO2↑+ H2O
B.工业废水中的 Pb2+用 FeS 去除:Pb2+ + S2- = PbS↓
C - -.海水提溴过程中将溴吹入 SO2吸收塔:Br2 + SO2 + 2H 22O = 2Br +SO4 + 4H+
D.用草酸标准溶液测定高锰酸钾溶液的浓度:2MnO-4 +5C2O2-4 +16H+=2Mn2++10CO2↑+8H2O
11.(2024·全国·新课标卷)我国科学家最近研究的一种无机盐 Y3[Z(WX)6]2纳米药物,具有高效的细胞内
亚铁离子捕获和抗氧化能力。W、X、Y、Z 的原子序数依次增加,且 W、X、Y 属于不同族的短周期
元素。W 的外层电子数是其内层电子数的 2 倍,X 和 Y 的第一电离能都比左右相邻元素的高。Z 的 M
层未成对电子数为 4。下列叙述错误的是
A.W、X、Y、Z 四种元素的单质中,Z 的熔点最高
B.在 X 的简单氢化物中,X 原子轨道杂化类型为 sp3
C.Y 的氢氧化物难溶于 NaCl 溶液,可溶于 NH4Cl 溶液
D.Y3[Z(WX)6] -2中,WX 提供电子对与 Z3+形成配位键
12.(2024·全国·新课标卷)一种可植入体内的微型电池工作原理如图所示,通过 CuO 催化消耗血糖发电,
从而控制血糖浓度。当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止
工作。(血糖浓度以葡萄糖浓度计)
电池工作时,下列叙述错误的是
A.电池总反应为:2C6H12O6 + O2 = 2C6H12O7
B.b 电极上 CuO 通过 Cu(Ⅱ)和 Cu(Ⅰ)相互转变起催化作用
C.消耗 18 mg 葡萄糖,理论上 a 电极有 0.4 mmol 电子流入
D.两电极间血液中的 Na+在电场驱动下的迁移方向为 b→a
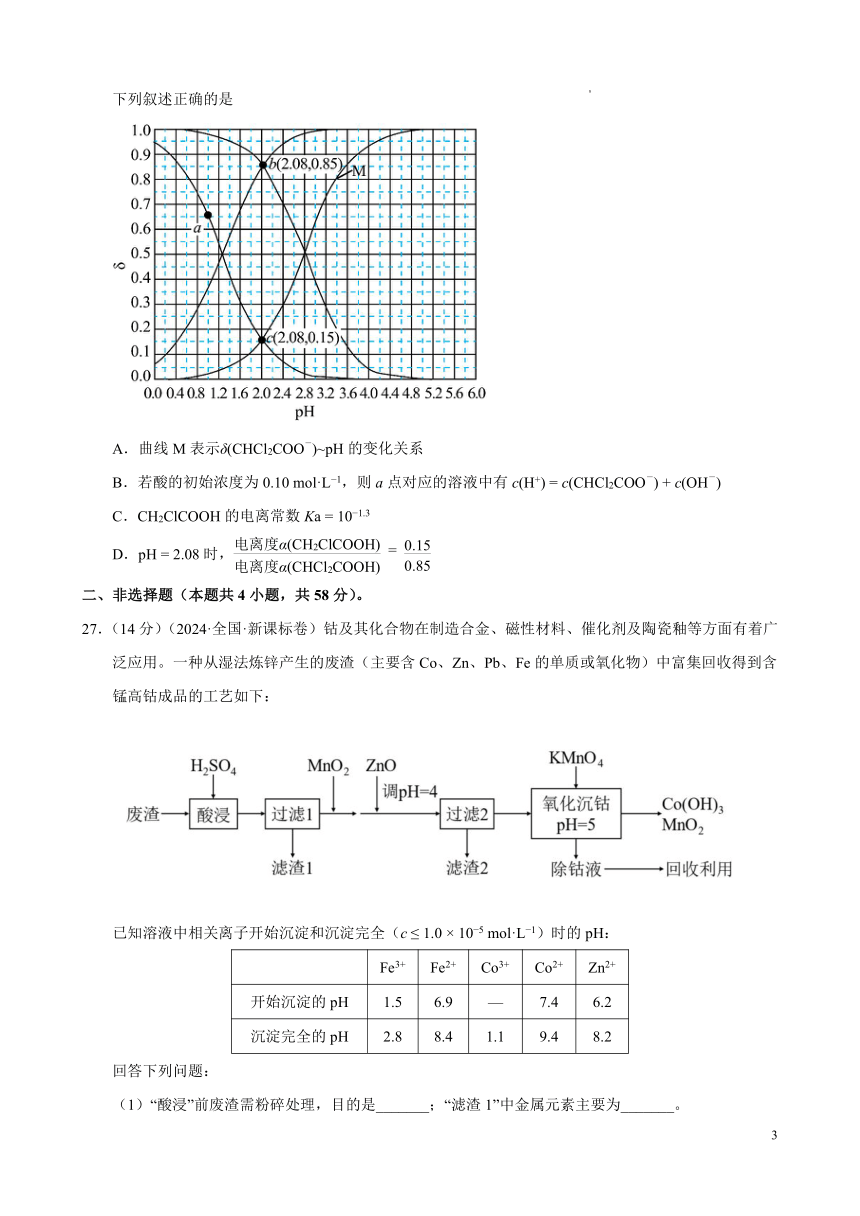
13.(2024·全国·新课标卷)常温下 CH2ClCOOH 和 CHCl2COOH 的两种溶液中,分布系数δ与 pH 的变化关
c(CH -2ClCOO )
系如图所示。[比如:δ(CH ClCOO-2 )= ]
c(CH2ClCOOH) + c(CH2ClCOO-)
2
下列叙述正确的是
A.曲线 M 表示δ(CHCl -2COO )~pH 的变化关系
B.若酸的初始浓度为 0.10 mol·L 1 a c(H+) = c(CHCl COO- -,则 点对应的溶液中有 2 ) + c(OH )
C.CH2ClCOOH 的电离常数 Ka = 10 1.3
电离度
D pH = 2.08 α(CH2ClCOOH) 0.15. 时, =
电离度α(CHCl2COOH) 0.85
二、非选择题(本题共 4小题,共 58分)。
27.(14 分)(2024·全国·新课标卷)钴及其化合物在制造合金、磁性材料、催化剂及陶瓷釉等方面有着广
泛应用。一种从湿法炼锌产生的废渣(主要含 Co、Zn、Pb、Fe 的单质或氧化物)中富集回收得到含
锰高钴成品的工艺如下:
已知溶液中相关离子开始沉淀和沉淀完全(c ≤ 1.0 × 10 5 mol·L 1)时的 pH:
Fe3+ Fe2+ Co3+ Co2+ Zn2+
开始沉淀的 pH 1.5 6.9 — 7.4 6.2
沉淀完全的 pH 2.8 8.4 1.1 9.4 8.2
回答下列问题:
(1)“酸浸”前废渣需粉碎处理,目的是_______;“滤渣 1”中金属元素主要为_______。
3
(2)“过滤 1”后的溶液中加入 MnO2 的作用是_____________________,取少量反应后的溶液,加入
化学试剂_______检验_______,若出现蓝色沉淀,需补加 MnO2。
(3)“氧化沉钴”中氧化还原反应的离子方程式为______________、______________。
(4)“除钴液”中主要的盐有_______(写化学式),残留的 Co3+浓度为_______ mol·L 1。
28.(15 分)(2024·全国·新课标卷)吡咯类化合物在导电聚合物、化学传感器及药物制剂上有着广泛应用。
一种合成 1-(4-甲氧基苯基)-2,5-二甲基吡咯(用吡咯 X 表示)的反应和方法如下:
实验装置如图所示。将 100 mmol 己-2,5-二酮(熔点:-5.5 ℃,密度:0.737 g·cm 3)与 100 mmol
4-甲氧基苯胺(熔点:57 ℃)放入①中,搅拌。
待反应完成后,加入 50%的乙醇溶液,析出浅棕色固体。加热至 65 ℃,至固体溶解,加入脱色剂,
回流 20 min,趁热过滤。滤液静置至室温,冰水浴冷却,有大量白色固体析出。经过滤、洗涤、干燥得到
产品。
回答下列问题:
(1)量取己-2,5-二酮应使用的仪器为________________(填名称)。
(2)仪器①用铁夹固定在③上,③的名称是_______;仪器②的名称是_______。
(3)“搅拌”的作用是________________。
(4)“加热”方式为___________________。
(5)使用的“脱色剂”是________________。
(6)“趁热过滤”的目的是________________________;用____________洗涤白色固体。
(7)若需进一步提纯产品,可采用的方法是_______。
4
29.(14 分)(2024·全国·新课标卷)Ni(CO)4(四羰合镍,沸点 43 ℃)可用于制备高纯镍,也是有机化合
物羰基化反应的催化剂。回答下列问题:
(1)Ni 基态原子价电子的轨道表示式为_______。镍的晶胞结构类型与铜的相同,晶胞体积为 a3,镍
原子半径为_______。
(2)Ni(CO)4 结构如图所示,其中含有σ键的数目为_______,Ni(CO)4 晶体的类型为_______。
(3)在总压分别为 0.10、0.50、1.0、2.0 MPa 下,Ni(s)和 CO(g)反应达平衡时,Ni(CO)4 体积分数 x
与温度的关系如图所示。反应 Ni(s)+4CO(g)= Ni(CO)4 (g)的ΔH_______0(填“大于”或“小于”)。从热力学角
度考虑,_______有利于 Ni(CO)4的生成(写出两点)。p3、100 ℃时 CO 的平衡转化率α=_______,该温度
下平衡常数 Kp =_______ (MPa) 3。
(4)对于同位素交换反应 Ni(C16O)4+C18O → Ni(C16O)3C18O +C16O,20 ℃时反应物浓度随时间的变化
关系为 ct[Ni(C16O)4] = c0[Ni(C16O)4] e k(t k为反应速率常数),则 Ni(C16O)4反应一半所需时间 t1/2 =_______
(用 k表示)。
30.(15 分)(2024·全国·新课标卷)四氟咯草胺(化合物 G)是一种新型除草剂,可有效控制稻田杂草。
G 的一条合成路线如下(略去部分试剂和条件,忽略立体化学)。
5
CH3SO2Cl,(C H ) N)
已知反应Ⅰ:ROH—————————2 —5—3 ——→ROSO2CH3 + (CCH Cl 2
H5)3N·HCl
2 2
已知反应Ⅱ:
R1 为烃基或 H,R、R2、R3、R4为烃基
回答下列问题:
(1)反应①的反应类型为_______;加入 K2CO3 的作用是_______。
(2)D 分子中采用 sp3 杂化的碳原子数是_______。
(3)对照已知反应Ⅰ,反应③不使用(C2H5)3N 也能进行,原因是_______。
(4)E 中含氧官能团名称是_______。
(5)F 的结构简式是_______;反应⑤分两步进行,第一步产物的分子式为 C15H18F3NO4,其结构简式
是_______。
(6)G 中手性碳原子是_______(写出标号)。
(7)化合物 H 是 B 的同分异构体,具有苯环结构,核磁共振氢谱中显示为四组峰,且可以发生已知
反应Ⅱ。则 H 的可能结构是_______。
6
02-2024 年 全国甲卷
一、选择题(本题共 7小题,每小题 6分,共 42分)
7.(2024·全国·甲卷)人类对能源的利用经历了柴薪、煤炭和石油时期,现正向新能源方向高质量发展。
下列有关能源的叙述错误的是
A.木材与煤均含有碳元素 B.石油裂化可生产汽油
C.燃料电池将热能转化为电能 D.太阳能光解水可制氢
8.(2024·全国·甲卷)下列过程对应的离子方程式正确的是
A 2- - +.用氢氟酸刻蚀玻璃:SiO3 +4F +6H =SiF4 +3H2O
B.用三氯化铁溶液刻制覆铜电路板: 2Fe3+ +3Cu=3Cu2+ +2Fe
C S O2-.用硫代硫酸钠溶液脱氯: 2 3 +2Cl2 +3H2O=2SO
2-
3 +4Cl
- +6H+
D 2-.用碳酸钠溶液浸泡锅炉水垢中的硫酸钙:CaSO4 +CO3 =CaCO3 +SO
2-
4
9.(2024·全国·甲卷)我国化学工作者开发了一种回收利用聚乳酸(PLA)高分子材料的方法,其转化路
线如下所示。
下列叙述错误的是
A.PLA 在碱性条件下可发生降解反应
B.MP 的化学名称是丙酸甲酯
C.MP 的同分异构体中含羧基的有 3 种
D.MMA 可加聚生成高分子
10.(2024·全国·甲卷)四瓶无色溶液 NH4NO3、Na2CO3、Ba(OH)2、AlCl3,它们之间的反应关系如图所示。
其中 a、b、c、d 代表四种溶液,e 和 g 为无色气体,f 为白色沉淀。下列叙述正确的是
A.a 呈弱碱性
B.f 可溶于过量的 b 中
C.c 中通入过量的 e 可得到无色溶液
D.b 和 d 反应生成的沉淀不溶于稀硝酸
11.(2024· -全国·甲卷)W、X、Y、Z 为原子序数依次增大的短周期元素。W 和 X 原子序数之和等于 Y
7
的核外电子数,化合物 W+[ZY6]-作化学电源的电解质。下列叙述正确的是
A.X 和 Z 属于同一主族
B.非金属性:X >Y > Z
C.气态氢化物的稳定性:Z > Y
D.原子半径:Y > X > W
12.(2024·全国·甲卷)科学家使用δ – MnO2研制了一种 MnO2 – Zn 可充电电池(如图所示)。电池工作一
段时间后,MnO2电极上检测到 MnOOH 和少量 ZnMn2O4。下列叙述正确的是
A.充电时,Zn2+向阳极方向迁移
B.充电时,会发生反应 Zn + 2MnO2 = ZnMn2O4
C -.放电时,正极反应有 MnO2 + H2O + e = MnOOH + OH-
D.放电时,Zn 电极质量减少 0.65 g,MnO2电极生成了 0.020 mol MnOOH
13.(2024·全国·甲卷)将 0.10 mmol Ag2CrO4配制成 1.0 mL 悬浊液,向其中滴加 0.10 mol·L-1 的 NaCl 溶液。
lg c / mol L-1 M Ag+ Cl-( 代表 、 或 CrO2- M 4 )随加入 NaCl 溶液体积(V)的变化关系如图所示。
下列叙述正确的是
A Ksp(AgCl).交点 a处:c(Na+) = 2c(Cl-) B. = 10 2.21
Ksp(Ag2CrO4)
c(CrO2-)
C.V ≤ 2.0 mL 时, 4 不变 D.y1 =-7.82,y2 =- lg 34
c(Cl-)
二、非选择题:共 58分,第 26~28题为必考题,每个试题考生都必须作答。第 35~36题为选考题,考生
8
根据要求作答。
(一)必考题(3题,共 43分)
26.(14 分)(2024·全国·甲卷)钴在新能源、新材料领域具有重要用途。某炼锌废渣含有锌、铅、铜、铁、
钴、锰的+2 价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
注:加沉淀剂使一种金属离子浓度小于等于 10 5 mol L 1,其他金属离子不沉淀,即认为完全分离。
已知:①Ksp(CuS) = 6.3×10 36,Ksp(ZnS) = 2.5×10 22,Ksp(CoS) = 4.0×10 21。
②以氢氧化物形式沉淀时,lg[c(M)/(mol·L-1)]和溶液 pH 的关系如图所示。
回答下列问题:
(1)“酸浸”前,需将废渣磨碎,其目的是___________________________________。
(2)“酸浸”步骤中,CoO 发生反应的化学方程式是________________________________。
(3)假设“沉铜”后得到的滤液中 c(Zn2+)和 c(Co2+)均为 0.10 mol L 1,向其中加入 Na2S 至 Zn2+沉淀完
全,此时溶液中 c(Co2+) = _____________ mol L 1,据此判断能否实现 Zn2+和 Co2+的完全分离__________(填
“能”或“不能”)。
(4)“沉锰”步骤中,生成 1.0 mol MnO2,产生 H+的物质的量为_____________。
(5)“沉淀”步骤中,用 NaOH 调 pH=4,分离出的滤渣是______________________。
(6)“沉钴”步骤中,控制溶液 pH = 5.0~5.5,加入适量的 NaClO 氧化 Co2+,其反应的离子方程式为
_____________________________________________________________________。
(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是_______________。
27.(14 分)(2024·全国·甲卷)CO(NH2)2 H2O2(俗称过氧化脲)是一种消毒剂,实验室中可用尿素与过
氧化氢制取,反应方程式如下:CO(NH2)2 + H2O2 = CO(NH2)2 H2O2
9
(一)过氧化脲的合成
烧杯中分别加入 25 mL 30% H2O2(ρ = 1.11 g·cm 3)、40 mL 蒸馏水和 12.0 g 尿素,搅拌溶解。30 ℃下
反应 40 min,冷却结晶、过滤、干燥,得白色针状晶体 9.4 g。
(二)过氧化脲性质检测
I.过氧化脲溶液用稀 H2SO4 酸化后,滴加 KMnO4溶液,紫红色消失。
Ⅱ.过氧化脲溶液用稀 H2SO4酸化后,加入 KI 溶液和四氯化碳,振荡,静置。
(三)产品纯度测定
溶液配制:称取一定量产品,用蒸馏水溶解后配制成 100 mL 溶液。
滴定分析:量取 25.00 mL 过氧化脲溶液至锥形瓶中,加入一定量稀 H2SO4,用准确浓度的 KMnO4溶
液滴定至微红色,记录滴定体积,计算纯度。
回答下列问题:
(1)过滤中使用到的玻璃仪器有____________________(写出两种即可)。
(2)过氧化脲的产率为____________________。
(3)性质检测Ⅱ中的现象为____________________。性质检测 I 和Ⅱ分别说明过氧化脲具有的性质是
____________________。
(4)如图为“溶液配制”的部分过程,操作 a 应重复 3 次,目的是____________________,定容后
还需要的操作为____________________。
(5)“滴定分析”步骤中,下列操作错误的是_________(填标号)。
A.KMnO4溶液置于酸式滴定管中
B.用量筒量取 25.00 mL 过氧化脲溶液
C.滴定近终点时,用洗瓶冲洗锥形瓶内壁
D.锥形瓶内溶液变色后,立即记录滴定管液面刻度
(6)以下操作导致过氧化脲纯度测定结果偏低的是__________(填标号)。
A.容量瓶中液面超过刻度线
B.滴定管水洗后未用 KMnO4溶液润洗
10
C.摇动锥形瓶时 KMnO4溶液滴到锥形瓶外
D.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
28.(15 分)(2024·全国·甲卷)甲烷转化为多碳化合物具有重要意义。一种将甲烷溴化再偶联为丙烯(C3H6)
的研究所获得的部分数据如下。回答下列问题:
(1)已知如下热化学方程式:
CH4(g) + Br2(g) == CH3Br(g) + HBr(g) H1 = -29 kJ mol 1
3CH3Br(g) == C3H6(g) + 3HBr(g) H2 = + 20 kJ mol 1
计算反应 3CH4(g) + 3Br2(g) == C3H6(g) + 6HBr(g)的 H = kJ mol 1。
(2)CH4与 Br2 反应生成 CH3Br,部分 CH3Br 会进一
步溴化。将 8 mmol CH4 和 8 mmol Br2通入密闭容器,平衡
时,n(CH4)、n(CH3Br)与温度的关系如图(假设反应后的
含碳物质只有 CH4、CH3Br 和 CH2Br2)。
(i)图中 CH3Br 的曲线是______(填“a”或“b”)。
(ii)560℃时,CH4 的转化率α=________,n(HBr) =
________mmol。
(iii)560℃时,反应 CH3Br(g) + Br2(g) == CH2Br2(g) +
HBr(g)的平衡常数 K=________。
(3)少量 I2 可提高生成 CH3Br 的选择性。500 ℃时,
分别在有 I2和无 I2的条件下,将 8 mmol CH4和 8 mmol Br2
通入密闭容器,溴代甲烷的物质的量(n)随时间(t)的
变化关系如图。
(i)在 11~19 s 之间,有 I2和无 I2 时 CH3Br 的生成
v(有 I2)
速率之比 =___________。
v(无 I2)
(ii)从图中找出 I2提高了 CH3Br 选择性的证据:
_______________________________________。
(iii)研究表明,I2参与反应的可能机理如下:
① I2(g) == I(g) + I(g)
② I(g) + CH2Br2(g) == IBr(g) + CH2Br(g)
③ CH2Br(g) + HBr(g) == CH3Br(g) + Br(g)
④ Br(g) + CH4(g) ==HBr(g) + CH3(g)
11
⑤ CH3(g) + IBr(g) == CH3Br(g) + I(g)
⑥ I(g) + I(g) == I2(g)
根据上述机理,分析 I2提高 CH3Br 选择性的原因:_____________________________________。
(二)选考题(共 15分。请考生从 2道题中任选 1题作答。如果多做,则按所做的第 1题计分。)
35.[化学——选修 3:物质结构与性质](15 分)
(2024·全国·甲卷)ⅣA 族元素具有丰富的化学性质,其化合物有着广泛的应用。回答下列问题:
(1)该族元素基态原子核外未成对电子数为__________,在与其他元素形成化合物时,呈现的最高
化合价为__________。
(2)CaC2俗称电石,该化合物中不存在的化学键类型为__________(填标号)。
a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷 ,其中电负性最大的元素是__________,硅原子的杂化
轨道类型为__________。
(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:
_____________________________________________。
物质 SnF4 SnCl4 SnBr4 SnI4
熔点/℃ 442 -34 29 143
(5)结晶型 PbS 可作为放射性探测器元件材料,其立方晶胞如图所示。其中 Pb 的
配位数为_____。设 NA为阿伏加德罗常数的值,则该晶体密度为_______________g·cm 3(列出计算式)。
36.[化学——选修 5:有机化学基础](15 分)
(2024·全国·甲卷)白藜芦醇(化合物 I)具有抗肿瘤、抗氧化、消炎等功效。以下是某课题组合成化
合物 I 的路线。
回答下列问题:
(1)A 中的官能团名称为___________________。
(2)B 的结构简式为___________________。
12
(3)由 C 生成 D 的反应类型为___________________。
(4)由 E 生成 F 的化学方程式为_________________________________。
(5)已知 G 可以发生银镜反应,G 的化学名称为___________________。
(6)选用一种鉴别 H 和 I 的试剂并描述实验现象_________________________________。
(7)I 的同分异构体中,同时满足下列条件的共有__________种(不考虑立体异构)。
①含有手性碳(连有 4 个不同的原子或基团的碳为手性碳);
②含有两个苯环; ③含有两个酚羟基; ④可发生银镜反应。
13
14
03-2024 年 北京卷
一、选择题
1.(2024·北京卷)我国科研人员利用激光操控方法,从 Ca 原子束流中直接俘获 41Ca 原子,实现了对同位
素 41Ca 的灵敏检测。41Ca 的半衰期(放射性元素的原子核有半数发生衰变所需的时间)长达 10 万年,
是 14C 的 17 倍,可应用于地球科学与考古学。下列说法正确的是
A.41Ca 的原子核内有 21 个中子 20 Ca
B.41Ca 的半衰期长,说明 41Ca 难以失去电子 钙
C.41
2
Ca 衰变一半所需的时间小于 14C 衰变一半所需的时间 4s
40.08
D.从 Ca 原子束流中直接俘获 41Ca 原子的过程属于化学变化
2.(2024·北京卷)下列化学用语或图示表达不正确的是
A.H2O2 的电子式: B.CH4 分子的球棍模型:
C.Al3+的结构示意图: D.乙炔的结构式:H—C C—H
3.(2024·北京卷)酸性锌锰干电池的构造示意图如下。关于该电池及其工作原理,下列说法正确的是
A.石墨作电池的负极材料
B NH +.电池工作时, 4 向负极方向移动
C.MnO2发生氧化反应
D.锌筒发生的电极反应为 Zn—2e-= Zn2+
4.(2024·北京卷)下列说法不正确的是
A.葡萄糖氧化生成 CO2和 H2O 的反应是放热反应
B.核酸可看作磷酸、戊糖和碱基通过一定方式结合而成的生物大分子
C.由氨基乙酸形成的二肽中存在两个氨基和两个羧基
D.向饱和的 NaCl 溶液中加入少量鸡蛋清溶液会发生盐析
5.(2024·北京卷)下列方程式与所给事实不相符的是
A.海水提溴过程中,用氯气氧化苦卤得到溴单质:2Br- + Cl2 = Br2 + 2Cl-
B.用绿矾(FeSO4 7H2O)将酸性工业废水中的 Cr2O 2-7 转化为 Cr3+:6Fe2++Cr2O2-+14H+7 =
6Fe3++2Cr3++7H2O
C.用 5% Na -2SO4 溶液能有效除去误食的 Ba2+:SO2 2+4 +Ba = BaSO4 ↓
D -.用 Na2CO3 溶液将水垢中的 CaSO4转化为溶于酸的 CaCO3:Ca2++CO23 = CaCO3 ↓
15
6.(2024·北京卷)下列实验的对应操作中,不合理的是
眼睛注视锥形瓶中溶液
A.用 HCl 标准溶液滴定 NaOH 溶液 B.稀释浓硫酸
C.从提纯后的 NaCl 溶液获得 NaCl 晶体 D.配制一定物质的量浓度的 KCl 溶液
7.(2024·北京卷)硫酸是重要化工原料,工业生产制取硫酸的原理示意图如下。
下列说法不正确的是
△
A.I 的化学方程式:3FeS2+8O2 === Fe3O4+6SO2
B.Ⅱ中的反应条件都是为了提高 SO2 平衡转化率
C.将黄铁矿换成硫黄可以减少废渣的产生
D.生产过程中产生的尾气可用碱液吸收
8.(2024·北京卷)关于 Na2CO3和 NaHCO3的下列说法中,不正确的是
A.两种物质的溶液中,所含微粒的种类相同
B.可用 NaOH 溶液使 NaHCO3 转化为 Na2CO3
C.利用二者热稳定性差异,可从它们的固体混合物中除去 NaHCO3
D.室温下,二者饱和溶液的 pH 差约为 4,主要是由于它们的溶解度差异
9.(2024·北京卷)氘代氨(ND3)可用于反应机理研究。下列两种方法均可得到 ND3:①Mg3N2与 D2O 的水
解反应;②NH3 与 D2O 反应。下列说法不正确的是
A.NH3 和 ND3 可用质谱法区分
16
B.NH3和 ND3均为极性分子
C.方法①的化学方程式是 Mg3N2+ 6D2O = 3Mg(OD)2+ 2 ND3↑
D.方法②得到的产品纯度比方法①的高
10.(2024·北京卷)可采用 Deacon 催化氧化法将工业副产物 HCl 制成 Cl2,实现氯资源的再利用。反应的
4HCl(g)+O (g) =CuO热化学方程式: 2 ==== 2Cl2(g) + 2H2O(g) H = -114.4 kJ mol 1。下图所示为该法的
一种催化机理。
下列说法不正确的是
A.Y 为反应物 HCl,W 为生成物 H2O
B.反应制得 1mol Cl2,须投入 2mol CuO
C.升高反应温度,HCl 被 O2氧化制 Cl2的反应平衡常数减小
D.图中转化涉及的反应中有两个属于氧化还原反应
11.(2024·北京卷)CO2 的资源化利用有利于实现“碳中和”。利用 CO2为原料可以合成新型可降解高分子
P,其合成路线如下。
已知:反应①中无其他产物生成。下列说法不正确的是
A.CO2与 X 的化学计量比为 1:2
B.P 完全水解得到的产物的分子式和 Y 的分子式相同
C.P 可以利用碳碳双键进一步交联形成网状结构
D.Y 通过碳碳双键的加聚反应生成的高分子难以降解
12.(2024·北京卷)下列依据相关数据作出的推断中,不正确的是
A.依据相同温度下可逆反应的 Q 与 K 大小的比较,可推断反应进行的方向
B.依据一元弱酸的 Ka,可推断它们同温度同浓度稀溶液的 pH 大小
C.依据第二周期主族元素电负性依次增大,可推断它们的第一电离能依次增大
17
D.依据 F、Cl、Br、I 的氢化物分子中氢卤键的键能,可推断它们的热稳定性强弱
13.(2024·北京卷)苯在浓 HNO3 和浓 H2SO4 作用下,反应过程中能量变化示意图如下。下列说法不正确
的是
A.从中间体到产物,无论从产物稳定性还是反应速率的角度均有利于产物Ⅱ
B.X 为苯的加成产物,Y 为苯的取代产物
C.由苯得到 M 时,苯中的大 键没有变化
D.对于生成 Y 的反应,浓 H2SO4 作催化剂
14.(2024·北京卷)不同条件下,当 KMnO4 与 KI 按照反应①②的化学计量比恰好反应,结果如下。
KI KMnO4
反应序号 起始酸碱性 还原产物 氧化产物
物质的量/mol 物质的量/mol
① 酸性 0.001 n Mn2+ I2
② 中性 0.001 10n MnO2 IO-x
-
已知:MnO 4 的氧化性随酸性减弱而减弱。
下列说法正确的是
A.反应①,n(Mn2+):n(I2) = 1:5
B.对比反应①和②,x = 3
C -.对比反应①和②,I 的还原性随酸性减弱而减弱
D.随反应进行,体系 pH 变化:①增大,②不变
二、非选择题:本部分共 5题,共 58分。
15.(9 分)(2024·北京卷)锡(Sn)是现代“五金”之一,广泛应用于合金、半导体工业等。
(1)Sn 位于元素周期表的第 5 周期第 IV A 族。将 Sn 的基态原子最外层轨道表示式补充完整:
5s 5p
18
(2)SnCl2 和 SnCl4是锡的常见氯化物,SnCl2 可被氧化得到 SnCl4。
①SnCl2分子的 VSEPR 模型名称是_______。
②SnCl4的 Sn—Cl 键是由锡的_______轨道与氯的 3p 轨道重叠形成σ键。
(3)白锡和灰锡是单质 Sn 的常见同素异形体。二者晶胞如图:白锡具有体心四方结构;灰锡具有立
方金刚石结构。
①灰锡中每个 Sn 原子周围与它最近且距离相等的 Sn 原子有_______个。
②若白锡和灰锡的晶胞体积分别为 v1 nm3 和 v2 nm3,则白锡和灰锡晶体的密度之比是__________。
(4)单质 Sn 的制备:将 SnO2与焦炭充分混合后,于惰性气氛中加热至 800℃,由于固体之间反应慢,
未明显发生反应。若通入空气在 800℃下,SnO2能迅速被还原为单质 Sn,通入空气的作用是
__________________________________________。
16.(10 分)(2024·北京卷)HNO3是一种重要的工业原料。可采用不同的氮源制备 HNO3。
(1)方法一:早期以硝石(含 NaNO3)为氮源制备 HNO3,反应的化学方程式为:H2SO4(浓)+ NaNO3 =
NaHSO4+ HNO3↑。该反应利用了浓硫酸的性质是酸性和_______。
(2)方法二:以 NH3为氮源催化氧化制备 HNO3,反应原理分三步进行。
①第 I 步反应的化学方程式为
__________________________________________。
②针对第Ⅱ步反应进行研究:在容积可变的密闭容器中,充入 2n mol
NO 和 n mol O2进行反应。在不同压强下(p1、p2),反应达到平衡时,测得 NO
转化率随温度的变化如图所示。解释 y点的容器容积小于 x点的容器容积的原
因__________________________________________。
(3)方法三:研究表明可以用电解法以 N2为氮源直接制备 HNO3,其原理示意图如下。
19
①电极 a -表面生成 NO 3 的电极反应式:___________________________________。
-
②研究发现:N2转化可能的途径为 N —i2 →NO—ii→NO3。电极 a 表面还发生 iii.H2O—→O2。iii
的存在,有利于途径 ii,原因是__________________________________________。
(4)人工固氮是高能耗的过程,结合 N2 分子结构解释原因__________________________。方法三为
N2的直接利用提供了一种新的思路。
17.(13 分)(2024·北京卷)除草剂苯嘧磺草胺的中间体 M 合成路线如下。
(1)D 中含氧官能团的名称是_______。
(2)A→B 的化学方程式是_____________________________________。
(3)I→J 的制备过程中,下列说法正确的是_______(填序号)。
a.依据平衡移动原理,加入过量的乙醇或将 J 蒸出,都有利于提高 I 的转化率
b.利用饱和碳酸钠溶液可吸收蒸出的 I 和乙醇
c.若反应温度过高,可能生成副产物乙醚或者乙烯
(4)已知:
20
①K 的结构简式是______________________。
②判断并解释 K 中氟原子对α—H 的活泼性的影响_______。
(5)M 的分子式为 C13H7ClF4N2O4。除苯环外,M 分子中还有一个含两个氮原子的六元环,在合成 M
的同时还生成产物甲醇和乙醇。由此可知,在生成 M 时,L 分子和 G 分子断裂的化学键均为 C—O 键和
_______键,M 的结构简式是______________________。
18.(12 分)(2024·北京卷)利用黄铜矿(主要成分为 CuFeS2,含有 SiO2等杂质)生产纯铜,流程示意图如
下。
(1)矿石在焙烧前需粉碎,其作用是______________________。
(2)(NH4)2SO4 的作用是利用其分解产生的 SO3使矿石中的铜元素转化为 CuSO4。(NH4)2SO4发生热
分解的化学方程式是_____________________________________。
(3)矿石和过量(NH4)2SO4按一定比例混合,取相同质量,
在不同温度下焙烧相同时间,测得:i.“吸收”过程氨吸收率和“浸
铜”过程铜浸出率变化如图;
ii.400℃和 500℃时,固体 B 中所含铜、铁的主要物质如
表。
温度/℃ B 中所含铜、铁的主要物质
400 Fe2O3、CuSO4、CuFeS2
500 Fe2(SO4)3、CuSO4、CuO
①温度低于 425℃,随焙烧温度升高,铜浸出率显著增大的原因是_________________。
②温度高于 425℃,根据焙烧时可能发生的反应,解释铜浸出率随焙烧温度升高而降低的原因是
______________________________________________。
(4)用离子方程式表示置换过程中加入 Fe 的目的__________________________________。
(5)粗铜经酸浸处理,再进行电解精炼;电解时用酸化的 CuSO4 溶液做电解液,并维持一定的 c(H+)
和 c(Cu2+)。粗铜若未经酸浸处理,消耗相同电量时,会降低得到纯铜的量,原因是
____________________________________________________。
19.(14 分)(2024·北京卷)某小组同学向 pH=1 的 0.5 mol·L 1 的 FeCl3 溶液中分别加入过量的 Cu 粉、Zn
21
粉和 Mg 粉,探究溶液中氧化剂的微粒及其还原产物。
(1)理论分析
依据金属活动性顺序,Cu、Zn、Mg 中可将 Fe3+还原为 Fe 的金属是_______。
(2)实验验证
实验 金属 操作、现象及产物
过量
I 一段时间后,溶液逐渐变为蓝绿色,固体中未检测到 Fe 单质
Cu
过量 一段时间后有气泡产生,反应缓慢,pH 逐渐增大,产生了大量红褐色沉淀后,无气泡冒
Ⅱ
Zn 出,此时溶液 pH 为 3~4,取出固体,固体中未检测到 Fe 单质
过量 有大量气泡产生,反应剧烈,pH 逐渐增大,产生了大量红褐色沉淀后,持续产生大量气
Ⅲ
Mg 泡,当溶液 pH 为 3~4 时,取出固体,固体中检测到 Fe 单质
①分别取实验 I、Ⅱ、Ⅲ中的少量溶液,滴加 K3[Fe(CN)6]溶液,证明都有 Fe2+生成,依据的现象
是___________________________________________________________________________。
②实验Ⅱ、Ⅲ都有红褐色沉淀生成,用平衡移动原理解释原因______________________
___________________________________________________________________________________。
③对实验Ⅱ未检测到 Fe 单质进行分析及探究。
i.a.甲认为实验Ⅱ中,当 Fe3+、H+浓度较大时,即使 Zn 与 Fe2+反应置换出少量 Fe,Fe 也会被
Fe3+、H+消耗。写出 Fe 与 Fe3+、H+反应的离子方程式____________________________。
b.乙认为在 pH 为 3~4 的溶液中即便生成 Fe 也会被 H+消耗。设计实验____________
_____________________________________________________________________________________(填实验
操作和现象)。证实了此条件下可忽略 H+对 Fe 的消耗。
c.丙认为产生的红褐色沉淀包裹在 Zn 粉上,阻碍了 Zn 与 Fe2+的反应。实验证实了 Zn 粉被包
裹。
ii.查阅资料:0.5 mol·L 1 Fe3+开始沉淀的 pH 约为 1.2,完全沉淀的 pH 约为 3。
结合 a、b 和 c,重新做实验Ⅱ,当溶液 pH 为 3~4 时,不取出固体,向固—液混合物中持续加入
盐酸,控制 pH < 1.2,_________________________________________________________ (填实验操作和现
象),待 pH 为 3~4 时,取出固体,固体中检测到 Fe 单质。
(3)对比实验Ⅱ和Ⅲ,解释实验Ⅲ的固体中检测到 Fe 单质的原因______________________
___________________________________________________________________________________。
22
04-2024 年 天津卷
一、单选题
1.(2024·天津卷)关于天津博物馆典藏文物的相关化学知识,判断错.误.的是
A.太保鼎(西周)的材质是青铜,青铜属于合金
B.《雪景寒林图》(北宋)的材质是绢(蚕丝织品),绢属于天然高分子制品
C.白釉龙柄联腹传瓶(隋),其材质是陶瓷,陶瓷属于无机非金属材料
D.乾隆款珐琅彩芍药雉鸡图玉壶春瓶(清),其珐琅彩由矿物颜料经高温烧制而成,该颜料属于有机化
合物
2.(2024·天津卷)我国学者在碳化硅 SiC 表面制备出超高迁移率半导体外延石墨烯。下列说法正确的是
A.SiC是离子化合物 B.SiC晶体的熔点高、硬度大
C.核素 14 C的质子数为 8 D.石墨烯属于烯烃
3.(2024·天津卷)实验室中下列做法错.误.的是
A.含重金属离子(如Pb2+、Hg2+ 等)的废液,加水稀释后排放
B.轻微烫伤时,先用洁净的冷水处理,再涂抹烫伤药膏
C.乙炔等可燃性气体点燃前要检验纯度
D.将有机废液收集后送专业机构处理
4.(2024·天津卷)柠檬烯是芳香植物和水果中的常见组分。下列有关它的说法错.误.的是
柠檬烯
A.属于不饱和烃 B.所含碳原子采取 sp2或 sp3杂化
C.与氯气能发生 1,2-加成和 1,4-加成 D.可发生聚合反应
5.(2024· 天津卷)甲胺 CH3NH2 水溶液中存在以下平衡:CH3NH2 H2O CH3NH3 OH 。已知:25℃
时,CH3NH2 的Kb 4.2 10
4
,NH3 H2O 的Kb 1.8 10
5
。下列说法错.误.的是
c CH NH CH c OH
A. 3NH2 的Kb
3 3
c CH3NH2
B.CH3NH2 溶液中存在 c H c CH3NH 3 c OH
C . 25℃时,0.1mol / LNH4Cl 溶液与0.1mol / LCH3NH3Cl溶液相比, NH4Cl溶液中的 c H 小
23
D.0.01mol / LCH3NH2溶液与相同浓度的CH3NH3Cl溶液以任意比例混合,混合液中存在
c CH 3NH2 c CH3NH3 0.01mol / L
二、解答题
6.(2024·天津卷)天然产物 P 是具有除草活性的植物化感物质,其合成路线如下:
(1)A 因官能团位置不同而产生的异构体(不包含 A)数目为 ;其中核磁共振氢谱有四组峰的异构体的
结构简式为 ,系统命名为 。
(2)B 的含氧官能团名称为 。
(3)写出B C的化学方程式 。
(4)D 的结构简式为 。
(5) F G 的反应类型为 。
(6)根据 G 与 H 的分子结构,判断下列说法正确的是 (填序号)。
a.二者互为同分异构体 b.H 的水溶性相对较高 c.不能用红外光谱区分二者
(7)已知产物 P 在常温下存在如下互变异构平衡。下列说法错.误.的是 (填序号)。
a.P 和P'经催化加氢可得相同产物 b.P 和P'互为构造异构体
c.P 存在分子内氢键 d.P'含有手性碳原子
(8)已知氯代烃 R Cl 与醇 (R' OH)在碱的作用下生成醚 R O R' 。以甲苯和化合物 C 为原料,参照题
干路线,完成目标化合物的合成 (无机试剂任选)。
24
7.(2024·天津卷)柠檬酸钙 Ca3 C6H5O7 2 微溶于水、难溶于乙醇,是一种安全的食品补钙剂。某学习
小组以蛋壳为主要原料,开展制备柠檬酸钙的如下实验。
Ⅰ.实验流程
(1)实验中,需将蛋壳研磨成粉,其目的是 。
(2)写出蛋壳主要成分与醋酸反应的离子方程式 ,此反应的实验现象是 。
(3)实验流程中,先将蛋壳粉与醋酸反应,而不是直接与柠檬酸溶液反应。解释该设计的理由 。
(4)过滤时用到的玻璃仪器有 。
(5)洗涤柠檬酸钙最适宜的试剂是 (填序号)。
a.水 b.乙醇 c.醋酸
(6)上述实验流程中可循环使用的反应物为 。
Ⅱ.柠檬酸钙样品纯度的测定
已知:柠檬酸钙的摩尔质量为Mg/mol,EDTA 与Ca 2+ 按1:1(物质的量之比)形成稳定配合物。
将干燥后的柠檬酸钙样品 ag 置于锥形瓶中,按照滴定要求将其配成浅液,用溶液调节 pH 大于 13,加入钙
指示剂,用bmol/L的EDTA标准溶液滴定至试液由紫红色变为蓝色,达到滴定终点,消耗EDTA标准溶液
VmL。
(7)配制1mol/LNaOH 溶液时,需将洗涤烧杯内壁和玻璃棒的洗涤液一并转移至容量瓶中,其目的
是 。
(8)测定实验中,滴定管用蒸馏水洗涤后,加入EDTA 标准溶液之前,需进行的操作为 。若滴定所
用锥形瓶在使用前洗净但未干燥,会导致测定结果 (填“偏高”、“偏低”或“无影响”)。
(9)样品中柠檬酸钙质量分数的表达式是 (用字母表示)。
25
26
05-2024 年 山东卷
一、选择题:本题共 10小题,每小题 2分,共 20分。每小题只有一个选项符合题目要求。
1.(2024·山东卷)中国书画是世界艺术瑰宝,古人所用文房四宝制作过程中发生氧化还原反应的是
A.竹管、动物尾毫→湖笔 B.松木→油烟→徽墨
C.楮树皮→纸浆纤维→宣纸 D.端石→端砚
2.(2024·山东卷)化学品在食品工业中也有重要应用,下列说法错误的是
A.活性炭可用作食品脱色剂 B.铁粉可用作食品脱氧剂
C.谷氨酸钠可用作食品增味剂 D.五氧化二磷可用作食品干燥剂
3.(2024·山东卷)下列化学用语或图示正确的是
A. 的系统命名:2-甲基苯酚
B.O3 分子的球棍模型:
C.激发态 H 原子的轨道表示式:
D.p-p 键形成的轨道重叠示意图:
4.(2024·山东卷)下列物质均为共价晶体且成键结构相似,其中熔点最低的是
A.金刚石(C) B.单晶硅(Si) C.金刚砂(SiC) D.氮化硼(BN,立方相)
5.(2024·山东卷)物质性质决定用途,下列两者对应关系错误的是
A.石灰乳除去废气中二氧化硫,体现了 Ca(OH)2的碱性
B.氯化铁溶液腐蚀铜电路板,体现了 Fe3+的氧化性
C.制作豆腐时添加石膏,体现了 CaSO4的难溶性
D.用氨水配制银氨溶液,体现了 NH3的配位性
6.(2024·山东卷)下列图示实验中,操作规范的是
A. 调控滴定速度 B. 用 pH 试纸测定溶液 pH C. 加热试管中的液体 D. 向试管中滴加溶液
7.(2024·山东卷)我国科学家在青蒿素研究方面为人类健康作出了巨大贡献。在青蒿素研究实验中,下列
27
叙述错误的是
A.通过萃取法可获得含青蒿素的提取液
B.通过 X 射线衍射可测定青蒿素晶体结构
C.通过核磁共振谱可推测青蒿素相对分子质量
D.通过红外光谱可推测青蒿素分子中的官能团
8.(2024·山东卷)植物提取物阿魏萜宁具有抗菌活性,其结构简式
如图所示,下列关于阿魏萜宁的说法错误的是
A.可与 Na2CO3溶液反应
B.消去反应产物最多有 2 种
C.酸性条件下的水解产物均可生成高聚物
D.与 Br2反应时可发生取代和加成两种反应
9.(2024·山东卷)由 O、F、I 组成化学式为 IO2F 的化合物,能体现其成键结构的片段如图所示。下列说
法正确的是
A.图中 O 代表 F 原子
B.该化合物中存在过氧键
C.该化合物中 I 原子存在孤对电子
D.该化合物中所有碘氧键键长相等
10.(2024· -山东卷)常温下 Ag(I)—CH3COOH 水溶液体系中存在反应:Ag++CH3COO CH3COOAg(aq),
平衡常数为 K。已初始浓度 c0(Ag+) = c0(CH3COOH) = 0.08 mol·L 1,所有含碳物种的摩尔分数与 pH 变
化关系如图所示(忽略溶液体积变化)。
下列说法正确的是
A.线Ⅱ表示 CH3COOH 的变化情况
B.CH3COOH 的电离平衡常数 Ka = 10 n
m n
C.pH = n 10时,c(Ag+) = mol·L 1
K
D.pH = 10 时,c(Ag+) + c(CH3COOAg) = 0.08 mol·L 1
二、选择题:本题共 5小题,每小题 4分,共 20分。每小题有一个或两个选项符合题目要求,全部选对
得 4分,选对但不全的得 2分,有选错的得 0分。
11.中国美食享誉世界,东坡诗句“芽姜紫醋炙银鱼”描述了古人烹饪时对食醋的妙用。食醋风味形成的关
键是发酵,包括淀粉水解、发酵制醇和发酵制酸等三个阶段。下列说法错误的是
A.淀粉水解阶段有葡萄糖产生 B.发酵制醇阶段有 CO2产生
28
C.发酵制酸阶段有酯类物质产生 D.上述三个阶段均应在无氧条件下进行
12.(2024·山东卷)由下列事实或现象能得出相应结论的是
事实或现象 结论
A 向酸性 KMnO4溶液中加入草酸,紫色褪去 草酸具有还原性
B 铅蓄电池使用过程中两电极的质量均增加 电池发生了放电反应
向等物质的量浓度的 NaCl,Na2CrO4 混合溶液中滴加
C Ksp(AgCl) < Ksp(Ag2CrO4)
AgNO3溶液,先生成 AgCl 白色沉淀
2NO2 N2O4 为基元反应,将盛有 NO2 的密闭烧瓶浸
D 正反应活化能大于逆反应活化能
入冷水,红棕色变浅
13.(2024·山东卷)以不同材料修饰的 Pt 为电极,一定
浓度的 NaBr 溶液为电解液,采用电解和催化相结合
的循环方式,可实现高效制 H2和 O2,装置如图所示。
下列说法错误的是
A.电极 a 连接电源负极
B.加入 Y 的目的是补充 NaBr
电解
C - -.电解总反应式为 Br +3H2O ===== BrO3 +3H2↑
D -.催化阶段反应产物物质的量之比 n(Z):n(Br ) = 3:2
14.(2024·山东卷)钧瓷是宋代五大名瓷之一,其中红色钧瓷的发色剂为 Cu2O。为探究 Cu2O 的性质,取
等量少许 Cu2O 分别加入甲、乙两支试管,进行如下实验。下列说法正确的是
实验操作及现象
滴加过量 0.3 mol·L 1 HNO3溶液并充分振荡,砖红色沉淀转化为另一颜色沉淀,溶液
试管甲
显浅蓝色;倾掉溶液,滴加浓硝酸,沉淀逐渐消失
滴加过量 6 mol·L 1氨水并充分振荡,沉淀逐渐溶解,溶液颜色为无色;静置一段时
试管乙
间后,溶液颜色变为深蓝色
A.试管甲中新生成的沉淀为金属 Cu
B.试管甲中沉淀的变化均体现了 HNO3 的氧化性
C.试管乙实验可证明 Cu(I)与 NH3形成无色配合物
D.上述两个实验表明 Cu2O 为两性氧化物
15.(2024·山东卷)逆水气变换反应:CO2(g) + H2(g) CO(g) + H2O(g) ΔH > 0。一定压力下,按 CO2,
H2物质的量之比 n(CO2):n(H2) = 1:1 投料,T1,T2温度时反应物摩尔分数随时间变化关系如图所示。
29
已知该反应的速率方程为 v = kc0.5(H2) c(CO2),T1,T2 温度时反应速率常数 k分别为 k1,k2。下列说法
错误的是
A.k1 > k2
B.T1,T2 温度下达平衡时反应速率的比值:
v(T1) < k1
v(T2) k2
C.温度不变,仅改变体系初始压力,反应物摩尔分
数随时间的变化曲线不变
D.T2温度下,改变初始投料比例,可使平衡时各组分摩尔分数与 T1温度时相同
三、非选择题:本题共 5小题,共 60分。
16.(12 分)(2024·山东卷)锰氧化物具有较大应用价值,回答下列问题:
(1)Mn 在元素周期表中位于第_______周期_______族;同周期中,基态原子未成对电子数比 Mn 多
的元素是_______(填元素符号)。
(2)Mn 的某种氧化物 MnOx的四方晶胞及其在 xy平面的投影如图所示,该氧化物化学式为_______。
当 MnOx晶体有 O 原子脱出时,出现 O 空位,Mn 的化合价_______(填“升高”“降低”或“不变”),O
空位的产生使晶体具有半导体性质。下列氧化物晶体难以通过该方式获有半导体性质的是_______(填标
号)。
A.CaO B.V2O5 C.Fe2O3 D.CuO
(3)[BMIM]+BF-4(见图)是 MnOx晶型转变的诱导剂。BF
-
4 的空间构型为_______;[BMIM]+中咪唑
环存在Π65大 键,则 N 原子采取的轨道杂化方式为_______。
(4)MnOx可作 HMF 转化为 FDCA 的催化剂(见下图)。FDCA 的熔点远大于 HMF,除相对分子质
量存在差异外,另一重要原因是_______。
17.(12 分)(2024·山东卷)心血管药物缬沙坦中间体(F)的两条合成路线如下:
30
已知:
I.
R CHO (1) R2 NHⅡ. 21 (2) NaBH CN R1CH3 2
NHR2
回答下列问题:
(1)A 结构简式为_____________________;B→C 反应类型为________________。
(2)C+D→F 化学方程式为___________________________________________。
(3)E 中含氧官能团名称为_______;F 中手性碳原子有_______个。
(4)D 的一种同分异构体含硝基和 3 种不同化学环境的氢原子(个数比为 6:6:1),其结构简式为
_________________________。
(5)C→E 的合成路线设计如下:
C 试剂 X G C H NO 试剂 Y14 11 E
试剂 X 为___________________(填化学式);试剂 Y 不能选用 KMnO4,原因是__________
___________________________________________________。
18.(12 分)(2024·山东卷)以铅精矿(含 PbS,Ag2S 等)为主要原料提取金属 Pb 和 Ag 的工艺流程如下:
回答下列问题:
(1)“热浸”时,难溶的 PbS 和 Ag2S 转化为[PbCl4]2 和[AgCl2] 及单质硫。溶解等物质的量的 PbS 和
Ag2S 时,消耗 Fe3+物质的量之比为_______;溶液中盐酸浓度不宜过大,除防止“热浸”时 HCl 挥发外,另
31
一目的是防止产生_______(填化学式)。
(2)将“过滤Ⅱ”得到的 PbCl2 沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属 Pb。“电解 I”阳
极产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为_______。
(3)“还原”中加入铅精矿的目的是_______________________________。
(4)“置换”中可选用的试剂 X 为_______(填标号);
A.Al B.Zn C.Pb D.Ag
“置换”反应的离子方程式为_______。
(5)“电解 II”中将富银铅泥制成电极板,用作_______(填“阴极”或“阳极”)。
19.(12 分)(2024·山东卷)利用“燃烧—碘酸钾滴定法”测定钢铁中硫含量的实验装置如下图所示(夹持
装置略)。
实验过程如下:
①加样:将 a mg 样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管 G 内
预装 c(KIO3):c(KI)略小于 1:5 的 KIO3 碱性标准溶液,吸收管 F 内盛有盐酸酸化的淀粉水溶液。向 F 内
滴入适量 KIO3碱性标准溶液,发生反应:KIO3+5KI+6HCl = 3I2+6KCl+3H2O,使溶液显浅蓝色。
②燃烧:按一定流速通入 O2,一段时间后,加热并使样品燃烧。
③滴定:当 F 内溶液浅蓝色消退时(发生反应:SO2+ I2+2H2O = H2SO4 +2HI),立即用 KIO3碱性标准
溶液滴定至浅蓝色复现。随 SO2不断进入 F,滴定过程中溶液颜色“消退—变蓝”不断变换,直至终点。
回答下列问题:
(1)取 20.00 mL 0.1000 mol·L 1 KIO3 的碱性溶液和一定量的 KI 固体,配制 1000 mL KIO3碱性标准
溶液,下列仪器必须用到的是_______(填标号)。
A.玻璃棒 B.1000 mL 锥形瓶 C.500 mL 容量瓶 D.胶头滴管
(2)装置 B 和 C 的作用是充分干燥 O2,B 中的试剂为_______。装置 F 中通气管末端多孔玻璃泡内
置一密度小于水的磨砂浮子(见放大图),目的是_______。
(3)该滴定实验达终点的现象是_______;滴定消耗 KIO3碱性标准溶液 V mL,样品中硫的质量分数
是_______(用代数式表示)。
32
(4)若装置 D 中瓷舟未加盖,会因燃烧时产生粉尘而促进 SO3的生成,粉尘在该过程中的作用是
_______ -;若装置 E 冷却气体不充分,可能导致测定结果偏大,原因是_______;若滴定过程中,有少量 IO3
不经 I2 直接将 SO2 氧化成 H2SO4,测定结果会_______(填“偏大”“偏小”或“不变”)
20.(12 分)(2024·山东卷)水煤气是 H2 的主要来源,研究 CaO 对 C—H2O 体系制 H2的影响,涉及主要
反应如下:
C(s) + H2O(g) CO(g) + H2(g) (I) ΔH1 > 0
CO(g) + H2O(g) CO2(g) + H2(g) (II) ΔH2 < 0
CaO(s) + CO2(g) CaCO3(s) (III) ΔH3 < 0
回答下列问题:
(1)C(s) + CaO(s) + 2H2O(g) CaCO3(s) + 2H2(g)的焓变ΔH=________(用代数式表示)。
(2)压力 p下,C—H2O—CaO 体系达平衡后,图示温度范围内 C(s)已完全反应,CaCO3(s)在 T1温度
时完全分解。气相中CO,CO2和H2摩尔分数随温度的变化关系如图所示,则 a线对应物种为______________
(填化学式)。当温度高于 T1 时,随温度升高 c 线对应物种摩尔分数逐渐降低的原因是
____________________________。
(3)压力 p下、温度为 T0时,图示三种气体的摩尔分数分别为 0.50,0.15,0.05,则反应 CO(g)
+H2O(g) CO2(g)+H2(g)的平衡常数 Kp =_______;此时气体总物质的量为 4.0 mol,则 CaCO3(s)的物质
的量为_______mol;若向平衡体系中通入少量 CO2(g),重新达平衡后,分压 p(CO2)将_______(填“增大”“减
小”或“不变”),p(CO)将_______(填“增大”“减小”或“不变”)
33
34
06-2024 年 海南卷
一、单选题
1.(2024·海南卷)化学为实现社会可持续发展贡献巨大。下列说法错.误.的是
A.以竹代塑,可减少白色污染 B.使用人工合成杀虫剂,对环境无影响
C.无纸化办公,可减少人工合成油墨的使用 D.使用无磷洗涤剂,可减少水体污染
2.(2024·海南卷)下列包装标签上的安全标识与试剂对应正确的是
A B C D
丁烷 葡萄糖 浓硫酸 氯化钡
3.(2024·海南卷)高分子物质与我们生活息息相关。下列说法错.误.的是
A.糖原(成分类似于淀粉)可转化为葡萄糖
B.聚合物 是CH2 = CH2的加聚物
C.畜禽毛羽(主要成分为角蛋白)完全水解可以得到氨基酸
D.聚合物 的单体是 HOOC CH2 4COOH和CH3CH2OH CH3CH2OH
4.(2024·海南卷)过氧化脲[CO NH2 2 H2O2]是一种常用的消毒剂,可由
过氧化氢(H2O2)和脲 CO NH2 2 加合而成,代表性结构如图所示。下列关
于过氧化脲的说法正确的是
A.所有原子处于同一平面 B.氧的化合价均为-2 价
C.杀菌能力源于其氧化性 D.所有共价键均为极性键
5.(2024·海南卷)下列化学应用实例与方程式不.匹.配.的是
选项 应用实例 方程式
海上油气 1 工平台海葵一号的钢壳外壁铺装锌锭
A Zn2+ aq +2e-=Zn s
减缓腐蚀
B 用硫磺粉减少破损水银体温计洒落的 Hg 的危害 Hg(l)+S s =HgS s
4Ag s +8S O2-2 3 aq +O2 g +2H2O(l)=
C 用浓Na2S2O3溶液洗除实验服上的黑色银斑 -
4 Ag S2O
3 -
3 2 aq +4OH aq
35
D 烘焙糕点时,以食品级NH4HCO3作膨松剂 NH4HCO3 aq NH3 g +CO2 g +H2O l
6.(2024·海南卷)NA代表阿伏加德罗常数的值。下列说法正确的是
A.2.2g超重水( 3H2O)所含的电子数目为NA
B.1L 0.1mol L 1NaClO溶液中ClO 的数目为 0.1NA
C.过量 C 与1mol SiO2充分反应转移电子数目为3NA
D.1mol Cl2与足量CH4发生取代反应生成 HCl 分子的数目为2NA
7.(2024·海南卷)已知 298K,101kPa 时,CO2 g +3H2 g CH3OH g +H2O g ΔH=-49.5kJ mol-1。该
反应在密闭的刚性容器中分别于 T1、T2 温度下进行,CO2的初始浓度为 0.4mol L 1,c CO2 t关系如图
所示。下列说法错.误.的是
A. T1>T2
B.T1下反应达到平衡时 c CH3OH = 0.15mol L 1
C.使用催化剂 1 的反应活化能比催化剂 2 的大
D.使用催化剂 2 和催化剂 3 的反应历程相同
8.(2024·海南卷)已知 298K,101kPa时,2H2 g +O2 g =2H2O l ΔH = 571.6kJ mol 1,H2的临界温度(能
够液化的最高温度)为 32.98K,下列说法错.误.的是
A.氢气燃烧热ΔH = 285.8kJ mol 1
B.题述条件下2mol H2和1mol O2,在燃料电池中完全反应,电功+放热量= 571.6kJ
C.氢能利用的关键技术在于安全储存与运输
D.不同电极材料电解水所需电压不同,产生2g H2 g 消耗的电功相同
9.(2024·海南卷)根据下列实验及现象,所得结论错.误.的是
选项 实验及现象 结论
A 将SO2通入溴水至过量,溶液的橙色褪去 SO2有漂白性
自热米饭附带的热源包(主要成分 CaO,少许Na2CO3、Al 粉)
B Al 粉已经变质
加水后,未产生气体
配体H O、Cl 2+2 与Cu 间存在配位
C CuCl2浓溶液呈黄绿色,加水稀释后溶液呈蓝色
平衡移动
D 淀粉-KI 试纸遇FeCl3 NH4HF2的混合液不变色 FeF 3 6 配离子氧化能力弱
10.(2024·海南卷)下列实验装置或操作不.能.达到实验目的的是
36
选项 A B C D
目的 提纯含砂的粗碘 观察气体扩散现象 制取少量乙酸乙酯 测定中和反应的反应热
装置或
操作
二、多选题
11.(2024·海南卷)海南暗罗是一种药用植物,具有抗菌、抗肿瘤活性。从中提取的一种生物活性物质结
构简式如图所示。下列关于该分子说法正确的是
A.能使酸性高锰酸钾溶液褪色
B.分子式为C19H28O4
C.含有 4 个手性碳原子
D.预测在不同溶剂中的溶解度 S: S环己烷 > S乙醇
12.(2024·海南卷)某温控质子驱动反应如图所示,下列说法错.误.的是
A.I 转化为Ⅱ后,N1 C2键长变短 B.基态N+离子的核外电子排式为1s22s22p3
C.I 具备在热敏指示剂方面的应用前景 D.加热时,Ⅰ的O1与H+结合,O1 C1键断开
13.(2024·海南卷)电解NH4HSO4溶液得到S 2 2O8 ,是早期制备H2O2的重要步骤。某实验装置如图所示。
电解过程流出液 b 中混有少量气泡。下列说法错.误.的是
A.电解过程中阴极区的SO2 4 不断迁移到阳极区
B.图中 a 代表H2
C.回路中通过 1mol电子产生 0.5mol NH4 2S2O8
D.SO2 2 2- - 2-4 氧化成S2O8 的电极反应为2SO4 -2e =S2O8
14.(2024·海南卷)H2S在生态系统的硫循环中不可或缺。298K,101kPa时,水溶液中 2价 S 不同形态的
分布分数如图所示,下列说法正确的是
37
A.线 a 表示HS 的分布分数
B.298K时,Na2S的pKb2约为 7.0
C.1.0L 1mol L 1的 NaOH溶液吸收H2S g 的量大于 1mol
D.可以向燃气中掺入微量H2S g 以示警燃气泄漏
三、解答题
15.(2024·海南卷)锰锌铁氧体(MnxZn1-yFe2O4)元件是电子线路中的基础组成部分。某实验室利用废弃电
子产品中的锰锌铁氧体制备MnO2、ZnO 和FeC2O4 2H2O,可用于电池,催化剂等行业,其工艺流程如下:
回答问题:
(1)氨浸的作用是将 元素(填元素符号)有效转移到水溶液中。
(2)煮沸含有配合物的溶液 B,产生混合气体,经冷凝后所得溶液可循环用于氨浸,该溶液是 。
(3)沉锰反应的离子方程式为 。某次实验时,将原料中的 Mn 以MnO2 nH2O形式定量沉淀完全,消
耗了 2.0mol KMnO4,并产出 81g ZnO(纯度为 99.9%),则该原料MnxZn1-yFe2O4化学式中 x = 。
(4)沉铁时,选择K2C2O4是为了便于从滤液中回收有价值的钾盐 (填化学式)。该钾盐在种植业中的
一种用途是 。
(5)通过加入CaSO4固体,除去滤液中危害环境的C O2 2 4 ,已知Ksp CaSO4 = 7.1 × 10 5,Ksp CaC2O4 = 2.3 ×
10 9。反应CaSO 2-4 s +C2O4 aq CaC 2-2O4 s +SO4 aq 的平衡常数为 。
16.(2024·海南卷)氨是一种理想的储氢载体,具有储氢密度高、储运技术成熟等优点。已知 298K,100kPa
时,反应①:N2 g +3H2 g 2NH3 g ΔH1 = 92kJ mol 1;p NH3 = 总压 × NH3物质的量分数。
回答问题:
(1)题述条件下,反应②:2NH 13 g N2 g +3H2 g ΔH2= kJ mol 。
38
(2)设反应为一步完成,且ΔH与温度无关,已知 673K下,反应①活化能为 335kJ mol 1,则NH3 g 分解
反应的活化能为 kJ mol 1。
(3)既能影响反应②平衡转化率又能影响其反应速率的因素有 、 。
(4)温度 T 下恒容密闭容器中进行氨催化分解反应,p NH3 -t关系曲线如图所示,其函数关系 p NH3 /kPa =
(写表达式),增大氨的初始分压,氨的转化速率 ;假设吸附到催化剂表面后NH3都变成活化分子,
其它条件不变,改用比表面积更大的催化剂,则单位时间H2的产量将 。
17.(2024·海南卷)羟基磷酸钙 Cax PO4 yOH 1.40 ≤ x/y ≤ 1.75 是骨骼石灰和牙釉质的主要成分。某课
题组按照下述步骤进行其制备探索:在 75℃下向由一定量 Ca OH 2粉末配制的含有分散剂的浆液中,边搅
拌边滴加计算量的稀H3PO4,滴加完成后继续搅拌一段时间。冷至室温固液分离,烘干固体得纳米级微粉
产品。制备依据的代表反应式为:5Ca OH 2+3H3PO4=Ca5 PO4 3OH+9H2O,装置如图所示(固定器具已省
略)。
回答问题:
(1)装置图中,安装不当的是 (填仪器标号)
(2)使用冷凝管的目的是 ,冷凝水进水口为 (填序号),干燥管中熟石灰用于吸收 (填
化学式)。
(3)实验中使用水浴加热,其优点为 、 。
(4)投料时应使用新制 Ca OH 2粉末,以降低杂质 (填化学式)对实验的影响。
(5)完成反应后,可以保持产品组成稳定的固液分离方式有 、 (填标号)。
a.倾倒 b.常压过滤 c.减压过滤 d.离心分离
(6)实验中以题述加料方式所得产品中 x/y = 1.67。某次实验将 Ca OH 2浆液滴入稀H3PO4得到的产品中
x/y = 1.50。造成这种结果差异的原因是 。
18.(2024·海南卷)消炎镇痛药 F 的一种合成路线如下:
39
回答问题:
(1)A 的结构简式为 ,其化学名称为 。
(2)A→B、C→D 反应的类型分别为 、 。
(3)某化合物 X 的分子式为C15H14O,符合下列条件 X 的结构简式为 。
①与 C 具有相同的官能团 ②含有 2 个苯环 ③核磁共振氢谱有 3 组峰
(4)D 中所含官能团名称为 。
(5)E→F 反应方程式如下,F 和 Y 的结构简式分别为 、 。
(6)以至多 3 个碳的有机物为原料(无机试剂任选),设计合成 的路
线 。
已知:
19.(2024·海南卷)锂电池是新型储能系统中的核心部件。作为锂电池中用到的电解质材料之一,Li bfsi(阴
离子bfsi 结构见下图。A)深受关注。
回答问题:
(1)Li bfsi的制备前体 Li bfsi(B),可由 C 的氟化反应得到,C 中第三周期元素有 (填元素符号)。
(2)C 分子中,两个 H N S键角均为 117°,S N S键角为 126°,N 的原子轨道杂化类型为 。
40
(3)B 溶于某溶剂发生自耦电离(2B A+F),阳离子 F 的结构式为 。
(4)B 和 D 水溶液均呈酸性,相同温度下,Ka值大小关系:B D(填“>”或“<”);沸点大小关系:
B(170℃)>E(60.8℃),其原因是 。
(5)研究表明,某有机溶剂中,相同浓度的 G 溶液和 H 溶液,前者电导率显著低于后者,原因是 。
(6)Li2 OH Cl在固体离子电导方面具有潜在的应用前景。其两种晶型中,一种取长方体形晶胞(图 1,长方
体棱长为 a、b、c),另一种取立方体形晶胞(图 2,Cl 居于立方体中心,立方体棱长为 d)。图中氢原子皆己
隐去。
①立方体形晶胞所代表的晶体中部分锂离子(●Li)位置上存在缺位现象,锂离子的总缺位率为 ;该
晶型中氯离子周围紧邻的锂离子平均数目为 。
②两种晶型的密度近似相等,则 c = 。(以含 a、b 和 d 的代数式表达)
41
42
07-2024 年 浙江卷 1 月
一、单选题
1.(2024·浙江·1 月)下列物质不.属.于.电解质的是
A.CO2 B.HCl C. NaOH D.BaSO4
2.(2024·浙江·1 月)工业上将 Cl2通入冷的 NaOH 溶液中制得漂白液,下列说法不正确的是
A.漂白液的有效成分是 NaClO B. ClO-水解生成HClO使漂白液呈酸性
C.通入 CO2后的漂白液消毒能力增强 D. NaClO溶液比HClO溶液稳定
3.(2024·浙江·1 月)下列表示不.正.确.的是
A 18.中子数为 10 的氧原子: 8 O
B.SO2 的价层电子对互斥(VSEPR)模型:
C.用电子式表示KCl的形成过程:
D. 的名称:2-甲基-4-乙基戊烷
催化剂
4.(2024·浙江·1 月)汽车尾气中的 NO 和CO在催化剂作用下发生反应:2NO+2CO 2CO2 +N2 ,下
列说法不.正.确.的是( NA 为阿伏加德罗常数的值)
A.生成1 mol CO2 转移电子的数目为 2NA B.催化剂降低 NO 与CO反应的活化能
C.NO 是氧化剂,CO是还原剂 D. N2 既是氧化产物又是还原产物
5.(2024·浙江·1 月)在溶液中能大量共存的离子组是
A H+、I-. 、Ba 2+、NO- B.Fe3+、K+、CN-、Cl-3
C +.Na 、SiO2-、Br -3 、Ca
2+ D + 2- - -. NH4、SO4、CH3COO 、HCO3
6.(2024·浙江·1 月)为回收利用含 I2 的CCl4 废液,某化学兴趣小组设计方案如下所示,下列说法不.正.确.
的是
43
A.步骤 I 中,加入足量 Na 2CO3 溶液充分反应后,上下两层均为无色
B.步骤 I 中,分液时从分液漏斗下口放出溶液 A
C.试剂 X 可用硫酸
D.粗 I2 可用升华法进一步提纯
7.(2024·浙江·1 月)根据材料的组成和结构变化可推测其性能变化,下列推测不.合.理.的是
材料 组成和结构变化 性能变化
A 生铁 减少含碳量 延展性增强
B 晶体硅 用碳原子取代部分硅原子 导电性增强
C 纤维素 接入带有强亲水基团的支链 吸水能力提高
D 顺丁橡胶 硫化使其结构由线型转变为网状 强度提高
8.(2024·浙江·1 月)下列实验装置使用不.正.确.的是
A.图①装置用于二氧化锰和浓盐酸反应制氯气
B.图②装置用于标准酸溶液滴定未知碱溶液
C.图③装置用于测定中和反应的反应热
D.图④装置用于制备乙酸乙酯
9.(2024·浙江·1 月)关于有机物检测,下列说法正确的是
A.用浓溴水可鉴别溴乙烷、乙醛和苯酚
B.用红外光谱可确定有机物的元素组成
C.质谱法测得某有机物的相对分子质量为 72,可推断其分子式为C5H12
D.麦芽糖与稀硫酸共热后加 NaOH 溶液调至碱性,再加入新制氢氧化铜并加热,可判断麦芽糖是否水
解
44
10.(2024·浙江·1 月)下列化学反应与方程式不.相.符.的是
点燃
A.黑火药爆炸:S+2KNO3 +3C K2S+N2 +3CO2
B.四氯化钛水解:TiCl4 +(x+2)H2O TiO2 xH2O +4HCl
C 2- +.硫化钠溶液在空气中氧化变质: 2S +O2 +4H 2S +2H2O
D .硬脂酸甘油酯在 NaOH 溶液中皂化: +3NaOH +
3C17H35COONa
11.(2024·浙江·1 月)制造隐形眼镜的功能高分子材料 Q 的合成路线如下:
下列说法不.正.确.的是
A.试剂 a 为NaOH 乙醇溶液 B.Y 易溶于水
C.Z 的结构简式可能为 D.M 分子中有 3 种官能团
12.(2024·浙江·1 月)X、Y、Z、M 和 Q 五种主族元素,原子序数依次增大,X 原子半径最小,短周期中
M 电负性最小,Z 与 Y、Q 相邻,基态 Z 原子的 s 能级与 p 能级的电子数相等,下列说法不.正.确.的是
A.沸点:X2Z>X2Q
B.M 与 Q 可形成化合物M2Q 、M2Q2
C.化学键中离子键成分的百分数:M2Z>M2Q
D 2-.YZ-3 与QZ3 离子空间结构均为三角锥形
2+
13.(2024·浙江·1 月)破损的镀锌铁皮在氨水中发生电化学腐蚀,生成 Zn NH3 H4 和 2,下列说法不正
确的是
A.氨水浓度越大,腐蚀趋势越大
B.随着腐蚀的进行,溶液 pH 变大
45
C - -.铁电极上的电极反应式为: 2NH3 +2e 2NH2 +H2
D.每生成标准状况下224 mL H2 ,消耗0.010 mol Zn
14.(2024·浙江·1 月)酯在 NaOH 溶液中发生水解反应,历程如下:
已知:
①
②RCOOCH2CH3水解相对速率与取代基 R 的关系如下表:
取代基 R CH3 ClCH2 Cl2CH
水解相对速率 1 290 7200
下列说法不.正.确.的是
A.步骤 I 是OH -与酯中Cδ+作用
B.步骤 III 使 I 和Ⅱ平衡正向移动,使酯在 NaOH 溶液中发生的水解反应不可逆
C.酯的水解速率:FCH2COOCH2CH3 >ClCH2COOCH2CH3
D. 与OH-反应、 与 18 OH- 反应,两者所得醇和羧酸盐均不同
15 -1.(2024·浙江·1 月)常温下、将等体积、浓度均为0.40 mol L BaCl2溶液与新制H2SO3溶液混合,出现白
色浑浊;再滴加过量的H2O2 溶液,振荡,出现白色沉淀。
已知:H2SO3 Ka1=1.4 10
-2 , Ka2 =6.0 10
-8
Ksp BaSO3 =5.0 10-10 , Ksp BaSO4 =1.1 10-10
下列说法不.正.确.的是
A.H SO c H+ >c HSO- 2- -2 3溶液中存在 3 >c SO3 >c OH
46
B.将 0.40 mol L-1H SO 溶液稀释到0.20 mol L-12 3 , c SO2-3 几乎不变
C.BaCl2溶液与H2SO3 溶液混合后出现的白色浑浊不含有BaSO3
D 2+.存在反应Ba +H2SO3 +H2O2 BaSO4 +2H
+ +H2O是出现白色沉淀的主要原因
16.(2024·浙江·1 月)根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不.正.确.
的是
实验目的 方案设计 现象 结论
将NO2 通入下列溶液至饱和:
HNO ①无色变黄 Cu和浓
HNO3反应后溶液
探究Cu和浓 3
色
A ①浓HNO3 呈绿色的主要原因是溶有
反应后溶液呈绿色 ②蓝色变绿
的原因 NOCu(NO ) 色HNO 2② 3 2 和 3,混合溶液
向等物质的量浓度的KF和KSCN
比较F- 与SCN - 结合B 混合溶液中滴加几滴FeCl
溶液颜色无 3+ - -
Fe3+ 3
溶液, 结合Fe 的能力:F >SCN
的能力 明显变化
振荡
分别测定等物质的量浓度的
比较HF与H
C 2
SO3的
前者 pH 小 酸性:HF>H SO酸性 NH4F与 NH4 SO pH 2 32 3溶液的
等体积、等物质的量浓度的
温度高的溶
探究温度对反应速
D Na 2S2O3与H2SO4 溶液在不同温 液中先出现 温度升高,该反应速率加快
率的影响
浑浊
度下反应
二、解答题
17.(2024·浙江·1 月)氮和氧是构建化合物的常见元素。
已知:
47
请回答:
(1)某化合物的晶胞如图,其化学式是 ,晶体类型是 。
(2)下列说法正确的是_______。
A.电负性:B>N>O B.离子半径: P3-C.第一电离能:Ge(3)①H2N-NH
+
2 +H H2N-NH
+
3 ,其中 -NH2 的 N 原子杂化方式为 ;比较键角 HNH:H2N-NH2中
的 -NH2 H2N-NH
+
3 中的 -NH
+
3 (填“>”、“<”或“=”),请说明理由 。
+
②将HNO3与SO3按物质的量之比 1:2 发生化合反应生成 A,测得 A 由 2 种微粒构成,其中之一是 NO2 。
+
比较氧化性强弱: NO2 HNO3 (填“>”、“<”或“=”);写出 A 中阴离子的结构式 。
18.(2024·浙江·1 月)固态化合物 Y 的组成为MgCaFeMn CO3 4 ,以 Y 为原料实现如下转化。
已知: NH3与溶液 A 中金属离子均不能形成配合物。
请回答:
(1)依据步骤Ⅲ,MnCO3 、CaCO3和MgCO3 中溶解度最大的是 。写出溶液 C 中的所有阴离
子 。步骤Ⅱ中,加入 NH4Cl的作用是 。
(2)下列说法正确的是_______。
A.气体 D 是形成酸雨的主要成分 B.固体 E 可能含有 Na 2CO3
C.Mn(OH)2 可溶于NH4Cl 溶液 D.碱性:Ca(OH)2(3)酸性条件下,固体 NaBiO3 (微溶于水,其还原产物为无色的Bi3+ )可氧化Mn2+ 为MnO
-
4,根据该反应原理,
-
设计实验验证 Y 中含有Mn 元素 ;写出Mn2+ 转化为MnO4 的离子方程式 。
19.(2024·浙江·1 月)通过电化学、热化学等方法,将CO2转化为HCOOH 等化学品,是实现“双碳”目标
的途径之一。请回答:
(1)某研究小组采用电化学方法将CO2转化为HCOOH ,装置如图。电极 B 上的电极反应式是 。
48
(2)该研究小组改用热化学方法,相关热化学方程式如下:
I:C(s)+O2 (g) CO2 (g) ΔH1=-393.5 kJ mol
-1
Ⅱ:C(s)+H2 (g)+O2 (g) HCOOH(g) ΔH2 =-378.7 kJ mol
-1
Ⅲ:CO2(g)+H2(g) HCOOH(g) ΔH3
①ΔH -13 = kJ mol 。
②反应Ⅲ在恒温、恒容的密闭容器中进行,CO2和H2的投料浓度均为1.0 mol L-1,平衡常数K=2.4 10-8,
则CO2的平衡转化率为 。
③用氨水吸收HCOOH ,得到1.00 mol L-1氨水和0.18 mol L-1甲酸铵的混合溶液, 298 K 时该混合溶液的
pH= [ 298 K K NH H O =1.8 10-5。 已知: 时,电离常数 b 3 2 、Ka (HCOOH)=1.8 10-4 ]
(3)为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂 M 的DMSO (有
机溶剂)溶液,CO2和H2在溶液中反应制备HCOOH ,反应过程中保持CO2(g) 和H2 (g)的压强不变,总反
应CO2 +H 2 HCOOH 的反应速率为 v,反应机理如下列三个基元反应,各反应的活化能E2考虑催化剂活性降低或丧失)。
Ⅳ:M+CO 2 Q E1
V:Q+H 2 L E2
VI:L M+HCOOH E3
①催化剂 M 足量条件下,下列说法正确的是 。
A.v 与CO2(g) 的压强无关 B.v 与溶液中溶解H2 的浓度无关
C.温度升高,v 不一定增大 D.在溶液中加入N CH2CH3 3,可提高CO2转化率
②实验测得:298 K,p CO2 =p H2 =2MPa 下,v 随催化剂 M 浓度 c 变化如图。c c0 时,v 随 c 增大而
49
增大: c>c0 时,v 不再显著增大。请解释原因 。
20.(2024·浙江·1 月)H2S可用于合成光电材料。某兴趣小组用CaS与MgCl2 反应制备液态H2S,实验装
置如图,反应方程式为:CaS+MgCl2 +2H2 O CaCl2 +Mg(OH)2 +H2S 。
已知:①H2S的沸点是 -61℃,有毒;②装置 A 内产生的H2S气体中含有酸性气体杂质。
请回答:
(1)仪器 X 的名称是 。
(2)完善虚框内的装置排序:A→B→ →F+G
(3)下列干燥剂,可用于装置 C 中的是_______。
A.氢氧化钾 B.五氧化二磷 C.氯化钙 D.碱石灰
(4)装置 G 中汞的两个作用是:①平衡气压:② 。
(5)下列说法正确的是_______。
A.该实验操作须在通风橱中进行
B.装置 D 的主要作用是预冷却H2S
C.加入的MgCl2 固体,可使MgCl2 溶液保持饱和,有利于平稳持续产生H2S
D.该实验产生的尾气可用硝酸吸收
50
(6)取0.680 g H2S产品,与足量CuSO4 溶液充分反应后,将生成的CuS置于已恒重、质量为31.230 g 的坩埚
中,煅烧生成CuO ,恒重后总质量为32.814 g 。产品的纯度为 。
21.(2024·浙江·1 月)某研究小组通过下列路线合成镇静药物氯硝西泮。
已知:
请回答:
(1)化合物 E 的含氧官能团的名称是 。
(2)化合物 C 的结构简式是 。
(3)下列说法不正确的是_______。
A.化合物 A→D 的过程中,采用了保护氨基的方法
B.化合物 A 的碱性比化合物 D 弱
C.化合物 B 在氢氧化钠溶液加热的条件下可转化为化合物 A
D.化合物 G→氯硝西泮的反应类型为取代反应
(4)写出 F→G 的化学方程式 。
(5)聚乳酸( )是一种可降解高分子,可通过化合物 X( )开环聚合得到,设计以乙炔
为原料合成 X 的路线 (用流程图表示,无机试剂任选)。
(6)写出同时符合下列条件的化合物 B 的同分异构体的结构简式 。
①分子中含有二取代的苯环。
1
② H-NMR 谱和 IR 谱检测表明:分子中共有 4 种不同化学环境的氢原子,无碳氧单键。
51
52
08-2024 年 浙江卷 6 月
一、单选题
1.(2024·浙江·6 月)按物质组成分类, KAl SO 12H O4 2 2 属于
A.酸 B.碱 C.盐 D.混合物
2.(2024·浙江·6 月)下列说法不.正.确.的是
A.Al(OH)3呈两性,不能用于治疗胃酸过多
B.Na2O2 能与CO2反应产生O2,可作供氧剂
C.FeO有还原性,能被氧化成Fe3O4
D.HNO3见光易分解,应保存在棕色试剂瓶中
3.(2024·浙江·6 月)下列表示不.正.确.的是
A.CO2的电子式: B.Cl2 中共价键的电子云图:
C.NH3的空间填充模型: D.3,3-二甲基戊烷的键线式:
4.(2024·浙江·6 月)下列说法不.正.确.的是
A.装置①可用于铜与浓硫酸反应并检验气态产物 B.图②标识表示易燃类物质
C.装置③可用于制取并收集氨气 D.装置④可用于从碘水中萃取碘
5.(2024·浙江·6 月)化学与人类社会可持续发展息息相关。下列说法不.正.确.的是
A.部分金属可在高温下用焦炭、一氧化碳、氢气等还原金属矿物得到
B.煤的气化是通过物理变化将煤转化为可燃性气体的过程
C.制作水果罐头时加入抗氧化剂维生素 C,可延长保质期
D.加入混凝剂聚合氯化铝,可使污水中细小悬浮物聚集成大颗粒
6.(2024· -浙江·6 月)利用CH3OH 可将废水中的 NO3转化为对环境无害的物质后排放。反应原理为:
H+ +CH3OH+NO
-
3 X+CO2 +H2O (未配平)。下列说法正确的是
53
A.X 表示 NO2 B.可用O3替换CH3OH
C.氧化剂与还原剂物质的量之比为6:5
D.若生成标准状况下的CO2气体11.2L,则反应转移的电子数为 2NA ( NA 表示阿伏加德罗常数的值)
7.(2024·浙江·6 月)物质微观结构决定宏观性质,进而影响用途。下列结构或性质不.能.解.释.其用途的是
选项 结构或性质 用途
A 石墨呈层状结构,层间以范德华力结合 石墨可用作润滑剂
B SO2 具有氧化性 SO2 可用作漂白剂
C 聚丙烯酸钠( )中含有亲水基团 聚丙烯酸钠可用于制备高吸水性树脂
冠醚 18-冠-6 空腔直径( 260~320pm )与 K+ 直径 冠醚 18-冠-6 可识别 K+ ,能增大KMnO4 在有机溶
D
( 276pm )接近 剂中的溶解度
8.(2024·浙江·6 月)下列离子方程式正确的是
A.用CuSO 2+ 2-4 溶液除H2S气体:Cu +S CuS
B 2+ +.H2SO3溶液中滴加Ba NO3 2溶液:H2SO3 +Ba BaSO3 +2H
C.NaHCO - - -3溶液中通入少量Cl2 : 2HCO3 +Cl2 2CO2 +Cl +ClO +H2O
D.用FeCl3 溶液刻蚀覆铜板制作印刷电路板: 2Fe3+ +Cu 2Fe2+ +Cu2+
9.(2024·浙江·6 月)有机物 A 经元素分析仪测得只含碳、氢、氧 3 种元素,红外光谱显示 A 分子中没有
醚键,质谱和核磁共振氢谱示意图如下。下列关于 A 的说法正确的是
A.能发生水解反应 B.能与 NaHCO3溶液反应生成CO2
54
C.能与O2反应生成丙酮 D.能与 Na 反应生成H2
10.(2024·浙江·6 月)X、Y、Z、M 四种主族元素,原子序数依次增大,分别位于三个不同短周期,Y 与
M 同主族,Y 与 Z 核电荷数相差 2,Z 的原子最外层电子数是内层电子数的 3 倍。下列说法不.正.确.的是
A YX+ >YX-.键角: 3 3 B.分子的极性:Y2X2 >X2Z2
C.共价晶体熔点:Y M D.热稳定性:YX4 >MX4
11.(2024·浙江·6 月)二氧化碳氧化乙烷制备乙烯,主要发生如下两个反应:
I.C2H6 (g)+CO2 (g) C2H4 (g)+CO(g)+H2O(g) ΔH1>0
II.C2H6 (g)+2CO2 (g) 4CO(g)+3H2 (g) ΔH2 >0
向容积为10L 的密闭容器中投入 2mol C2H6 和3mol CO2 ,不同温度下,测得5min时(反应均未平衡)的相关
数据见下表,下列说法不.正.确.的是
温度( C ) 400 500 600
乙烷转化率( % ) 2.2 9.0 17.8
乙烯选择性( % ) 92.6 80.0 61.8
转化为乙烯的乙烷的物质的量
注:乙烯选择性 100%
转化的乙烷的总物质的量
A.反应活化能: I<Ⅱ
B 500 0 ~ 5min I v C H =2.88 10-3mol L-1 min -1. ℃时, 反应 的平均速率为: 2 4
C.其他条件不变,平衡后及时移除H2O(g),可提高乙烯的产率
D.其他条件不变,增大投料比 n C2H6 /n CO2 投料,平衡后可提高乙烷转化率
12.(2024·浙江·6 月)丙烯可发生如下转化(反应条件略):
下列说法不.正.确.的是
A.产物 M 有 2 种且互为同分异构体(不考虑立体异构)
55
B.H+可提高 Y→Z 转化的反应速率
C.Y→Z 过程中,a 处碳氧键比 b 处更易断裂
D.Y→P 是缩聚反应,该工艺有利于减轻温室效应
13.(2024·浙江·6 月)金属腐蚀会对设备产生严重危害,腐蚀快慢与材料种类、所处环境有关。下图为两
种对海水中钢闸门的防腐措施示意图:
下列说法正确的是
A.图 1、图 2 中,阳极材料本身均失去电子
B - -.图 2 中,外加电压偏高时,钢闸门表面可发生反应:O2 +4e +2H2O 4OH
C.图 2 中,外加电压保持恒定不变,有利于提高对钢闸门的防护效果
D.图 1、图 2 中,当钢闸门表面的腐蚀电流为零时,钢闸门、阳极均不发生化学反应
14.(2024·浙江·6 月)Si5Cl10中的Si原子均通过 sp3 杂化轨道成键,与 NaOH 溶液反应Si元素均转化成
Na2SiO3。下列说法不.正.确.的是
A.Si5Cl10分子结构可能是 B.Si5Cl10与水反应可生成一种强酸
C.Si5Cl10与NaOH 溶液反应会产生H2 D.Si5Cl10沸点低于相同结构的Si5Br10
15.(2024·浙江·6 月)室温下,H2S水溶液中各含硫微粒物质的量分数 δ随 pH 变化关系如下图[例如
δ c H SH 2 -18 -172S = c H2S +c HS- +c S2- ]。已知:
Ksp (FeS)=6.3 10 ,Ksp Fe(OH)2 =4.9 10 。
56
下列说法正确的是
A.溶解度:FeS大于Fe(OH) 2
B.以酚酞为指示剂(变色的 pH 范围 8.2~10.0),用 NaOH 标准溶液可滴定H2S水溶液的浓度
C.忽略S2- 的第二步水解,0.10mol/L的 Na 2S溶液中S2- 水解率约为62%
D.0.010mol/L的FeCl2 溶液中加入等体积0.20mol/L的 Na 2S溶液,反应初始生成的沉淀是 FeS
16.(2024·浙江·6 月)为探究化学平衡移动的影响因素,设计方案并进行实验,观察到相关现象。其中方
案设计和结论都正确的是
选项 影响因素 方案设计 现象 结论
向1mL 0.1mol/L K2CrO4 溶液中加入 增大反应物浓度,平衡向
A 浓度 黄色溶液变橙色
1mL1.0mol/L HBr 溶液 正反应方向移动
向恒温恒容密闭玻璃容器中充入 对于反应前后气体总体
B 压强 100mL HI气体,分解达到平衡后再 气体颜色不变 积不变的可逆反应,改变
充入100mL Ar 压强平衡不移动
将封装有 NO2 和 N2O4 混合气体的 升高温度,平衡向吸热反
C 温度 气体颜色变深
烧瓶浸泡在热水中 应方向移动
向1mL乙酸乙酯中加入 上层液体逐渐减 使用合适的催化剂可使
D 催化剂
1mL 0.3mol/L H 2SO4 溶液,水浴加热 少 平衡向正反应方向移动
二、解答题
17.(2024·浙江·6 月)氧是构建化合物的重要元素。请回答:
(1)某化合物的晶胞如图 1,Cl- 的配位数(紧邻的阳离子数)为 ;写出该化合物的化学式 ,写
出该化合物与足量 NH4Cl溶液反应的化学方程式 。
(2)下列有关单核微粒的描述正确的是_______。
A.Ar 的基态原子电子排布方式只有一种
B. Na 的第二电离能 >Ne 的第一电离能
57
C.Ge的基态原子简化电子排布式为[Ar]4s 24p 2
D. Fe原子变成Fe+ ,优先失去3d 轨道上的电子
(3)化合物HA、HB、HC和HD的结构如图 2。
①HA、HB和HC中羟基与水均可形成氢键( -O-H…OH2 ),按照氢键由强到弱对三种酸排序 ,请说
明理由 。
②已知HC、HD钠盐的碱性 NaC>NaD,请从结构角度说明理由 。
18.(2024·浙江·6 月)矿物资源的综合利用有多种方法,如铅锌矿(主要成分为PbS、ZnS )的利用有火法和
电解法等。
已知:①PbCl (s) 热
水
2 PbCl (aq)
HC
l
H PbCl ;
冷却 2 2 4
②电解前后 ZnS总量不变;③AgF易溶于水。
请回答:
(1)根据富氧煅烧(在空气流中煅烧)和通电电解(如图)的结果,PbS中硫元素体现的性质是 (选填“氧
化性”、“还原性”、“酸性”、“热稳定性”之一)。产物 B 中有少量Pb3O4,该物质可溶于浓盐酸,Pb 元素转
化为 PbCl 2-4 ,写出该反应的化学方程式 ;从该反应液中提取PbCl2 的步骤如下:加热条件下,加
入 (填一种反应试剂),充分反应,趁热过滤,冷却结晶,得到产品。
(2)下列说法正确的是_______。
A.电解池中发生的总反应是PbS Pb+S (条件省略)
B.产物 B 主要是铅氧化物与锌氧化物
C.1mol化合物 C 在水溶液中最多可中和 2mol NaOH
D.ClF的氧化性弱于Cl2
(3)D 的结构为 ( X=F或Cl ),设计实验先除去样品 D 中的硫元素,再用除去硫元素后的溶液探究
58
X 为何种元素。
①实验方案:取 D 的溶液,加入足量 NaOH 溶液,加热充分反应,然后 ;
②写出 D(用HSO3X 表示)的溶液与足量 NaOH 溶液反应的离子方程式 。
19.(2024·浙江·6 月)氢是清洁能源,硼氢化钠( NaBH 4 )是一种环境友好的固体储氢材料,其水解生氢反
应方程式如下:(除非特别说明,本题中反应条件均为 25℃,101kPa )
NaBH4 (s)+2H2O(l) NaBO2 (aq)+4H2 (g) ΔH<0
请回答:
(1)该反应能自发进行的条件是_______。
A.高温 B.低温 C.任意温度 D.无法判断
(2)该反应比较缓慢。忽略体积变化的影响,下列措施中可加快反应速率的是_______。
A.升高溶液温度 B.加入少量异丙胺 CH3 CHNH2 2
C.加入少量固体硼酸 B(OH)3 D.增大体系压强
(3)为加速 NaBH 4 水解,某研究小组开发了一种水溶性催化剂,当
该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速
率 v与投料比 n NaBH4 /n H2O 之间的关系,结果如图 1 所示。
请解释 ab 段变化的原因 。
(4)氢能的高效利用途径之一是在燃料电池中产生电能。某研究小组的自制熔融碳酸盐燃料电池工作原理如
图 2 所示,正极上的电极反应式是 。该电池以3.2A 恒定电流工作 14 分钟,消耗H2 体积为0.49L ,
故可测得该电池将化学能转化为电能的转化率为 。[已知:该条件下H2 的摩尔体积为 24.5L/mol ;
电荷量q(C)=电流 I(A) 时间 (s);NA =6.0 10
23mol-1; e=1.60 10-19C。]
59
(5)资源的再利用和再循环有利于人类的可持续发展。选用如下方程式,可以设计能自发进行的多种制备方
法,将反应副产物偏硼酸钠( NaBO2 )再生为NaBH 4 。(已知:ΔG是反应的自由能变化量,其计算方法也遵
循盖斯定律,可类比 H计算方法;当ΔG<0时,反应能自发进行。)
I. NaBH4 (s)+2H2O(l) NaBO2 (s)+4H2 (g) ΔG1=-320kJ/mol
1
II.H2 (g)+ O2 (g)=H2O(l) ΔG2 =-240kJ/mol2
1
III.Mg(s)+ O2 (g)=MgO(s) ΔG3 =-570kJ/mol2
请书写一个方程式表示 NaBO2 再生为 NaBH4 的一种制备方法,并注明ΔG 。(要求:反应物不超过
三种物质;氢原子利用率为100% 。)
20.(2024·浙江·6 月)某小组采用如下实验流程制备AlI3 :
已知:AlI3 是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。
请回答:
(1)如图为步骤 I 的实验装置图(夹持仪器和尾气处理装置已省略),图中仪器
A 的名称是 ,判断步骤 I 反应结束的实验现象是 。
(2)下列做法不.正.确.的是_______。
A.步骤 I 中,反应物和溶剂在使用前除水
B.步骤 I 中,若控温加热器发生故障,改用酒精灯(配石棉网)加热
C.步骤Ⅲ中,在通风橱中浓缩至蒸发皿内出现晶膜
D.步骤Ⅳ中,使用冷的正己烷洗涤
(3)所得粗产品呈浅棕黄色,小组成员认为其中混有碘单质,请设计实验方案验证 。
(4)纯化与分析:对粗产品纯化处理后得到产品,再采用银量法测定产品中 I- 含量以确定纯度。滴定原理为:
先用过量AgNO3标准溶液沉淀 I- ,再以NH4SCN标准溶液回滴剩余的Ag+ 。
已知:
难溶电解质 AgI (黄色) AgSCN (白色) Ag2CrO4 (红色)
溶度积常数K -17 -12 -12sp 8.5 10 1.0 10 1.1 10
①从下列选项中选择合适的操作补全测定步骤 。
60
称取产品1.0200g,用少量稀酸 A 溶解后转移至250mL容量瓶
目录
01-2024 年 新课标卷 ......................................................................................................................... 1
02-2024 年 全国甲卷 ......................................................................................................................... 7
03-2024 年 北京卷 ........................................................................................................................... 15
04-2024 年 天津卷 ........................................................................................................................... 23
05-2024 年 山东卷 ........................................................................................................................... 27
06-2024 年 海南卷 ........................................................................................................................... 35
07-2024 年 浙江卷 1 月 ...................................................................................................................43
08-2024 年 浙江卷 6 月 ................................................................................................................... 53
09-2024 年 江苏卷 ........................................................................................................................... 63
10-2024 年 河北卷 ........................................................................................................................... 71
11-2024 年 广东卷 ........................................................................................................................... 81
12-2024 年 湖南卷 ........................................................................................................................... 89
13-2024 年 湖北卷 ........................................................................................................................... 97
14-2024 年 福建卷 ......................................................................................................................... 105
15-2024 年 重庆卷 ......................................................................................................................... 113
16-2024 年 黑吉辽卷 ..................................................................................................................... 121
17-2024 年 江西卷 ......................................................................................................................... 129
18-2024 年 安徽卷 ......................................................................................................................... 137
19-2024 年 广西卷 ......................................................................................................................... 145
20-2024 年 贵州卷 ......................................................................................................................... 153
21-2024 年 甘肃卷 ......................................................................................................................... 163
22-2024 年 上海卷 ......................................................................................................................... 171
2024 年 各省市高考试题参考答案 ...............................................................................................177
01-2024 年 新课标卷
一、选择题(本题共 7小题,每小题 6分,共 42分)。
7.(2024·全国·新课标卷)文房四宝是中华传统文化的瑰宝。下列有关叙述错误的是
A.羊毛可用于制毛笔,主要成分为蛋白质
B.松木可用于制墨,墨的主要成分是单质碳
C.竹子可用于造纸,纸的主要成分是纤维素
D.大理石可用于制砚台,主要成分为硅酸盐
8.(2024·全国·新课标卷)一种点击化学方法合成聚硫酸酯(W)的路线如下所示:
下列说法正确的是
A.双酚 A 是苯酚的同系物,可与甲醛发生聚合反应
B. 催化聚合也可生成 W
C.生成 W 的反应③为缩聚反应,同时生成
D.在碱性条件下,W 比聚苯乙烯更难降解
9.(2024·全国·新课标卷)实验室中利用下图装置验证铁与水蒸气反应。下列说法错误的是
高温
A.反应为 3Fe(s)+4H2O(g) ===== Fe3O4(s)+4H2(g)
B.酒精灯移至湿棉花下方实验效果更佳
C.用火柴点燃肥皂泡检验生成的氢气
D.使用硬质玻璃试管盛装还原铁粉
1
10.(2024·全国·新课标卷)对于下列过程中发生的化学反应,相应离子方程式正确的是
A -.试管壁上的银镜用稀硝酸清洗:Ag + 2H+ + NO3 = Ag+ + NO2↑+ H2O
B.工业废水中的 Pb2+用 FeS 去除:Pb2+ + S2- = PbS↓
C - -.海水提溴过程中将溴吹入 SO2吸收塔:Br2 + SO2 + 2H 22O = 2Br +SO4 + 4H+
D.用草酸标准溶液测定高锰酸钾溶液的浓度:2MnO-4 +5C2O2-4 +16H+=2Mn2++10CO2↑+8H2O
11.(2024·全国·新课标卷)我国科学家最近研究的一种无机盐 Y3[Z(WX)6]2纳米药物,具有高效的细胞内
亚铁离子捕获和抗氧化能力。W、X、Y、Z 的原子序数依次增加,且 W、X、Y 属于不同族的短周期
元素。W 的外层电子数是其内层电子数的 2 倍,X 和 Y 的第一电离能都比左右相邻元素的高。Z 的 M
层未成对电子数为 4。下列叙述错误的是
A.W、X、Y、Z 四种元素的单质中,Z 的熔点最高
B.在 X 的简单氢化物中,X 原子轨道杂化类型为 sp3
C.Y 的氢氧化物难溶于 NaCl 溶液,可溶于 NH4Cl 溶液
D.Y3[Z(WX)6] -2中,WX 提供电子对与 Z3+形成配位键
12.(2024·全国·新课标卷)一种可植入体内的微型电池工作原理如图所示,通过 CuO 催化消耗血糖发电,
从而控制血糖浓度。当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止
工作。(血糖浓度以葡萄糖浓度计)
电池工作时,下列叙述错误的是
A.电池总反应为:2C6H12O6 + O2 = 2C6H12O7
B.b 电极上 CuO 通过 Cu(Ⅱ)和 Cu(Ⅰ)相互转变起催化作用
C.消耗 18 mg 葡萄糖,理论上 a 电极有 0.4 mmol 电子流入
D.两电极间血液中的 Na+在电场驱动下的迁移方向为 b→a
13.(2024·全国·新课标卷)常温下 CH2ClCOOH 和 CHCl2COOH 的两种溶液中,分布系数δ与 pH 的变化关
c(CH -2ClCOO )
系如图所示。[比如:δ(CH ClCOO-2 )= ]
c(CH2ClCOOH) + c(CH2ClCOO-)
2
下列叙述正确的是
A.曲线 M 表示δ(CHCl -2COO )~pH 的变化关系
B.若酸的初始浓度为 0.10 mol·L 1 a c(H+) = c(CHCl COO- -,则 点对应的溶液中有 2 ) + c(OH )
C.CH2ClCOOH 的电离常数 Ka = 10 1.3
电离度
D pH = 2.08 α(CH2ClCOOH) 0.15. 时, =
电离度α(CHCl2COOH) 0.85
二、非选择题(本题共 4小题,共 58分)。
27.(14 分)(2024·全国·新课标卷)钴及其化合物在制造合金、磁性材料、催化剂及陶瓷釉等方面有着广
泛应用。一种从湿法炼锌产生的废渣(主要含 Co、Zn、Pb、Fe 的单质或氧化物)中富集回收得到含
锰高钴成品的工艺如下:
已知溶液中相关离子开始沉淀和沉淀完全(c ≤ 1.0 × 10 5 mol·L 1)时的 pH:
Fe3+ Fe2+ Co3+ Co2+ Zn2+
开始沉淀的 pH 1.5 6.9 — 7.4 6.2
沉淀完全的 pH 2.8 8.4 1.1 9.4 8.2
回答下列问题:
(1)“酸浸”前废渣需粉碎处理,目的是_______;“滤渣 1”中金属元素主要为_______。
3
(2)“过滤 1”后的溶液中加入 MnO2 的作用是_____________________,取少量反应后的溶液,加入
化学试剂_______检验_______,若出现蓝色沉淀,需补加 MnO2。
(3)“氧化沉钴”中氧化还原反应的离子方程式为______________、______________。
(4)“除钴液”中主要的盐有_______(写化学式),残留的 Co3+浓度为_______ mol·L 1。
28.(15 分)(2024·全国·新课标卷)吡咯类化合物在导电聚合物、化学传感器及药物制剂上有着广泛应用。
一种合成 1-(4-甲氧基苯基)-2,5-二甲基吡咯(用吡咯 X 表示)的反应和方法如下:
实验装置如图所示。将 100 mmol 己-2,5-二酮(熔点:-5.5 ℃,密度:0.737 g·cm 3)与 100 mmol
4-甲氧基苯胺(熔点:57 ℃)放入①中,搅拌。
待反应完成后,加入 50%的乙醇溶液,析出浅棕色固体。加热至 65 ℃,至固体溶解,加入脱色剂,
回流 20 min,趁热过滤。滤液静置至室温,冰水浴冷却,有大量白色固体析出。经过滤、洗涤、干燥得到
产品。
回答下列问题:
(1)量取己-2,5-二酮应使用的仪器为________________(填名称)。
(2)仪器①用铁夹固定在③上,③的名称是_______;仪器②的名称是_______。
(3)“搅拌”的作用是________________。
(4)“加热”方式为___________________。
(5)使用的“脱色剂”是________________。
(6)“趁热过滤”的目的是________________________;用____________洗涤白色固体。
(7)若需进一步提纯产品,可采用的方法是_______。
4
29.(14 分)(2024·全国·新课标卷)Ni(CO)4(四羰合镍,沸点 43 ℃)可用于制备高纯镍,也是有机化合
物羰基化反应的催化剂。回答下列问题:
(1)Ni 基态原子价电子的轨道表示式为_______。镍的晶胞结构类型与铜的相同,晶胞体积为 a3,镍
原子半径为_______。
(2)Ni(CO)4 结构如图所示,其中含有σ键的数目为_______,Ni(CO)4 晶体的类型为_______。
(3)在总压分别为 0.10、0.50、1.0、2.0 MPa 下,Ni(s)和 CO(g)反应达平衡时,Ni(CO)4 体积分数 x
与温度的关系如图所示。反应 Ni(s)+4CO(g)= Ni(CO)4 (g)的ΔH_______0(填“大于”或“小于”)。从热力学角
度考虑,_______有利于 Ni(CO)4的生成(写出两点)。p3、100 ℃时 CO 的平衡转化率α=_______,该温度
下平衡常数 Kp =_______ (MPa) 3。
(4)对于同位素交换反应 Ni(C16O)4+C18O → Ni(C16O)3C18O +C16O,20 ℃时反应物浓度随时间的变化
关系为 ct[Ni(C16O)4] = c0[Ni(C16O)4] e k(t k为反应速率常数),则 Ni(C16O)4反应一半所需时间 t1/2 =_______
(用 k表示)。
30.(15 分)(2024·全国·新课标卷)四氟咯草胺(化合物 G)是一种新型除草剂,可有效控制稻田杂草。
G 的一条合成路线如下(略去部分试剂和条件,忽略立体化学)。
5
CH3SO2Cl,(C H ) N)
已知反应Ⅰ:ROH—————————2 —5—3 ——→ROSO2CH3 + (CCH Cl 2
H5)3N·HCl
2 2
已知反应Ⅱ:
R1 为烃基或 H,R、R2、R3、R4为烃基
回答下列问题:
(1)反应①的反应类型为_______;加入 K2CO3 的作用是_______。
(2)D 分子中采用 sp3 杂化的碳原子数是_______。
(3)对照已知反应Ⅰ,反应③不使用(C2H5)3N 也能进行,原因是_______。
(4)E 中含氧官能团名称是_______。
(5)F 的结构简式是_______;反应⑤分两步进行,第一步产物的分子式为 C15H18F3NO4,其结构简式
是_______。
(6)G 中手性碳原子是_______(写出标号)。
(7)化合物 H 是 B 的同分异构体,具有苯环结构,核磁共振氢谱中显示为四组峰,且可以发生已知
反应Ⅱ。则 H 的可能结构是_______。
6
02-2024 年 全国甲卷
一、选择题(本题共 7小题,每小题 6分,共 42分)
7.(2024·全国·甲卷)人类对能源的利用经历了柴薪、煤炭和石油时期,现正向新能源方向高质量发展。
下列有关能源的叙述错误的是
A.木材与煤均含有碳元素 B.石油裂化可生产汽油
C.燃料电池将热能转化为电能 D.太阳能光解水可制氢
8.(2024·全国·甲卷)下列过程对应的离子方程式正确的是
A 2- - +.用氢氟酸刻蚀玻璃:SiO3 +4F +6H =SiF4 +3H2O
B.用三氯化铁溶液刻制覆铜电路板: 2Fe3+ +3Cu=3Cu2+ +2Fe
C S O2-.用硫代硫酸钠溶液脱氯: 2 3 +2Cl2 +3H2O=2SO
2-
3 +4Cl
- +6H+
D 2-.用碳酸钠溶液浸泡锅炉水垢中的硫酸钙:CaSO4 +CO3 =CaCO3 +SO
2-
4
9.(2024·全国·甲卷)我国化学工作者开发了一种回收利用聚乳酸(PLA)高分子材料的方法,其转化路
线如下所示。
下列叙述错误的是
A.PLA 在碱性条件下可发生降解反应
B.MP 的化学名称是丙酸甲酯
C.MP 的同分异构体中含羧基的有 3 种
D.MMA 可加聚生成高分子
10.(2024·全国·甲卷)四瓶无色溶液 NH4NO3、Na2CO3、Ba(OH)2、AlCl3,它们之间的反应关系如图所示。
其中 a、b、c、d 代表四种溶液,e 和 g 为无色气体,f 为白色沉淀。下列叙述正确的是
A.a 呈弱碱性
B.f 可溶于过量的 b 中
C.c 中通入过量的 e 可得到无色溶液
D.b 和 d 反应生成的沉淀不溶于稀硝酸
11.(2024· -全国·甲卷)W、X、Y、Z 为原子序数依次增大的短周期元素。W 和 X 原子序数之和等于 Y
7
的核外电子数,化合物 W+[ZY6]-作化学电源的电解质。下列叙述正确的是
A.X 和 Z 属于同一主族
B.非金属性:X >Y > Z
C.气态氢化物的稳定性:Z > Y
D.原子半径:Y > X > W
12.(2024·全国·甲卷)科学家使用δ – MnO2研制了一种 MnO2 – Zn 可充电电池(如图所示)。电池工作一
段时间后,MnO2电极上检测到 MnOOH 和少量 ZnMn2O4。下列叙述正确的是
A.充电时,Zn2+向阳极方向迁移
B.充电时,会发生反应 Zn + 2MnO2 = ZnMn2O4
C -.放电时,正极反应有 MnO2 + H2O + e = MnOOH + OH-
D.放电时,Zn 电极质量减少 0.65 g,MnO2电极生成了 0.020 mol MnOOH
13.(2024·全国·甲卷)将 0.10 mmol Ag2CrO4配制成 1.0 mL 悬浊液,向其中滴加 0.10 mol·L-1 的 NaCl 溶液。
lg c / mol L-1 M Ag+ Cl-( 代表 、 或 CrO2- M 4 )随加入 NaCl 溶液体积(V)的变化关系如图所示。
下列叙述正确的是
A Ksp(AgCl).交点 a处:c(Na+) = 2c(Cl-) B. = 10 2.21
Ksp(Ag2CrO4)
c(CrO2-)
C.V ≤ 2.0 mL 时, 4 不变 D.y1 =-7.82,y2 =- lg 34
c(Cl-)
二、非选择题:共 58分,第 26~28题为必考题,每个试题考生都必须作答。第 35~36题为选考题,考生
8
根据要求作答。
(一)必考题(3题,共 43分)
26.(14 分)(2024·全国·甲卷)钴在新能源、新材料领域具有重要用途。某炼锌废渣含有锌、铅、铜、铁、
钴、锰的+2 价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
注:加沉淀剂使一种金属离子浓度小于等于 10 5 mol L 1,其他金属离子不沉淀,即认为完全分离。
已知:①Ksp(CuS) = 6.3×10 36,Ksp(ZnS) = 2.5×10 22,Ksp(CoS) = 4.0×10 21。
②以氢氧化物形式沉淀时,lg[c(M)/(mol·L-1)]和溶液 pH 的关系如图所示。
回答下列问题:
(1)“酸浸”前,需将废渣磨碎,其目的是___________________________________。
(2)“酸浸”步骤中,CoO 发生反应的化学方程式是________________________________。
(3)假设“沉铜”后得到的滤液中 c(Zn2+)和 c(Co2+)均为 0.10 mol L 1,向其中加入 Na2S 至 Zn2+沉淀完
全,此时溶液中 c(Co2+) = _____________ mol L 1,据此判断能否实现 Zn2+和 Co2+的完全分离__________(填
“能”或“不能”)。
(4)“沉锰”步骤中,生成 1.0 mol MnO2,产生 H+的物质的量为_____________。
(5)“沉淀”步骤中,用 NaOH 调 pH=4,分离出的滤渣是______________________。
(6)“沉钴”步骤中,控制溶液 pH = 5.0~5.5,加入适量的 NaClO 氧化 Co2+,其反应的离子方程式为
_____________________________________________________________________。
(7)根据题中给出的信息,从“沉钴”后的滤液中回收氢氧化锌的方法是_______________。
27.(14 分)(2024·全国·甲卷)CO(NH2)2 H2O2(俗称过氧化脲)是一种消毒剂,实验室中可用尿素与过
氧化氢制取,反应方程式如下:CO(NH2)2 + H2O2 = CO(NH2)2 H2O2
9
(一)过氧化脲的合成
烧杯中分别加入 25 mL 30% H2O2(ρ = 1.11 g·cm 3)、40 mL 蒸馏水和 12.0 g 尿素,搅拌溶解。30 ℃下
反应 40 min,冷却结晶、过滤、干燥,得白色针状晶体 9.4 g。
(二)过氧化脲性质检测
I.过氧化脲溶液用稀 H2SO4 酸化后,滴加 KMnO4溶液,紫红色消失。
Ⅱ.过氧化脲溶液用稀 H2SO4酸化后,加入 KI 溶液和四氯化碳,振荡,静置。
(三)产品纯度测定
溶液配制:称取一定量产品,用蒸馏水溶解后配制成 100 mL 溶液。
滴定分析:量取 25.00 mL 过氧化脲溶液至锥形瓶中,加入一定量稀 H2SO4,用准确浓度的 KMnO4溶
液滴定至微红色,记录滴定体积,计算纯度。
回答下列问题:
(1)过滤中使用到的玻璃仪器有____________________(写出两种即可)。
(2)过氧化脲的产率为____________________。
(3)性质检测Ⅱ中的现象为____________________。性质检测 I 和Ⅱ分别说明过氧化脲具有的性质是
____________________。
(4)如图为“溶液配制”的部分过程,操作 a 应重复 3 次,目的是____________________,定容后
还需要的操作为____________________。
(5)“滴定分析”步骤中,下列操作错误的是_________(填标号)。
A.KMnO4溶液置于酸式滴定管中
B.用量筒量取 25.00 mL 过氧化脲溶液
C.滴定近终点时,用洗瓶冲洗锥形瓶内壁
D.锥形瓶内溶液变色后,立即记录滴定管液面刻度
(6)以下操作导致过氧化脲纯度测定结果偏低的是__________(填标号)。
A.容量瓶中液面超过刻度线
B.滴定管水洗后未用 KMnO4溶液润洗
10
C.摇动锥形瓶时 KMnO4溶液滴到锥形瓶外
D.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
28.(15 分)(2024·全国·甲卷)甲烷转化为多碳化合物具有重要意义。一种将甲烷溴化再偶联为丙烯(C3H6)
的研究所获得的部分数据如下。回答下列问题:
(1)已知如下热化学方程式:
CH4(g) + Br2(g) == CH3Br(g) + HBr(g) H1 = -29 kJ mol 1
3CH3Br(g) == C3H6(g) + 3HBr(g) H2 = + 20 kJ mol 1
计算反应 3CH4(g) + 3Br2(g) == C3H6(g) + 6HBr(g)的 H = kJ mol 1。
(2)CH4与 Br2 反应生成 CH3Br,部分 CH3Br 会进一
步溴化。将 8 mmol CH4 和 8 mmol Br2通入密闭容器,平衡
时,n(CH4)、n(CH3Br)与温度的关系如图(假设反应后的
含碳物质只有 CH4、CH3Br 和 CH2Br2)。
(i)图中 CH3Br 的曲线是______(填“a”或“b”)。
(ii)560℃时,CH4 的转化率α=________,n(HBr) =
________mmol。
(iii)560℃时,反应 CH3Br(g) + Br2(g) == CH2Br2(g) +
HBr(g)的平衡常数 K=________。
(3)少量 I2 可提高生成 CH3Br 的选择性。500 ℃时,
分别在有 I2和无 I2的条件下,将 8 mmol CH4和 8 mmol Br2
通入密闭容器,溴代甲烷的物质的量(n)随时间(t)的
变化关系如图。
(i)在 11~19 s 之间,有 I2和无 I2 时 CH3Br 的生成
v(有 I2)
速率之比 =___________。
v(无 I2)
(ii)从图中找出 I2提高了 CH3Br 选择性的证据:
_______________________________________。
(iii)研究表明,I2参与反应的可能机理如下:
① I2(g) == I(g) + I(g)
② I(g) + CH2Br2(g) == IBr(g) + CH2Br(g)
③ CH2Br(g) + HBr(g) == CH3Br(g) + Br(g)
④ Br(g) + CH4(g) ==HBr(g) + CH3(g)
11
⑤ CH3(g) + IBr(g) == CH3Br(g) + I(g)
⑥ I(g) + I(g) == I2(g)
根据上述机理,分析 I2提高 CH3Br 选择性的原因:_____________________________________。
(二)选考题(共 15分。请考生从 2道题中任选 1题作答。如果多做,则按所做的第 1题计分。)
35.[化学——选修 3:物质结构与性质](15 分)
(2024·全国·甲卷)ⅣA 族元素具有丰富的化学性质,其化合物有着广泛的应用。回答下列问题:
(1)该族元素基态原子核外未成对电子数为__________,在与其他元素形成化合物时,呈现的最高
化合价为__________。
(2)CaC2俗称电石,该化合物中不存在的化学键类型为__________(填标号)。
a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷 ,其中电负性最大的元素是__________,硅原子的杂化
轨道类型为__________。
(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:
_____________________________________________。
物质 SnF4 SnCl4 SnBr4 SnI4
熔点/℃ 442 -34 29 143
(5)结晶型 PbS 可作为放射性探测器元件材料,其立方晶胞如图所示。其中 Pb 的
配位数为_____。设 NA为阿伏加德罗常数的值,则该晶体密度为_______________g·cm 3(列出计算式)。
36.[化学——选修 5:有机化学基础](15 分)
(2024·全国·甲卷)白藜芦醇(化合物 I)具有抗肿瘤、抗氧化、消炎等功效。以下是某课题组合成化
合物 I 的路线。
回答下列问题:
(1)A 中的官能团名称为___________________。
(2)B 的结构简式为___________________。
12
(3)由 C 生成 D 的反应类型为___________________。
(4)由 E 生成 F 的化学方程式为_________________________________。
(5)已知 G 可以发生银镜反应,G 的化学名称为___________________。
(6)选用一种鉴别 H 和 I 的试剂并描述实验现象_________________________________。
(7)I 的同分异构体中,同时满足下列条件的共有__________种(不考虑立体异构)。
①含有手性碳(连有 4 个不同的原子或基团的碳为手性碳);
②含有两个苯环; ③含有两个酚羟基; ④可发生银镜反应。
13
14
03-2024 年 北京卷
一、选择题
1.(2024·北京卷)我国科研人员利用激光操控方法,从 Ca 原子束流中直接俘获 41Ca 原子,实现了对同位
素 41Ca 的灵敏检测。41Ca 的半衰期(放射性元素的原子核有半数发生衰变所需的时间)长达 10 万年,
是 14C 的 17 倍,可应用于地球科学与考古学。下列说法正确的是
A.41Ca 的原子核内有 21 个中子 20 Ca
B.41Ca 的半衰期长,说明 41Ca 难以失去电子 钙
C.41
2
Ca 衰变一半所需的时间小于 14C 衰变一半所需的时间 4s
40.08
D.从 Ca 原子束流中直接俘获 41Ca 原子的过程属于化学变化
2.(2024·北京卷)下列化学用语或图示表达不正确的是
A.H2O2 的电子式: B.CH4 分子的球棍模型:
C.Al3+的结构示意图: D.乙炔的结构式:H—C C—H
3.(2024·北京卷)酸性锌锰干电池的构造示意图如下。关于该电池及其工作原理,下列说法正确的是
A.石墨作电池的负极材料
B NH +.电池工作时, 4 向负极方向移动
C.MnO2发生氧化反应
D.锌筒发生的电极反应为 Zn—2e-= Zn2+
4.(2024·北京卷)下列说法不正确的是
A.葡萄糖氧化生成 CO2和 H2O 的反应是放热反应
B.核酸可看作磷酸、戊糖和碱基通过一定方式结合而成的生物大分子
C.由氨基乙酸形成的二肽中存在两个氨基和两个羧基
D.向饱和的 NaCl 溶液中加入少量鸡蛋清溶液会发生盐析
5.(2024·北京卷)下列方程式与所给事实不相符的是
A.海水提溴过程中,用氯气氧化苦卤得到溴单质:2Br- + Cl2 = Br2 + 2Cl-
B.用绿矾(FeSO4 7H2O)将酸性工业废水中的 Cr2O 2-7 转化为 Cr3+:6Fe2++Cr2O2-+14H+7 =
6Fe3++2Cr3++7H2O
C.用 5% Na -2SO4 溶液能有效除去误食的 Ba2+:SO2 2+4 +Ba = BaSO4 ↓
D -.用 Na2CO3 溶液将水垢中的 CaSO4转化为溶于酸的 CaCO3:Ca2++CO23 = CaCO3 ↓
15
6.(2024·北京卷)下列实验的对应操作中,不合理的是
眼睛注视锥形瓶中溶液
A.用 HCl 标准溶液滴定 NaOH 溶液 B.稀释浓硫酸
C.从提纯后的 NaCl 溶液获得 NaCl 晶体 D.配制一定物质的量浓度的 KCl 溶液
7.(2024·北京卷)硫酸是重要化工原料,工业生产制取硫酸的原理示意图如下。
下列说法不正确的是
△
A.I 的化学方程式:3FeS2+8O2 === Fe3O4+6SO2
B.Ⅱ中的反应条件都是为了提高 SO2 平衡转化率
C.将黄铁矿换成硫黄可以减少废渣的产生
D.生产过程中产生的尾气可用碱液吸收
8.(2024·北京卷)关于 Na2CO3和 NaHCO3的下列说法中,不正确的是
A.两种物质的溶液中,所含微粒的种类相同
B.可用 NaOH 溶液使 NaHCO3 转化为 Na2CO3
C.利用二者热稳定性差异,可从它们的固体混合物中除去 NaHCO3
D.室温下,二者饱和溶液的 pH 差约为 4,主要是由于它们的溶解度差异
9.(2024·北京卷)氘代氨(ND3)可用于反应机理研究。下列两种方法均可得到 ND3:①Mg3N2与 D2O 的水
解反应;②NH3 与 D2O 反应。下列说法不正确的是
A.NH3 和 ND3 可用质谱法区分
16
B.NH3和 ND3均为极性分子
C.方法①的化学方程式是 Mg3N2+ 6D2O = 3Mg(OD)2+ 2 ND3↑
D.方法②得到的产品纯度比方法①的高
10.(2024·北京卷)可采用 Deacon 催化氧化法将工业副产物 HCl 制成 Cl2,实现氯资源的再利用。反应的
4HCl(g)+O (g) =CuO热化学方程式: 2 ==== 2Cl2(g) + 2H2O(g) H = -114.4 kJ mol 1。下图所示为该法的
一种催化机理。
下列说法不正确的是
A.Y 为反应物 HCl,W 为生成物 H2O
B.反应制得 1mol Cl2,须投入 2mol CuO
C.升高反应温度,HCl 被 O2氧化制 Cl2的反应平衡常数减小
D.图中转化涉及的反应中有两个属于氧化还原反应
11.(2024·北京卷)CO2 的资源化利用有利于实现“碳中和”。利用 CO2为原料可以合成新型可降解高分子
P,其合成路线如下。
已知:反应①中无其他产物生成。下列说法不正确的是
A.CO2与 X 的化学计量比为 1:2
B.P 完全水解得到的产物的分子式和 Y 的分子式相同
C.P 可以利用碳碳双键进一步交联形成网状结构
D.Y 通过碳碳双键的加聚反应生成的高分子难以降解
12.(2024·北京卷)下列依据相关数据作出的推断中,不正确的是
A.依据相同温度下可逆反应的 Q 与 K 大小的比较,可推断反应进行的方向
B.依据一元弱酸的 Ka,可推断它们同温度同浓度稀溶液的 pH 大小
C.依据第二周期主族元素电负性依次增大,可推断它们的第一电离能依次增大
17
D.依据 F、Cl、Br、I 的氢化物分子中氢卤键的键能,可推断它们的热稳定性强弱
13.(2024·北京卷)苯在浓 HNO3 和浓 H2SO4 作用下,反应过程中能量变化示意图如下。下列说法不正确
的是
A.从中间体到产物,无论从产物稳定性还是反应速率的角度均有利于产物Ⅱ
B.X 为苯的加成产物,Y 为苯的取代产物
C.由苯得到 M 时,苯中的大 键没有变化
D.对于生成 Y 的反应,浓 H2SO4 作催化剂
14.(2024·北京卷)不同条件下,当 KMnO4 与 KI 按照反应①②的化学计量比恰好反应,结果如下。
KI KMnO4
反应序号 起始酸碱性 还原产物 氧化产物
物质的量/mol 物质的量/mol
① 酸性 0.001 n Mn2+ I2
② 中性 0.001 10n MnO2 IO-x
-
已知:MnO 4 的氧化性随酸性减弱而减弱。
下列说法正确的是
A.反应①,n(Mn2+):n(I2) = 1:5
B.对比反应①和②,x = 3
C -.对比反应①和②,I 的还原性随酸性减弱而减弱
D.随反应进行,体系 pH 变化:①增大,②不变
二、非选择题:本部分共 5题,共 58分。
15.(9 分)(2024·北京卷)锡(Sn)是现代“五金”之一,广泛应用于合金、半导体工业等。
(1)Sn 位于元素周期表的第 5 周期第 IV A 族。将 Sn 的基态原子最外层轨道表示式补充完整:
5s 5p
18
(2)SnCl2 和 SnCl4是锡的常见氯化物,SnCl2 可被氧化得到 SnCl4。
①SnCl2分子的 VSEPR 模型名称是_______。
②SnCl4的 Sn—Cl 键是由锡的_______轨道与氯的 3p 轨道重叠形成σ键。
(3)白锡和灰锡是单质 Sn 的常见同素异形体。二者晶胞如图:白锡具有体心四方结构;灰锡具有立
方金刚石结构。
①灰锡中每个 Sn 原子周围与它最近且距离相等的 Sn 原子有_______个。
②若白锡和灰锡的晶胞体积分别为 v1 nm3 和 v2 nm3,则白锡和灰锡晶体的密度之比是__________。
(4)单质 Sn 的制备:将 SnO2与焦炭充分混合后,于惰性气氛中加热至 800℃,由于固体之间反应慢,
未明显发生反应。若通入空气在 800℃下,SnO2能迅速被还原为单质 Sn,通入空气的作用是
__________________________________________。
16.(10 分)(2024·北京卷)HNO3是一种重要的工业原料。可采用不同的氮源制备 HNO3。
(1)方法一:早期以硝石(含 NaNO3)为氮源制备 HNO3,反应的化学方程式为:H2SO4(浓)+ NaNO3 =
NaHSO4+ HNO3↑。该反应利用了浓硫酸的性质是酸性和_______。
(2)方法二:以 NH3为氮源催化氧化制备 HNO3,反应原理分三步进行。
①第 I 步反应的化学方程式为
__________________________________________。
②针对第Ⅱ步反应进行研究:在容积可变的密闭容器中,充入 2n mol
NO 和 n mol O2进行反应。在不同压强下(p1、p2),反应达到平衡时,测得 NO
转化率随温度的变化如图所示。解释 y点的容器容积小于 x点的容器容积的原
因__________________________________________。
(3)方法三:研究表明可以用电解法以 N2为氮源直接制备 HNO3,其原理示意图如下。
19
①电极 a -表面生成 NO 3 的电极反应式:___________________________________。
-
②研究发现:N2转化可能的途径为 N —i2 →NO—ii→NO3。电极 a 表面还发生 iii.H2O—→O2。iii
的存在,有利于途径 ii,原因是__________________________________________。
(4)人工固氮是高能耗的过程,结合 N2 分子结构解释原因__________________________。方法三为
N2的直接利用提供了一种新的思路。
17.(13 分)(2024·北京卷)除草剂苯嘧磺草胺的中间体 M 合成路线如下。
(1)D 中含氧官能团的名称是_______。
(2)A→B 的化学方程式是_____________________________________。
(3)I→J 的制备过程中,下列说法正确的是_______(填序号)。
a.依据平衡移动原理,加入过量的乙醇或将 J 蒸出,都有利于提高 I 的转化率
b.利用饱和碳酸钠溶液可吸收蒸出的 I 和乙醇
c.若反应温度过高,可能生成副产物乙醚或者乙烯
(4)已知:
20
①K 的结构简式是______________________。
②判断并解释 K 中氟原子对α—H 的活泼性的影响_______。
(5)M 的分子式为 C13H7ClF4N2O4。除苯环外,M 分子中还有一个含两个氮原子的六元环,在合成 M
的同时还生成产物甲醇和乙醇。由此可知,在生成 M 时,L 分子和 G 分子断裂的化学键均为 C—O 键和
_______键,M 的结构简式是______________________。
18.(12 分)(2024·北京卷)利用黄铜矿(主要成分为 CuFeS2,含有 SiO2等杂质)生产纯铜,流程示意图如
下。
(1)矿石在焙烧前需粉碎,其作用是______________________。
(2)(NH4)2SO4 的作用是利用其分解产生的 SO3使矿石中的铜元素转化为 CuSO4。(NH4)2SO4发生热
分解的化学方程式是_____________________________________。
(3)矿石和过量(NH4)2SO4按一定比例混合,取相同质量,
在不同温度下焙烧相同时间,测得:i.“吸收”过程氨吸收率和“浸
铜”过程铜浸出率变化如图;
ii.400℃和 500℃时,固体 B 中所含铜、铁的主要物质如
表。
温度/℃ B 中所含铜、铁的主要物质
400 Fe2O3、CuSO4、CuFeS2
500 Fe2(SO4)3、CuSO4、CuO
①温度低于 425℃,随焙烧温度升高,铜浸出率显著增大的原因是_________________。
②温度高于 425℃,根据焙烧时可能发生的反应,解释铜浸出率随焙烧温度升高而降低的原因是
______________________________________________。
(4)用离子方程式表示置换过程中加入 Fe 的目的__________________________________。
(5)粗铜经酸浸处理,再进行电解精炼;电解时用酸化的 CuSO4 溶液做电解液,并维持一定的 c(H+)
和 c(Cu2+)。粗铜若未经酸浸处理,消耗相同电量时,会降低得到纯铜的量,原因是
____________________________________________________。
19.(14 分)(2024·北京卷)某小组同学向 pH=1 的 0.5 mol·L 1 的 FeCl3 溶液中分别加入过量的 Cu 粉、Zn
21
粉和 Mg 粉,探究溶液中氧化剂的微粒及其还原产物。
(1)理论分析
依据金属活动性顺序,Cu、Zn、Mg 中可将 Fe3+还原为 Fe 的金属是_______。
(2)实验验证
实验 金属 操作、现象及产物
过量
I 一段时间后,溶液逐渐变为蓝绿色,固体中未检测到 Fe 单质
Cu
过量 一段时间后有气泡产生,反应缓慢,pH 逐渐增大,产生了大量红褐色沉淀后,无气泡冒
Ⅱ
Zn 出,此时溶液 pH 为 3~4,取出固体,固体中未检测到 Fe 单质
过量 有大量气泡产生,反应剧烈,pH 逐渐增大,产生了大量红褐色沉淀后,持续产生大量气
Ⅲ
Mg 泡,当溶液 pH 为 3~4 时,取出固体,固体中检测到 Fe 单质
①分别取实验 I、Ⅱ、Ⅲ中的少量溶液,滴加 K3[Fe(CN)6]溶液,证明都有 Fe2+生成,依据的现象
是___________________________________________________________________________。
②实验Ⅱ、Ⅲ都有红褐色沉淀生成,用平衡移动原理解释原因______________________
___________________________________________________________________________________。
③对实验Ⅱ未检测到 Fe 单质进行分析及探究。
i.a.甲认为实验Ⅱ中,当 Fe3+、H+浓度较大时,即使 Zn 与 Fe2+反应置换出少量 Fe,Fe 也会被
Fe3+、H+消耗。写出 Fe 与 Fe3+、H+反应的离子方程式____________________________。
b.乙认为在 pH 为 3~4 的溶液中即便生成 Fe 也会被 H+消耗。设计实验____________
_____________________________________________________________________________________(填实验
操作和现象)。证实了此条件下可忽略 H+对 Fe 的消耗。
c.丙认为产生的红褐色沉淀包裹在 Zn 粉上,阻碍了 Zn 与 Fe2+的反应。实验证实了 Zn 粉被包
裹。
ii.查阅资料:0.5 mol·L 1 Fe3+开始沉淀的 pH 约为 1.2,完全沉淀的 pH 约为 3。
结合 a、b 和 c,重新做实验Ⅱ,当溶液 pH 为 3~4 时,不取出固体,向固—液混合物中持续加入
盐酸,控制 pH < 1.2,_________________________________________________________ (填实验操作和现
象),待 pH 为 3~4 时,取出固体,固体中检测到 Fe 单质。
(3)对比实验Ⅱ和Ⅲ,解释实验Ⅲ的固体中检测到 Fe 单质的原因______________________
___________________________________________________________________________________。
22
04-2024 年 天津卷
一、单选题
1.(2024·天津卷)关于天津博物馆典藏文物的相关化学知识,判断错.误.的是
A.太保鼎(西周)的材质是青铜,青铜属于合金
B.《雪景寒林图》(北宋)的材质是绢(蚕丝织品),绢属于天然高分子制品
C.白釉龙柄联腹传瓶(隋),其材质是陶瓷,陶瓷属于无机非金属材料
D.乾隆款珐琅彩芍药雉鸡图玉壶春瓶(清),其珐琅彩由矿物颜料经高温烧制而成,该颜料属于有机化
合物
2.(2024·天津卷)我国学者在碳化硅 SiC 表面制备出超高迁移率半导体外延石墨烯。下列说法正确的是
A.SiC是离子化合物 B.SiC晶体的熔点高、硬度大
C.核素 14 C的质子数为 8 D.石墨烯属于烯烃
3.(2024·天津卷)实验室中下列做法错.误.的是
A.含重金属离子(如Pb2+、Hg2+ 等)的废液,加水稀释后排放
B.轻微烫伤时,先用洁净的冷水处理,再涂抹烫伤药膏
C.乙炔等可燃性气体点燃前要检验纯度
D.将有机废液收集后送专业机构处理
4.(2024·天津卷)柠檬烯是芳香植物和水果中的常见组分。下列有关它的说法错.误.的是
柠檬烯
A.属于不饱和烃 B.所含碳原子采取 sp2或 sp3杂化
C.与氯气能发生 1,2-加成和 1,4-加成 D.可发生聚合反应
5.(2024· 天津卷)甲胺 CH3NH2 水溶液中存在以下平衡:CH3NH2 H2O CH3NH3 OH 。已知:25℃
时,CH3NH2 的Kb 4.2 10
4
,NH3 H2O 的Kb 1.8 10
5
。下列说法错.误.的是
c CH NH CH c OH
A. 3NH2 的Kb
3 3
c CH3NH2
B.CH3NH2 溶液中存在 c H c CH3NH 3 c OH
C . 25℃时,0.1mol / LNH4Cl 溶液与0.1mol / LCH3NH3Cl溶液相比, NH4Cl溶液中的 c H 小
23
D.0.01mol / LCH3NH2溶液与相同浓度的CH3NH3Cl溶液以任意比例混合,混合液中存在
c CH 3NH2 c CH3NH3 0.01mol / L
二、解答题
6.(2024·天津卷)天然产物 P 是具有除草活性的植物化感物质,其合成路线如下:
(1)A 因官能团位置不同而产生的异构体(不包含 A)数目为 ;其中核磁共振氢谱有四组峰的异构体的
结构简式为 ,系统命名为 。
(2)B 的含氧官能团名称为 。
(3)写出B C的化学方程式 。
(4)D 的结构简式为 。
(5) F G 的反应类型为 。
(6)根据 G 与 H 的分子结构,判断下列说法正确的是 (填序号)。
a.二者互为同分异构体 b.H 的水溶性相对较高 c.不能用红外光谱区分二者
(7)已知产物 P 在常温下存在如下互变异构平衡。下列说法错.误.的是 (填序号)。
a.P 和P'经催化加氢可得相同产物 b.P 和P'互为构造异构体
c.P 存在分子内氢键 d.P'含有手性碳原子
(8)已知氯代烃 R Cl 与醇 (R' OH)在碱的作用下生成醚 R O R' 。以甲苯和化合物 C 为原料,参照题
干路线,完成目标化合物的合成 (无机试剂任选)。
24
7.(2024·天津卷)柠檬酸钙 Ca3 C6H5O7 2 微溶于水、难溶于乙醇,是一种安全的食品补钙剂。某学习
小组以蛋壳为主要原料,开展制备柠檬酸钙的如下实验。
Ⅰ.实验流程
(1)实验中,需将蛋壳研磨成粉,其目的是 。
(2)写出蛋壳主要成分与醋酸反应的离子方程式 ,此反应的实验现象是 。
(3)实验流程中,先将蛋壳粉与醋酸反应,而不是直接与柠檬酸溶液反应。解释该设计的理由 。
(4)过滤时用到的玻璃仪器有 。
(5)洗涤柠檬酸钙最适宜的试剂是 (填序号)。
a.水 b.乙醇 c.醋酸
(6)上述实验流程中可循环使用的反应物为 。
Ⅱ.柠檬酸钙样品纯度的测定
已知:柠檬酸钙的摩尔质量为Mg/mol,EDTA 与Ca 2+ 按1:1(物质的量之比)形成稳定配合物。
将干燥后的柠檬酸钙样品 ag 置于锥形瓶中,按照滴定要求将其配成浅液,用溶液调节 pH 大于 13,加入钙
指示剂,用bmol/L的EDTA标准溶液滴定至试液由紫红色变为蓝色,达到滴定终点,消耗EDTA标准溶液
VmL。
(7)配制1mol/LNaOH 溶液时,需将洗涤烧杯内壁和玻璃棒的洗涤液一并转移至容量瓶中,其目的
是 。
(8)测定实验中,滴定管用蒸馏水洗涤后,加入EDTA 标准溶液之前,需进行的操作为 。若滴定所
用锥形瓶在使用前洗净但未干燥,会导致测定结果 (填“偏高”、“偏低”或“无影响”)。
(9)样品中柠檬酸钙质量分数的表达式是 (用字母表示)。
25
26
05-2024 年 山东卷
一、选择题:本题共 10小题,每小题 2分,共 20分。每小题只有一个选项符合题目要求。
1.(2024·山东卷)中国书画是世界艺术瑰宝,古人所用文房四宝制作过程中发生氧化还原反应的是
A.竹管、动物尾毫→湖笔 B.松木→油烟→徽墨
C.楮树皮→纸浆纤维→宣纸 D.端石→端砚
2.(2024·山东卷)化学品在食品工业中也有重要应用,下列说法错误的是
A.活性炭可用作食品脱色剂 B.铁粉可用作食品脱氧剂
C.谷氨酸钠可用作食品增味剂 D.五氧化二磷可用作食品干燥剂
3.(2024·山东卷)下列化学用语或图示正确的是
A. 的系统命名:2-甲基苯酚
B.O3 分子的球棍模型:
C.激发态 H 原子的轨道表示式:
D.p-p 键形成的轨道重叠示意图:
4.(2024·山东卷)下列物质均为共价晶体且成键结构相似,其中熔点最低的是
A.金刚石(C) B.单晶硅(Si) C.金刚砂(SiC) D.氮化硼(BN,立方相)
5.(2024·山东卷)物质性质决定用途,下列两者对应关系错误的是
A.石灰乳除去废气中二氧化硫,体现了 Ca(OH)2的碱性
B.氯化铁溶液腐蚀铜电路板,体现了 Fe3+的氧化性
C.制作豆腐时添加石膏,体现了 CaSO4的难溶性
D.用氨水配制银氨溶液,体现了 NH3的配位性
6.(2024·山东卷)下列图示实验中,操作规范的是
A. 调控滴定速度 B. 用 pH 试纸测定溶液 pH C. 加热试管中的液体 D. 向试管中滴加溶液
7.(2024·山东卷)我国科学家在青蒿素研究方面为人类健康作出了巨大贡献。在青蒿素研究实验中,下列
27
叙述错误的是
A.通过萃取法可获得含青蒿素的提取液
B.通过 X 射线衍射可测定青蒿素晶体结构
C.通过核磁共振谱可推测青蒿素相对分子质量
D.通过红外光谱可推测青蒿素分子中的官能团
8.(2024·山东卷)植物提取物阿魏萜宁具有抗菌活性,其结构简式
如图所示,下列关于阿魏萜宁的说法错误的是
A.可与 Na2CO3溶液反应
B.消去反应产物最多有 2 种
C.酸性条件下的水解产物均可生成高聚物
D.与 Br2反应时可发生取代和加成两种反应
9.(2024·山东卷)由 O、F、I 组成化学式为 IO2F 的化合物,能体现其成键结构的片段如图所示。下列说
法正确的是
A.图中 O 代表 F 原子
B.该化合物中存在过氧键
C.该化合物中 I 原子存在孤对电子
D.该化合物中所有碘氧键键长相等
10.(2024· -山东卷)常温下 Ag(I)—CH3COOH 水溶液体系中存在反应:Ag++CH3COO CH3COOAg(aq),
平衡常数为 K。已初始浓度 c0(Ag+) = c0(CH3COOH) = 0.08 mol·L 1,所有含碳物种的摩尔分数与 pH 变
化关系如图所示(忽略溶液体积变化)。
下列说法正确的是
A.线Ⅱ表示 CH3COOH 的变化情况
B.CH3COOH 的电离平衡常数 Ka = 10 n
m n
C.pH = n 10时,c(Ag+) = mol·L 1
K
D.pH = 10 时,c(Ag+) + c(CH3COOAg) = 0.08 mol·L 1
二、选择题:本题共 5小题,每小题 4分,共 20分。每小题有一个或两个选项符合题目要求,全部选对
得 4分,选对但不全的得 2分,有选错的得 0分。
11.中国美食享誉世界,东坡诗句“芽姜紫醋炙银鱼”描述了古人烹饪时对食醋的妙用。食醋风味形成的关
键是发酵,包括淀粉水解、发酵制醇和发酵制酸等三个阶段。下列说法错误的是
A.淀粉水解阶段有葡萄糖产生 B.发酵制醇阶段有 CO2产生
28
C.发酵制酸阶段有酯类物质产生 D.上述三个阶段均应在无氧条件下进行
12.(2024·山东卷)由下列事实或现象能得出相应结论的是
事实或现象 结论
A 向酸性 KMnO4溶液中加入草酸,紫色褪去 草酸具有还原性
B 铅蓄电池使用过程中两电极的质量均增加 电池发生了放电反应
向等物质的量浓度的 NaCl,Na2CrO4 混合溶液中滴加
C Ksp(AgCl) < Ksp(Ag2CrO4)
AgNO3溶液,先生成 AgCl 白色沉淀
2NO2 N2O4 为基元反应,将盛有 NO2 的密闭烧瓶浸
D 正反应活化能大于逆反应活化能
入冷水,红棕色变浅
13.(2024·山东卷)以不同材料修饰的 Pt 为电极,一定
浓度的 NaBr 溶液为电解液,采用电解和催化相结合
的循环方式,可实现高效制 H2和 O2,装置如图所示。
下列说法错误的是
A.电极 a 连接电源负极
B.加入 Y 的目的是补充 NaBr
电解
C - -.电解总反应式为 Br +3H2O ===== BrO3 +3H2↑
D -.催化阶段反应产物物质的量之比 n(Z):n(Br ) = 3:2
14.(2024·山东卷)钧瓷是宋代五大名瓷之一,其中红色钧瓷的发色剂为 Cu2O。为探究 Cu2O 的性质,取
等量少许 Cu2O 分别加入甲、乙两支试管,进行如下实验。下列说法正确的是
实验操作及现象
滴加过量 0.3 mol·L 1 HNO3溶液并充分振荡,砖红色沉淀转化为另一颜色沉淀,溶液
试管甲
显浅蓝色;倾掉溶液,滴加浓硝酸,沉淀逐渐消失
滴加过量 6 mol·L 1氨水并充分振荡,沉淀逐渐溶解,溶液颜色为无色;静置一段时
试管乙
间后,溶液颜色变为深蓝色
A.试管甲中新生成的沉淀为金属 Cu
B.试管甲中沉淀的变化均体现了 HNO3 的氧化性
C.试管乙实验可证明 Cu(I)与 NH3形成无色配合物
D.上述两个实验表明 Cu2O 为两性氧化物
15.(2024·山东卷)逆水气变换反应:CO2(g) + H2(g) CO(g) + H2O(g) ΔH > 0。一定压力下,按 CO2,
H2物质的量之比 n(CO2):n(H2) = 1:1 投料,T1,T2温度时反应物摩尔分数随时间变化关系如图所示。
29
已知该反应的速率方程为 v = kc0.5(H2) c(CO2),T1,T2 温度时反应速率常数 k分别为 k1,k2。下列说法
错误的是
A.k1 > k2
B.T1,T2 温度下达平衡时反应速率的比值:
v(T1) < k1
v(T2) k2
C.温度不变,仅改变体系初始压力,反应物摩尔分
数随时间的变化曲线不变
D.T2温度下,改变初始投料比例,可使平衡时各组分摩尔分数与 T1温度时相同
三、非选择题:本题共 5小题,共 60分。
16.(12 分)(2024·山东卷)锰氧化物具有较大应用价值,回答下列问题:
(1)Mn 在元素周期表中位于第_______周期_______族;同周期中,基态原子未成对电子数比 Mn 多
的元素是_______(填元素符号)。
(2)Mn 的某种氧化物 MnOx的四方晶胞及其在 xy平面的投影如图所示,该氧化物化学式为_______。
当 MnOx晶体有 O 原子脱出时,出现 O 空位,Mn 的化合价_______(填“升高”“降低”或“不变”),O
空位的产生使晶体具有半导体性质。下列氧化物晶体难以通过该方式获有半导体性质的是_______(填标
号)。
A.CaO B.V2O5 C.Fe2O3 D.CuO
(3)[BMIM]+BF-4(见图)是 MnOx晶型转变的诱导剂。BF
-
4 的空间构型为_______;[BMIM]+中咪唑
环存在Π65大 键,则 N 原子采取的轨道杂化方式为_______。
(4)MnOx可作 HMF 转化为 FDCA 的催化剂(见下图)。FDCA 的熔点远大于 HMF,除相对分子质
量存在差异外,另一重要原因是_______。
17.(12 分)(2024·山东卷)心血管药物缬沙坦中间体(F)的两条合成路线如下:
30
已知:
I.
R CHO (1) R2 NHⅡ. 21 (2) NaBH CN R1CH3 2
NHR2
回答下列问题:
(1)A 结构简式为_____________________;B→C 反应类型为________________。
(2)C+D→F 化学方程式为___________________________________________。
(3)E 中含氧官能团名称为_______;F 中手性碳原子有_______个。
(4)D 的一种同分异构体含硝基和 3 种不同化学环境的氢原子(个数比为 6:6:1),其结构简式为
_________________________。
(5)C→E 的合成路线设计如下:
C 试剂 X G C H NO 试剂 Y14 11 E
试剂 X 为___________________(填化学式);试剂 Y 不能选用 KMnO4,原因是__________
___________________________________________________。
18.(12 分)(2024·山东卷)以铅精矿(含 PbS,Ag2S 等)为主要原料提取金属 Pb 和 Ag 的工艺流程如下:
回答下列问题:
(1)“热浸”时,难溶的 PbS 和 Ag2S 转化为[PbCl4]2 和[AgCl2] 及单质硫。溶解等物质的量的 PbS 和
Ag2S 时,消耗 Fe3+物质的量之比为_______;溶液中盐酸浓度不宜过大,除防止“热浸”时 HCl 挥发外,另
31
一目的是防止产生_______(填化学式)。
(2)将“过滤Ⅱ”得到的 PbCl2 沉淀反复用饱和食盐水热溶,电解所得溶液可制备金属 Pb。“电解 I”阳
极产物用尾液吸收后在工艺中循环使用,利用该吸收液的操作单元为_______。
(3)“还原”中加入铅精矿的目的是_______________________________。
(4)“置换”中可选用的试剂 X 为_______(填标号);
A.Al B.Zn C.Pb D.Ag
“置换”反应的离子方程式为_______。
(5)“电解 II”中将富银铅泥制成电极板,用作_______(填“阴极”或“阳极”)。
19.(12 分)(2024·山东卷)利用“燃烧—碘酸钾滴定法”测定钢铁中硫含量的实验装置如下图所示(夹持
装置略)。
实验过程如下:
①加样:将 a mg 样品加入管式炉内瓷舟中(瓷舟两端带有气孔且有盖),聚四氟乙烯活塞滴定管 G 内
预装 c(KIO3):c(KI)略小于 1:5 的 KIO3 碱性标准溶液,吸收管 F 内盛有盐酸酸化的淀粉水溶液。向 F 内
滴入适量 KIO3碱性标准溶液,发生反应:KIO3+5KI+6HCl = 3I2+6KCl+3H2O,使溶液显浅蓝色。
②燃烧:按一定流速通入 O2,一段时间后,加热并使样品燃烧。
③滴定:当 F 内溶液浅蓝色消退时(发生反应:SO2+ I2+2H2O = H2SO4 +2HI),立即用 KIO3碱性标准
溶液滴定至浅蓝色复现。随 SO2不断进入 F,滴定过程中溶液颜色“消退—变蓝”不断变换,直至终点。
回答下列问题:
(1)取 20.00 mL 0.1000 mol·L 1 KIO3 的碱性溶液和一定量的 KI 固体,配制 1000 mL KIO3碱性标准
溶液,下列仪器必须用到的是_______(填标号)。
A.玻璃棒 B.1000 mL 锥形瓶 C.500 mL 容量瓶 D.胶头滴管
(2)装置 B 和 C 的作用是充分干燥 O2,B 中的试剂为_______。装置 F 中通气管末端多孔玻璃泡内
置一密度小于水的磨砂浮子(见放大图),目的是_______。
(3)该滴定实验达终点的现象是_______;滴定消耗 KIO3碱性标准溶液 V mL,样品中硫的质量分数
是_______(用代数式表示)。
32
(4)若装置 D 中瓷舟未加盖,会因燃烧时产生粉尘而促进 SO3的生成,粉尘在该过程中的作用是
_______ -;若装置 E 冷却气体不充分,可能导致测定结果偏大,原因是_______;若滴定过程中,有少量 IO3
不经 I2 直接将 SO2 氧化成 H2SO4,测定结果会_______(填“偏大”“偏小”或“不变”)
20.(12 分)(2024·山东卷)水煤气是 H2 的主要来源,研究 CaO 对 C—H2O 体系制 H2的影响,涉及主要
反应如下:
C(s) + H2O(g) CO(g) + H2(g) (I) ΔH1 > 0
CO(g) + H2O(g) CO2(g) + H2(g) (II) ΔH2 < 0
CaO(s) + CO2(g) CaCO3(s) (III) ΔH3 < 0
回答下列问题:
(1)C(s) + CaO(s) + 2H2O(g) CaCO3(s) + 2H2(g)的焓变ΔH=________(用代数式表示)。
(2)压力 p下,C—H2O—CaO 体系达平衡后,图示温度范围内 C(s)已完全反应,CaCO3(s)在 T1温度
时完全分解。气相中CO,CO2和H2摩尔分数随温度的变化关系如图所示,则 a线对应物种为______________
(填化学式)。当温度高于 T1 时,随温度升高 c 线对应物种摩尔分数逐渐降低的原因是
____________________________。
(3)压力 p下、温度为 T0时,图示三种气体的摩尔分数分别为 0.50,0.15,0.05,则反应 CO(g)
+H2O(g) CO2(g)+H2(g)的平衡常数 Kp =_______;此时气体总物质的量为 4.0 mol,则 CaCO3(s)的物质
的量为_______mol;若向平衡体系中通入少量 CO2(g),重新达平衡后,分压 p(CO2)将_______(填“增大”“减
小”或“不变”),p(CO)将_______(填“增大”“减小”或“不变”)
33
34
06-2024 年 海南卷
一、单选题
1.(2024·海南卷)化学为实现社会可持续发展贡献巨大。下列说法错.误.的是
A.以竹代塑,可减少白色污染 B.使用人工合成杀虫剂,对环境无影响
C.无纸化办公,可减少人工合成油墨的使用 D.使用无磷洗涤剂,可减少水体污染
2.(2024·海南卷)下列包装标签上的安全标识与试剂对应正确的是
A B C D
丁烷 葡萄糖 浓硫酸 氯化钡
3.(2024·海南卷)高分子物质与我们生活息息相关。下列说法错.误.的是
A.糖原(成分类似于淀粉)可转化为葡萄糖
B.聚合物 是CH2 = CH2的加聚物
C.畜禽毛羽(主要成分为角蛋白)完全水解可以得到氨基酸
D.聚合物 的单体是 HOOC CH2 4COOH和CH3CH2OH CH3CH2OH
4.(2024·海南卷)过氧化脲[CO NH2 2 H2O2]是一种常用的消毒剂,可由
过氧化氢(H2O2)和脲 CO NH2 2 加合而成,代表性结构如图所示。下列关
于过氧化脲的说法正确的是
A.所有原子处于同一平面 B.氧的化合价均为-2 价
C.杀菌能力源于其氧化性 D.所有共价键均为极性键
5.(2024·海南卷)下列化学应用实例与方程式不.匹.配.的是
选项 应用实例 方程式
海上油气 1 工平台海葵一号的钢壳外壁铺装锌锭
A Zn2+ aq +2e-=Zn s
减缓腐蚀
B 用硫磺粉减少破损水银体温计洒落的 Hg 的危害 Hg(l)+S s =HgS s
4Ag s +8S O2-2 3 aq +O2 g +2H2O(l)=
C 用浓Na2S2O3溶液洗除实验服上的黑色银斑 -
4 Ag S2O
3 -
3 2 aq +4OH aq
35
D 烘焙糕点时,以食品级NH4HCO3作膨松剂 NH4HCO3 aq NH3 g +CO2 g +H2O l
6.(2024·海南卷)NA代表阿伏加德罗常数的值。下列说法正确的是
A.2.2g超重水( 3H2O)所含的电子数目为NA
B.1L 0.1mol L 1NaClO溶液中ClO 的数目为 0.1NA
C.过量 C 与1mol SiO2充分反应转移电子数目为3NA
D.1mol Cl2与足量CH4发生取代反应生成 HCl 分子的数目为2NA
7.(2024·海南卷)已知 298K,101kPa 时,CO2 g +3H2 g CH3OH g +H2O g ΔH=-49.5kJ mol-1。该
反应在密闭的刚性容器中分别于 T1、T2 温度下进行,CO2的初始浓度为 0.4mol L 1,c CO2 t关系如图
所示。下列说法错.误.的是
A. T1>T2
B.T1下反应达到平衡时 c CH3OH = 0.15mol L 1
C.使用催化剂 1 的反应活化能比催化剂 2 的大
D.使用催化剂 2 和催化剂 3 的反应历程相同
8.(2024·海南卷)已知 298K,101kPa时,2H2 g +O2 g =2H2O l ΔH = 571.6kJ mol 1,H2的临界温度(能
够液化的最高温度)为 32.98K,下列说法错.误.的是
A.氢气燃烧热ΔH = 285.8kJ mol 1
B.题述条件下2mol H2和1mol O2,在燃料电池中完全反应,电功+放热量= 571.6kJ
C.氢能利用的关键技术在于安全储存与运输
D.不同电极材料电解水所需电压不同,产生2g H2 g 消耗的电功相同
9.(2024·海南卷)根据下列实验及现象,所得结论错.误.的是
选项 实验及现象 结论
A 将SO2通入溴水至过量,溶液的橙色褪去 SO2有漂白性
自热米饭附带的热源包(主要成分 CaO,少许Na2CO3、Al 粉)
B Al 粉已经变质
加水后,未产生气体
配体H O、Cl 2+2 与Cu 间存在配位
C CuCl2浓溶液呈黄绿色,加水稀释后溶液呈蓝色
平衡移动
D 淀粉-KI 试纸遇FeCl3 NH4HF2的混合液不变色 FeF 3 6 配离子氧化能力弱
10.(2024·海南卷)下列实验装置或操作不.能.达到实验目的的是
36
选项 A B C D
目的 提纯含砂的粗碘 观察气体扩散现象 制取少量乙酸乙酯 测定中和反应的反应热
装置或
操作
二、多选题
11.(2024·海南卷)海南暗罗是一种药用植物,具有抗菌、抗肿瘤活性。从中提取的一种生物活性物质结
构简式如图所示。下列关于该分子说法正确的是
A.能使酸性高锰酸钾溶液褪色
B.分子式为C19H28O4
C.含有 4 个手性碳原子
D.预测在不同溶剂中的溶解度 S: S环己烷 > S乙醇
12.(2024·海南卷)某温控质子驱动反应如图所示,下列说法错.误.的是
A.I 转化为Ⅱ后,N1 C2键长变短 B.基态N+离子的核外电子排式为1s22s22p3
C.I 具备在热敏指示剂方面的应用前景 D.加热时,Ⅰ的O1与H+结合,O1 C1键断开
13.(2024·海南卷)电解NH4HSO4溶液得到S 2 2O8 ,是早期制备H2O2的重要步骤。某实验装置如图所示。
电解过程流出液 b 中混有少量气泡。下列说法错.误.的是
A.电解过程中阴极区的SO2 4 不断迁移到阳极区
B.图中 a 代表H2
C.回路中通过 1mol电子产生 0.5mol NH4 2S2O8
D.SO2 2 2- - 2-4 氧化成S2O8 的电极反应为2SO4 -2e =S2O8
14.(2024·海南卷)H2S在生态系统的硫循环中不可或缺。298K,101kPa时,水溶液中 2价 S 不同形态的
分布分数如图所示,下列说法正确的是
37
A.线 a 表示HS 的分布分数
B.298K时,Na2S的pKb2约为 7.0
C.1.0L 1mol L 1的 NaOH溶液吸收H2S g 的量大于 1mol
D.可以向燃气中掺入微量H2S g 以示警燃气泄漏
三、解答题
15.(2024·海南卷)锰锌铁氧体(MnxZn1-yFe2O4)元件是电子线路中的基础组成部分。某实验室利用废弃电
子产品中的锰锌铁氧体制备MnO2、ZnO 和FeC2O4 2H2O,可用于电池,催化剂等行业,其工艺流程如下:
回答问题:
(1)氨浸的作用是将 元素(填元素符号)有效转移到水溶液中。
(2)煮沸含有配合物的溶液 B,产生混合气体,经冷凝后所得溶液可循环用于氨浸,该溶液是 。
(3)沉锰反应的离子方程式为 。某次实验时,将原料中的 Mn 以MnO2 nH2O形式定量沉淀完全,消
耗了 2.0mol KMnO4,并产出 81g ZnO(纯度为 99.9%),则该原料MnxZn1-yFe2O4化学式中 x = 。
(4)沉铁时,选择K2C2O4是为了便于从滤液中回收有价值的钾盐 (填化学式)。该钾盐在种植业中的
一种用途是 。
(5)通过加入CaSO4固体,除去滤液中危害环境的C O2 2 4 ,已知Ksp CaSO4 = 7.1 × 10 5,Ksp CaC2O4 = 2.3 ×
10 9。反应CaSO 2-4 s +C2O4 aq CaC 2-2O4 s +SO4 aq 的平衡常数为 。
16.(2024·海南卷)氨是一种理想的储氢载体,具有储氢密度高、储运技术成熟等优点。已知 298K,100kPa
时,反应①:N2 g +3H2 g 2NH3 g ΔH1 = 92kJ mol 1;p NH3 = 总压 × NH3物质的量分数。
回答问题:
(1)题述条件下,反应②:2NH 13 g N2 g +3H2 g ΔH2= kJ mol 。
38
(2)设反应为一步完成,且ΔH与温度无关,已知 673K下,反应①活化能为 335kJ mol 1,则NH3 g 分解
反应的活化能为 kJ mol 1。
(3)既能影响反应②平衡转化率又能影响其反应速率的因素有 、 。
(4)温度 T 下恒容密闭容器中进行氨催化分解反应,p NH3 -t关系曲线如图所示,其函数关系 p NH3 /kPa =
(写表达式),增大氨的初始分压,氨的转化速率 ;假设吸附到催化剂表面后NH3都变成活化分子,
其它条件不变,改用比表面积更大的催化剂,则单位时间H2的产量将 。
17.(2024·海南卷)羟基磷酸钙 Cax PO4 yOH 1.40 ≤ x/y ≤ 1.75 是骨骼石灰和牙釉质的主要成分。某课
题组按照下述步骤进行其制备探索:在 75℃下向由一定量 Ca OH 2粉末配制的含有分散剂的浆液中,边搅
拌边滴加计算量的稀H3PO4,滴加完成后继续搅拌一段时间。冷至室温固液分离,烘干固体得纳米级微粉
产品。制备依据的代表反应式为:5Ca OH 2+3H3PO4=Ca5 PO4 3OH+9H2O,装置如图所示(固定器具已省
略)。
回答问题:
(1)装置图中,安装不当的是 (填仪器标号)
(2)使用冷凝管的目的是 ,冷凝水进水口为 (填序号),干燥管中熟石灰用于吸收 (填
化学式)。
(3)实验中使用水浴加热,其优点为 、 。
(4)投料时应使用新制 Ca OH 2粉末,以降低杂质 (填化学式)对实验的影响。
(5)完成反应后,可以保持产品组成稳定的固液分离方式有 、 (填标号)。
a.倾倒 b.常压过滤 c.减压过滤 d.离心分离
(6)实验中以题述加料方式所得产品中 x/y = 1.67。某次实验将 Ca OH 2浆液滴入稀H3PO4得到的产品中
x/y = 1.50。造成这种结果差异的原因是 。
18.(2024·海南卷)消炎镇痛药 F 的一种合成路线如下:
39
回答问题:
(1)A 的结构简式为 ,其化学名称为 。
(2)A→B、C→D 反应的类型分别为 、 。
(3)某化合物 X 的分子式为C15H14O,符合下列条件 X 的结构简式为 。
①与 C 具有相同的官能团 ②含有 2 个苯环 ③核磁共振氢谱有 3 组峰
(4)D 中所含官能团名称为 。
(5)E→F 反应方程式如下,F 和 Y 的结构简式分别为 、 。
(6)以至多 3 个碳的有机物为原料(无机试剂任选),设计合成 的路
线 。
已知:
19.(2024·海南卷)锂电池是新型储能系统中的核心部件。作为锂电池中用到的电解质材料之一,Li bfsi(阴
离子bfsi 结构见下图。A)深受关注。
回答问题:
(1)Li bfsi的制备前体 Li bfsi(B),可由 C 的氟化反应得到,C 中第三周期元素有 (填元素符号)。
(2)C 分子中,两个 H N S键角均为 117°,S N S键角为 126°,N 的原子轨道杂化类型为 。
40
(3)B 溶于某溶剂发生自耦电离(2B A+F),阳离子 F 的结构式为 。
(4)B 和 D 水溶液均呈酸性,相同温度下,Ka值大小关系:B D(填“>”或“<”);沸点大小关系:
B(170℃)>E(60.8℃),其原因是 。
(5)研究表明,某有机溶剂中,相同浓度的 G 溶液和 H 溶液,前者电导率显著低于后者,原因是 。
(6)Li2 OH Cl在固体离子电导方面具有潜在的应用前景。其两种晶型中,一种取长方体形晶胞(图 1,长方
体棱长为 a、b、c),另一种取立方体形晶胞(图 2,Cl 居于立方体中心,立方体棱长为 d)。图中氢原子皆己
隐去。
①立方体形晶胞所代表的晶体中部分锂离子(●Li)位置上存在缺位现象,锂离子的总缺位率为 ;该
晶型中氯离子周围紧邻的锂离子平均数目为 。
②两种晶型的密度近似相等,则 c = 。(以含 a、b 和 d 的代数式表达)
41
42
07-2024 年 浙江卷 1 月
一、单选题
1.(2024·浙江·1 月)下列物质不.属.于.电解质的是
A.CO2 B.HCl C. NaOH D.BaSO4
2.(2024·浙江·1 月)工业上将 Cl2通入冷的 NaOH 溶液中制得漂白液,下列说法不正确的是
A.漂白液的有效成分是 NaClO B. ClO-水解生成HClO使漂白液呈酸性
C.通入 CO2后的漂白液消毒能力增强 D. NaClO溶液比HClO溶液稳定
3.(2024·浙江·1 月)下列表示不.正.确.的是
A 18.中子数为 10 的氧原子: 8 O
B.SO2 的价层电子对互斥(VSEPR)模型:
C.用电子式表示KCl的形成过程:
D. 的名称:2-甲基-4-乙基戊烷
催化剂
4.(2024·浙江·1 月)汽车尾气中的 NO 和CO在催化剂作用下发生反应:2NO+2CO 2CO2 +N2 ,下
列说法不.正.确.的是( NA 为阿伏加德罗常数的值)
A.生成1 mol CO2 转移电子的数目为 2NA B.催化剂降低 NO 与CO反应的活化能
C.NO 是氧化剂,CO是还原剂 D. N2 既是氧化产物又是还原产物
5.(2024·浙江·1 月)在溶液中能大量共存的离子组是
A H+、I-. 、Ba 2+、NO- B.Fe3+、K+、CN-、Cl-3
C +.Na 、SiO2-、Br -3 、Ca
2+ D + 2- - -. NH4、SO4、CH3COO 、HCO3
6.(2024·浙江·1 月)为回收利用含 I2 的CCl4 废液,某化学兴趣小组设计方案如下所示,下列说法不.正.确.
的是
43
A.步骤 I 中,加入足量 Na 2CO3 溶液充分反应后,上下两层均为无色
B.步骤 I 中,分液时从分液漏斗下口放出溶液 A
C.试剂 X 可用硫酸
D.粗 I2 可用升华法进一步提纯
7.(2024·浙江·1 月)根据材料的组成和结构变化可推测其性能变化,下列推测不.合.理.的是
材料 组成和结构变化 性能变化
A 生铁 减少含碳量 延展性增强
B 晶体硅 用碳原子取代部分硅原子 导电性增强
C 纤维素 接入带有强亲水基团的支链 吸水能力提高
D 顺丁橡胶 硫化使其结构由线型转变为网状 强度提高
8.(2024·浙江·1 月)下列实验装置使用不.正.确.的是
A.图①装置用于二氧化锰和浓盐酸反应制氯气
B.图②装置用于标准酸溶液滴定未知碱溶液
C.图③装置用于测定中和反应的反应热
D.图④装置用于制备乙酸乙酯
9.(2024·浙江·1 月)关于有机物检测,下列说法正确的是
A.用浓溴水可鉴别溴乙烷、乙醛和苯酚
B.用红外光谱可确定有机物的元素组成
C.质谱法测得某有机物的相对分子质量为 72,可推断其分子式为C5H12
D.麦芽糖与稀硫酸共热后加 NaOH 溶液调至碱性,再加入新制氢氧化铜并加热,可判断麦芽糖是否水
解
44
10.(2024·浙江·1 月)下列化学反应与方程式不.相.符.的是
点燃
A.黑火药爆炸:S+2KNO3 +3C K2S+N2 +3CO2
B.四氯化钛水解:TiCl4 +(x+2)H2O TiO2 xH2O +4HCl
C 2- +.硫化钠溶液在空气中氧化变质: 2S +O2 +4H 2S +2H2O
D .硬脂酸甘油酯在 NaOH 溶液中皂化: +3NaOH +
3C17H35COONa
11.(2024·浙江·1 月)制造隐形眼镜的功能高分子材料 Q 的合成路线如下:
下列说法不.正.确.的是
A.试剂 a 为NaOH 乙醇溶液 B.Y 易溶于水
C.Z 的结构简式可能为 D.M 分子中有 3 种官能团
12.(2024·浙江·1 月)X、Y、Z、M 和 Q 五种主族元素,原子序数依次增大,X 原子半径最小,短周期中
M 电负性最小,Z 与 Y、Q 相邻,基态 Z 原子的 s 能级与 p 能级的电子数相等,下列说法不.正.确.的是
A.沸点:X2Z>X2Q
B.M 与 Q 可形成化合物M2Q 、M2Q2
C.化学键中离子键成分的百分数:M2Z>M2Q
D 2-.YZ-3 与QZ3 离子空间结构均为三角锥形
2+
13.(2024·浙江·1 月)破损的镀锌铁皮在氨水中发生电化学腐蚀,生成 Zn NH3 H4 和 2,下列说法不正
确的是
A.氨水浓度越大,腐蚀趋势越大
B.随着腐蚀的进行,溶液 pH 变大
45
C - -.铁电极上的电极反应式为: 2NH3 +2e 2NH2 +H2
D.每生成标准状况下224 mL H2 ,消耗0.010 mol Zn
14.(2024·浙江·1 月)酯在 NaOH 溶液中发生水解反应,历程如下:
已知:
①
②RCOOCH2CH3水解相对速率与取代基 R 的关系如下表:
取代基 R CH3 ClCH2 Cl2CH
水解相对速率 1 290 7200
下列说法不.正.确.的是
A.步骤 I 是OH -与酯中Cδ+作用
B.步骤 III 使 I 和Ⅱ平衡正向移动,使酯在 NaOH 溶液中发生的水解反应不可逆
C.酯的水解速率:FCH2COOCH2CH3 >ClCH2COOCH2CH3
D. 与OH-反应、 与 18 OH- 反应,两者所得醇和羧酸盐均不同
15 -1.(2024·浙江·1 月)常温下、将等体积、浓度均为0.40 mol L BaCl2溶液与新制H2SO3溶液混合,出现白
色浑浊;再滴加过量的H2O2 溶液,振荡,出现白色沉淀。
已知:H2SO3 Ka1=1.4 10
-2 , Ka2 =6.0 10
-8
Ksp BaSO3 =5.0 10-10 , Ksp BaSO4 =1.1 10-10
下列说法不.正.确.的是
A.H SO c H+ >c HSO- 2- -2 3溶液中存在 3 >c SO3 >c OH
46
B.将 0.40 mol L-1H SO 溶液稀释到0.20 mol L-12 3 , c SO2-3 几乎不变
C.BaCl2溶液与H2SO3 溶液混合后出现的白色浑浊不含有BaSO3
D 2+.存在反应Ba +H2SO3 +H2O2 BaSO4 +2H
+ +H2O是出现白色沉淀的主要原因
16.(2024·浙江·1 月)根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不.正.确.
的是
实验目的 方案设计 现象 结论
将NO2 通入下列溶液至饱和:
HNO ①无色变黄 Cu和浓
HNO3反应后溶液
探究Cu和浓 3
色
A ①浓HNO3 呈绿色的主要原因是溶有
反应后溶液呈绿色 ②蓝色变绿
的原因 NOCu(NO ) 色HNO 2② 3 2 和 3,混合溶液
向等物质的量浓度的KF和KSCN
比较F- 与SCN - 结合B 混合溶液中滴加几滴FeCl
溶液颜色无 3+ - -
Fe3+ 3
溶液, 结合Fe 的能力:F >SCN
的能力 明显变化
振荡
分别测定等物质的量浓度的
比较HF与H
C 2
SO3的
前者 pH 小 酸性:HF>H SO酸性 NH4F与 NH4 SO pH 2 32 3溶液的
等体积、等物质的量浓度的
温度高的溶
探究温度对反应速
D Na 2S2O3与H2SO4 溶液在不同温 液中先出现 温度升高,该反应速率加快
率的影响
浑浊
度下反应
二、解答题
17.(2024·浙江·1 月)氮和氧是构建化合物的常见元素。
已知:
47
请回答:
(1)某化合物的晶胞如图,其化学式是 ,晶体类型是 。
(2)下列说法正确的是_______。
A.电负性:B>N>O B.离子半径: P3-
+
2 +H H2N-NH
+
3 ,其中 -NH2 的 N 原子杂化方式为 ;比较键角 HNH:H2N-NH2中
的 -NH2 H2N-NH
+
3 中的 -NH
+
3 (填“>”、“<”或“=”),请说明理由 。
+
②将HNO3与SO3按物质的量之比 1:2 发生化合反应生成 A,测得 A 由 2 种微粒构成,其中之一是 NO2 。
+
比较氧化性强弱: NO2 HNO3 (填“>”、“<”或“=”);写出 A 中阴离子的结构式 。
18.(2024·浙江·1 月)固态化合物 Y 的组成为MgCaFeMn CO3 4 ,以 Y 为原料实现如下转化。
已知: NH3与溶液 A 中金属离子均不能形成配合物。
请回答:
(1)依据步骤Ⅲ,MnCO3 、CaCO3和MgCO3 中溶解度最大的是 。写出溶液 C 中的所有阴离
子 。步骤Ⅱ中,加入 NH4Cl的作用是 。
(2)下列说法正确的是_______。
A.气体 D 是形成酸雨的主要成分 B.固体 E 可能含有 Na 2CO3
C.Mn(OH)2 可溶于NH4Cl 溶液 D.碱性:Ca(OH)2
-
4,根据该反应原理,
-
设计实验验证 Y 中含有Mn 元素 ;写出Mn2+ 转化为MnO4 的离子方程式 。
19.(2024·浙江·1 月)通过电化学、热化学等方法,将CO2转化为HCOOH 等化学品,是实现“双碳”目标
的途径之一。请回答:
(1)某研究小组采用电化学方法将CO2转化为HCOOH ,装置如图。电极 B 上的电极反应式是 。
48
(2)该研究小组改用热化学方法,相关热化学方程式如下:
I:C(s)+O2 (g) CO2 (g) ΔH1=-393.5 kJ mol
-1
Ⅱ:C(s)+H2 (g)+O2 (g) HCOOH(g) ΔH2 =-378.7 kJ mol
-1
Ⅲ:CO2(g)+H2(g) HCOOH(g) ΔH3
①ΔH -13 = kJ mol 。
②反应Ⅲ在恒温、恒容的密闭容器中进行,CO2和H2的投料浓度均为1.0 mol L-1,平衡常数K=2.4 10-8,
则CO2的平衡转化率为 。
③用氨水吸收HCOOH ,得到1.00 mol L-1氨水和0.18 mol L-1甲酸铵的混合溶液, 298 K 时该混合溶液的
pH= [ 298 K K NH H O =1.8 10-5。 已知: 时,电离常数 b 3 2 、Ka (HCOOH)=1.8 10-4 ]
(3)为提高效率,该研究小组参考文献优化热化学方法,在如图密闭装置中充分搅拌催化剂 M 的DMSO (有
机溶剂)溶液,CO2和H2在溶液中反应制备HCOOH ,反应过程中保持CO2(g) 和H2 (g)的压强不变,总反
应CO2 +H 2 HCOOH 的反应速率为 v,反应机理如下列三个基元反应,各反应的活化能E2
Ⅳ:M+CO 2 Q E1
V:Q+H 2 L E2
VI:L M+HCOOH E3
①催化剂 M 足量条件下,下列说法正确的是 。
A.v 与CO2(g) 的压强无关 B.v 与溶液中溶解H2 的浓度无关
C.温度升高,v 不一定增大 D.在溶液中加入N CH2CH3 3,可提高CO2转化率
②实验测得:298 K,p CO2 =p H2 =2MPa 下,v 随催化剂 M 浓度 c 变化如图。c c0 时,v 随 c 增大而
49
增大: c>c0 时,v 不再显著增大。请解释原因 。
20.(2024·浙江·1 月)H2S可用于合成光电材料。某兴趣小组用CaS与MgCl2 反应制备液态H2S,实验装
置如图,反应方程式为:CaS+MgCl2 +2H2 O CaCl2 +Mg(OH)2 +H2S 。
已知:①H2S的沸点是 -61℃,有毒;②装置 A 内产生的H2S气体中含有酸性气体杂质。
请回答:
(1)仪器 X 的名称是 。
(2)完善虚框内的装置排序:A→B→ →F+G
(3)下列干燥剂,可用于装置 C 中的是_______。
A.氢氧化钾 B.五氧化二磷 C.氯化钙 D.碱石灰
(4)装置 G 中汞的两个作用是:①平衡气压:② 。
(5)下列说法正确的是_______。
A.该实验操作须在通风橱中进行
B.装置 D 的主要作用是预冷却H2S
C.加入的MgCl2 固体,可使MgCl2 溶液保持饱和,有利于平稳持续产生H2S
D.该实验产生的尾气可用硝酸吸收
50
(6)取0.680 g H2S产品,与足量CuSO4 溶液充分反应后,将生成的CuS置于已恒重、质量为31.230 g 的坩埚
中,煅烧生成CuO ,恒重后总质量为32.814 g 。产品的纯度为 。
21.(2024·浙江·1 月)某研究小组通过下列路线合成镇静药物氯硝西泮。
已知:
请回答:
(1)化合物 E 的含氧官能团的名称是 。
(2)化合物 C 的结构简式是 。
(3)下列说法不正确的是_______。
A.化合物 A→D 的过程中,采用了保护氨基的方法
B.化合物 A 的碱性比化合物 D 弱
C.化合物 B 在氢氧化钠溶液加热的条件下可转化为化合物 A
D.化合物 G→氯硝西泮的反应类型为取代反应
(4)写出 F→G 的化学方程式 。
(5)聚乳酸( )是一种可降解高分子,可通过化合物 X( )开环聚合得到,设计以乙炔
为原料合成 X 的路线 (用流程图表示,无机试剂任选)。
(6)写出同时符合下列条件的化合物 B 的同分异构体的结构简式 。
①分子中含有二取代的苯环。
1
② H-NMR 谱和 IR 谱检测表明:分子中共有 4 种不同化学环境的氢原子,无碳氧单键。
51
52
08-2024 年 浙江卷 6 月
一、单选题
1.(2024·浙江·6 月)按物质组成分类, KAl SO 12H O4 2 2 属于
A.酸 B.碱 C.盐 D.混合物
2.(2024·浙江·6 月)下列说法不.正.确.的是
A.Al(OH)3呈两性,不能用于治疗胃酸过多
B.Na2O2 能与CO2反应产生O2,可作供氧剂
C.FeO有还原性,能被氧化成Fe3O4
D.HNO3见光易分解,应保存在棕色试剂瓶中
3.(2024·浙江·6 月)下列表示不.正.确.的是
A.CO2的电子式: B.Cl2 中共价键的电子云图:
C.NH3的空间填充模型: D.3,3-二甲基戊烷的键线式:
4.(2024·浙江·6 月)下列说法不.正.确.的是
A.装置①可用于铜与浓硫酸反应并检验气态产物 B.图②标识表示易燃类物质
C.装置③可用于制取并收集氨气 D.装置④可用于从碘水中萃取碘
5.(2024·浙江·6 月)化学与人类社会可持续发展息息相关。下列说法不.正.确.的是
A.部分金属可在高温下用焦炭、一氧化碳、氢气等还原金属矿物得到
B.煤的气化是通过物理变化将煤转化为可燃性气体的过程
C.制作水果罐头时加入抗氧化剂维生素 C,可延长保质期
D.加入混凝剂聚合氯化铝,可使污水中细小悬浮物聚集成大颗粒
6.(2024· -浙江·6 月)利用CH3OH 可将废水中的 NO3转化为对环境无害的物质后排放。反应原理为:
H+ +CH3OH+NO
-
3 X+CO2 +H2O (未配平)。下列说法正确的是
53
A.X 表示 NO2 B.可用O3替换CH3OH
C.氧化剂与还原剂物质的量之比为6:5
D.若生成标准状况下的CO2气体11.2L,则反应转移的电子数为 2NA ( NA 表示阿伏加德罗常数的值)
7.(2024·浙江·6 月)物质微观结构决定宏观性质,进而影响用途。下列结构或性质不.能.解.释.其用途的是
选项 结构或性质 用途
A 石墨呈层状结构,层间以范德华力结合 石墨可用作润滑剂
B SO2 具有氧化性 SO2 可用作漂白剂
C 聚丙烯酸钠( )中含有亲水基团 聚丙烯酸钠可用于制备高吸水性树脂
冠醚 18-冠-6 空腔直径( 260~320pm )与 K+ 直径 冠醚 18-冠-6 可识别 K+ ,能增大KMnO4 在有机溶
D
( 276pm )接近 剂中的溶解度
8.(2024·浙江·6 月)下列离子方程式正确的是
A.用CuSO 2+ 2-4 溶液除H2S气体:Cu +S CuS
B 2+ +.H2SO3溶液中滴加Ba NO3 2溶液:H2SO3 +Ba BaSO3 +2H
C.NaHCO - - -3溶液中通入少量Cl2 : 2HCO3 +Cl2 2CO2 +Cl +ClO +H2O
D.用FeCl3 溶液刻蚀覆铜板制作印刷电路板: 2Fe3+ +Cu 2Fe2+ +Cu2+
9.(2024·浙江·6 月)有机物 A 经元素分析仪测得只含碳、氢、氧 3 种元素,红外光谱显示 A 分子中没有
醚键,质谱和核磁共振氢谱示意图如下。下列关于 A 的说法正确的是
A.能发生水解反应 B.能与 NaHCO3溶液反应生成CO2
54
C.能与O2反应生成丙酮 D.能与 Na 反应生成H2
10.(2024·浙江·6 月)X、Y、Z、M 四种主族元素,原子序数依次增大,分别位于三个不同短周期,Y 与
M 同主族,Y 与 Z 核电荷数相差 2,Z 的原子最外层电子数是内层电子数的 3 倍。下列说法不.正.确.的是
A YX+ >YX-.键角: 3 3 B.分子的极性:Y2X2 >X2Z2
C.共价晶体熔点:Y M D.热稳定性:YX4 >MX4
11.(2024·浙江·6 月)二氧化碳氧化乙烷制备乙烯,主要发生如下两个反应:
I.C2H6 (g)+CO2 (g) C2H4 (g)+CO(g)+H2O(g) ΔH1>0
II.C2H6 (g)+2CO2 (g) 4CO(g)+3H2 (g) ΔH2 >0
向容积为10L 的密闭容器中投入 2mol C2H6 和3mol CO2 ,不同温度下,测得5min时(反应均未平衡)的相关
数据见下表,下列说法不.正.确.的是
温度( C ) 400 500 600
乙烷转化率( % ) 2.2 9.0 17.8
乙烯选择性( % ) 92.6 80.0 61.8
转化为乙烯的乙烷的物质的量
注:乙烯选择性 100%
转化的乙烷的总物质的量
A.反应活化能: I<Ⅱ
B 500 0 ~ 5min I v C H =2.88 10-3mol L-1 min -1. ℃时, 反应 的平均速率为: 2 4
C.其他条件不变,平衡后及时移除H2O(g),可提高乙烯的产率
D.其他条件不变,增大投料比 n C2H6 /n CO2 投料,平衡后可提高乙烷转化率
12.(2024·浙江·6 月)丙烯可发生如下转化(反应条件略):
下列说法不.正.确.的是
A.产物 M 有 2 种且互为同分异构体(不考虑立体异构)
55
B.H+可提高 Y→Z 转化的反应速率
C.Y→Z 过程中,a 处碳氧键比 b 处更易断裂
D.Y→P 是缩聚反应,该工艺有利于减轻温室效应
13.(2024·浙江·6 月)金属腐蚀会对设备产生严重危害,腐蚀快慢与材料种类、所处环境有关。下图为两
种对海水中钢闸门的防腐措施示意图:
下列说法正确的是
A.图 1、图 2 中,阳极材料本身均失去电子
B - -.图 2 中,外加电压偏高时,钢闸门表面可发生反应:O2 +4e +2H2O 4OH
C.图 2 中,外加电压保持恒定不变,有利于提高对钢闸门的防护效果
D.图 1、图 2 中,当钢闸门表面的腐蚀电流为零时,钢闸门、阳极均不发生化学反应
14.(2024·浙江·6 月)Si5Cl10中的Si原子均通过 sp3 杂化轨道成键,与 NaOH 溶液反应Si元素均转化成
Na2SiO3。下列说法不.正.确.的是
A.Si5Cl10分子结构可能是 B.Si5Cl10与水反应可生成一种强酸
C.Si5Cl10与NaOH 溶液反应会产生H2 D.Si5Cl10沸点低于相同结构的Si5Br10
15.(2024·浙江·6 月)室温下,H2S水溶液中各含硫微粒物质的量分数 δ随 pH 变化关系如下图[例如
δ c H SH 2 -18 -172S = c H2S +c HS- +c S2- ]。已知:
Ksp (FeS)=6.3 10 ,Ksp Fe(OH)2 =4.9 10 。
56
下列说法正确的是
A.溶解度:FeS大于Fe(OH) 2
B.以酚酞为指示剂(变色的 pH 范围 8.2~10.0),用 NaOH 标准溶液可滴定H2S水溶液的浓度
C.忽略S2- 的第二步水解,0.10mol/L的 Na 2S溶液中S2- 水解率约为62%
D.0.010mol/L的FeCl2 溶液中加入等体积0.20mol/L的 Na 2S溶液,反应初始生成的沉淀是 FeS
16.(2024·浙江·6 月)为探究化学平衡移动的影响因素,设计方案并进行实验,观察到相关现象。其中方
案设计和结论都正确的是
选项 影响因素 方案设计 现象 结论
向1mL 0.1mol/L K2CrO4 溶液中加入 增大反应物浓度,平衡向
A 浓度 黄色溶液变橙色
1mL1.0mol/L HBr 溶液 正反应方向移动
向恒温恒容密闭玻璃容器中充入 对于反应前后气体总体
B 压强 100mL HI气体,分解达到平衡后再 气体颜色不变 积不变的可逆反应,改变
充入100mL Ar 压强平衡不移动
将封装有 NO2 和 N2O4 混合气体的 升高温度,平衡向吸热反
C 温度 气体颜色变深
烧瓶浸泡在热水中 应方向移动
向1mL乙酸乙酯中加入 上层液体逐渐减 使用合适的催化剂可使
D 催化剂
1mL 0.3mol/L H 2SO4 溶液,水浴加热 少 平衡向正反应方向移动
二、解答题
17.(2024·浙江·6 月)氧是构建化合物的重要元素。请回答:
(1)某化合物的晶胞如图 1,Cl- 的配位数(紧邻的阳离子数)为 ;写出该化合物的化学式 ,写
出该化合物与足量 NH4Cl溶液反应的化学方程式 。
(2)下列有关单核微粒的描述正确的是_______。
A.Ar 的基态原子电子排布方式只有一种
B. Na 的第二电离能 >Ne 的第一电离能
57
C.Ge的基态原子简化电子排布式为[Ar]4s 24p 2
D. Fe原子变成Fe+ ,优先失去3d 轨道上的电子
(3)化合物HA、HB、HC和HD的结构如图 2。
①HA、HB和HC中羟基与水均可形成氢键( -O-H…OH2 ),按照氢键由强到弱对三种酸排序 ,请说
明理由 。
②已知HC、HD钠盐的碱性 NaC>NaD,请从结构角度说明理由 。
18.(2024·浙江·6 月)矿物资源的综合利用有多种方法,如铅锌矿(主要成分为PbS、ZnS )的利用有火法和
电解法等。
已知:①PbCl (s) 热
水
2 PbCl (aq)
HC
l
H PbCl ;
冷却 2 2 4
②电解前后 ZnS总量不变;③AgF易溶于水。
请回答:
(1)根据富氧煅烧(在空气流中煅烧)和通电电解(如图)的结果,PbS中硫元素体现的性质是 (选填“氧
化性”、“还原性”、“酸性”、“热稳定性”之一)。产物 B 中有少量Pb3O4,该物质可溶于浓盐酸,Pb 元素转
化为 PbCl 2-4 ,写出该反应的化学方程式 ;从该反应液中提取PbCl2 的步骤如下:加热条件下,加
入 (填一种反应试剂),充分反应,趁热过滤,冷却结晶,得到产品。
(2)下列说法正确的是_______。
A.电解池中发生的总反应是PbS Pb+S (条件省略)
B.产物 B 主要是铅氧化物与锌氧化物
C.1mol化合物 C 在水溶液中最多可中和 2mol NaOH
D.ClF的氧化性弱于Cl2
(3)D 的结构为 ( X=F或Cl ),设计实验先除去样品 D 中的硫元素,再用除去硫元素后的溶液探究
58
X 为何种元素。
①实验方案:取 D 的溶液,加入足量 NaOH 溶液,加热充分反应,然后 ;
②写出 D(用HSO3X 表示)的溶液与足量 NaOH 溶液反应的离子方程式 。
19.(2024·浙江·6 月)氢是清洁能源,硼氢化钠( NaBH 4 )是一种环境友好的固体储氢材料,其水解生氢反
应方程式如下:(除非特别说明,本题中反应条件均为 25℃,101kPa )
NaBH4 (s)+2H2O(l) NaBO2 (aq)+4H2 (g) ΔH<0
请回答:
(1)该反应能自发进行的条件是_______。
A.高温 B.低温 C.任意温度 D.无法判断
(2)该反应比较缓慢。忽略体积变化的影响,下列措施中可加快反应速率的是_______。
A.升高溶液温度 B.加入少量异丙胺 CH3 CHNH2 2
C.加入少量固体硼酸 B(OH)3 D.增大体系压强
(3)为加速 NaBH 4 水解,某研究小组开发了一种水溶性催化剂,当
该催化剂足量、浓度一定且活性不变时,测得反应开始时生氢速
率 v与投料比 n NaBH4 /n H2O 之间的关系,结果如图 1 所示。
请解释 ab 段变化的原因 。
(4)氢能的高效利用途径之一是在燃料电池中产生电能。某研究小组的自制熔融碳酸盐燃料电池工作原理如
图 2 所示,正极上的电极反应式是 。该电池以3.2A 恒定电流工作 14 分钟,消耗H2 体积为0.49L ,
故可测得该电池将化学能转化为电能的转化率为 。[已知:该条件下H2 的摩尔体积为 24.5L/mol ;
电荷量q(C)=电流 I(A) 时间 (s);NA =6.0 10
23mol-1; e=1.60 10-19C。]
59
(5)资源的再利用和再循环有利于人类的可持续发展。选用如下方程式,可以设计能自发进行的多种制备方
法,将反应副产物偏硼酸钠( NaBO2 )再生为NaBH 4 。(已知:ΔG是反应的自由能变化量,其计算方法也遵
循盖斯定律,可类比 H计算方法;当ΔG<0时,反应能自发进行。)
I. NaBH4 (s)+2H2O(l) NaBO2 (s)+4H2 (g) ΔG1=-320kJ/mol
1
II.H2 (g)+ O2 (g)=H2O(l) ΔG2 =-240kJ/mol2
1
III.Mg(s)+ O2 (g)=MgO(s) ΔG3 =-570kJ/mol2
请书写一个方程式表示 NaBO2 再生为 NaBH4 的一种制备方法,并注明ΔG 。(要求:反应物不超过
三种物质;氢原子利用率为100% 。)
20.(2024·浙江·6 月)某小组采用如下实验流程制备AlI3 :
已知:AlI3 是一种无色晶体,吸湿性极强,可溶于热的正己烷,在空气中受热易被氧化。
请回答:
(1)如图为步骤 I 的实验装置图(夹持仪器和尾气处理装置已省略),图中仪器
A 的名称是 ,判断步骤 I 反应结束的实验现象是 。
(2)下列做法不.正.确.的是_______。
A.步骤 I 中,反应物和溶剂在使用前除水
B.步骤 I 中,若控温加热器发生故障,改用酒精灯(配石棉网)加热
C.步骤Ⅲ中,在通风橱中浓缩至蒸发皿内出现晶膜
D.步骤Ⅳ中,使用冷的正己烷洗涤
(3)所得粗产品呈浅棕黄色,小组成员认为其中混有碘单质,请设计实验方案验证 。
(4)纯化与分析:对粗产品纯化处理后得到产品,再采用银量法测定产品中 I- 含量以确定纯度。滴定原理为:
先用过量AgNO3标准溶液沉淀 I- ,再以NH4SCN标准溶液回滴剩余的Ag+ 。
已知:
难溶电解质 AgI (黄色) AgSCN (白色) Ag2CrO4 (红色)
溶度积常数K -17 -12 -12sp 8.5 10 1.0 10 1.1 10
①从下列选项中选择合适的操作补全测定步骤 。
60
称取产品1.0200g,用少量稀酸 A 溶解后转移至250mL容量瓶
同课章节目录
