2025年九年级中考化学专题复习 溶 液 课件(共49张PPT)
文档属性
| 名称 | 2025年九年级中考化学专题复习 溶 液 课件(共49张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 14:29:56 | ||
图片预览






文档简介
(共49张PPT)
溶液
第 5 讲 溶 液
实验 1 溶解性实验
(1)试管①中的现象是 ______________________,试管③中的现象是 ______________________________________________________________。
碘在水中几乎不溶解
高锰酸钾固体溶解,形成紫红色溶液
基础实验过关
第 5 讲 溶 液
(2)对比 ____________ 两支试管中的现象得出同种溶质在不同溶剂中的溶解性不同;对比①、③两支试管中的现象得出的结论是 ______________________________________。
(3)该对比实验中还需控制 ___________________、_______________相同。
(4)该实验用到的研究方法是 ____________。
创新考法
(5)[原理应用]根据上述实验,高锰酸钾固体中若混有少量的碘单质,____________(选填“可以”或“不可以”)用汽油除去。
①②(或③④)
不同种溶质在相同溶剂中的溶解性不同
水和汽油的体积
固体颗粒的大小
控制变量法
可以
第 5 讲 溶 液
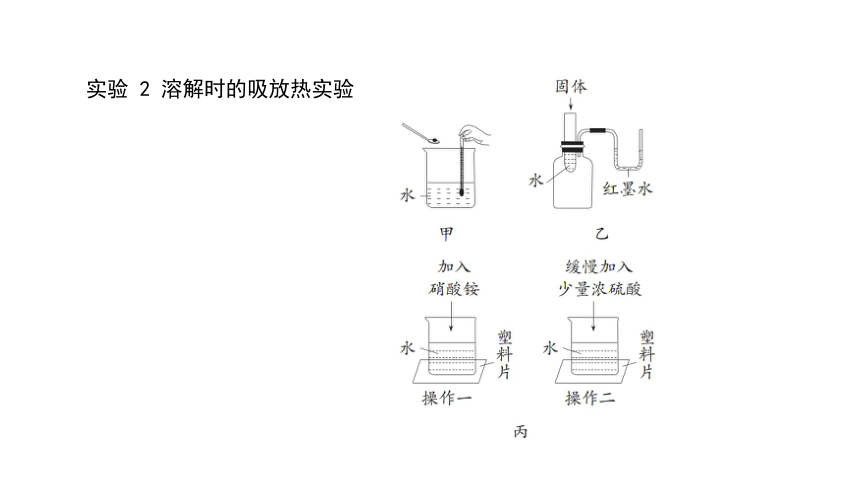
实验 2 溶解时的吸放热实验
第 5 讲 溶 液
(1)甲实验,若观察到温度计示数增大,则加入的固体物质为 ___________(选填“氯化钠”“氢氧化钠”或“硝酸铵”),该固体溶于水时______(选填“吸收”或“放出”)热量;若观察到温度计示数减小,则加入的固体物质为_______(选填“氯化钠”“氢氧化钠”或“硝酸铵”),该固体溶水时 ______(选填“吸收”或“放出”)热量,若观察到温度计示数变化不大,则加入的固体可能为氯化钠。
氢氧化钠
放出
硝酸铵
吸收
第 5 讲 溶 液
(2)乙实验,若加入的固体是 NH4NO3,则 U 形管中液面 _______________(选填“左高右低”或“右高左低”);若得到和上述实验相反的现象,应加入的一种固体物质是 _______________________(填化学式)。
(3)丙实验,操作一中加入硝酸铵后一会儿发现烧杯与塑料片粘在一起,其原因是 ____________________________________________________________
________________________;操作二中烧杯与塑料片分离的原因是 ____________________________________________。
左高右低
NaOH(答案合理即可)
硝酸铵晶体溶于水时吸收热量,使溶液的温度降到 0 ℃以下,
塑料片上的水结成冰
浓硫酸溶于水放出大量的热,使温度升高
第 5 讲 溶 液
创新考法
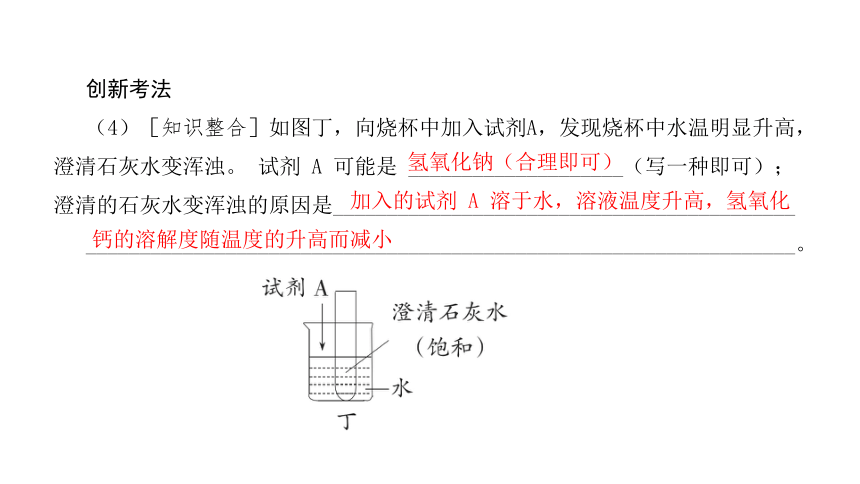
(4)[知识整合]如图丁,向烧杯中加入试剂A,发现烧杯中水温明显升高,澄清石灰水变浑浊。 试剂 A 可能是 ____________________(写一种即可);澄清的石灰水变浑浊的原因是___________________________________________
__________________________________________________________________。
氢氧化钠(合理即可)
加入的试剂 A 溶于水,溶液温度升高,氢氧化
钙的溶解度随温度的升高而减小
第 5 讲 溶 液
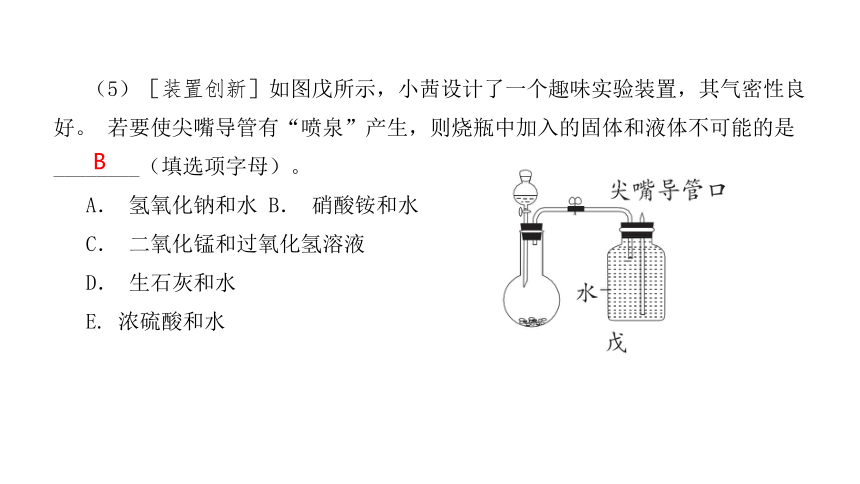
(5)[装置创新]如图戊所示,小茜设计了一个趣味实验装置,其气密性良好。 若要使尖嘴导管有“喷泉”产生,则烧瓶中加入的固体和液体不可能的是 ________(填选项字母)。
A. 氢氧化钠和水 B. 硝酸铵和水
C. 二氧化锰和过氧化氢溶液
D. 生石灰和水
E. 浓硫酸和水
B
第 5 讲 溶 液
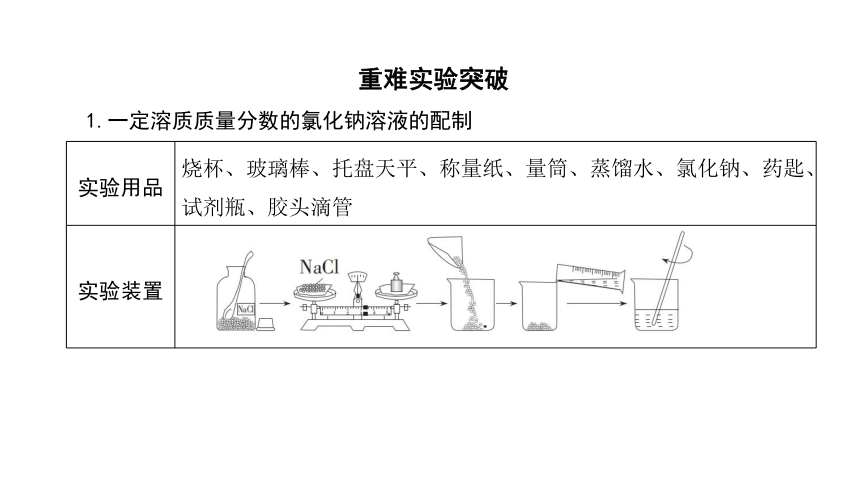
1.一定溶质质量分数的氯化钠溶液的配制
实验用品 烧杯、玻璃棒、托盘天平、称量纸、量筒、蒸馏水、氯化钠、药匙、试剂瓶、胶头滴管
实验装置
重难实验突破
第 5 讲 溶 液
续表
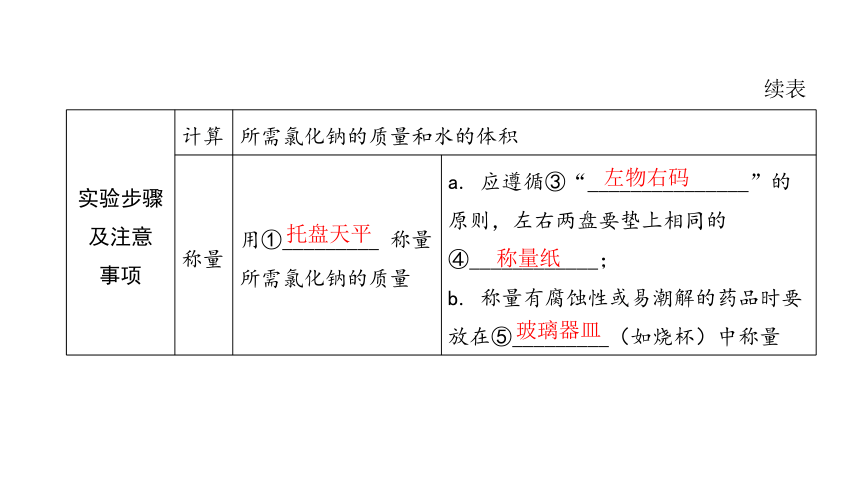
实验步骤 及注意 事项 计算 所需氯化钠的质量和水的体积
称量 用①_________ 称量所需氯化钠的质量 a. 应遵循③“_______________”的原则,左右两盘要垫上相同的
④____________;
b. 称量有腐蚀性或易潮解的药品时要放在⑤_________(如烧杯)中称量
托盘天平
左物右码
称量纸
玻璃器皿
第 5 讲 溶 液
续表
实验步骤 及注意 事项 量取 用②_____ 量取所需 水的体积 a. 用量筒量取液体时,读数时视线与⑥_______________________________
保持水平;
b. 选取量筒的量程要比所要量取的液体的体积稍大,且越接近越好
溶解 将氯化钠倒入烧杯中,把量好的水倒入盛有氯化钠的烧杯中,用⑦________ 搅拌,使氯化钠溶解
量筒
量筒内液体凹液面的最低处
玻璃棒
第 5 讲 溶 液
续表
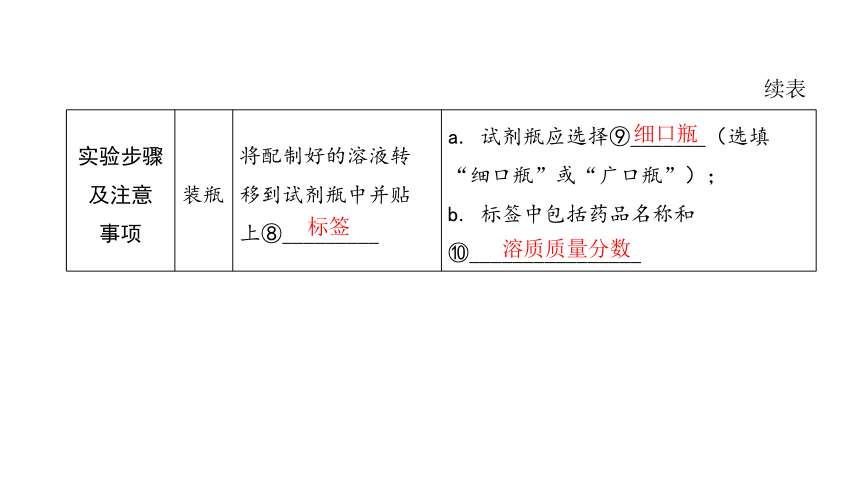
实验步骤 及注意 事项 装瓶 将配制好的溶液转 移到试剂瓶中并贴 上⑧_________ a. 试剂瓶应选择⑨_______(选填“细口瓶”或“广口瓶”);
b. 标签中包括药品名称和⑩________________
标签
细口瓶
溶质质量分数
第 5 讲 溶 液
续表
误差分析 溶质质量 分数偏小 溶质质量偏小 a. 称量时,将药品和砝码的位置放颠倒了,且使用了游码;
b. 固体倒入烧杯时部分撒落或残留在纸片上;
c. 药品不纯,含有杂质
溶剂质量偏大 a. 用量筒量取水时, _____ 视读数;
b. 烧杯或试剂瓶内有水
仰
第 5 讲 溶 液
续表
误差分析 溶质质量 分数偏大 溶质质量偏大 a. 天平砝码生锈(没有脱落)或沾有其他物质;
b. 称量前未调节天平平衡,指针偏 _____
溶剂质量偏小 a. 用量筒量取水时, _____ 视读数;
b. 水倒入烧杯时部分洒出
右
俯
第 5 讲 溶 液
【补充实验】 用 5%的氯化钠溶液配制一定量溶质质量分数为 1%的氯化钠溶液
计算 计算所需浓溶液的体积和所需水的体积
量取 用量筒量取溶质质量分数为 5%的氯化钠溶液,用量筒量取所需蒸馏水
稀释 把量取的溶质质量分数为 5%的氯化钠溶液注入烧杯中,再注入量取的蒸馏水,用玻璃棒搅拌混合均匀
装瓶 将配制好的溶液转移到试剂瓶中,盖好瓶盖并贴上标签
第 5 讲 溶 液
续表
误差 分析 溶质质量分数偏小 用量筒量取浓溶液时 ____ 视读数,量取水时 ____ 视读数
溶质质量分数偏大 用量筒量取浓溶液时 ____ 视读数,量取水时 ____ 视读数
俯
仰
仰
俯
第 5 讲 溶 液
实验考点一遍过
例 题 某同学配制 100 g 6%的氯化钠溶液,操作过程如图甲所示,回答下列问题。
第 5 讲 溶 液
(1)图示中正确的操作顺序为 _____________(填序号)。
(2)所需氯化钠和水的质量分别为氯化钠____ g,水 ______ g。
(3)图中使用到的玻璃仪器有 ______、量筒、玻璃棒、广口瓶四种。
(4)溶解时用玻璃棒搅拌的目的是 ________________________________。
(5)在量取水的操作中,量水时选用的量筒的量程为 ______ mL;当水面接近所需刻度时,应使用 ______________ 添加水。
(6)图中的错误操作是 ______(填序号),该错误导致的结果是溶质质量分数 _______(选填“偏大”“偏小”或“不变”)。
②①⑤③④
6
94
烧杯
加快溶解速率
100
胶头滴管
①
偏小
第 5 讲 溶 液
(7)将配制好的溶液装在 ______(选填“广口瓶”或“细口瓶”)中,并填好标签,在如图标签中填上相应的内容。
(8)量取水仰视读数,则配制的溶液 _______(选填“>”“=”或“<”)6%;装瓶时,有少量溶液洒出,则所配制的溶液的溶质质量分数 _____(选填“偏大”“偏小”或“不变”)。
细口瓶
氯化钠溶液
6%
<
不变
第 5 讲 溶 液
(9)称量完毕后,发现砝码缺损,则所配溶液的溶质质量分数 ______(选填“偏大”“偏小”或“不变”)。
(10)取 10 g 配制好的质量分数为 6%的 NaCl溶液,稀释成质量分数为 1%的 NaCl 溶液,需加水 ______ g。
偏小
50
第 5 讲 溶 液
拓 展
【创新设问】(1)[操作分析]用已调节平衡的天平称取氯化钠固体时,发现指针偏右,接下来的操作是 _______________________________ 。
(2)[数据分析]若如图①中砝码的质量 15 g,游码的读数 3.5 g,则小明称得的氯化钠的质量实际为 _______ g。
(3)[实验仪器选择][2024·成都]将质量分数为 7.08%的硝酸钾溶液稀释为 4.04%,需选择图乙中的烧杯和 __________(填序号)。
继续添加氯化钠直至天平平衡
11.5
③④⑤
第 5 讲 溶 液
(4)[改变试剂]实验室要配制一定溶质质量分数的氢氧化钠溶液。 在配制过程中有同学提议,将称量和量取步骤对调,老师认为该建议合理,理由是 ___________________________________________________。
(5)[与溶解度结合]若用已配好的 100 g 溶质质量分数为 6%的氯化钠溶液配制成 20 ℃时氯化钠的饱和溶液,最简单的操作是 _______________________________(已知 20 ℃时氯化钠的溶解度为 36.0 g)。
往溶液中添加 27.84 g 氯化钠
后称量氢氧化钠可减少其潮解吸水,减少实验误差
第 5 讲 溶 液
解题通法
第 5 讲 溶 液
【迁移应用】实验室要配制 50 g 溶质质量分数为 20%的硝酸钾溶液,现有 25 g 溶质质量分数为 40%的硝酸钾溶液、20 g 溶质质量分数为 15%的硝酸钾溶液及足够多的硝酸钾晶体和蒸馏水,请选用上述的试剂,设计三种配制方案填入下表。
第 5 讲 溶 液
配制方案(只要说明配制时所需的各种试剂及用量即可)
方案一
方案二
方案三
10 g KNO3 晶体和 40 g 蒸馏水
25 g 40%的 KNO3 溶液和 25 g 蒸馏水
20 g 15%的 KNO3 溶液、7 g KNO3 晶体和 23 g 蒸馏水
第 5 讲 溶 液
2. 粗盐中难溶性杂质的去除
实验用品 烧杯、玻璃棒、蒸发皿、坩埚钳、酒精灯、漏斗、药匙、量筒、铁架台(带铁圈)、托盘天平、滤纸、称量纸、火柴、粗盐、蒸馏水
实验装置
溶解
第 5 讲 溶 液
续表
实验步骤 称量:称量粗盐
溶解:加水溶解,用玻璃棒不断搅拌,直到粗盐不再溶解为止
过滤:a. 做好过滤器,装配好仪器;b. 将溶解好的液体用玻璃棒引流到过滤器;c. 若滤液浑浊再过滤
蒸发:a. 装配好仪器;b. 将过滤后的澄清液倒入蒸发皿中,边加热边用玻璃棒搅拌,当蒸发皿中②_____________ 时停止加热,利用余热将其蒸干
出现较多固体
第 5 讲 溶 液
续表
实验步骤 计算产率:a. 用玻璃棒把蒸发皿中的固体转移到纸上称量并计算精盐的产率, 计算公式: 产率= ×100%;b. 将提纯的精盐放到指定容器中
误差分析 产率偏低的原因 a. 称量时,药品与砝码放反并使用了游码;
b. 溶解时未充分搅拌;
c. 蒸发时液体溅出;
d. 转移固体时固体撒落等
第 5 讲 溶 液
续表
误差分析 产率偏高的原因 a. 称量时多称了;
b. 蒸发时未充分蒸干;
c. 过滤时漏斗内液面高于滤纸边缘等
补充说明 (1)四次使用玻璃棒的作用:a. 溶解:③_____________________;b. 过滤:④_______;c. 蒸发:搅拌, ⑤________________________________;d. 计算产率:转移固体; (2)过滤后的液体仍浑浊的原因:a. 操作过程中液面高出滤纸的边缘;b. 滤纸破损;c. 接滤液的烧杯内壁不干净等
搅拌,加速溶解
引流
防止局部温度过高而造成液滴飞溅
第 5 讲 溶 液
实验考点一遍过
例题 某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,如图是同学们做粗盐提纯实验的操作示意图。
(1)粗盐提纯实验的操作顺序 _____________(填操作序号)、称量精盐并计算产率。
(2)图中有一处明显的错误,请指出:_________________________。
①⑤②③⑥④
④中未用玻璃棒搅拌
第 5 讲 溶 液
(3)操作⑥名称为 _____,用到的玻璃仪器是玻璃棒、烧杯、____________。 过滤操作中速度慢的原因可能是 _______________________________。结束后发现溶液仍浑浊,则可能原因是_______________________。
(4)操作④中,当观察到 __________________________即可停止加热。
(5)若得到的实验数据如下,则氯化钠的产率为 ________。
过滤
漏斗
滤纸和漏斗间有气泡(合理即可)
滤纸破损(合理即可)
蒸发皿中出现较多固体
85%
第 5 讲 溶 液
(6)兴趣小组通过计算结果发现实验测得的精盐产率比实际偏高,可能进行的不当操作是__________________________________________________________。
拓 展
【创新设问】(1)[操作分析]操作④中,为了防止液体飞溅,除了用玻璃棒搅拌以外,还可以进行的操作是 ________________________________。
(2)[改进实验]老师建议在溶解和过滤之间增加“溶液静置”的步骤,其目的是 ______________________________________________________________。
(3)[过程分析]去除杂质的关键一步是 _______。
蒸发时,固体没有完全蒸干就进行称量(合理即可)
间歇加热(或左右移动酒精灯)
使不溶物质沉降,避免堵住滤纸的小孔,加快过滤速率
过滤
第 5 讲 溶 液
【创新方案】(4)[化学提纯]为除去上述粗盐水中的 Na2SO4、CaCl2、MgCl2 等杂质,需要依次加入过量的 BaCl2、______________、NaOH 溶液 ,分离出沉淀后,再加入适量盐酸后蒸发。
(5)[与溶解度结合]在老师的指导下,同学们提纯含少量泥沙的粗盐样品 10 g,20 ℃时,氯化钠的溶解度为 36 g,溶解该粗盐样品,需加入水的量约为 _______(选填“15”“30”或“60”)mL,理由是 __________________________________________________________________________________________________________________________________________。
Na2CO3
30
20 ℃时,氯化钠的溶解度为36 g,实验中称取的粗盐质量为10 g,加入约 30 mL 水既可使粗盐中的氯化钠充分溶解,又不会因为加水过多而影响后续蒸发操作的效率
第 5 讲 溶 液
解题通法 粗盐中难溶性杂质的去除的思路与方法
第 5 讲 溶 液
【迁移应用】除去 NaCl 固体中的 CaCO3 应用的是 _________(选填“物理转移”或“化学转化”)的方法。
物理转移
■题型一 溶液知识的相关判断
题型解法
1. 均一、稳定的液体并不一定是溶液,如水、酒精等纯净物;溶液不一定都是无色的,如硫酸铜溶液是蓝色的。
2. 掌握几种常见物质溶于水的吸、放热情况,包括氢氧化钠(放热)、硝酸铵(吸热)、浓硫酸(放热)、氧化钙(放热)等。
3. 饱和溶液、不饱和溶液是针对某一溶质而言,不是针对所有溶质。
第 5 讲 溶 液
例 1 [2024·邯郸二模]溶液用途广泛,与人们的生活息息相关。 下列说法正确的是 ( )
A. 溶液都是无色透明的液体
B. 溶液都是由溶质和溶剂组成的
C. 均一的、稳定的液体都是溶液
D. 饱和溶液一定比不饱和溶液的浓度大
第 5 讲 溶 液
B
衍生 变形式———结合实物图
下列有关如图所示的溶液的说法正确的是 ( )
A. 氯化钠溶于水温度明显上升
B. 下层液体比上层液体咸
C. 该溶液中的溶质为固体,所以溶液中的溶质只能是固体
D. 氯化钠溶液是混合物
第 5 讲 溶 液
D
■题型二 溶解度及溶解度曲线
思路点拨
第 5 讲 溶 液
题型解法
1. 理解溶解度曲线中各点的含义:
曲线上的每一点表示物质在该点所对应温度下的溶解度
曲线下方的点表示对应温度下的不饱和溶液
曲线的交点表示两物质在该点所对应温度下的溶解度相同
2. 饱和溶液与不饱和溶液的判断方法:根据溶解度曲线找出该温度下物质的溶解度→确定给定量的水中可溶解的溶质的质量→判断加入的物质能否全部溶解→判断溶液状态。
第 5 讲 溶 液
例 2 [2024·河北 7 题]如表是 KNO3 和NaNO3 在不同温度时的溶解度,小明用其中一种物质(X)进行了如图所示的实验(水蒸发忽略不计)。 下列分析错误的是 ( )
第 5 讲 溶 液
C
A. X 为 NaNO3
B. ③中溶液为 X 的不饱和溶液
C. ④中溶液的质量为 100 g
D. 溶液中溶质的质量分数:②=③>④
第 5 讲 溶 液
衍生 变形式———将表格+流程图变为表格加溶解度曲线图
NaCl 和 Na2SO4 的溶解度表及溶解度曲线如下。下列说法正确的是( )
A. 甲为 NaCl
B. a1 ℃应介于 40 ℃~50 ℃
C. 甲、乙饱和溶液从 a3 ℃降温到 a2℃溶质的质量分数:甲变大、乙变小
D. 等质量的 NaCl、Na2SO4 饱和溶液从 a1 ℃升温到 a3 ℃,要使两溶液均达饱和,则加入 Na2SO4 的质量大于 NaCl 的质量
第 5 讲 溶 液
D
第 5 讲 溶 液
■题型三 溶质质量分数的综合计算
题型解法
1. 找出已知量,代入化学方程式,根据化学方程式计算出溶质的质量。
2. 找准溶液的质量,根据溶质的质量分数 = ×100%计算溶质的质量分数。
第 5 讲 溶 液
例 3 [2024·廊坊广阳区二模]化学实验室现取 15.6 g 含杂质的碳酸钠样品于烧杯中,缓慢加入稀盐酸(碳酸钠样品中的杂质不溶于水,也不与稀盐酸反应),剩余固体质量与加入稀盐酸的质量关系如图。 请计算:
(1)15.6 g 样品中碳酸钠的质量为 _________ g。
(2)稀盐酸的溶质质量分数。
第 5 讲 溶 液
10.6
第 5 讲 溶 液
(2)解:设 73 g 稀盐酸中溶质的质量为 x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
10.6 g x
=
x= =7.3 g
稀盐酸的溶质质量分数为×100%=10%
答:稀盐酸的溶质质量分数为 10%。
衍生 变形式———实物流程图类计算题
[2020·河北 36 题]某小组用粗锌测定某稀硫酸中溶质的质量分数。 取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后,向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。 请计算:
(1)生成氢气的总质量为 _____ g。
(2)稀硫酸中溶质的质量分数。
第 5 讲 溶 液
0.2
第 5 讲 溶 液
(2)解:设稀硫酸中溶质的质量为 x。
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.2 g
=
x= =9.8 g
稀硫酸中溶质的质量分数为×100%=9.8%
答:稀硫酸中溶质的质量分数为 9.8%。
溶液
第 5 讲 溶 液
实验 1 溶解性实验
(1)试管①中的现象是 ______________________,试管③中的现象是 ______________________________________________________________。
碘在水中几乎不溶解
高锰酸钾固体溶解,形成紫红色溶液
基础实验过关
第 5 讲 溶 液
(2)对比 ____________ 两支试管中的现象得出同种溶质在不同溶剂中的溶解性不同;对比①、③两支试管中的现象得出的结论是 ______________________________________。
(3)该对比实验中还需控制 ___________________、_______________相同。
(4)该实验用到的研究方法是 ____________。
创新考法
(5)[原理应用]根据上述实验,高锰酸钾固体中若混有少量的碘单质,____________(选填“可以”或“不可以”)用汽油除去。
①②(或③④)
不同种溶质在相同溶剂中的溶解性不同
水和汽油的体积
固体颗粒的大小
控制变量法
可以
第 5 讲 溶 液
实验 2 溶解时的吸放热实验
第 5 讲 溶 液
(1)甲实验,若观察到温度计示数增大,则加入的固体物质为 ___________(选填“氯化钠”“氢氧化钠”或“硝酸铵”),该固体溶于水时______(选填“吸收”或“放出”)热量;若观察到温度计示数减小,则加入的固体物质为_______(选填“氯化钠”“氢氧化钠”或“硝酸铵”),该固体溶水时 ______(选填“吸收”或“放出”)热量,若观察到温度计示数变化不大,则加入的固体可能为氯化钠。
氢氧化钠
放出
硝酸铵
吸收
第 5 讲 溶 液
(2)乙实验,若加入的固体是 NH4NO3,则 U 形管中液面 _______________(选填“左高右低”或“右高左低”);若得到和上述实验相反的现象,应加入的一种固体物质是 _______________________(填化学式)。
(3)丙实验,操作一中加入硝酸铵后一会儿发现烧杯与塑料片粘在一起,其原因是 ____________________________________________________________
________________________;操作二中烧杯与塑料片分离的原因是 ____________________________________________。
左高右低
NaOH(答案合理即可)
硝酸铵晶体溶于水时吸收热量,使溶液的温度降到 0 ℃以下,
塑料片上的水结成冰
浓硫酸溶于水放出大量的热,使温度升高
第 5 讲 溶 液
创新考法
(4)[知识整合]如图丁,向烧杯中加入试剂A,发现烧杯中水温明显升高,澄清石灰水变浑浊。 试剂 A 可能是 ____________________(写一种即可);澄清的石灰水变浑浊的原因是___________________________________________
__________________________________________________________________。
氢氧化钠(合理即可)
加入的试剂 A 溶于水,溶液温度升高,氢氧化
钙的溶解度随温度的升高而减小
第 5 讲 溶 液
(5)[装置创新]如图戊所示,小茜设计了一个趣味实验装置,其气密性良好。 若要使尖嘴导管有“喷泉”产生,则烧瓶中加入的固体和液体不可能的是 ________(填选项字母)。
A. 氢氧化钠和水 B. 硝酸铵和水
C. 二氧化锰和过氧化氢溶液
D. 生石灰和水
E. 浓硫酸和水
B
第 5 讲 溶 液
1.一定溶质质量分数的氯化钠溶液的配制
实验用品 烧杯、玻璃棒、托盘天平、称量纸、量筒、蒸馏水、氯化钠、药匙、试剂瓶、胶头滴管
实验装置
重难实验突破
第 5 讲 溶 液
续表
实验步骤 及注意 事项 计算 所需氯化钠的质量和水的体积
称量 用①_________ 称量所需氯化钠的质量 a. 应遵循③“_______________”的原则,左右两盘要垫上相同的
④____________;
b. 称量有腐蚀性或易潮解的药品时要放在⑤_________(如烧杯)中称量
托盘天平
左物右码
称量纸
玻璃器皿
第 5 讲 溶 液
续表
实验步骤 及注意 事项 量取 用②_____ 量取所需 水的体积 a. 用量筒量取液体时,读数时视线与⑥_______________________________
保持水平;
b. 选取量筒的量程要比所要量取的液体的体积稍大,且越接近越好
溶解 将氯化钠倒入烧杯中,把量好的水倒入盛有氯化钠的烧杯中,用⑦________ 搅拌,使氯化钠溶解
量筒
量筒内液体凹液面的最低处
玻璃棒
第 5 讲 溶 液
续表
实验步骤 及注意 事项 装瓶 将配制好的溶液转 移到试剂瓶中并贴 上⑧_________ a. 试剂瓶应选择⑨_______(选填“细口瓶”或“广口瓶”);
b. 标签中包括药品名称和⑩________________
标签
细口瓶
溶质质量分数
第 5 讲 溶 液
续表
误差分析 溶质质量 分数偏小 溶质质量偏小 a. 称量时,将药品和砝码的位置放颠倒了,且使用了游码;
b. 固体倒入烧杯时部分撒落或残留在纸片上;
c. 药品不纯,含有杂质
溶剂质量偏大 a. 用量筒量取水时, _____ 视读数;
b. 烧杯或试剂瓶内有水
仰
第 5 讲 溶 液
续表
误差分析 溶质质量 分数偏大 溶质质量偏大 a. 天平砝码生锈(没有脱落)或沾有其他物质;
b. 称量前未调节天平平衡,指针偏 _____
溶剂质量偏小 a. 用量筒量取水时, _____ 视读数;
b. 水倒入烧杯时部分洒出
右
俯
第 5 讲 溶 液
【补充实验】 用 5%的氯化钠溶液配制一定量溶质质量分数为 1%的氯化钠溶液
计算 计算所需浓溶液的体积和所需水的体积
量取 用量筒量取溶质质量分数为 5%的氯化钠溶液,用量筒量取所需蒸馏水
稀释 把量取的溶质质量分数为 5%的氯化钠溶液注入烧杯中,再注入量取的蒸馏水,用玻璃棒搅拌混合均匀
装瓶 将配制好的溶液转移到试剂瓶中,盖好瓶盖并贴上标签
第 5 讲 溶 液
续表
误差 分析 溶质质量分数偏小 用量筒量取浓溶液时 ____ 视读数,量取水时 ____ 视读数
溶质质量分数偏大 用量筒量取浓溶液时 ____ 视读数,量取水时 ____ 视读数
俯
仰
仰
俯
第 5 讲 溶 液
实验考点一遍过
例 题 某同学配制 100 g 6%的氯化钠溶液,操作过程如图甲所示,回答下列问题。
第 5 讲 溶 液
(1)图示中正确的操作顺序为 _____________(填序号)。
(2)所需氯化钠和水的质量分别为氯化钠____ g,水 ______ g。
(3)图中使用到的玻璃仪器有 ______、量筒、玻璃棒、广口瓶四种。
(4)溶解时用玻璃棒搅拌的目的是 ________________________________。
(5)在量取水的操作中,量水时选用的量筒的量程为 ______ mL;当水面接近所需刻度时,应使用 ______________ 添加水。
(6)图中的错误操作是 ______(填序号),该错误导致的结果是溶质质量分数 _______(选填“偏大”“偏小”或“不变”)。
②①⑤③④
6
94
烧杯
加快溶解速率
100
胶头滴管
①
偏小
第 5 讲 溶 液
(7)将配制好的溶液装在 ______(选填“广口瓶”或“细口瓶”)中,并填好标签,在如图标签中填上相应的内容。
(8)量取水仰视读数,则配制的溶液 _______(选填“>”“=”或“<”)6%;装瓶时,有少量溶液洒出,则所配制的溶液的溶质质量分数 _____(选填“偏大”“偏小”或“不变”)。
细口瓶
氯化钠溶液
6%
<
不变
第 5 讲 溶 液
(9)称量完毕后,发现砝码缺损,则所配溶液的溶质质量分数 ______(选填“偏大”“偏小”或“不变”)。
(10)取 10 g 配制好的质量分数为 6%的 NaCl溶液,稀释成质量分数为 1%的 NaCl 溶液,需加水 ______ g。
偏小
50
第 5 讲 溶 液
拓 展
【创新设问】(1)[操作分析]用已调节平衡的天平称取氯化钠固体时,发现指针偏右,接下来的操作是 _______________________________ 。
(2)[数据分析]若如图①中砝码的质量 15 g,游码的读数 3.5 g,则小明称得的氯化钠的质量实际为 _______ g。
(3)[实验仪器选择][2024·成都]将质量分数为 7.08%的硝酸钾溶液稀释为 4.04%,需选择图乙中的烧杯和 __________(填序号)。
继续添加氯化钠直至天平平衡
11.5
③④⑤
第 5 讲 溶 液
(4)[改变试剂]实验室要配制一定溶质质量分数的氢氧化钠溶液。 在配制过程中有同学提议,将称量和量取步骤对调,老师认为该建议合理,理由是 ___________________________________________________。
(5)[与溶解度结合]若用已配好的 100 g 溶质质量分数为 6%的氯化钠溶液配制成 20 ℃时氯化钠的饱和溶液,最简单的操作是 _______________________________(已知 20 ℃时氯化钠的溶解度为 36.0 g)。
往溶液中添加 27.84 g 氯化钠
后称量氢氧化钠可减少其潮解吸水,减少实验误差
第 5 讲 溶 液
解题通法
第 5 讲 溶 液
【迁移应用】实验室要配制 50 g 溶质质量分数为 20%的硝酸钾溶液,现有 25 g 溶质质量分数为 40%的硝酸钾溶液、20 g 溶质质量分数为 15%的硝酸钾溶液及足够多的硝酸钾晶体和蒸馏水,请选用上述的试剂,设计三种配制方案填入下表。
第 5 讲 溶 液
配制方案(只要说明配制时所需的各种试剂及用量即可)
方案一
方案二
方案三
10 g KNO3 晶体和 40 g 蒸馏水
25 g 40%的 KNO3 溶液和 25 g 蒸馏水
20 g 15%的 KNO3 溶液、7 g KNO3 晶体和 23 g 蒸馏水
第 5 讲 溶 液
2. 粗盐中难溶性杂质的去除
实验用品 烧杯、玻璃棒、蒸发皿、坩埚钳、酒精灯、漏斗、药匙、量筒、铁架台(带铁圈)、托盘天平、滤纸、称量纸、火柴、粗盐、蒸馏水
实验装置
溶解
第 5 讲 溶 液
续表
实验步骤 称量:称量粗盐
溶解:加水溶解,用玻璃棒不断搅拌,直到粗盐不再溶解为止
过滤:a. 做好过滤器,装配好仪器;b. 将溶解好的液体用玻璃棒引流到过滤器;c. 若滤液浑浊再过滤
蒸发:a. 装配好仪器;b. 将过滤后的澄清液倒入蒸发皿中,边加热边用玻璃棒搅拌,当蒸发皿中②_____________ 时停止加热,利用余热将其蒸干
出现较多固体
第 5 讲 溶 液
续表
实验步骤 计算产率:a. 用玻璃棒把蒸发皿中的固体转移到纸上称量并计算精盐的产率, 计算公式: 产率= ×100%;b. 将提纯的精盐放到指定容器中
误差分析 产率偏低的原因 a. 称量时,药品与砝码放反并使用了游码;
b. 溶解时未充分搅拌;
c. 蒸发时液体溅出;
d. 转移固体时固体撒落等
第 5 讲 溶 液
续表
误差分析 产率偏高的原因 a. 称量时多称了;
b. 蒸发时未充分蒸干;
c. 过滤时漏斗内液面高于滤纸边缘等
补充说明 (1)四次使用玻璃棒的作用:a. 溶解:③_____________________;b. 过滤:④_______;c. 蒸发:搅拌, ⑤________________________________;d. 计算产率:转移固体; (2)过滤后的液体仍浑浊的原因:a. 操作过程中液面高出滤纸的边缘;b. 滤纸破损;c. 接滤液的烧杯内壁不干净等
搅拌,加速溶解
引流
防止局部温度过高而造成液滴飞溅
第 5 讲 溶 液
实验考点一遍过
例题 某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,如图是同学们做粗盐提纯实验的操作示意图。
(1)粗盐提纯实验的操作顺序 _____________(填操作序号)、称量精盐并计算产率。
(2)图中有一处明显的错误,请指出:_________________________。
①⑤②③⑥④
④中未用玻璃棒搅拌
第 5 讲 溶 液
(3)操作⑥名称为 _____,用到的玻璃仪器是玻璃棒、烧杯、____________。 过滤操作中速度慢的原因可能是 _______________________________。结束后发现溶液仍浑浊,则可能原因是_______________________。
(4)操作④中,当观察到 __________________________即可停止加热。
(5)若得到的实验数据如下,则氯化钠的产率为 ________。
过滤
漏斗
滤纸和漏斗间有气泡(合理即可)
滤纸破损(合理即可)
蒸发皿中出现较多固体
85%
第 5 讲 溶 液
(6)兴趣小组通过计算结果发现实验测得的精盐产率比实际偏高,可能进行的不当操作是__________________________________________________________。
拓 展
【创新设问】(1)[操作分析]操作④中,为了防止液体飞溅,除了用玻璃棒搅拌以外,还可以进行的操作是 ________________________________。
(2)[改进实验]老师建议在溶解和过滤之间增加“溶液静置”的步骤,其目的是 ______________________________________________________________。
(3)[过程分析]去除杂质的关键一步是 _______。
蒸发时,固体没有完全蒸干就进行称量(合理即可)
间歇加热(或左右移动酒精灯)
使不溶物质沉降,避免堵住滤纸的小孔,加快过滤速率
过滤
第 5 讲 溶 液
【创新方案】(4)[化学提纯]为除去上述粗盐水中的 Na2SO4、CaCl2、MgCl2 等杂质,需要依次加入过量的 BaCl2、______________、NaOH 溶液 ,分离出沉淀后,再加入适量盐酸后蒸发。
(5)[与溶解度结合]在老师的指导下,同学们提纯含少量泥沙的粗盐样品 10 g,20 ℃时,氯化钠的溶解度为 36 g,溶解该粗盐样品,需加入水的量约为 _______(选填“15”“30”或“60”)mL,理由是 __________________________________________________________________________________________________________________________________________。
Na2CO3
30
20 ℃时,氯化钠的溶解度为36 g,实验中称取的粗盐质量为10 g,加入约 30 mL 水既可使粗盐中的氯化钠充分溶解,又不会因为加水过多而影响后续蒸发操作的效率
第 5 讲 溶 液
解题通法 粗盐中难溶性杂质的去除的思路与方法
第 5 讲 溶 液
【迁移应用】除去 NaCl 固体中的 CaCO3 应用的是 _________(选填“物理转移”或“化学转化”)的方法。
物理转移
■题型一 溶液知识的相关判断
题型解法
1. 均一、稳定的液体并不一定是溶液,如水、酒精等纯净物;溶液不一定都是无色的,如硫酸铜溶液是蓝色的。
2. 掌握几种常见物质溶于水的吸、放热情况,包括氢氧化钠(放热)、硝酸铵(吸热)、浓硫酸(放热)、氧化钙(放热)等。
3. 饱和溶液、不饱和溶液是针对某一溶质而言,不是针对所有溶质。
第 5 讲 溶 液
例 1 [2024·邯郸二模]溶液用途广泛,与人们的生活息息相关。 下列说法正确的是 ( )
A. 溶液都是无色透明的液体
B. 溶液都是由溶质和溶剂组成的
C. 均一的、稳定的液体都是溶液
D. 饱和溶液一定比不饱和溶液的浓度大
第 5 讲 溶 液
B
衍生 变形式———结合实物图
下列有关如图所示的溶液的说法正确的是 ( )
A. 氯化钠溶于水温度明显上升
B. 下层液体比上层液体咸
C. 该溶液中的溶质为固体,所以溶液中的溶质只能是固体
D. 氯化钠溶液是混合物
第 5 讲 溶 液
D
■题型二 溶解度及溶解度曲线
思路点拨
第 5 讲 溶 液
题型解法
1. 理解溶解度曲线中各点的含义:
曲线上的每一点表示物质在该点所对应温度下的溶解度
曲线下方的点表示对应温度下的不饱和溶液
曲线的交点表示两物质在该点所对应温度下的溶解度相同
2. 饱和溶液与不饱和溶液的判断方法:根据溶解度曲线找出该温度下物质的溶解度→确定给定量的水中可溶解的溶质的质量→判断加入的物质能否全部溶解→判断溶液状态。
第 5 讲 溶 液
例 2 [2024·河北 7 题]如表是 KNO3 和NaNO3 在不同温度时的溶解度,小明用其中一种物质(X)进行了如图所示的实验(水蒸发忽略不计)。 下列分析错误的是 ( )
第 5 讲 溶 液
C
A. X 为 NaNO3
B. ③中溶液为 X 的不饱和溶液
C. ④中溶液的质量为 100 g
D. 溶液中溶质的质量分数:②=③>④
第 5 讲 溶 液
衍生 变形式———将表格+流程图变为表格加溶解度曲线图
NaCl 和 Na2SO4 的溶解度表及溶解度曲线如下。下列说法正确的是( )
A. 甲为 NaCl
B. a1 ℃应介于 40 ℃~50 ℃
C. 甲、乙饱和溶液从 a3 ℃降温到 a2℃溶质的质量分数:甲变大、乙变小
D. 等质量的 NaCl、Na2SO4 饱和溶液从 a1 ℃升温到 a3 ℃,要使两溶液均达饱和,则加入 Na2SO4 的质量大于 NaCl 的质量
第 5 讲 溶 液
D
第 5 讲 溶 液
■题型三 溶质质量分数的综合计算
题型解法
1. 找出已知量,代入化学方程式,根据化学方程式计算出溶质的质量。
2. 找准溶液的质量,根据溶质的质量分数 = ×100%计算溶质的质量分数。
第 5 讲 溶 液
例 3 [2024·廊坊广阳区二模]化学实验室现取 15.6 g 含杂质的碳酸钠样品于烧杯中,缓慢加入稀盐酸(碳酸钠样品中的杂质不溶于水,也不与稀盐酸反应),剩余固体质量与加入稀盐酸的质量关系如图。 请计算:
(1)15.6 g 样品中碳酸钠的质量为 _________ g。
(2)稀盐酸的溶质质量分数。
第 5 讲 溶 液
10.6
第 5 讲 溶 液
(2)解:设 73 g 稀盐酸中溶质的质量为 x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
10.6 g x
=
x= =7.3 g
稀盐酸的溶质质量分数为×100%=10%
答:稀盐酸的溶质质量分数为 10%。
衍生 变形式———实物流程图类计算题
[2020·河北 36 题]某小组用粗锌测定某稀硫酸中溶质的质量分数。 取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后,向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。 请计算:
(1)生成氢气的总质量为 _____ g。
(2)稀硫酸中溶质的质量分数。
第 5 讲 溶 液
0.2
第 5 讲 溶 液
(2)解:设稀硫酸中溶质的质量为 x。
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.2 g
=
x= =9.8 g
稀硫酸中溶质的质量分数为×100%=9.8%
答:稀硫酸中溶质的质量分数为 9.8%。
同课章节目录
