2025年九年级中考化学专题复习 中和反应及探究 无明显现象反应的探究 反应后溶质成分的探究 课件(共33张PPT)
文档属性
| 名称 | 2025年九年级中考化学专题复习 中和反应及探究 无明显现象反应的探究 反应后溶质成分的探究 课件(共33张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 770.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 15:12:18 | ||
图片预览








文档简介
(共33张PPT)
中和反应及探究
培优专题六 中和反应及探究
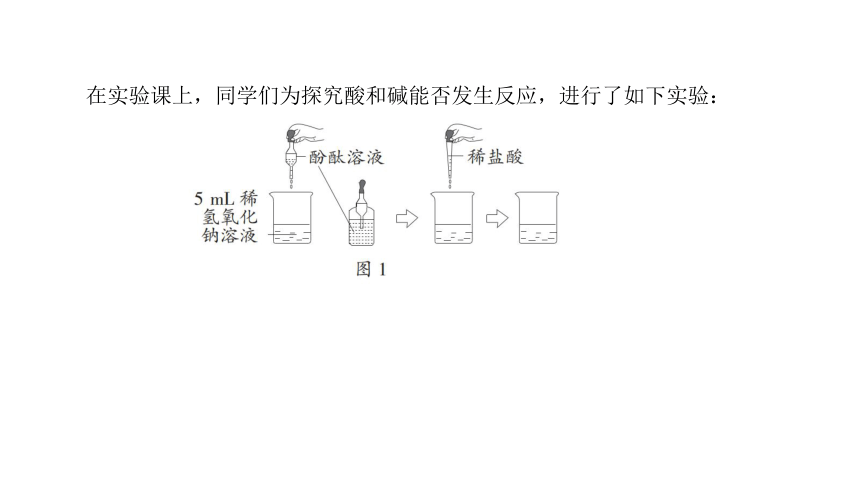
在实验课上,同学们为探究酸和碱能否发生反应,进行了如下实验:
培优专题六 中和反应及探究
培优专题六 中和反应及探究
[实验操作及现象](1)在烧杯中加入约 5 mL稀氢氧化钠溶液,滴入几滴酚酞溶液。 用滴管慢慢滴入稀盐酸,并用玻璃棒 ________________,该操作的目的是 _____________________,至溶液颜色恰好 ________________ 为止。
[实验原理](2)发生反应的化学方程式为 ___________________________。
[实验结论](3)反应后,氢氧化钠消失,说明 ____________________。
[问题与交流](4)实验后,将残余物倒入 _____________,洗涤仪器,整理并擦拭实验台,完善实验报告,离开实验室。
不断搅拌
使反应更充分
变成无色
NaOH+HCl NaCl+H2O
酸和碱能发生中和反应
废液缸
培优专题六 中和反应及探究
(5)甲同学将氢氧化钠溶液滴入含有酚酞的稀盐酸中,该方法 ________(选填“能”或“不能”)验证二者恰好完全反应,当烧杯内溶液变色时,所得溶液呈 ______(选填“酸”“碱”或“中”)性。
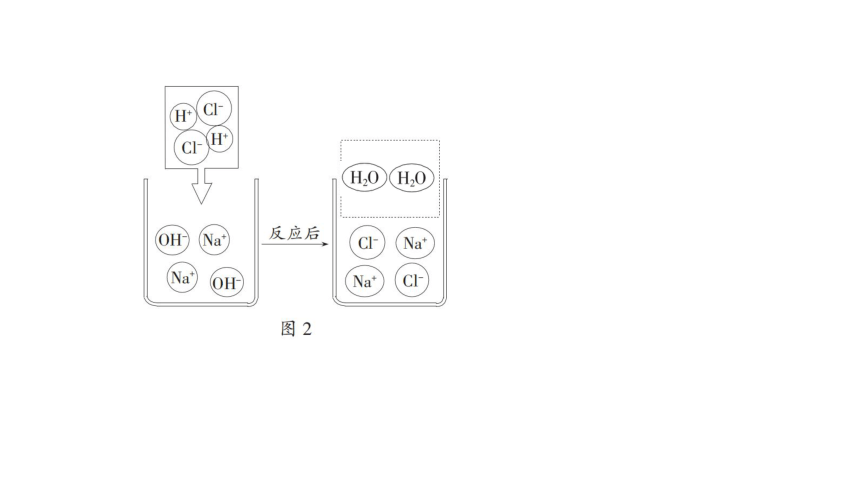
[微观实质](6)如图 2 是氢氧化钠溶液和稀盐酸反应的微观示意图,请将此时溶液中的微粒在题图中补充完整。 反应过程中没有发生改变的粒子是 ____________。 该反应的微观实质是______________________________。
[反应后溶质成分的检验](7)向反应后的烧杯中加入铁片,有 ___________________________的现象,说明反应后的溶质为氯化钠和稀盐酸。
不能
碱
Na+、Cl-
氢离子和氢氧根离子反应生成水
气泡产生,且溶液变为浅绿色
培优专题六 中和反应及探究
[曲线分析](8)用 pH 计测定反应过程中溶液pH 变化探究中和反应(以氢氧化钠与稀盐酸反应为例),如图 3 所示:
培优专题六 中和反应及探究
A 点:pH>7,溶液中的溶质为 ______________。A~B 段:pH 逐渐减小,仍大于 7,溶液中的溶质为 ________________。
B 点:pH=7,酸和碱恰好完全反应,溶液中的溶质为 ___________________。
B~C 段:pH 逐渐减小,pH<7, 溶液中的溶质为____________。
图 4 是将 _________(选填“碱加入酸中”或“酸加入碱中”),判断的依据是 ________________。
氢氧化钠
氢氧化钠、氯化钠
氯化钠
氯化钠、氯化氢
碱加入酸中
开始时溶液的 pH<7
培优专题六 中和反应及探究
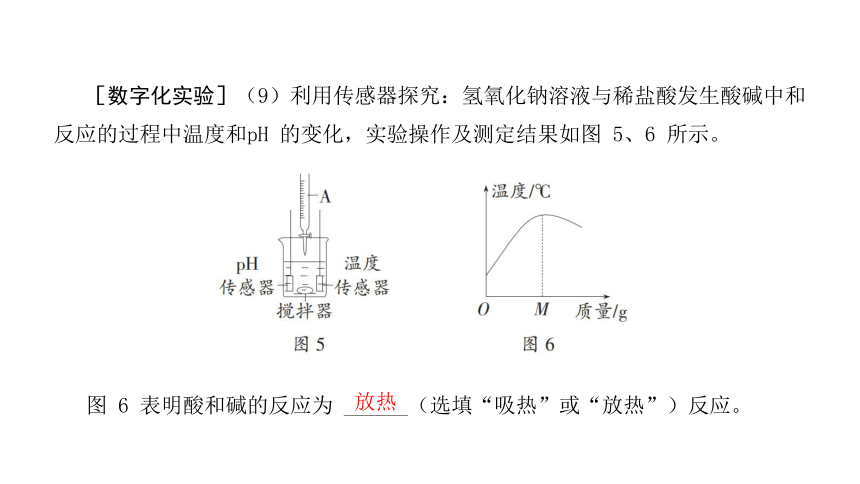
[数字化实验](9)利用传感器探究:氢氧化钠溶液与稀盐酸发生酸碱中和反应的过程中温度和pH 的变化,实验操作及测定结果如图 5、6 所示。
图 6 表明酸和碱的反应为 ______(选填“吸热”或“放热”)反应。
放热
无明显现象反应的探究
培优专题九 无明显现象反应的探究
证明无明显现象反应发生的一般思路:
培优专题九 无明显现象反应的探究
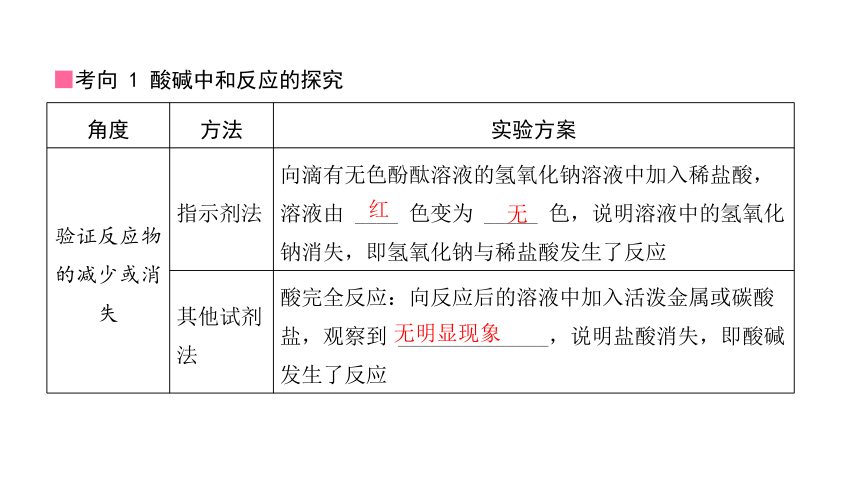
■考向 1 酸碱中和反应的探究
角度 方法 实验方案
验证反应物的减少或消失 指示剂法 向滴有无色酚酞溶液的氢氧化钠溶液中加入稀盐酸,溶液由 ____ 色变为 _____ 色,说明溶液中的氢氧化钠消失,即氢氧化钠与稀盐酸发生了反应
其他试剂 法 酸完全反应:向反应后的溶液中加入活泼金属或碳酸盐,观察到 ______________,说明盐酸消失,即酸碱发生了反应
红
无
无明显现象
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反应物的减少或消失 其他试剂 法 碱完全反应:向反应后的溶液中加入硫酸铜溶液,观察到 ______________,说明氢氧化钠消失,即酸碱发生了反应
无明显现象
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反应物的减少或消失 测 pH 法 如图 1,起点时,测得溶液的pH<7,说明该曲线表示向稀盐酸中加入氢氧化钠溶液。 随着氢氧化钠溶液的加入,溶液的pH____ 或 ____7,证明酸碱发生了反应
等于
大于
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反应物的减少或消失 测 pH 法 如图 2,起点时,测得溶液的 pH>7,说明该曲线表示向氢氧化钠溶液中 加入稀盐酸。 随着稀盐酸的加入, 溶液的pH____或 ____7,证明酸碱发生了反应
等于
小于
培优专题九 无明显现象反应的探究
■考向 2 二氧化碳与氢氧化钠反应的探究
角度 方法 实验方案
验证反应物的减少或消失 压强 差法 【思路】借助反应时二氧化碳减少产生的压强差所导致的明显现象,间接证明二氧化碳与氢氧化钠发生了反应。
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反 应物的 减少或 消失 压强 差法 【现象】图①中试管内液面 ______,图②中塑料瓶 ______,图③中气球 ______,图④中红墨水液面 ____________。
【提示】利用压强差验证时需设置对照实验(将实验中氢氧化钠溶液换为 ____________),排除二氧化碳溶于水、能与水反应对实验的干扰
上升
变瘪
膨胀
左高右低
等体积的水
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证有 新物质 生成 其他试 剂法 加酸:向反应后的溶液中加入稀盐酸或稀硫酸,观察到 ______________,说明生成了碳酸钠,即二氧化碳与氢氧化钠发生了反应
加盐:向反应后的溶液中加入氯化钙或氯化钡溶液,观察到 ______________,说明生成了碳酸钠,即二氧化碳与氢氧化钠发生了反应
有气泡产生
有白色沉淀产生
培优专题九 无明显现象反应的探究
■考向 3 二氧化碳与水反应的探究
角度 方法 实验方案
验证有 新物质 生成 指示 剂法 【思路】借助指示剂,通入二氧化碳,对比有水和无水两种不同状况下产生的不同现象,证明二氧化碳与水反应产生了酸性物质。
【现象】甲试管中石蕊纸花 ________,
乙试管中石蕊纸花 ______,证明二氧
化碳与水反应产生了酸性物质,使石
蕊变色
不变色
变红色
反应后溶质成分的探究
培优专题九 无明显现象反应的探究
证明无明显现象反应发生的一般思路:
培优专题九 无明显现象反应的探究
■考向 1 酸碱中和反应的探究
角度 方法 实验方案
验证反应物的减少或消失 指示剂法 向滴有无色酚酞溶液的氢氧化钠溶液中加入稀盐酸,溶液由 ____ 色变为 _____ 色,说明溶液中的氢氧化钠消失,即氢氧化钠与稀盐酸发生了反应
其他试剂 法 酸完全反应:向反应后的溶液中加入活泼金属或碳酸盐,观察到 ______________,说明盐酸消失,即酸碱发生了反应
红
无
无明显现象
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反应物的减少或消失 其他试剂 法 碱完全反应:向反应后的溶液中加入硫酸铜溶液,观察到 ______________,说明氢氧化钠消失,即酸碱发生了反应
无明显现象
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反应物的减少或消失 测 pH 法 如图 1,起点时,测得溶液的pH<7,说明该曲线表示向稀盐酸中加入氢氧化钠溶液。 随着氢氧化钠溶液的加入,溶液的pH____ 或 ____7,证明酸碱发生了反应
等于
大于
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反应物的减少或消失 测 pH 法 如图 2,起点时,测得溶液的 pH>7,说明该曲线表示向氢氧化钠溶液中 加入稀盐酸。 随着稀盐酸的加入, 溶液的pH____或 ____7,证明酸碱发生了反应
等于
小于
培优专题九 无明显现象反应的探究
■考向 2 二氧化碳与氢氧化钠反应的探究
角度 方法 实验方案
验证反应物的减少或消失 压强 差法 【思路】借助反应时二氧化碳减少产生的压强差所导致的明显现象,间接证明二氧化碳与氢氧化钠发生了反应。
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反 应物的 减少或 消失 压强 差法 【现象】图①中试管内液面 ______,图②中塑料瓶 ______,图③中气球 ______,图④中红墨水液面 ____________。
【提示】利用压强差验证时需设置对照实验(将实验中氢氧化钠溶液换为 ____________),排除二氧化碳溶于水、能与水反应对实验的干扰
上升
变瘪
膨胀
左高右低
等体积的水
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证有 新物质 生成 其他试 剂法 加酸:向反应后的溶液中加入稀盐酸或稀硫酸,观察到 ______________,说明生成了碳酸钠,即二氧化碳与氢氧化钠发生了反应
加盐:向反应后的溶液中加入氯化钙或氯化钡溶液,观察到 ______________,说明生成了碳酸钠,即二氧化碳与氢氧化钠发生了反应
有气泡产生
有白色沉淀产生
培优专题九 无明显现象反应的探究
■考向 3 二氧化碳与水反应的探究
角度 方法 实验方案
验证有 新物质 生成 指示 剂法 【思路】借助指示剂,通入二氧化碳,对比有水和无水两种不同状况下产生的不同现象,证明二氧化碳与水反应产生了酸性物质。
【现象】甲试管中石蕊纸花 ________,
乙试管中石蕊纸花 ______,证明二氧
化碳与水反应产生了酸性物质,使石
蕊变色
不变色
变红色
培优专题十 反应后溶质成分的探究
确定反应后溶液中溶质成分的一般思路:
培优专题十 反应后溶质成分的探究
例题 将一定量的澄清石灰水加入到盛有碳酸钠溶液的烧杯中,产生白色沉淀,滤出沉淀后,兴趣小组对滤液成分产生了兴趣,进行了如下探究。
(1)书写化学方程式。
根据反应原理写出上述实验过程中的化学方程式:________________________________________________。
Ca(OH)2+Na2CO3 CaCO3↓+ 2NaOH
培优专题十 反应后溶质成分的探究
(2)判断反应物和生成物。
【提出问题】滤液中的溶质成分是什么?
【猜想假设】
(3)根据是否恰好反应进行猜想,判断溶质成分
猜想一:恰好完全反应时,溶质的成分为 _________(填物质名称)。
猜想二:当碳酸钠过量时,溶质的成分为 _______________(填物质名称)。
猜想三:当氢氧化钙过量时,溶质的成分为 ___________________(填物质名称)。
(4)确定需要检验的物质。
比较猜想一、二、三,确定需要检验的物质是 _________________。
氢氧化钠
氢氧化钠、碳酸钠
氢氧化钠、氢氧化钙
氢氧化钙、碳酸钠
培优专题十 反应后溶质成分的探究
(5)根据物质特性,设计实验方案检验,对猜想进行验证
实验目的 方法步骤 实验现象 实验结论
方案一 检验氢氧化钙 取少量滤液于试管中,加入适量碳酸钠溶液 产生白色沉淀 猜想 _____ 成立
方案二 检验碳酸钠 取少量滤液于试管中,加入过量稀盐酸 ___________ 猜想二成立
方案三 检验氢氧化钙、碳酸钠 取少量滤液于两支试管中,分别加入碳酸钠溶液和过量稀盐酸 均无明显现象 猜想一成立
三
有气泡产生
培优专题十 反应后溶质成分的探究
【实验活动】A 小组同学采取实验方案二进行实验,取少量滤液于试管中,加入少量稀盐酸,观察无明显现象。 得出结论猜想二不成立。
【交流讨论】(6)B 小组同学认为 A 小组同学得出的结论不准确,原因是 ______________________________________________________________________
_____________________________________________________________。 经过讨论,B 小组同学认为方案二可以用一种碱溶液来替代稀盐酸进行实验也能得到相同的结论,这种碱的化学式为 _______________。
【反思评价】(7)分析反应后溶液中的溶质成分,除要考虑生成物外,还需考虑 _________________。
稀盐酸先和氢氧化钠反应,如果少量的稀盐酸和氢氧化钠反应后没有剩余,即使溶液中含有碳酸钠,碳酸钠也不能反应,无法证明碳酸钠的存在
Ba(OH)2 [或 Ca(OH)2]
反应物是否过量
中和反应及探究
培优专题六 中和反应及探究
在实验课上,同学们为探究酸和碱能否发生反应,进行了如下实验:
培优专题六 中和反应及探究
培优专题六 中和反应及探究
[实验操作及现象](1)在烧杯中加入约 5 mL稀氢氧化钠溶液,滴入几滴酚酞溶液。 用滴管慢慢滴入稀盐酸,并用玻璃棒 ________________,该操作的目的是 _____________________,至溶液颜色恰好 ________________ 为止。
[实验原理](2)发生反应的化学方程式为 ___________________________。
[实验结论](3)反应后,氢氧化钠消失,说明 ____________________。
[问题与交流](4)实验后,将残余物倒入 _____________,洗涤仪器,整理并擦拭实验台,完善实验报告,离开实验室。
不断搅拌
使反应更充分
变成无色
NaOH+HCl NaCl+H2O
酸和碱能发生中和反应
废液缸
培优专题六 中和反应及探究
(5)甲同学将氢氧化钠溶液滴入含有酚酞的稀盐酸中,该方法 ________(选填“能”或“不能”)验证二者恰好完全反应,当烧杯内溶液变色时,所得溶液呈 ______(选填“酸”“碱”或“中”)性。
[微观实质](6)如图 2 是氢氧化钠溶液和稀盐酸反应的微观示意图,请将此时溶液中的微粒在题图中补充完整。 反应过程中没有发生改变的粒子是 ____________。 该反应的微观实质是______________________________。
[反应后溶质成分的检验](7)向反应后的烧杯中加入铁片,有 ___________________________的现象,说明反应后的溶质为氯化钠和稀盐酸。
不能
碱
Na+、Cl-
氢离子和氢氧根离子反应生成水
气泡产生,且溶液变为浅绿色
培优专题六 中和反应及探究
[曲线分析](8)用 pH 计测定反应过程中溶液pH 变化探究中和反应(以氢氧化钠与稀盐酸反应为例),如图 3 所示:
培优专题六 中和反应及探究
A 点:pH>7,溶液中的溶质为 ______________。A~B 段:pH 逐渐减小,仍大于 7,溶液中的溶质为 ________________。
B 点:pH=7,酸和碱恰好完全反应,溶液中的溶质为 ___________________。
B~C 段:pH 逐渐减小,pH<7, 溶液中的溶质为____________。
图 4 是将 _________(选填“碱加入酸中”或“酸加入碱中”),判断的依据是 ________________。
氢氧化钠
氢氧化钠、氯化钠
氯化钠
氯化钠、氯化氢
碱加入酸中
开始时溶液的 pH<7
培优专题六 中和反应及探究
[数字化实验](9)利用传感器探究:氢氧化钠溶液与稀盐酸发生酸碱中和反应的过程中温度和pH 的变化,实验操作及测定结果如图 5、6 所示。
图 6 表明酸和碱的反应为 ______(选填“吸热”或“放热”)反应。
放热
无明显现象反应的探究
培优专题九 无明显现象反应的探究
证明无明显现象反应发生的一般思路:
培优专题九 无明显现象反应的探究
■考向 1 酸碱中和反应的探究
角度 方法 实验方案
验证反应物的减少或消失 指示剂法 向滴有无色酚酞溶液的氢氧化钠溶液中加入稀盐酸,溶液由 ____ 色变为 _____ 色,说明溶液中的氢氧化钠消失,即氢氧化钠与稀盐酸发生了反应
其他试剂 法 酸完全反应:向反应后的溶液中加入活泼金属或碳酸盐,观察到 ______________,说明盐酸消失,即酸碱发生了反应
红
无
无明显现象
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反应物的减少或消失 其他试剂 法 碱完全反应:向反应后的溶液中加入硫酸铜溶液,观察到 ______________,说明氢氧化钠消失,即酸碱发生了反应
无明显现象
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反应物的减少或消失 测 pH 法 如图 1,起点时,测得溶液的pH<7,说明该曲线表示向稀盐酸中加入氢氧化钠溶液。 随着氢氧化钠溶液的加入,溶液的pH____ 或 ____7,证明酸碱发生了反应
等于
大于
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反应物的减少或消失 测 pH 法 如图 2,起点时,测得溶液的 pH>7,说明该曲线表示向氢氧化钠溶液中 加入稀盐酸。 随着稀盐酸的加入, 溶液的pH____或 ____7,证明酸碱发生了反应
等于
小于
培优专题九 无明显现象反应的探究
■考向 2 二氧化碳与氢氧化钠反应的探究
角度 方法 实验方案
验证反应物的减少或消失 压强 差法 【思路】借助反应时二氧化碳减少产生的压强差所导致的明显现象,间接证明二氧化碳与氢氧化钠发生了反应。
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反 应物的 减少或 消失 压强 差法 【现象】图①中试管内液面 ______,图②中塑料瓶 ______,图③中气球 ______,图④中红墨水液面 ____________。
【提示】利用压强差验证时需设置对照实验(将实验中氢氧化钠溶液换为 ____________),排除二氧化碳溶于水、能与水反应对实验的干扰
上升
变瘪
膨胀
左高右低
等体积的水
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证有 新物质 生成 其他试 剂法 加酸:向反应后的溶液中加入稀盐酸或稀硫酸,观察到 ______________,说明生成了碳酸钠,即二氧化碳与氢氧化钠发生了反应
加盐:向反应后的溶液中加入氯化钙或氯化钡溶液,观察到 ______________,说明生成了碳酸钠,即二氧化碳与氢氧化钠发生了反应
有气泡产生
有白色沉淀产生
培优专题九 无明显现象反应的探究
■考向 3 二氧化碳与水反应的探究
角度 方法 实验方案
验证有 新物质 生成 指示 剂法 【思路】借助指示剂,通入二氧化碳,对比有水和无水两种不同状况下产生的不同现象,证明二氧化碳与水反应产生了酸性物质。
【现象】甲试管中石蕊纸花 ________,
乙试管中石蕊纸花 ______,证明二氧
化碳与水反应产生了酸性物质,使石
蕊变色
不变色
变红色
反应后溶质成分的探究
培优专题九 无明显现象反应的探究
证明无明显现象反应发生的一般思路:
培优专题九 无明显现象反应的探究
■考向 1 酸碱中和反应的探究
角度 方法 实验方案
验证反应物的减少或消失 指示剂法 向滴有无色酚酞溶液的氢氧化钠溶液中加入稀盐酸,溶液由 ____ 色变为 _____ 色,说明溶液中的氢氧化钠消失,即氢氧化钠与稀盐酸发生了反应
其他试剂 法 酸完全反应:向反应后的溶液中加入活泼金属或碳酸盐,观察到 ______________,说明盐酸消失,即酸碱发生了反应
红
无
无明显现象
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反应物的减少或消失 其他试剂 法 碱完全反应:向反应后的溶液中加入硫酸铜溶液,观察到 ______________,说明氢氧化钠消失,即酸碱发生了反应
无明显现象
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反应物的减少或消失 测 pH 法 如图 1,起点时,测得溶液的pH<7,说明该曲线表示向稀盐酸中加入氢氧化钠溶液。 随着氢氧化钠溶液的加入,溶液的pH____ 或 ____7,证明酸碱发生了反应
等于
大于
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反应物的减少或消失 测 pH 法 如图 2,起点时,测得溶液的 pH>7,说明该曲线表示向氢氧化钠溶液中 加入稀盐酸。 随着稀盐酸的加入, 溶液的pH____或 ____7,证明酸碱发生了反应
等于
小于
培优专题九 无明显现象反应的探究
■考向 2 二氧化碳与氢氧化钠反应的探究
角度 方法 实验方案
验证反应物的减少或消失 压强 差法 【思路】借助反应时二氧化碳减少产生的压强差所导致的明显现象,间接证明二氧化碳与氢氧化钠发生了反应。
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证反 应物的 减少或 消失 压强 差法 【现象】图①中试管内液面 ______,图②中塑料瓶 ______,图③中气球 ______,图④中红墨水液面 ____________。
【提示】利用压强差验证时需设置对照实验(将实验中氢氧化钠溶液换为 ____________),排除二氧化碳溶于水、能与水反应对实验的干扰
上升
变瘪
膨胀
左高右低
等体积的水
培优专题九 无明显现象反应的探究
续表
角度 方法 实验方案
验证有 新物质 生成 其他试 剂法 加酸:向反应后的溶液中加入稀盐酸或稀硫酸,观察到 ______________,说明生成了碳酸钠,即二氧化碳与氢氧化钠发生了反应
加盐:向反应后的溶液中加入氯化钙或氯化钡溶液,观察到 ______________,说明生成了碳酸钠,即二氧化碳与氢氧化钠发生了反应
有气泡产生
有白色沉淀产生
培优专题九 无明显现象反应的探究
■考向 3 二氧化碳与水反应的探究
角度 方法 实验方案
验证有 新物质 生成 指示 剂法 【思路】借助指示剂,通入二氧化碳,对比有水和无水两种不同状况下产生的不同现象,证明二氧化碳与水反应产生了酸性物质。
【现象】甲试管中石蕊纸花 ________,
乙试管中石蕊纸花 ______,证明二氧
化碳与水反应产生了酸性物质,使石
蕊变色
不变色
变红色
培优专题十 反应后溶质成分的探究
确定反应后溶液中溶质成分的一般思路:
培优专题十 反应后溶质成分的探究
例题 将一定量的澄清石灰水加入到盛有碳酸钠溶液的烧杯中,产生白色沉淀,滤出沉淀后,兴趣小组对滤液成分产生了兴趣,进行了如下探究。
(1)书写化学方程式。
根据反应原理写出上述实验过程中的化学方程式:________________________________________________。
Ca(OH)2+Na2CO3 CaCO3↓+ 2NaOH
培优专题十 反应后溶质成分的探究
(2)判断反应物和生成物。
【提出问题】滤液中的溶质成分是什么?
【猜想假设】
(3)根据是否恰好反应进行猜想,判断溶质成分
猜想一:恰好完全反应时,溶质的成分为 _________(填物质名称)。
猜想二:当碳酸钠过量时,溶质的成分为 _______________(填物质名称)。
猜想三:当氢氧化钙过量时,溶质的成分为 ___________________(填物质名称)。
(4)确定需要检验的物质。
比较猜想一、二、三,确定需要检验的物质是 _________________。
氢氧化钠
氢氧化钠、碳酸钠
氢氧化钠、氢氧化钙
氢氧化钙、碳酸钠
培优专题十 反应后溶质成分的探究
(5)根据物质特性,设计实验方案检验,对猜想进行验证
实验目的 方法步骤 实验现象 实验结论
方案一 检验氢氧化钙 取少量滤液于试管中,加入适量碳酸钠溶液 产生白色沉淀 猜想 _____ 成立
方案二 检验碳酸钠 取少量滤液于试管中,加入过量稀盐酸 ___________ 猜想二成立
方案三 检验氢氧化钙、碳酸钠 取少量滤液于两支试管中,分别加入碳酸钠溶液和过量稀盐酸 均无明显现象 猜想一成立
三
有气泡产生
培优专题十 反应后溶质成分的探究
【实验活动】A 小组同学采取实验方案二进行实验,取少量滤液于试管中,加入少量稀盐酸,观察无明显现象。 得出结论猜想二不成立。
【交流讨论】(6)B 小组同学认为 A 小组同学得出的结论不准确,原因是 ______________________________________________________________________
_____________________________________________________________。 经过讨论,B 小组同学认为方案二可以用一种碱溶液来替代稀盐酸进行实验也能得到相同的结论,这种碱的化学式为 _______________。
【反思评价】(7)分析反应后溶液中的溶质成分,除要考虑生成物外,还需考虑 _________________。
稀盐酸先和氢氧化钠反应,如果少量的稀盐酸和氢氧化钠反应后没有剩余,即使溶液中含有碳酸钠,碳酸钠也不能反应,无法证明碳酸钠的存在
Ba(OH)2 [或 Ca(OH)2]
反应物是否过量
同课章节目录
