4-1-1原子结构元素周期表 课件 (共26张PPT) 高中化学 人教版(2019) 必修 第一册
文档属性
| 名称 | 4-1-1原子结构元素周期表 课件 (共26张PPT) 高中化学 人教版(2019) 必修 第一册 |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 00:00:00 | ||
图片预览






文档简介
(共26张PPT)
第一课时 原子结构 元素周期表
第一节 原子结构与元素周期表
泛在
第四章 物质结构 元素周期律
原子结构
1.原子的构成
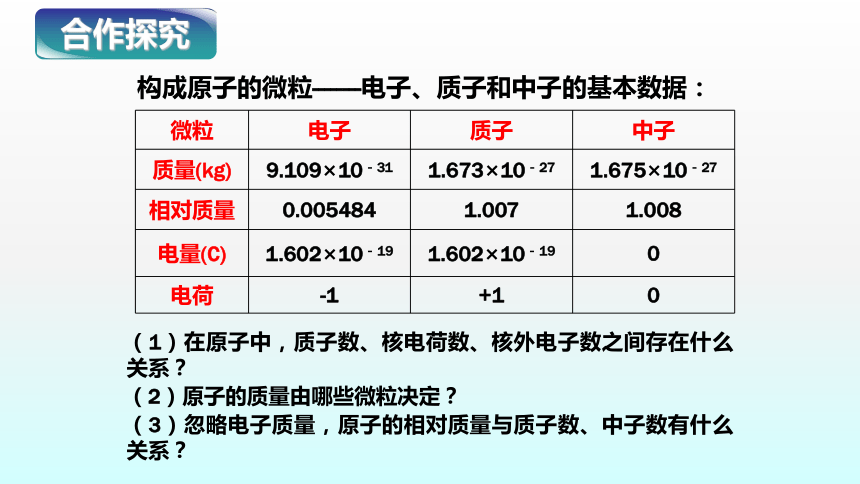
微粒 电子 质子 中子
质量(kg) 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.005484 1.007 1.008
电量(C) 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
构成原子的微粒--------电子、质子和中子的基本数据:
合作探究
(1)在原子中,质子数、核电荷数、核外电子数之间存在什么关系?
(2)原子的质量由哪些微粒决定?
(3)忽略电子质量,原子的相对质量与质子数、中子数有什么关系?
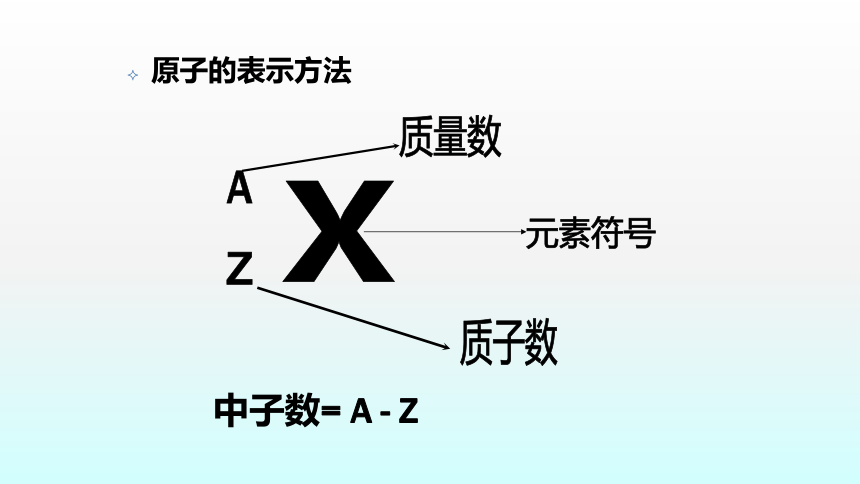
关系:
1)核电荷数=质子数=核外电子数
2)原子质量主要集中在原子核上,由质子和中
子的质量决定
3)原子的相对质量在数值上≈质子数+中子数
质子数(Z) + 中子数(N) =质量数(A)
(Z)
(N)
中子数= A - Z
原子的表示方法
练习
1、据最新报道,某放射性元素的原子16667Ho可有效治疗肝癌,该核素原子核内中子数与核外电子数之差为( )
A.32 B.67 C.99 D.166
A
练习
2、某阳离子Rn+的核外共有x个电子,核内有y个中子,则R的质量数为( )
A.y-x+n B.y-x-n C.y+x+n D.y+x-n
C
自主学习
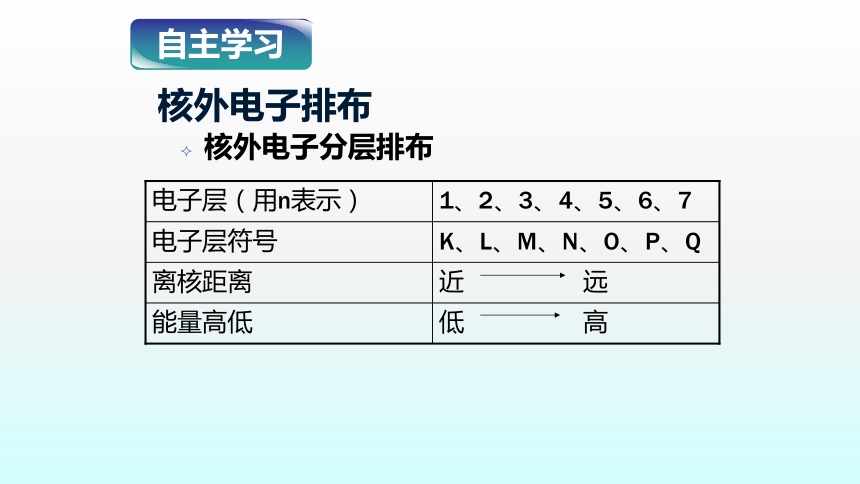
核外电子排布
核外电子分层排布
低 高
能量高低
近 远
离核距离
K、L、M、N、O、P、Q
电子层符号
1、2、3、4、5、6、7
电子层(用n表示)
(2)各电子层最多容纳2n2个电子;
(3)最外层电子数不超过8个电子(K层是最外层时,最多不超过2个);
(1)核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层(能量最低原理)。
核外电子的排布规律
原子结构示意图
Na
+11 2 8 1
元素符号
原子核
核内质子
电子层
层内电子数
N
He
Li
Be
B
C
H
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
1-18号元素的排布
二、元素周期表
由1—18号元素的原子结构分析
1.每一横行有什么相同点?
2.每一纵行有什么相同点?
横行:电子层数相同
纵行:最外层电子数相同(He除外)
原子序数=核电荷数=质子数=核外电子数
(1) 横行原则:把 相同的元素,按 的顺序从左到右排列。
(2) 纵行原则:把不同横行中 相同的元素,按 的顺序由上而下排列。
(3) 原子序数:按照元素 给元素编的序号。
(4) 原子序数与元素的原子结构之间的关系:
原子序数= = = 。
电子层数目
在周期表中的顺序
最外层电子数
核电荷数
原子序数递增
质子数
电子层数递增
核外电子数
元素周期表的编排原则
元素周期表的结构
周期序数 = 电子层数
(1)横行——
周期(7个)
周期
长周期
第1周期:
第2周期:
第3周期:
第4周期:
第5周期:
第6周期:
不完全周期
短周期
2种元素
8种元素
8种元素
18种元素
18种元素
32种元素
每周期可容纳的元素种类
周期 1 2 3 4 5 6
元素种数 2 8 8 18 18 32
7
32
③锕89Ac – 铹103Lr 共15 种元素称锕系元素,
位于第7周期.
②镧57La – 镥71Lu 共15 种元素称镧系元素,
位于第6周期.
注意:
①除第1、7周期外,每个周期都是从碱金属元 素开始,逐渐过渡到卤素,最后以稀有气体元素结束.
④超铀元素:
92号元素铀以后的元素
族
主族 (A)
副族 (B)
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
第VIII 族:
稀有气体元素
零族:
共七个主族
ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB , ⅠB , ⅡB
共七个副族
第八、九、十纵行,位于Ⅶ B 与ⅠB中间
(2)纵行( 个)—
族(16个)
18
主族族序数=最外层电子数
第VIII 族
三种不同的氢原子
观察思考
原子 质子数 中子数 质量数
氕
氘
氚
1
1
1
2
1
0
1
2
3
1)氕、氘、氚的原子结构有什么异同?它们是同一种元素吗?它们是同一种原子吗?
2)原子核都是由质子和中子组成的吗?
元素:
具有相同质子数(核电荷数)的同一类原子的总称。
核素:
具有一定数目质子和一定数目中子的一种原子。
三.核素
自主学习
同位素:
质子数相同而中子数不同的同一元素的不同核素互为同位素。
8 O
16
8O
17
8O
18
1
H
H
H
1
1
1
2
3
总结
元素、核素、同位素及同素异形体的区别与联系
元素 核素 同位素 同素异形体
概念
决定因素
举例
质子数(核电荷数)相同的一类原子
质子数、中子数都一定的一类原子
质子数相同、中子数不同的核素的互称
同种元素形成的不同的单质
质子数
质子数
中子数
质子数
中子数
组成元素
结构
C 、 H 、O三种元素
1
H
H
H
1
1
1
2
3
三种核素
互为同位素
8 O
16
8O
17
8O
18
O2与O3
经典题
1、已知R2+离子核外有a个电子,b个中子,表示R原子符号正确的是 ( )
2、某元素的原子最外层电子数为次外层电子数的3倍,则该元素
原子核内质子数为( )
A、3 B、7 C、8 D、10
R B.
R C.
R D.
R
A.
C
C
经典题
3、用符号填空:a质子数;b中子数;c核外电子数;d最外层电子数.
1)、原子种类由 决定。
2)、元素种类由 决定。
3)、核电荷数由 决定。
4)、相对原子质量 决定。
5)、元素的化合价主要由 决定。
6)、元素的化学性质主要由 决定。
a
ab
a
ab
d
d
第一课时 原子结构 元素周期表
第一节 原子结构与元素周期表
泛在
第四章 物质结构 元素周期律
原子结构
1.原子的构成
微粒 电子 质子 中子
质量(kg) 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.005484 1.007 1.008
电量(C) 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
构成原子的微粒--------电子、质子和中子的基本数据:
合作探究
(1)在原子中,质子数、核电荷数、核外电子数之间存在什么关系?
(2)原子的质量由哪些微粒决定?
(3)忽略电子质量,原子的相对质量与质子数、中子数有什么关系?
关系:
1)核电荷数=质子数=核外电子数
2)原子质量主要集中在原子核上,由质子和中
子的质量决定
3)原子的相对质量在数值上≈质子数+中子数
质子数(Z) + 中子数(N) =质量数(A)
(Z)
(N)
中子数= A - Z
原子的表示方法
练习
1、据最新报道,某放射性元素的原子16667Ho可有效治疗肝癌,该核素原子核内中子数与核外电子数之差为( )
A.32 B.67 C.99 D.166
A
练习
2、某阳离子Rn+的核外共有x个电子,核内有y个中子,则R的质量数为( )
A.y-x+n B.y-x-n C.y+x+n D.y+x-n
C
自主学习
核外电子排布
核外电子分层排布
低 高
能量高低
近 远
离核距离
K、L、M、N、O、P、Q
电子层符号
1、2、3、4、5、6、7
电子层(用n表示)
(2)各电子层最多容纳2n2个电子;
(3)最外层电子数不超过8个电子(K层是最外层时,最多不超过2个);
(1)核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层(能量最低原理)。
核外电子的排布规律
原子结构示意图
Na
+11 2 8 1
元素符号
原子核
核内质子
电子层
层内电子数
N
He
Li
Be
B
C
H
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
1-18号元素的排布
二、元素周期表
由1—18号元素的原子结构分析
1.每一横行有什么相同点?
2.每一纵行有什么相同点?
横行:电子层数相同
纵行:最外层电子数相同(He除外)
原子序数=核电荷数=质子数=核外电子数
(1) 横行原则:把 相同的元素,按 的顺序从左到右排列。
(2) 纵行原则:把不同横行中 相同的元素,按 的顺序由上而下排列。
(3) 原子序数:按照元素 给元素编的序号。
(4) 原子序数与元素的原子结构之间的关系:
原子序数= = = 。
电子层数目
在周期表中的顺序
最外层电子数
核电荷数
原子序数递增
质子数
电子层数递增
核外电子数
元素周期表的编排原则
元素周期表的结构
周期序数 = 电子层数
(1)横行——
周期(7个)
周期
长周期
第1周期:
第2周期:
第3周期:
第4周期:
第5周期:
第6周期:
不完全周期
短周期
2种元素
8种元素
8种元素
18种元素
18种元素
32种元素
每周期可容纳的元素种类
周期 1 2 3 4 5 6
元素种数 2 8 8 18 18 32
7
32
③锕89Ac – 铹103Lr 共15 种元素称锕系元素,
位于第7周期.
②镧57La – 镥71Lu 共15 种元素称镧系元素,
位于第6周期.
注意:
①除第1、7周期外,每个周期都是从碱金属元 素开始,逐渐过渡到卤素,最后以稀有气体元素结束.
④超铀元素:
92号元素铀以后的元素
族
主族 (A)
副族 (B)
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
第VIII 族:
稀有气体元素
零族:
共七个主族
ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB , ⅠB , ⅡB
共七个副族
第八、九、十纵行,位于Ⅶ B 与ⅠB中间
(2)纵行( 个)—
族(16个)
18
主族族序数=最外层电子数
第VIII 族
三种不同的氢原子
观察思考
原子 质子数 中子数 质量数
氕
氘
氚
1
1
1
2
1
0
1
2
3
1)氕、氘、氚的原子结构有什么异同?它们是同一种元素吗?它们是同一种原子吗?
2)原子核都是由质子和中子组成的吗?
元素:
具有相同质子数(核电荷数)的同一类原子的总称。
核素:
具有一定数目质子和一定数目中子的一种原子。
三.核素
自主学习
同位素:
质子数相同而中子数不同的同一元素的不同核素互为同位素。
8 O
16
8O
17
8O
18
1
H
H
H
1
1
1
2
3
总结
元素、核素、同位素及同素异形体的区别与联系
元素 核素 同位素 同素异形体
概念
决定因素
举例
质子数(核电荷数)相同的一类原子
质子数、中子数都一定的一类原子
质子数相同、中子数不同的核素的互称
同种元素形成的不同的单质
质子数
质子数
中子数
质子数
中子数
组成元素
结构
C 、 H 、O三种元素
1
H
H
H
1
1
1
2
3
三种核素
互为同位素
8 O
16
8O
17
8O
18
O2与O3
经典题
1、已知R2+离子核外有a个电子,b个中子,表示R原子符号正确的是 ( )
2、某元素的原子最外层电子数为次外层电子数的3倍,则该元素
原子核内质子数为( )
A、3 B、7 C、8 D、10
R B.
R C.
R D.
R
A.
C
C
经典题
3、用符号填空:a质子数;b中子数;c核外电子数;d最外层电子数.
1)、原子种类由 决定。
2)、元素种类由 决定。
3)、核电荷数由 决定。
4)、相对原子质量 决定。
5)、元素的化合价主要由 决定。
6)、元素的化学性质主要由 决定。
a
ab
a
ab
d
d
