3.1.2电离平衡常数 课件 (共25张PPT) 高中化学 人教版(2019) 选择性必修1
文档属性
| 名称 | 3.1.2电离平衡常数 课件 (共25张PPT) 高中化学 人教版(2019) 选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 22:16:12 | ||
图片预览







文档简介
(共25张PPT)
第1节 电离平衡
第3章 水溶液中的离子反应与平衡
第2课时 电离平衡常数
电解质
强电解质:在水溶液中完全电离,如强酸、强碱、大多数盐
弱电解质:在水溶液中完全电离,如弱酸、弱碱、水
HCl H+ + Cl-
CH3COOH H+ + CH3COO-
二、电离平衡常数(K)—— 定量表征弱电解质电离能力
电离常数是化学平衡常数的一种,服从化学平衡常数的一般规律。
1. 定义
在一定条件下达到电离平衡时,弱电解质电离形成的各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数。
写出醋酸的电离方程式,并写出平衡常数表达式。
K=
c(CH3COO )·c(H+)
c(CH3COOH)
这个常数叫做电离平衡常数,简称电离常数。
Ka= ————————
c平(H+) c平(CH3COO-)
c平(CH3COOH)
Kb= ———————
c平(NH4+) c平(OH-)
c平(NH3·H2O)
CH3COOH H+ + CH3COO-
⑴ 一元弱酸的电离常数(Ka):
⑵ 一元弱碱的电离常数(Kb):
NH3·H2O NH4+ + OH-
2. 表达方式
多元酸的电离是分步进行的,每一步电离都有自己的电离常数,通常用 Ka1、Ka2……来表示。例如:
多元弱酸的各级电离常数逐级减小且一般相差很大,所以其水溶液中的H+主要由第一步电离产生
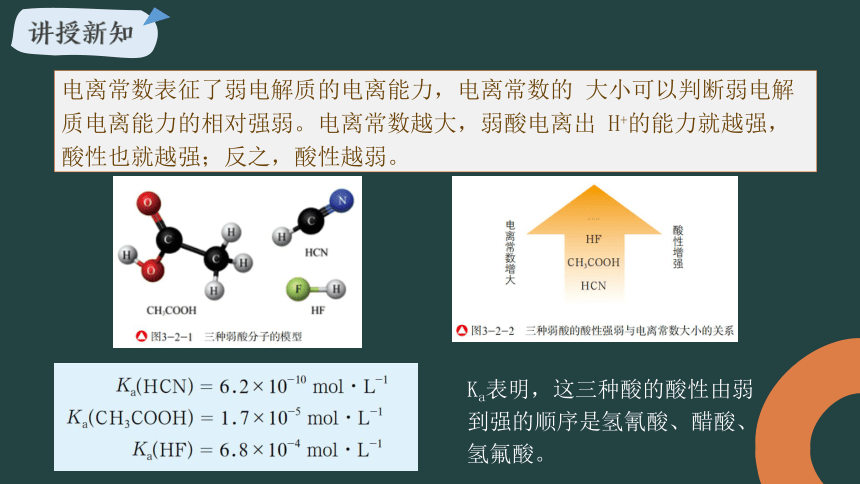
Ka表明,这三种酸的酸性由弱到强的顺序是氢氰酸、醋酸、氢氟酸。
电离常数表征了弱电解质的电离能力,电离常数的 大小可以判断弱电解质电离能力的相对强弱。电离常数越大,弱酸电离出 H+的能力就越强,酸性也就越强;反之,酸性越弱。
1. 判断25℃时HCl、HCN、CH3COOH、HF、H2CO3五种酸的酸性强弱顺序。
2. 由上表数据,判断温度与CH3COOH的Ka之间的关系,并解释其原因。
酸性:HCl >HF > CH3COOH > H2CO3 >HClO > HCN
温度升高, Ka值增大;因为CH3COOH的电离是一个吸热过程,温度升高,电离平衡正向移动。
思考:
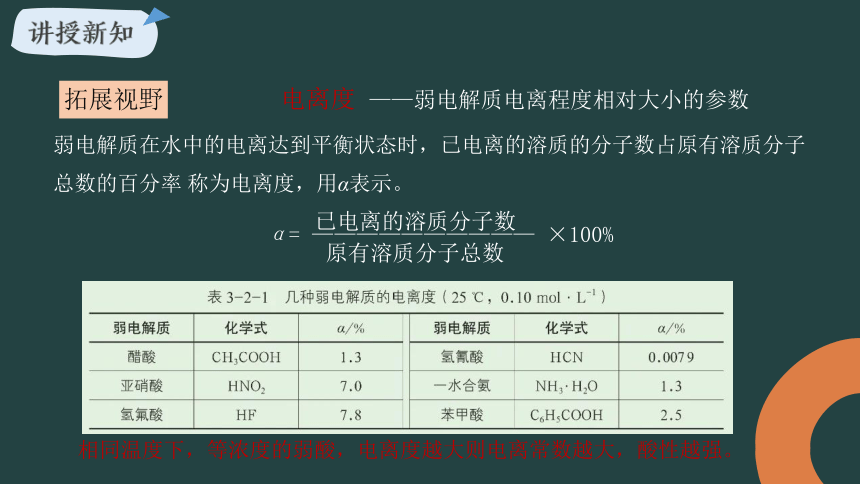
电离度
弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数的百分率 称为电离度,用α表示。
相同温度下,等浓度的弱酸,电离度越大则电离常数越大,酸性越强。
拓展视野
α= —————————— ×100%
已电离的溶质分子数
原有溶质分子总数
——弱电解质电离程度相对大小的参数
醋酸的电离常数表达式
一水合氨的电离常数表达式
Kb=
c(NH4+)·c(OH )
c(NH3·H2O)
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
CH3COOH H+ + CH3COO
NH3·H2O NH4+ + OH
=
(1.7×10 3)·(1.7×10 3)
0.2
≈
1.4×10 5
该温度下电离程度小
c(NH3·H2O)
Kb=
c(NH4+ )·c(OH )
某温度下,0.20 mol·L-1的氨水中,已电离的NH3·H2O的浓度为1.7×10-3mol·L-1,则该温度下NH3·H2O的Kb=_____
电离平衡常数
进一步计算该温度下,有多少比例的NH3·H2O发生了电离:
已电离弱电解质分子数
原弱电解质分子数
×100%
=
1.7×10 3×V(溶液)
0.2×V(溶液)
×100%
=
0.85%
该温度下电离程度小
CH3COOH > HCN
酸性:
电离常数由物质本身性质决定
Ka(CH3COOH) > Ka(HCN)
25 ℃时,相同浓度的CH3COOH溶液与HCN溶液相比较,CH3COOH溶液酸性相对更强
你能比较该温度下CH3COOH、HCN电离常数的大小吗?
Ka值越大,电离程度越大,达到电离平衡时电离出的H+越多,酸性越强。反之,酸性越弱。
K 服从化学平衡常数的一般规律,只受温度影响。
Ka (HCN)=6.2×10-10mol/L
Ka(CH3COOH)=1.7×10-5mol/L
Ka (HF)=6.8×10-4mol/L
由此可得:酸性强弱顺序:HF > CH3COOH > HCN
H3PO4
H+ + H2PO4- Ka1=7.1×10-3mol/L
H2PO4-
H+ + HPO42- Ka2=6.2×10-8mol/L
HPO42-
H+ + PO43- Ka3=4.5×10-13mol/L
多元弱酸,分步电离,每一步电离都有各自的电离常数,通常用Ka1 Ka2 Ka3 来表示。
CH3COOH的电离常数(25 ℃)
=1.75×10 5
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
=6.2×10 10
Ka=
c(CN )·c(H+)
c(HCN)
CH3COOH > HCN
酸性:
1.相同温度下,直接比较弱电解质的相对强弱
电离常数的应用
HCN的电离常数(25 ℃)
CH3COOH CH3COO + H+
Q =
c(H+)
2
·
c(CH3COO )
2
c(CH3COOH)
2
=
Ka
2
< Ka
加水稀释,电离平衡向电离的方向移动
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
2.判断电离平衡移动的方向
将0.1 mol/L 醋酸加水稀释,使其浓度变为原来的一半,电离平衡移动的方向?
越稀越电离,平衡正向移动
3.计算粒子的浓度
取1 mL 2 mol/L 醋酸,加水稀释到10 mL,稀释后的溶液,酸的浓度和氢离子浓度分别为多少?
=
x·x
0.2
≈
1.75×10 5
变化浓度/(mol·L 1)
x
x
x
平衡浓度/(mol·L 1)
x
0.2 x
x
c(CH3COOH)=(0.2 x) mol·L 1 ≈ 0.2 mol·L 1
c(H+)= x = 0.001 87 mol/L
Ka=1.75×10 5(25 ℃)
0
起始浓度/(mol·L 1)
0.2
0
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
4.计算电离度
已知弱电解质在水中达到电离平衡状态时,已电离的电解质分子数占原有电解质分子总数的百分率,称为电离度。
X
X
X
起始
C
0
0
平衡
C-X
X
X
思考: 通过那些事实(或实验)可以证明CH3COOH是弱电解质?
方法一:取同浓度的HCl和CH3COOH,进行溶液导电性实验
方法七:测定CH3COONa的水溶液的pH pH>7
方法三:测定0.1mol/L CH3COOH 的pH值 pH >1
方法二:取同浓度的HCl 和 CH3COOH 和相同大小颗粒的锌粒比较反应速率。 CH3COOH的反应速率较慢。
方法五:相同pH值相同体积的HCl和CH3COOH,和足量的锌粒反应。
CH3COOH在反应过程中速率较快且最终产生的氢气多。
方法四:取相同pH的HCl和CH3COOH,稀释100倍。pH值变化小的是CH3COOH
方法六:测定等pH等体积的HCl 和 CH3COOH溶液中和碱的量。
CH3COOH耗碱量大。
A、HF B、K2SO4
下列物质溶于水后,溶质存在电离平衡的有( )
C、HNO3 D、Ca(OH)2
AE
E、NH3·H2O F、BaSO4
下列关于强、弱电解质的叙述正确的是( )
A、强电解质都是离子化合物,弱电解质都是共价化合物
B、强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C、强电解质溶液的导电能力强,弱电解质溶液的导电能力弱
D、强电解质溶液中无溶质分子,弱电解质溶液中分子和其电离产生的离子同时存在
D
欧盟委员会发布条例,修订芥酸和氢氰酸在部分食品中的最大含量。氢氰酸及部分弱酸的电离常数如表:
弱酸 HCOOH HCN H2CO3
电离常数(25 ℃) Ka=1.8×10-4 Ka=6.2×10-10 Ka1=4.5×10-7
Ka2=4.7×10-11
(1)依据表格中三种酸的电离常数,判断三种酸酸性强弱的顺序为________________。
HCOOH>H2CO3>HCN
(2)向NaCN溶液中通入CO2气体能否制得HCN?若能,写出反应的化学方程式:______________________________________________
_________________________________________________________。
能,NaCN+H2O+CO2===HCN+NaHCO3
1.下列关于电解质的电离平衡状态的叙述中,正确的是( )
A.弱电解质的电离达到平衡状态后,电离就停止了
B.弱电解质的电离达到平衡状态后,分子的消耗速率和离子的生成速率相等
C.弱电解质的电离达到平衡状态后,分子和离子的浓度相等
D.弱电解质的电离达到平衡状态后,外界条件改变,电离平衡可能要发生移动
D
3.下表是常温下某些一元弱酸的电离常数:
弱酸 HCN HF CH3COOH HNO2
电离常数 6.2×10-10 6.8×10-4 1.7×10-5 6.4×10-6
则0.1 mol·L-1的下列溶液中,pH最小的是( ) A.HCN B.HF C.CH3COOH D.HNO2
C
2.下列电解质在溶液中存在分子的是( )
A.Ba(OH)2 B. CH3COOH C.Ca(OH)2 D. NH3 6H2O
B
4.已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数(25 ℃),若已知下列反应可以发生:NaCN+HNO2 HCN+NaNO2、NaCN+HF HCN+NaF、NaNO2+HF HNO2+NaF。由此可判断下列叙述中不正确的是( )
A.K(HF)=7.2×10-4
B.K(HNO2)=4.9×10-10
C.根据两个反应即可得出一元弱酸的强弱顺序为HF>HNO2>HCN
D.K(HCN)<K(HNO2)<K(HF)
B
表示形式
影响因素
仅受温度影响
意义
定量表示
弱电解质电离能力的强弱
电离平衡常数
定义
各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比
Ka =
c(H+)·c(CH3COO-)
c(CH3COOH)
弱电解质的电离
(以 CH3COOH 的电离为例)
电离平衡移动
定量表达
CH3COOH H++CH3COO-
温度
浓度
宏观角度
物质组成
相互反应
作用结果(宏观现象)
微观角度
微粒种类微粒数量
微粒间的相互作用
微粒种类数量变化化学平衡移动
第1节 电离平衡
第3章 水溶液中的离子反应与平衡
第2课时 电离平衡常数
电解质
强电解质:在水溶液中完全电离,如强酸、强碱、大多数盐
弱电解质:在水溶液中完全电离,如弱酸、弱碱、水
HCl H+ + Cl-
CH3COOH H+ + CH3COO-
二、电离平衡常数(K)—— 定量表征弱电解质电离能力
电离常数是化学平衡常数的一种,服从化学平衡常数的一般规律。
1. 定义
在一定条件下达到电离平衡时,弱电解质电离形成的各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比是一个常数,这个常数称为电离平衡常数。
写出醋酸的电离方程式,并写出平衡常数表达式。
K=
c(CH3COO )·c(H+)
c(CH3COOH)
这个常数叫做电离平衡常数,简称电离常数。
Ka= ————————
c平(H+) c平(CH3COO-)
c平(CH3COOH)
Kb= ———————
c平(NH4+) c平(OH-)
c平(NH3·H2O)
CH3COOH H+ + CH3COO-
⑴ 一元弱酸的电离常数(Ka):
⑵ 一元弱碱的电离常数(Kb):
NH3·H2O NH4+ + OH-
2. 表达方式
多元酸的电离是分步进行的,每一步电离都有自己的电离常数,通常用 Ka1、Ka2……来表示。例如:
多元弱酸的各级电离常数逐级减小且一般相差很大,所以其水溶液中的H+主要由第一步电离产生
Ka表明,这三种酸的酸性由弱到强的顺序是氢氰酸、醋酸、氢氟酸。
电离常数表征了弱电解质的电离能力,电离常数的 大小可以判断弱电解质电离能力的相对强弱。电离常数越大,弱酸电离出 H+的能力就越强,酸性也就越强;反之,酸性越弱。
1. 判断25℃时HCl、HCN、CH3COOH、HF、H2CO3五种酸的酸性强弱顺序。
2. 由上表数据,判断温度与CH3COOH的Ka之间的关系,并解释其原因。
酸性:HCl >HF > CH3COOH > H2CO3 >HClO > HCN
温度升高, Ka值增大;因为CH3COOH的电离是一个吸热过程,温度升高,电离平衡正向移动。
思考:
电离度
弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数的百分率 称为电离度,用α表示。
相同温度下,等浓度的弱酸,电离度越大则电离常数越大,酸性越强。
拓展视野
α= —————————— ×100%
已电离的溶质分子数
原有溶质分子总数
——弱电解质电离程度相对大小的参数
醋酸的电离常数表达式
一水合氨的电离常数表达式
Kb=
c(NH4+)·c(OH )
c(NH3·H2O)
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
CH3COOH H+ + CH3COO
NH3·H2O NH4+ + OH
=
(1.7×10 3)·(1.7×10 3)
0.2
≈
1.4×10 5
该温度下电离程度小
c(NH3·H2O)
Kb=
c(NH4+ )·c(OH )
某温度下,0.20 mol·L-1的氨水中,已电离的NH3·H2O的浓度为1.7×10-3mol·L-1,则该温度下NH3·H2O的Kb=_____
电离平衡常数
进一步计算该温度下,有多少比例的NH3·H2O发生了电离:
已电离弱电解质分子数
原弱电解质分子数
×100%
=
1.7×10 3×V(溶液)
0.2×V(溶液)
×100%
=
0.85%
该温度下电离程度小
CH3COOH > HCN
酸性:
电离常数由物质本身性质决定
Ka(CH3COOH) > Ka(HCN)
25 ℃时,相同浓度的CH3COOH溶液与HCN溶液相比较,CH3COOH溶液酸性相对更强
你能比较该温度下CH3COOH、HCN电离常数的大小吗?
Ka值越大,电离程度越大,达到电离平衡时电离出的H+越多,酸性越强。反之,酸性越弱。
K 服从化学平衡常数的一般规律,只受温度影响。
Ka (HCN)=6.2×10-10mol/L
Ka(CH3COOH)=1.7×10-5mol/L
Ka (HF)=6.8×10-4mol/L
由此可得:酸性强弱顺序:HF > CH3COOH > HCN
H3PO4
H+ + H2PO4- Ka1=7.1×10-3mol/L
H2PO4-
H+ + HPO42- Ka2=6.2×10-8mol/L
HPO42-
H+ + PO43- Ka3=4.5×10-13mol/L
多元弱酸,分步电离,每一步电离都有各自的电离常数,通常用Ka1 Ka2 Ka3 来表示。
CH3COOH的电离常数(25 ℃)
=1.75×10 5
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
=6.2×10 10
Ka=
c(CN )·c(H+)
c(HCN)
CH3COOH > HCN
酸性:
1.相同温度下,直接比较弱电解质的相对强弱
电离常数的应用
HCN的电离常数(25 ℃)
CH3COOH CH3COO + H+
Q =
c(H+)
2
·
c(CH3COO )
2
c(CH3COOH)
2
=
Ka
2
< Ka
加水稀释,电离平衡向电离的方向移动
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
2.判断电离平衡移动的方向
将0.1 mol/L 醋酸加水稀释,使其浓度变为原来的一半,电离平衡移动的方向?
越稀越电离,平衡正向移动
3.计算粒子的浓度
取1 mL 2 mol/L 醋酸,加水稀释到10 mL,稀释后的溶液,酸的浓度和氢离子浓度分别为多少?
=
x·x
0.2
≈
1.75×10 5
变化浓度/(mol·L 1)
x
x
x
平衡浓度/(mol·L 1)
x
0.2 x
x
c(CH3COOH)=(0.2 x) mol·L 1 ≈ 0.2 mol·L 1
c(H+)= x = 0.001 87 mol/L
Ka=1.75×10 5(25 ℃)
0
起始浓度/(mol·L 1)
0.2
0
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
4.计算电离度
已知弱电解质在水中达到电离平衡状态时,已电离的电解质分子数占原有电解质分子总数的百分率,称为电离度。
X
X
X
起始
C
0
0
平衡
C-X
X
X
思考: 通过那些事实(或实验)可以证明CH3COOH是弱电解质?
方法一:取同浓度的HCl和CH3COOH,进行溶液导电性实验
方法七:测定CH3COONa的水溶液的pH pH>7
方法三:测定0.1mol/L CH3COOH 的pH值 pH >1
方法二:取同浓度的HCl 和 CH3COOH 和相同大小颗粒的锌粒比较反应速率。 CH3COOH的反应速率较慢。
方法五:相同pH值相同体积的HCl和CH3COOH,和足量的锌粒反应。
CH3COOH在反应过程中速率较快且最终产生的氢气多。
方法四:取相同pH的HCl和CH3COOH,稀释100倍。pH值变化小的是CH3COOH
方法六:测定等pH等体积的HCl 和 CH3COOH溶液中和碱的量。
CH3COOH耗碱量大。
A、HF B、K2SO4
下列物质溶于水后,溶质存在电离平衡的有( )
C、HNO3 D、Ca(OH)2
AE
E、NH3·H2O F、BaSO4
下列关于强、弱电解质的叙述正确的是( )
A、强电解质都是离子化合物,弱电解质都是共价化合物
B、强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C、强电解质溶液的导电能力强,弱电解质溶液的导电能力弱
D、强电解质溶液中无溶质分子,弱电解质溶液中分子和其电离产生的离子同时存在
D
欧盟委员会发布条例,修订芥酸和氢氰酸在部分食品中的最大含量。氢氰酸及部分弱酸的电离常数如表:
弱酸 HCOOH HCN H2CO3
电离常数(25 ℃) Ka=1.8×10-4 Ka=6.2×10-10 Ka1=4.5×10-7
Ka2=4.7×10-11
(1)依据表格中三种酸的电离常数,判断三种酸酸性强弱的顺序为________________。
HCOOH>H2CO3>HCN
(2)向NaCN溶液中通入CO2气体能否制得HCN?若能,写出反应的化学方程式:______________________________________________
_________________________________________________________。
能,NaCN+H2O+CO2===HCN+NaHCO3
1.下列关于电解质的电离平衡状态的叙述中,正确的是( )
A.弱电解质的电离达到平衡状态后,电离就停止了
B.弱电解质的电离达到平衡状态后,分子的消耗速率和离子的生成速率相等
C.弱电解质的电离达到平衡状态后,分子和离子的浓度相等
D.弱电解质的电离达到平衡状态后,外界条件改变,电离平衡可能要发生移动
D
3.下表是常温下某些一元弱酸的电离常数:
弱酸 HCN HF CH3COOH HNO2
电离常数 6.2×10-10 6.8×10-4 1.7×10-5 6.4×10-6
则0.1 mol·L-1的下列溶液中,pH最小的是( ) A.HCN B.HF C.CH3COOH D.HNO2
C
2.下列电解质在溶液中存在分子的是( )
A.Ba(OH)2 B. CH3COOH C.Ca(OH)2 D. NH3 6H2O
B
4.已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数(25 ℃),若已知下列反应可以发生:NaCN+HNO2 HCN+NaNO2、NaCN+HF HCN+NaF、NaNO2+HF HNO2+NaF。由此可判断下列叙述中不正确的是( )
A.K(HF)=7.2×10-4
B.K(HNO2)=4.9×10-10
C.根据两个反应即可得出一元弱酸的强弱顺序为HF>HNO2>HCN
D.K(HCN)<K(HNO2)<K(HF)
B
表示形式
影响因素
仅受温度影响
意义
定量表示
弱电解质电离能力的强弱
电离平衡常数
定义
各种离子的浓度(次方)的乘积与溶液中未电离的分子的浓度之比
Ka =
c(H+)·c(CH3COO-)
c(CH3COOH)
弱电解质的电离
(以 CH3COOH 的电离为例)
电离平衡移动
定量表达
CH3COOH H++CH3COO-
温度
浓度
宏观角度
物质组成
相互反应
作用结果(宏观现象)
微观角度
微粒种类微粒数量
微粒间的相互作用
微粒种类数量变化化学平衡移动
