第二节 反应热的计算 课件 (共49张PPT)高中化学 人教版(2019) 选择性必修1
文档属性
| 名称 | 第二节 反应热的计算 课件 (共49张PPT)高中化学 人教版(2019) 选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-25 22:21:15 | ||
图片预览










文档简介
(共49张PPT)
第一章 化学反应的热效应
第二节 反应热的计算
一 盖斯定律
01
相同
反应的途径
ΔH1+ΔH2
ΔH3+ΔH4+ΔH5
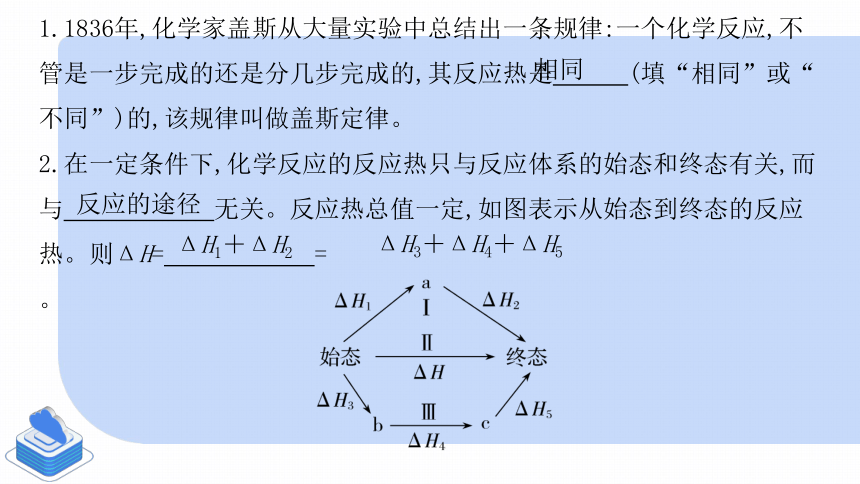
1.1836年,化学家盖斯从大量实验中总结出一条规律:一个化学反应,不管是一步完成的还是分几步完成的,其反应热是 (填“相同”或“不同”)的,该规律叫做盖斯定律。
2.在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与 无关。反应热总值一定,如图表示从始态到终态的反应热。则ΔH= = 。
增加
减少
3.能量守恒:能量既不会 ,也不会 ,只会从一种形式转化为另一种形式。
4.盖斯定律的应用
计算无法直接测量的反应的焓变。
×
√
×
1.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关。( )
2.盖斯定律遵守能量守恒定律。( )
3.已知某反应路径如图: ,则ΔH=ΔH1+ΔH2+ΔH3。( )
>
=
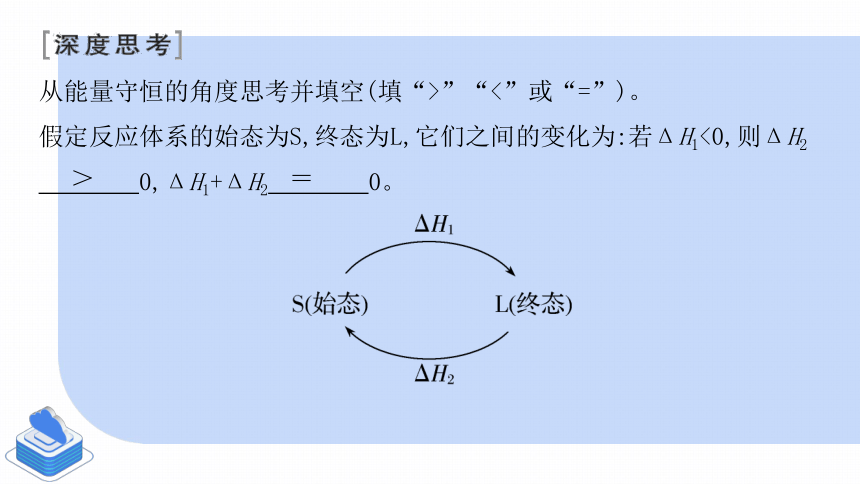
从能量守恒的角度思考并填空(填“>”“<”或“=”)。
假定反应体系的始态为S,终态为L,它们之间的变化为:若ΔH1<0,则ΔH2
0,ΔH1+ΔH2 0。
应用盖斯定律计算ΔH的方法
(1)“虚拟路径”法
若反应物A变为生成物D,可以有两个途径:
①由A直接变成D,反应热为ΔH;
②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示:
则ΔH=ΔH1+ΔH2+ΔH3。
(2)加合法
依据目标方程式中各物质的位置和化学计量数,调整已知方程式,最终加合成目标方程式,ΔH同时作出相应的调整和运算。
C
1.在298 K、101 kPa时,已知:
(1)C(s,石墨)+O2(g) ===CO2(g) ΔH1=-393.5 kJ·mol-1
(2)2H2(g)+O2(g) ===2H2O(l) ΔH2=-571.6 kJ·mol-1
(3)2C2H2(g)+5O2(g) ===4CO2(g)+2H2O(l) ΔH3=-2 599 kJ·mol-1
则相同条件下,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变ΔH4是 ( )
A.-226.7 kJ·mol-1 B.-326 kJ·mol-1
C.+226.7 kJ·mol-1 D.+326 kJ·mol-1
利用盖斯定律,反应(1)×2+反应(2)×-反应(3)×可得2C(s,石墨)+H2(g) ===C2H2(g) ΔH4=ΔH1×2+ΔH2×-ΔH3×=(-393.5 kJ·mol-1)×2+(-571.6 kJ·mol-1)×-(-2 599 kJ·mol-1)×=+226.7 kJ·mol-1,故C正确。
4HCl(g)+O2(g) ===2Cl2(g)+2H2O(g) ΔH=-116 kJ·mol-1
2.随着聚酯工业的快速发展,工业上对氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为当前科学研究的热点。Deacon直接氧化法可按下列催化过程进行:
CuCl2(s) ===CuCl(s)+Cl2(g) ΔH1=+83 kJ·mol-1 ①
CuCl(s)+O2(g) ===CuO(s)+Cl2(g) ΔH2=-20 kJ·mol-1 ②
CuO(s)+2HCl(g) ===CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1 ③
则氯化氢与氧气反应生成氯气和水蒸气的热化学方程式为___________________________________________________。
根据盖斯定律,①×2+②×2+③×2可得4HCl(g)+O2(g) ===2Cl2(g)+2H2O(g) ΔH=2ΔH1+2ΔH2+2ΔH3=(+83 kJ·mol-1)×2+(-20 kJ·mol-1)×2+(-121 kJ·mol-1)×2=-116 kJ·mol-1。
利用盖斯定律计算ΔH的四步骤
(1)定:确定待求反应的热化学方程式。
(2)找:找出待求热化学方程式中只在已知化学方程式中出现一次的物质。
(3)调:依据该物质调整已知化学方程式的方向(同侧相加,异侧相减)和化学计量数,每个已知化学方程式只能调整一次。
(4)算:ΔH与已知化学方程式一一对应调整和运算。
二 反应热的计算
02
1.计算依据
依据热化学方程式、盖斯定律等可以计算化学反应的反应热。
2.应用举例
[例1] 焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为
①C(s)+H2O(g) ===CO(g)+H2(g) ΔH1=+131.5 kJ/mol
②CH4(g)+H2O(g) ===CO(g)+3H2(g) ΔH2=+205.9 kJ/mol
试计算CH4(g) ===C(s)+2H2(g)的ΔH(写出计算过程)。
[答案] 解:分析各化学方程式的关系及盖斯定律可以得出,将反应②减反应①,得到反应:
CH4(g) ===C(s)+2H2(g)
ΔH=ΔH2-ΔH1
=(+205.9 kJ/mol)-(+131.5 kJ/mol)
=+74.4 kJ/mol
答:CH4(g) ===C(s)+2H2(g)的ΔH=+74.4 kJ/mol。
[例2] 黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一,反应的化学方程式为4FeS2+11O22Fe2O3+8SO2。
在25 ℃和101 kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853 kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。
(1)请写出FeS2燃烧的热化学方程式。
[答案] 解:(1)根据题意,FeS2燃烧的热化学方程式为FeS2(s)+O2(g)===Fe2O3(s)+2SO2(g) ΔH=-853 kJ/mol
答:(1)FeS2燃烧的热化学方程式为FeS2(s)+O2(g)===Fe2O3(s)+2SO2(g) ΔH=-853 kJ/mol。
(2)计算理论上1 kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量(写出计算过程)。
[答案] 解:(2)FeS2的摩尔质量为120 g/mol。
1 kg黄铁矿含FeS2的质量为1 000 g×90%=900 g
900 g FeS2的物质的量为=7.5 mol
理论上1 kg黄铁矿完全燃烧放出的热量为7.5 mol×853 kJ/mol=6 397.5 kJ
答:(2)理论上1 kg黄铁矿完全燃烧放出的热量为6 397.5 kJ。
发射火箭时使用的燃料可以是液氢和液氧,已知下列热化学方程式:
①H2(g)+O2(g) ===H2O(l)
ΔH1=-285.8 kJ·mol-1
②H2(g) ===H2(l)
ΔH2=-0.92 kJ·mol-1
③O2(g) ===O2(l)
ΔH3=-6.84 kJ·mol-1
④H2O(l) ===H2O(g)
ΔH4=+44.0 kJ·mol-1
-237.46 kJ·mol-1
(1)反应H2(l)+O2(l) ===H2O(g)的反应热ΔH= 。
(1)根据盖斯定律,将①-②-③×+④可得目标反应的热化学方程式,其反应热ΔH=ΔH1-ΔH2-ΔH3×+ΔH4,代入数据计算可得ΔH=-237.46 kJ·mol-1。
1.19×108
(2)若填装1吨液氢,在液氧中充分燃烧生成水蒸气,可为火箭提供
(保留三位有效数字)kJ的热量。
(2)设填装1吨液氢,在液氧中充分燃烧生成水蒸气,可为火箭提供的热量为x。
H2(l)+O2(l) ===H2O(g) ΔH=-237.46 kJ·mol-1
1 mol 237.46 kJ
1 000 kg×103/2 g·mol-1 x
解得x≈1.19×108 kJ。
2
3
4
5
6
7
8
1
9
10
B
11
本节训练
题组一 盖斯定律
1.物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是
( )
A.A―→F ΔH=-ΔH6
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C.C―→F |ΔH|=|ΔH1+ΔH2+ΔH6|
D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
2
3
4
5
6
7
8
1
9
10
11
由盖斯定律可知A―→F,ΔH=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=-ΔH6,即ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0,故A项正确,B项错误;由C―→F可以判断,ΔH=ΔH3+ΔH4+ΔH5=-(ΔH1+ΔH2+ΔH6),故C项正确;由A―→D知,
ΔH=ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6),故D项正确。
2
3
4
5
6
7
8
1
9
10
A
11
2.在298 K、101 kPa时,已知:
2H2O(g) ===2H2(g)+O2(g) ΔH1
H2(g)+Cl2(g) ===2HCl(g) ΔH2
2Cl2(g)+2H2O(g) ===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2
D.ΔH3=ΔH1-ΔH2
2
3
4
5
6
7
8
1
9
10
11
①2H2O(g) ===2H2(g)+O2(g) ΔH1;②H2(g)+Cl2(g) ===2HCl(g) ΔH2;③2Cl2(g)+2H2O(g) ===4HCl(g)+O2(g) ΔH3,则由盖斯定律可知,③=①+2×②,则ΔH3=ΔH1+2ΔH2,故A正确。
2
3
4
5
6
7
8
1
9
10
A
11
3.已知:①Zn(s)+O2(g) ===ZnO(s) ΔH1=-348.3 kJ·mol-1
②2Ag(s)+O2(g) ===Ag2O(s) ΔH2=-31.0 kJ·mol-1
则Zn(s)+Ag2O(s) ===ZnO(s)+2Ag(s)的ΔH等于( )
A.-317.3 kJ·mol-1 B.-379.3 kJ·mol-1
C.-332.8 kJ·mol-1 D.+317.3 kJ·mol-1
2
3
4
5
6
7
8
1
9
10
11
由盖斯定律,①-②可得目标反应,即ΔH=ΔH1-ΔH2=-348.3 kJ·mol-1-(-31.0 kJ·mol-1)=-317.3 kJ·mol-1,故A正确。
2
3
4
5
6
7
8
1
9
10
11
4.AlH3是一种储氢材料,可作为固体火箭推进剂。通过激光加热引发AlH3的燃烧反应,燃烧时温度随时间变化关系如图所示:
燃烧不同阶段发生的主要反应如下:
①2AlH3(s) ===2Al(s)+3H2(g) ΔH1
②H2(g)+O2(g) ===H2O(g) ΔH2
③Al(s) ===Al(g) ΔH3
④Al(g)+O2(g)===Al2O3(s) ΔH4
2
3
4
5
6
7
8
1
9
10
D
11
下列分析正确的是( )
A.AlH3燃烧需要激光加热引发,所以AlH3燃烧是吸热反应
B.ΔH2可以表示H2的燃烧热
C.在反应过程中,a点时物质所具有的总能量最大
D.2AlH3(s)+3O2(g) ===Al2O3(s)+3H2O(g) ΔH=ΔH1+3ΔH2+2ΔH3+2ΔH4
2
3
4
5
6
7
8
1
9
10
11
化学反应是放热反应还是吸热反应,与反应条件无关,AlH3燃烧是放热反应,A项错误;H2的燃烧热指的是1 mol H2完全燃烧生成1 mol H2O(l)释放的热量,B项错误;反应过程中,a点时释放的能量最大,a点时物质所具有的总能量最小,C项错误;根据盖斯定律,①+3×②+2×③+2×④得2AlH3(s)+3O2(g) ===Al2O3(s)+3H2O(g) ΔH=ΔH1+3ΔH2+2ΔH3+2ΔH4,D项正确。
2
3
4
5
6
7
8
1
9
10
+6
11
5.(2023·浙江6月卷)水煤气变换反应是工业上的重要反应,可用于制氢。
水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
该反应分两步完成:
3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH1=-47.2 kJ·mol-1
2Fe3O4(s)+H2O(g) 3Fe2O3(s)+H2(g) ΔH2
ΔH2= kJ·mol-1。
2
3
4
5
6
7
8
1
9
10
11
设方程式①CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
②3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH1=-47.2 kJ·mol-1
③2Fe3O4(s)+H2O(g) 3Fe2O3(s)+H2(g) ΔH2
根据盖斯定律可知,③=①-②,则ΔH2=ΔH-ΔH1=(-41.2 kJ·mol-1)-(-47.2 kJ·mol-1)=+6 kJ·mol-1。
2
3
4
5
6
7
8
1
9
10
11
题组二 利用热化学方程式计算反应热
6.已知:
①CH4(g)+2O2(g) === CO2(g)+2H2O(l)
ΔH1=-Q1 kJ/mol
②2H2(g)+O2(g) ===2H2O(g)
ΔH2=-2Q2 kJ/mol
③2H2(g)+O2(g) ===2H2O(l)
ΔH3=-2Q3 kJ/mol
2
3
4
5
6
7
8
1
9
10
D
11
常温下取体积比为4∶1的甲烷和氢气共11.2 L(已折合成标准状况)点燃,经完全燃烧恢复到常温,放出的热量(kJ)为( )
A.0.4Q1+0.05Q2 B.0.4Q1+0.1Q2
C.0.4Q1+0.05Q3 D.0.4Q1+0.1Q3
2
3
4
5
6
7
8
1
9
10
11
甲烷和氢气的混合气体11.2 L(已折合成标准状况),即甲烷和氢气的混合气体的总物质的量为n===0.5 mol,甲烷和氢气的体积比为4∶1,所以甲烷的物质的量为0.5 mol×=0.4 mol,氢气的物质的量为0.5 mol-0.4 mol=0.1 mol,由CH4(g)+2O2(g) ===CO2(g)+2H2O(l) ΔH1=-Q1 kJ/mol可知,0.4 mol甲烷燃烧放出的热量为0.4 mol×Q1 kJ/mol=0.4Q1 kJ;由2H2(g)+O2(g) ===2H2O(l) ΔH3=-2Q3 kJ/mol可知,0.1 mol 氢气燃烧生成液态水放出的热量为×0.1 mol ×2Q3 kJ/mol=0.1Q3 kJ,所以放出的热量为(0.4Q1+0.1Q3) kJ,故D正确。
2
3
4
5
6
7
8
1
9
10
D
11
7.关于反应:
①2C2H2(g)+5O2(g) ===4CO2(g)+2H2O(l) ΔH=-2 600 kJ·mol-1
②2CO(g)+O2(g) ===2CO2(g) ΔH=-566 kJ·mol-1
③CH4(g)+H2O(g) ===CO(g)+3H2(g) ΔH=+216 kJ·mol-1
下列叙述中正确的是( )
A.CO的燃烧热为-283 kJ·mol-1
B.在③反应进行时,若加入催化剂,可以使ΔH减小
C.若有3.2 g CH4与足量水蒸气按③反应,则放出的热量是43.2 kJ
D.若生成相同质量的CO2,C2H2放出的热量大于CO
2
3
4
5
6
7
8
1
9
10
11
CO的燃烧热为283 kJ·mol-1,A错误;对于一个确定的化学反应,ΔH与反应时是否加入催化剂无关,B错误;根据③可知,CH4与足量水蒸气的反应为吸热反应,C错误;根据①和②可知,D正确。
2
3
4
5
6
7
8
1
9
10
FeO(s)+CO(g) ===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1
11
8.已知冶炼铁的过程中发生如下反应:
①Fe2O3(s)+3CO(g) ===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g) ===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g) ===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
(1)写出FeO(s)被CO还原成Fe和CO2的热化学方程式:
。
2
3
4
5
6
7
8
1
9
10
11
(1)依据盖斯定律:一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。FeO(s)与CO反应生成Fe和CO2的化学方程式:
FeO(s)+CO(g) ===Fe(s)+CO2(g) ④,由盖斯定律可得,×[3×①-(2×③+②)]=④,可得该反应的反应热:ΔH=[3ΔH1-(2ΔH3+ΔH2)]=×{3×(-25)-[2×(+19)+(-47)]}kJ·mol-1=-11 kJ·mol-1。
2
3
4
5
6
7
8
1
9
10
1.25×106
11
(2)若用Fe2O3(s)与CO(g)反应冶炼5.6吨铁,则释放 kJ热量。
(2)设用Fe2O3(s)和CO(g)反应冶炼5.6吨铁时释放x kJ热量。
Fe2O3(s)+3CO(g) ===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
2 mol 25 kJ
5 600 kg×103/56 g·mol-1 x kJ
则x=1.25×106,即释放1.25×106 kJ热量。
2
3
4
5
6
7
8
1
9
10
A
11
综合强化
9.下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g) ===2H2O(g) ΔH=-483.6 kJ·mol-1,则1 mol H2燃烧生成水蒸气放出的热量为241.8 kJ
B.已知NaOH(aq)+HCl(aq) ===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
C.已知2C(s)+2O2(g) ===2CO2(g) ΔH=a kJ·mol-1;2C(s)+O2(g) ===2CO(g) ΔH=b kJ·mol-1,则a>b
D.已知C(石墨,s) ===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
2
3
4
5
6
7
8
1
9
10
11
根据热化学方程式进行计算,2 mol H2燃烧生成水蒸气放出的热量为483.6 kJ,则1 mol H2燃烧生成水蒸气放出的热量为241.8 kJ,故A正确;醋酸为弱酸,与含40.0 g NaOH的稀溶液完全中和放出的热量小于57.3 kJ,故B错误;碳完全燃烧放出的热量高于不完全燃烧放出的热量,两个反应均为放热反应,焓变是负值,故a0,石墨能量小于金刚石,则石墨比金刚石稳定,故D错误。
2
3
4
5
6
7
8
1
9
10
11
10.灰锡(以粉末状形态存在)和白锡是锡的两种同素异形体。已知:
①Sn(白,s)+2HCl(aq) === SnCl2(aq)+H2(g) ΔH1
②Sn(灰,s)+2HCl(aq) ===SnCl2(aq)+H2(g) ΔH2
③Sn(灰,s) Sn(白,s) ΔH3=+2.1 kJ· mol-1
2
3
4
5
6
7
8
1
9
10
D
11
下列说法正确的是( )
A.ΔH2 <ΔH1
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2 ℃ 的环境中,会自行毁坏
2
3
4
5
6
7
8
1
9
10
11
② -① 可得③,ΔH3=ΔH2-ΔH1=+2.1 kJ·mol-1>0,故ΔH2>ΔH1,故A错误;根据③,在常温下,灰锡会向白锡转化,故锡在常温下以白锡状态存在,正反应为吸热反应,故B、C错误;当锡制器皿长期处于低于13.2 ℃的环境中会转化为灰锡,灰锡以粉末状形态存在,故会自行毁坏,故D正确。
2
3
4
5
6
7
8
1
9
10
11
11.(2023·山东卷)一定条件下,水气变换反应CO+H2O CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
Ⅰ.HCOOH CO+H2O(快)
Ⅱ.HCOOH CO2+H2(慢)
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
2
3
4
5
6
7
8
1
9
10
ΔH2-ΔH1
11
一定条件下,反应Ⅰ、Ⅱ的焓变分别为ΔH1、ΔH2,则该条件下水气变换反应的焓变ΔH= (用含ΔH1、ΔH2的代数式表示)。
根据盖斯定律,由Ⅱ-Ⅰ可得水气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=ΔH2-ΔH1。
第一章 化学反应的热效应
第二节 反应热的计算
一 盖斯定律
01
相同
反应的途径
ΔH1+ΔH2
ΔH3+ΔH4+ΔH5
1.1836年,化学家盖斯从大量实验中总结出一条规律:一个化学反应,不管是一步完成的还是分几步完成的,其反应热是 (填“相同”或“不同”)的,该规律叫做盖斯定律。
2.在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与 无关。反应热总值一定,如图表示从始态到终态的反应热。则ΔH= = 。
增加
减少
3.能量守恒:能量既不会 ,也不会 ,只会从一种形式转化为另一种形式。
4.盖斯定律的应用
计算无法直接测量的反应的焓变。
×
√
×
1.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关。( )
2.盖斯定律遵守能量守恒定律。( )
3.已知某反应路径如图: ,则ΔH=ΔH1+ΔH2+ΔH3。( )
>
=
从能量守恒的角度思考并填空(填“>”“<”或“=”)。
假定反应体系的始态为S,终态为L,它们之间的变化为:若ΔH1<0,则ΔH2
0,ΔH1+ΔH2 0。
应用盖斯定律计算ΔH的方法
(1)“虚拟路径”法
若反应物A变为生成物D,可以有两个途径:
①由A直接变成D,反应热为ΔH;
②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示:
则ΔH=ΔH1+ΔH2+ΔH3。
(2)加合法
依据目标方程式中各物质的位置和化学计量数,调整已知方程式,最终加合成目标方程式,ΔH同时作出相应的调整和运算。
C
1.在298 K、101 kPa时,已知:
(1)C(s,石墨)+O2(g) ===CO2(g) ΔH1=-393.5 kJ·mol-1
(2)2H2(g)+O2(g) ===2H2O(l) ΔH2=-571.6 kJ·mol-1
(3)2C2H2(g)+5O2(g) ===4CO2(g)+2H2O(l) ΔH3=-2 599 kJ·mol-1
则相同条件下,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变ΔH4是 ( )
A.-226.7 kJ·mol-1 B.-326 kJ·mol-1
C.+226.7 kJ·mol-1 D.+326 kJ·mol-1
利用盖斯定律,反应(1)×2+反应(2)×-反应(3)×可得2C(s,石墨)+H2(g) ===C2H2(g) ΔH4=ΔH1×2+ΔH2×-ΔH3×=(-393.5 kJ·mol-1)×2+(-571.6 kJ·mol-1)×-(-2 599 kJ·mol-1)×=+226.7 kJ·mol-1,故C正确。
4HCl(g)+O2(g) ===2Cl2(g)+2H2O(g) ΔH=-116 kJ·mol-1
2.随着聚酯工业的快速发展,工业上对氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为当前科学研究的热点。Deacon直接氧化法可按下列催化过程进行:
CuCl2(s) ===CuCl(s)+Cl2(g) ΔH1=+83 kJ·mol-1 ①
CuCl(s)+O2(g) ===CuO(s)+Cl2(g) ΔH2=-20 kJ·mol-1 ②
CuO(s)+2HCl(g) ===CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1 ③
则氯化氢与氧气反应生成氯气和水蒸气的热化学方程式为___________________________________________________。
根据盖斯定律,①×2+②×2+③×2可得4HCl(g)+O2(g) ===2Cl2(g)+2H2O(g) ΔH=2ΔH1+2ΔH2+2ΔH3=(+83 kJ·mol-1)×2+(-20 kJ·mol-1)×2+(-121 kJ·mol-1)×2=-116 kJ·mol-1。
利用盖斯定律计算ΔH的四步骤
(1)定:确定待求反应的热化学方程式。
(2)找:找出待求热化学方程式中只在已知化学方程式中出现一次的物质。
(3)调:依据该物质调整已知化学方程式的方向(同侧相加,异侧相减)和化学计量数,每个已知化学方程式只能调整一次。
(4)算:ΔH与已知化学方程式一一对应调整和运算。
二 反应热的计算
02
1.计算依据
依据热化学方程式、盖斯定律等可以计算化学反应的反应热。
2.应用举例
[例1] 焦炭与水蒸气反应、甲烷与水蒸气反应均是工业上制取氢气的重要方法。这两个反应的热化学方程式分别为
①C(s)+H2O(g) ===CO(g)+H2(g) ΔH1=+131.5 kJ/mol
②CH4(g)+H2O(g) ===CO(g)+3H2(g) ΔH2=+205.9 kJ/mol
试计算CH4(g) ===C(s)+2H2(g)的ΔH(写出计算过程)。
[答案] 解:分析各化学方程式的关系及盖斯定律可以得出,将反应②减反应①,得到反应:
CH4(g) ===C(s)+2H2(g)
ΔH=ΔH2-ΔH1
=(+205.9 kJ/mol)-(+131.5 kJ/mol)
=+74.4 kJ/mol
答:CH4(g) ===C(s)+2H2(g)的ΔH=+74.4 kJ/mol。
[例2] 黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2的途径之一,反应的化学方程式为4FeS2+11O22Fe2O3+8SO2。
在25 ℃和101 kPa时,1 mol FeS2(s)完全燃烧生成Fe2O3(s)和SO2(g)时放出853 kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。
(1)请写出FeS2燃烧的热化学方程式。
[答案] 解:(1)根据题意,FeS2燃烧的热化学方程式为FeS2(s)+O2(g)===Fe2O3(s)+2SO2(g) ΔH=-853 kJ/mol
答:(1)FeS2燃烧的热化学方程式为FeS2(s)+O2(g)===Fe2O3(s)+2SO2(g) ΔH=-853 kJ/mol。
(2)计算理论上1 kg黄铁矿(FeS2的含量为90%)完全燃烧放出的热量(写出计算过程)。
[答案] 解:(2)FeS2的摩尔质量为120 g/mol。
1 kg黄铁矿含FeS2的质量为1 000 g×90%=900 g
900 g FeS2的物质的量为=7.5 mol
理论上1 kg黄铁矿完全燃烧放出的热量为7.5 mol×853 kJ/mol=6 397.5 kJ
答:(2)理论上1 kg黄铁矿完全燃烧放出的热量为6 397.5 kJ。
发射火箭时使用的燃料可以是液氢和液氧,已知下列热化学方程式:
①H2(g)+O2(g) ===H2O(l)
ΔH1=-285.8 kJ·mol-1
②H2(g) ===H2(l)
ΔH2=-0.92 kJ·mol-1
③O2(g) ===O2(l)
ΔH3=-6.84 kJ·mol-1
④H2O(l) ===H2O(g)
ΔH4=+44.0 kJ·mol-1
-237.46 kJ·mol-1
(1)反应H2(l)+O2(l) ===H2O(g)的反应热ΔH= 。
(1)根据盖斯定律,将①-②-③×+④可得目标反应的热化学方程式,其反应热ΔH=ΔH1-ΔH2-ΔH3×+ΔH4,代入数据计算可得ΔH=-237.46 kJ·mol-1。
1.19×108
(2)若填装1吨液氢,在液氧中充分燃烧生成水蒸气,可为火箭提供
(保留三位有效数字)kJ的热量。
(2)设填装1吨液氢,在液氧中充分燃烧生成水蒸气,可为火箭提供的热量为x。
H2(l)+O2(l) ===H2O(g) ΔH=-237.46 kJ·mol-1
1 mol 237.46 kJ
1 000 kg×103/2 g·mol-1 x
解得x≈1.19×108 kJ。
2
3
4
5
6
7
8
1
9
10
B
11
本节训练
题组一 盖斯定律
1.物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是
( )
A.A―→F ΔH=-ΔH6
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C.C―→F |ΔH|=|ΔH1+ΔH2+ΔH6|
D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
2
3
4
5
6
7
8
1
9
10
11
由盖斯定律可知A―→F,ΔH=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=-ΔH6,即ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0,故A项正确,B项错误;由C―→F可以判断,ΔH=ΔH3+ΔH4+ΔH5=-(ΔH1+ΔH2+ΔH6),故C项正确;由A―→D知,
ΔH=ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6),故D项正确。
2
3
4
5
6
7
8
1
9
10
A
11
2.在298 K、101 kPa时,已知:
2H2O(g) ===2H2(g)+O2(g) ΔH1
H2(g)+Cl2(g) ===2HCl(g) ΔH2
2Cl2(g)+2H2O(g) ===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2
D.ΔH3=ΔH1-ΔH2
2
3
4
5
6
7
8
1
9
10
11
①2H2O(g) ===2H2(g)+O2(g) ΔH1;②H2(g)+Cl2(g) ===2HCl(g) ΔH2;③2Cl2(g)+2H2O(g) ===4HCl(g)+O2(g) ΔH3,则由盖斯定律可知,③=①+2×②,则ΔH3=ΔH1+2ΔH2,故A正确。
2
3
4
5
6
7
8
1
9
10
A
11
3.已知:①Zn(s)+O2(g) ===ZnO(s) ΔH1=-348.3 kJ·mol-1
②2Ag(s)+O2(g) ===Ag2O(s) ΔH2=-31.0 kJ·mol-1
则Zn(s)+Ag2O(s) ===ZnO(s)+2Ag(s)的ΔH等于( )
A.-317.3 kJ·mol-1 B.-379.3 kJ·mol-1
C.-332.8 kJ·mol-1 D.+317.3 kJ·mol-1
2
3
4
5
6
7
8
1
9
10
11
由盖斯定律,①-②可得目标反应,即ΔH=ΔH1-ΔH2=-348.3 kJ·mol-1-(-31.0 kJ·mol-1)=-317.3 kJ·mol-1,故A正确。
2
3
4
5
6
7
8
1
9
10
11
4.AlH3是一种储氢材料,可作为固体火箭推进剂。通过激光加热引发AlH3的燃烧反应,燃烧时温度随时间变化关系如图所示:
燃烧不同阶段发生的主要反应如下:
①2AlH3(s) ===2Al(s)+3H2(g) ΔH1
②H2(g)+O2(g) ===H2O(g) ΔH2
③Al(s) ===Al(g) ΔH3
④Al(g)+O2(g)===Al2O3(s) ΔH4
2
3
4
5
6
7
8
1
9
10
D
11
下列分析正确的是( )
A.AlH3燃烧需要激光加热引发,所以AlH3燃烧是吸热反应
B.ΔH2可以表示H2的燃烧热
C.在反应过程中,a点时物质所具有的总能量最大
D.2AlH3(s)+3O2(g) ===Al2O3(s)+3H2O(g) ΔH=ΔH1+3ΔH2+2ΔH3+2ΔH4
2
3
4
5
6
7
8
1
9
10
11
化学反应是放热反应还是吸热反应,与反应条件无关,AlH3燃烧是放热反应,A项错误;H2的燃烧热指的是1 mol H2完全燃烧生成1 mol H2O(l)释放的热量,B项错误;反应过程中,a点时释放的能量最大,a点时物质所具有的总能量最小,C项错误;根据盖斯定律,①+3×②+2×③+2×④得2AlH3(s)+3O2(g) ===Al2O3(s)+3H2O(g) ΔH=ΔH1+3ΔH2+2ΔH3+2ΔH4,D项正确。
2
3
4
5
6
7
8
1
9
10
+6
11
5.(2023·浙江6月卷)水煤气变换反应是工业上的重要反应,可用于制氢。
水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
该反应分两步完成:
3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH1=-47.2 kJ·mol-1
2Fe3O4(s)+H2O(g) 3Fe2O3(s)+H2(g) ΔH2
ΔH2= kJ·mol-1。
2
3
4
5
6
7
8
1
9
10
11
设方程式①CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
②3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH1=-47.2 kJ·mol-1
③2Fe3O4(s)+H2O(g) 3Fe2O3(s)+H2(g) ΔH2
根据盖斯定律可知,③=①-②,则ΔH2=ΔH-ΔH1=(-41.2 kJ·mol-1)-(-47.2 kJ·mol-1)=+6 kJ·mol-1。
2
3
4
5
6
7
8
1
9
10
11
题组二 利用热化学方程式计算反应热
6.已知:
①CH4(g)+2O2(g) === CO2(g)+2H2O(l)
ΔH1=-Q1 kJ/mol
②2H2(g)+O2(g) ===2H2O(g)
ΔH2=-2Q2 kJ/mol
③2H2(g)+O2(g) ===2H2O(l)
ΔH3=-2Q3 kJ/mol
2
3
4
5
6
7
8
1
9
10
D
11
常温下取体积比为4∶1的甲烷和氢气共11.2 L(已折合成标准状况)点燃,经完全燃烧恢复到常温,放出的热量(kJ)为( )
A.0.4Q1+0.05Q2 B.0.4Q1+0.1Q2
C.0.4Q1+0.05Q3 D.0.4Q1+0.1Q3
2
3
4
5
6
7
8
1
9
10
11
甲烷和氢气的混合气体11.2 L(已折合成标准状况),即甲烷和氢气的混合气体的总物质的量为n===0.5 mol,甲烷和氢气的体积比为4∶1,所以甲烷的物质的量为0.5 mol×=0.4 mol,氢气的物质的量为0.5 mol-0.4 mol=0.1 mol,由CH4(g)+2O2(g) ===CO2(g)+2H2O(l) ΔH1=-Q1 kJ/mol可知,0.4 mol甲烷燃烧放出的热量为0.4 mol×Q1 kJ/mol=0.4Q1 kJ;由2H2(g)+O2(g) ===2H2O(l) ΔH3=-2Q3 kJ/mol可知,0.1 mol 氢气燃烧生成液态水放出的热量为×0.1 mol ×2Q3 kJ/mol=0.1Q3 kJ,所以放出的热量为(0.4Q1+0.1Q3) kJ,故D正确。
2
3
4
5
6
7
8
1
9
10
D
11
7.关于反应:
①2C2H2(g)+5O2(g) ===4CO2(g)+2H2O(l) ΔH=-2 600 kJ·mol-1
②2CO(g)+O2(g) ===2CO2(g) ΔH=-566 kJ·mol-1
③CH4(g)+H2O(g) ===CO(g)+3H2(g) ΔH=+216 kJ·mol-1
下列叙述中正确的是( )
A.CO的燃烧热为-283 kJ·mol-1
B.在③反应进行时,若加入催化剂,可以使ΔH减小
C.若有3.2 g CH4与足量水蒸气按③反应,则放出的热量是43.2 kJ
D.若生成相同质量的CO2,C2H2放出的热量大于CO
2
3
4
5
6
7
8
1
9
10
11
CO的燃烧热为283 kJ·mol-1,A错误;对于一个确定的化学反应,ΔH与反应时是否加入催化剂无关,B错误;根据③可知,CH4与足量水蒸气的反应为吸热反应,C错误;根据①和②可知,D正确。
2
3
4
5
6
7
8
1
9
10
FeO(s)+CO(g) ===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1
11
8.已知冶炼铁的过程中发生如下反应:
①Fe2O3(s)+3CO(g) ===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g) ===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g) ===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
(1)写出FeO(s)被CO还原成Fe和CO2的热化学方程式:
。
2
3
4
5
6
7
8
1
9
10
11
(1)依据盖斯定律:一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。FeO(s)与CO反应生成Fe和CO2的化学方程式:
FeO(s)+CO(g) ===Fe(s)+CO2(g) ④,由盖斯定律可得,×[3×①-(2×③+②)]=④,可得该反应的反应热:ΔH=[3ΔH1-(2ΔH3+ΔH2)]=×{3×(-25)-[2×(+19)+(-47)]}kJ·mol-1=-11 kJ·mol-1。
2
3
4
5
6
7
8
1
9
10
1.25×106
11
(2)若用Fe2O3(s)与CO(g)反应冶炼5.6吨铁,则释放 kJ热量。
(2)设用Fe2O3(s)和CO(g)反应冶炼5.6吨铁时释放x kJ热量。
Fe2O3(s)+3CO(g) ===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
2 mol 25 kJ
5 600 kg×103/56 g·mol-1 x kJ
则x=1.25×106,即释放1.25×106 kJ热量。
2
3
4
5
6
7
8
1
9
10
A
11
综合强化
9.下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g) ===2H2O(g) ΔH=-483.6 kJ·mol-1,则1 mol H2燃烧生成水蒸气放出的热量为241.8 kJ
B.已知NaOH(aq)+HCl(aq) ===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
C.已知2C(s)+2O2(g) ===2CO2(g) ΔH=a kJ·mol-1;2C(s)+O2(g) ===2CO(g) ΔH=b kJ·mol-1,则a>b
D.已知C(石墨,s) ===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
2
3
4
5
6
7
8
1
9
10
11
根据热化学方程式进行计算,2 mol H2燃烧生成水蒸气放出的热量为483.6 kJ,则1 mol H2燃烧生成水蒸气放出的热量为241.8 kJ,故A正确;醋酸为弱酸,与含40.0 g NaOH的稀溶液完全中和放出的热量小于57.3 kJ,故B错误;碳完全燃烧放出的热量高于不完全燃烧放出的热量,两个反应均为放热反应,焓变是负值,故a
2
3
4
5
6
7
8
1
9
10
11
10.灰锡(以粉末状形态存在)和白锡是锡的两种同素异形体。已知:
①Sn(白,s)+2HCl(aq) === SnCl2(aq)+H2(g) ΔH1
②Sn(灰,s)+2HCl(aq) ===SnCl2(aq)+H2(g) ΔH2
③Sn(灰,s) Sn(白,s) ΔH3=+2.1 kJ· mol-1
2
3
4
5
6
7
8
1
9
10
D
11
下列说法正确的是( )
A.ΔH2 <ΔH1
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2 ℃ 的环境中,会自行毁坏
2
3
4
5
6
7
8
1
9
10
11
② -① 可得③,ΔH3=ΔH2-ΔH1=+2.1 kJ·mol-1>0,故ΔH2>ΔH1,故A错误;根据③,在常温下,灰锡会向白锡转化,故锡在常温下以白锡状态存在,正反应为吸热反应,故B、C错误;当锡制器皿长期处于低于13.2 ℃的环境中会转化为灰锡,灰锡以粉末状形态存在,故会自行毁坏,故D正确。
2
3
4
5
6
7
8
1
9
10
11
11.(2023·山东卷)一定条件下,水气变换反应CO+H2O CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
Ⅰ.HCOOH CO+H2O(快)
Ⅱ.HCOOH CO2+H2(慢)
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
2
3
4
5
6
7
8
1
9
10
ΔH2-ΔH1
11
一定条件下,反应Ⅰ、Ⅱ的焓变分别为ΔH1、ΔH2,则该条件下水气变换反应的焓变ΔH= (用含ΔH1、ΔH2的代数式表示)。
根据盖斯定律,由Ⅱ-Ⅰ可得水气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=ΔH2-ΔH1。
