第二章第一节共价键第一课时 课件(共28张PPT) 高中化学 人教版(2019) 选择性必修2
文档属性
| 名称 | 第二章第一节共价键第一课时 课件(共28张PPT) 高中化学 人教版(2019) 选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-12-26 09:52:26 | ||
图片预览





文档简介
(共28张PPT)
第一节 共价键
第二章 分子结构与性质
第一课时
共价键
学习目标
1.从原子轨道重叠的视角认识共价键的本质,知道共价键具有饱和性和方向性,
2.能用模型、图像和符号等正确表征H2、Cl2、HCl等简单分子中原子轨道的重叠方式。
3.知道σ键和π键的区别和特征,能说明C2H6、C2H4和 C2H2等分子的成键类型。
知识回顾——化学键
1.什么是化学键?
化学键:相邻原子之间强烈的相互作用
2.化学键的类型有哪些?
①离子键:阴、阳离子之间通过静电作用形成的化学键
②共价键:原子间通过共用电子对形成的化学键
3.以NaCl和HCl为例,用电子式表示形成过程
由离子键构成的化合物叫离子化合物
只含共价键的化合物叫共价化合物
离子键
共价键
知识回顾——化学键
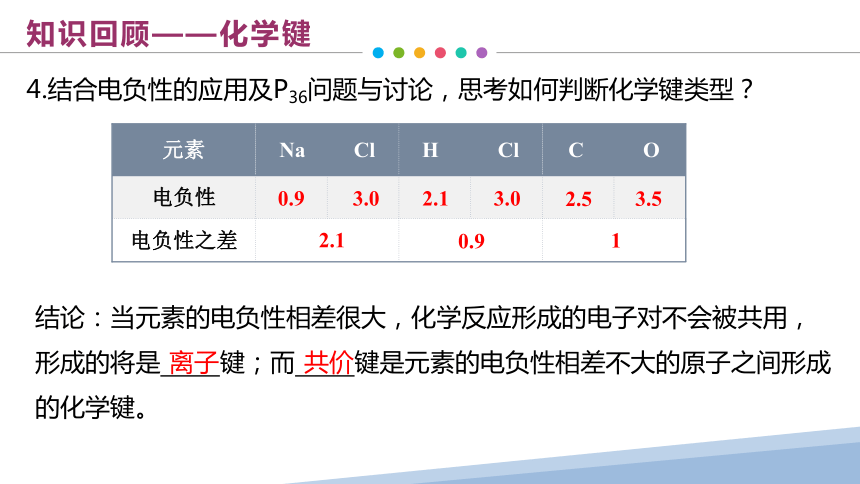
4.结合电负性的应用及P36问题与讨论,思考如何判断化学键类型?
元素 Na Cl H Cl C O 电负性
电负性之差 结论:当元素的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是 键;而 键是元素的电负性相差不大的原子之间形成的化学键。
离子
共价
0.9
3.0
3.5
2.5
3.0
2.1
2.1
0.9
1
1.概念:原子间通过共用电子对所形成的相互作用。
2.成键元素:电负性数值相差不大(小于1.7)的原子之间成键。
3.成键微粒:一般是非金属原子之间,或金属与非金属原子之间(如AlCl3)
4.分类:根据共用电子对是否偏移分为极性共价键和非极性共价键。
一、 共价键
原子间通过共用电子对形成稳定结构,使体系能量降低。
5. 成键本质:
原子轨道重叠
从电子云角度理解
①写出H2、Cl2、HCl的电子式,通过电子式分析为何它们是稳定的物质?
H达到2电子,Cl达到8电子稳定结构
②你认为是否存在H3、H2Cl、Cl3这样的物质?说出你判断的理由。
不存在,因为H和Cl都只差1个电子达到稳定结构,只需共用一次电子。
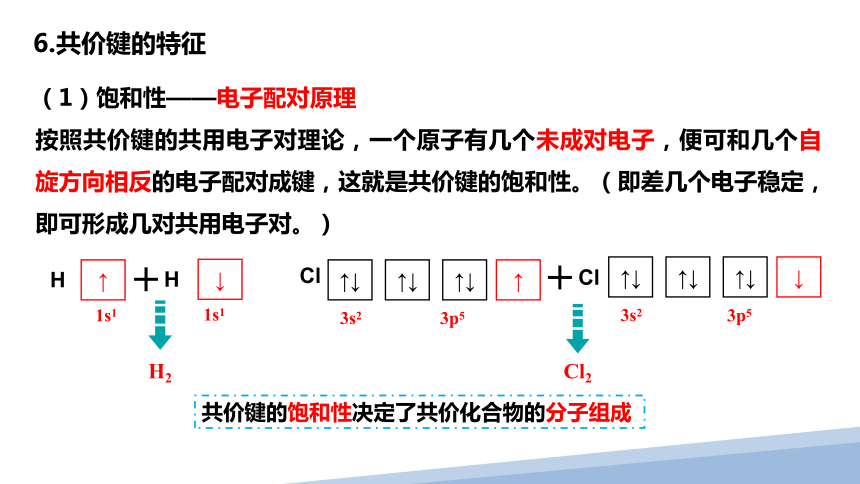
H
↑
1s1
Cl
↑↓
↑↓
↑
↑↓
3s2
3p5
H 原子、Cl原子都只有一个未成对电子
共价键具有饱和性
从微观和符号的视角分析问题
【思考与讨论】
(1)饱和性——电子配对原理
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋方向相反的电子配对成键,这就是共价键的饱和性。(即差几个电子稳定,即可形成几对共用电子对。)
H
↑
1s1
Cl
3p5
↑↓
↑↓
↑
↑↓
3s2
H
↓
1s1
H2
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
Cl2
共价键的饱和性决定了共价化合物的分子组成
6.共价键的特征
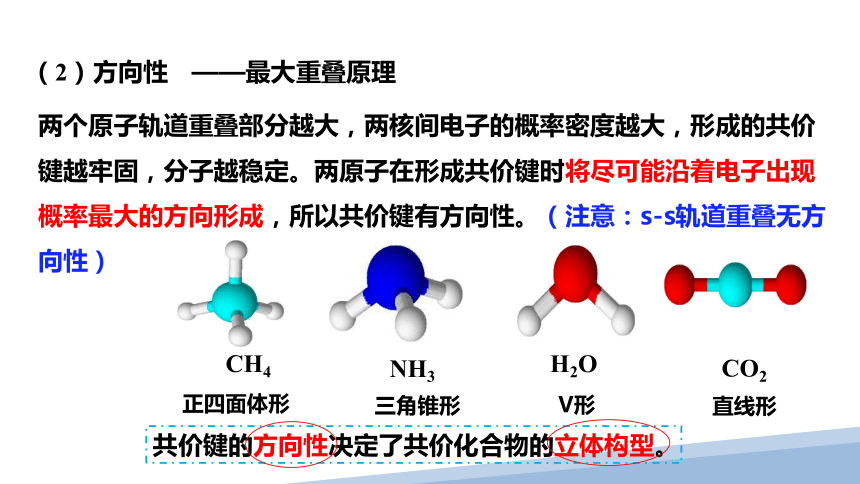
(2)方向性
共价键的方向性决定了共价化合物的立体构型。
CH4
NH3
H2O
CO2
正四面体形
三角锥形
V形
直线形
两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。两原子在形成共价键时将尽可能沿着电子出现概率最大的方向形成,所以共价键有方向性。(注意:s-s轨道重叠无方向性)
——最大重叠原理
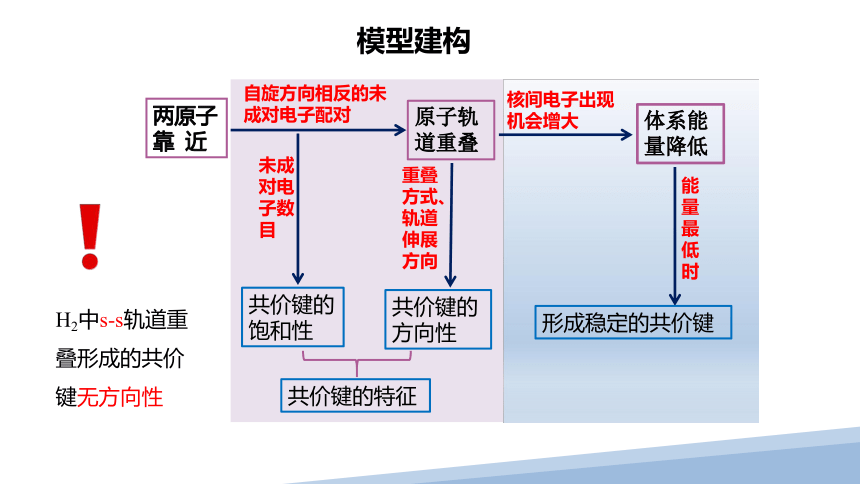
模型建构
两原子
靠 近
原子轨道重叠
核间电子出现机会增大
体系能量降低
未成对电子数目
共价键的饱和性
自旋方向相反的未成对电子配对
共价键的方向性
重叠方式、轨道伸展方向
能量最低时
形成稳定的共价键
共价键的特征
H2中s-s轨道重叠形成的共价键无方向性
课堂练习1:下列说法正确的是( )
A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的
B.H2O与H2S的空间结构一样是由共价键的饱和性决定的
C.并非所有的共价键都有方向性
D.两原子轨道发生重叠后,电子在两核间出现的概率减小
C
两个原子共用电子,意味着两个原子的距离足够近使其原子轨道在核间出现了重叠,电子在重叠区域出现的概率增大。由于s、p等原子轨道的形状是不一样的,它们如何才能发生有效的重叠呢?
H
H
1s1
1s1
H
H
H
H
原子轨道相互重叠
形成氢分子中的共价键
(H-H)
【思考与讨论】
s
s
s-s σ键
氢分子形成共价键示意图
未
成
对
电
子
的
原
子
轨
道
相
互
靠
拢
头碰头
无方向性
H2分子中共价键的形成
1s1
3p5
H
Cl
原子轨道相互重叠
形成氯化氢分子中的共价键
(Cl-H)
s
p
HCl分子中共价键的形成
s-p σ键
氯化氢分子形成共价键示意图
未
成
对
电
子
的
原
子
轨
道
相
互
靠
拢
头碰头
有方向性
3p5
3p5
Cl
Cl
原子轨道相互重叠
形成氯分子中的共价键
(Cl-Cl)
p
p
Cl2分子中共价键的形成
p-p σ键
氯气分子形成共价键示意图
未
成
对
电
子
的
原
子
轨
道
相
互
靠
拢
头碰头
有方向性
6. 类型(从原子轨道重叠角度):
(1)σ键:
由成键原子的s轨道或p轨道“头碰头”重叠形成。
①概念:
②类型:
a. 沿键轴(两核的连线)方向 “头碰头”重叠成键
b.σ键为轴对称,可以沿键轴旋转
③特征:
s-s σ键
s-p σ键
p-p σ键
H-H:两个s轨道重叠形成
H-Cl:H的s轨道和Cl的p轨道重叠形成
Cl-Cl:两个p轨道重叠形成
c. 形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性。
d.存在于一切共价键中
p
p
原子轨道相互重叠
p
p
未
成
对
电
子
的
原
子
轨
道
相
互
靠
拢
p-p π键的形成
p-p π键
肩并肩
有方向性
p轨道和p轨道除了能像Cl2中那样重叠外,还有别的重叠方式吗?
【思考】
(2)π 键 p-p π 键
① 概念:由成键原子的p轨道“肩并肩”重叠形成。
②特征:
a. “肩并肩”重叠成键;呈镜像对称。
b. 电子云重叠程度不及σ键大,π键不如σ键稳定,比较容易断裂;
特例:N2分子中的π键比σ键稳定。
c. π键必须与σ键共存;
d. π键不能自由旋转。
注意:s-s电子、s-p电子只形成σ键;p-p电子既形成σ键,又形成π键;且 p-p电子先形成σ键,后形成π键。即π键不能单独存在!
单键 双键 三键
σ键
1个σ键、1个π键
1个σ键、2个π键
(3)判断σ键、π键的一般规律:
【注意】σ键可以单独存在;π键不能单独存在
N
用电子式表示N2的形成过程,画出氮原子的轨道表示式,
并用原子轨道重叠来解释其共价键的形成过程。
↑
↑
↑
↑↓
2s
2px
2py
2pz
x
y
z
N的2p轨道示意图
【思考】
x
y
z
x
y
z
N2中共价三键的形成过程
“头碰头”
σ键
x
y
z
x
y
z
N2中共价三键的形成过程
σ键
“头碰头”
“肩并肩”
π键
“肩并肩”
π键
N≡N
z
z
y
y
x
π
π
σ
探究活动
1、观察乙烷、乙烯和乙炔的分子结构,它们的分子中的共价键分别由几个σ键和几个π键构成?
乙烷
乙烯
乙炔
①乙烷中含有1个C-C键和6个C-H键,所以乙烷中含有7个σ键;
②乙烯中含有1个C=C键和4个C-H键,即含有5个σ键和1个π键;
③乙炔中含有1个三键和2个C-H键,即含有3个σ键和2个π键;
乙烯分子:每个碳原子s轨道、2个p轨道(sp2杂化轨道)分别与2个氢原子、另一个碳原子形成3个σ键,共5个σ键;每个碳原子p轨道均有一个未成对电子,两个p轨道以“肩并肩"相互重叠,形成π键。
乙炔分子:每个碳原子s轨道、1个p轨道分别(sp杂化轨道)与1个氢原子、另一个碳原子形成2个σ键,共3个σ键;碳原子中另外两个p轨道与碳原子中的两个p轨道以“肩并肩”相互重叠,形成两个π键。
探究活动
2、解释乙烯分子中π键是如何形成的,预测乙炔分子中π键是如何形成的?
探究活动
3、模仿图2-3所示,绘制乙炔分子中的π键。(提示:两个碳原子各自用2个p轨道形成2个π键。)
共价键
本质:原子之间通过共用电子对(或原子轨道重叠)形成共价键
特征:具有方向性和饱和性
成键方式
σ键
原子轨道“头碰头”重叠,电子云呈轴对称
π键
原子轨道“肩并肩”重叠,电子云呈镜面对称
共价三键——1个σ键、2个π键
共价单键——1个σ键
共价双键——1个σ键、1个π键
一般规律
特征
特征
课堂小结
课堂练习2:共价键具有饱和性和方向性,下列关于共价键这两个特征的叙述中,不正确的是( )
A.共价键的饱和性是由成键原子的未成对电子数决定的
B.共价键的方向性是由成键原子的轨道的方向性决定的
C.共价键的饱和性决定了分子内部的原子的数量关系
D.共价键的饱和性与原子轨道的重叠程度有关
D
课堂练习3:下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是( )
A.CH4与NH3 B.C2H6与C2H4
C.H2与Cl2 D.Cl2与N2
课堂练习4:下列说法不正确的是( )
A.σ键是轴对称的,π键是镜像对称的
B.在气体单质中,一定有σ键,可能有π键
C.两个原子间形成共价键时,最多有一个σ键
D.BF3分子中原子的最外层电子数不全是8
A
B
自我检测
课堂练习5:丁烯二酸(HOOCCH==CHCOOH)分子结构中含有σ键、π键的个数分别是( )
A.4个σ键,1个π键 B.11个σ键,3个π键
C.4个σ键,3个π键 D.9个σ键,5个π键
B
课堂练习6:在下列分子中①HF ②Br2 ③H2O ④N2 ⑤CO2 ⑥H2 ⑦H2O2 ⑧HCN
(1)分子中只有σ 键的是:
(2)分子中含有π键的是:
(3)分子中所有原子均满足最外层8电子结构的是:
(4)分子中含有s-s σ键的是:
(5)分子中含有s-p σ 键的是:
(6)分子中含有p-p σ键的是:
② ④ ⑤ ⑦ ⑧
① ② ③ ⑥ ⑦
④ ⑤ ⑧
② ④ ⑤
⑥
① ③ ⑦ ⑧
(H—C≡N)
第一节 共价键
第二章 分子结构与性质
第一课时
共价键
学习目标
1.从原子轨道重叠的视角认识共价键的本质,知道共价键具有饱和性和方向性,
2.能用模型、图像和符号等正确表征H2、Cl2、HCl等简单分子中原子轨道的重叠方式。
3.知道σ键和π键的区别和特征,能说明C2H6、C2H4和 C2H2等分子的成键类型。
知识回顾——化学键
1.什么是化学键?
化学键:相邻原子之间强烈的相互作用
2.化学键的类型有哪些?
①离子键:阴、阳离子之间通过静电作用形成的化学键
②共价键:原子间通过共用电子对形成的化学键
3.以NaCl和HCl为例,用电子式表示形成过程
由离子键构成的化合物叫离子化合物
只含共价键的化合物叫共价化合物
离子键
共价键
知识回顾——化学键
4.结合电负性的应用及P36问题与讨论,思考如何判断化学键类型?
元素 Na Cl H Cl C O 电负性
电负性之差 结论:当元素的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是 键;而 键是元素的电负性相差不大的原子之间形成的化学键。
离子
共价
0.9
3.0
3.5
2.5
3.0
2.1
2.1
0.9
1
1.概念:原子间通过共用电子对所形成的相互作用。
2.成键元素:电负性数值相差不大(小于1.7)的原子之间成键。
3.成键微粒:一般是非金属原子之间,或金属与非金属原子之间(如AlCl3)
4.分类:根据共用电子对是否偏移分为极性共价键和非极性共价键。
一、 共价键
原子间通过共用电子对形成稳定结构,使体系能量降低。
5. 成键本质:
原子轨道重叠
从电子云角度理解
①写出H2、Cl2、HCl的电子式,通过电子式分析为何它们是稳定的物质?
H达到2电子,Cl达到8电子稳定结构
②你认为是否存在H3、H2Cl、Cl3这样的物质?说出你判断的理由。
不存在,因为H和Cl都只差1个电子达到稳定结构,只需共用一次电子。
H
↑
1s1
Cl
↑↓
↑↓
↑
↑↓
3s2
3p5
H 原子、Cl原子都只有一个未成对电子
共价键具有饱和性
从微观和符号的视角分析问题
【思考与讨论】
(1)饱和性——电子配对原理
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋方向相反的电子配对成键,这就是共价键的饱和性。(即差几个电子稳定,即可形成几对共用电子对。)
H
↑
1s1
Cl
3p5
↑↓
↑↓
↑
↑↓
3s2
H
↓
1s1
H2
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
Cl2
共价键的饱和性决定了共价化合物的分子组成
6.共价键的特征
(2)方向性
共价键的方向性决定了共价化合物的立体构型。
CH4
NH3
H2O
CO2
正四面体形
三角锥形
V形
直线形
两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。两原子在形成共价键时将尽可能沿着电子出现概率最大的方向形成,所以共价键有方向性。(注意:s-s轨道重叠无方向性)
——最大重叠原理
模型建构
两原子
靠 近
原子轨道重叠
核间电子出现机会增大
体系能量降低
未成对电子数目
共价键的饱和性
自旋方向相反的未成对电子配对
共价键的方向性
重叠方式、轨道伸展方向
能量最低时
形成稳定的共价键
共价键的特征
H2中s-s轨道重叠形成的共价键无方向性
课堂练习1:下列说法正确的是( )
A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的
B.H2O与H2S的空间结构一样是由共价键的饱和性决定的
C.并非所有的共价键都有方向性
D.两原子轨道发生重叠后,电子在两核间出现的概率减小
C
两个原子共用电子,意味着两个原子的距离足够近使其原子轨道在核间出现了重叠,电子在重叠区域出现的概率增大。由于s、p等原子轨道的形状是不一样的,它们如何才能发生有效的重叠呢?
H
H
1s1
1s1
H
H
H
H
原子轨道相互重叠
形成氢分子中的共价键
(H-H)
【思考与讨论】
s
s
s-s σ键
氢分子形成共价键示意图
未
成
对
电
子
的
原
子
轨
道
相
互
靠
拢
头碰头
无方向性
H2分子中共价键的形成
1s1
3p5
H
Cl
原子轨道相互重叠
形成氯化氢分子中的共价键
(Cl-H)
s
p
HCl分子中共价键的形成
s-p σ键
氯化氢分子形成共价键示意图
未
成
对
电
子
的
原
子
轨
道
相
互
靠
拢
头碰头
有方向性
3p5
3p5
Cl
Cl
原子轨道相互重叠
形成氯分子中的共价键
(Cl-Cl)
p
p
Cl2分子中共价键的形成
p-p σ键
氯气分子形成共价键示意图
未
成
对
电
子
的
原
子
轨
道
相
互
靠
拢
头碰头
有方向性
6. 类型(从原子轨道重叠角度):
(1)σ键:
由成键原子的s轨道或p轨道“头碰头”重叠形成。
①概念:
②类型:
a. 沿键轴(两核的连线)方向 “头碰头”重叠成键
b.σ键为轴对称,可以沿键轴旋转
③特征:
s-s σ键
s-p σ键
p-p σ键
H-H:两个s轨道重叠形成
H-Cl:H的s轨道和Cl的p轨道重叠形成
Cl-Cl:两个p轨道重叠形成
c. 形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性。
d.存在于一切共价键中
p
p
原子轨道相互重叠
p
p
未
成
对
电
子
的
原
子
轨
道
相
互
靠
拢
p-p π键的形成
p-p π键
肩并肩
有方向性
p轨道和p轨道除了能像Cl2中那样重叠外,还有别的重叠方式吗?
【思考】
(2)π 键 p-p π 键
① 概念:由成键原子的p轨道“肩并肩”重叠形成。
②特征:
a. “肩并肩”重叠成键;呈镜像对称。
b. 电子云重叠程度不及σ键大,π键不如σ键稳定,比较容易断裂;
特例:N2分子中的π键比σ键稳定。
c. π键必须与σ键共存;
d. π键不能自由旋转。
注意:s-s电子、s-p电子只形成σ键;p-p电子既形成σ键,又形成π键;且 p-p电子先形成σ键,后形成π键。即π键不能单独存在!
单键 双键 三键
σ键
1个σ键、1个π键
1个σ键、2个π键
(3)判断σ键、π键的一般规律:
【注意】σ键可以单独存在;π键不能单独存在
N
用电子式表示N2的形成过程,画出氮原子的轨道表示式,
并用原子轨道重叠来解释其共价键的形成过程。
↑
↑
↑
↑↓
2s
2px
2py
2pz
x
y
z
N的2p轨道示意图
【思考】
x
y
z
x
y
z
N2中共价三键的形成过程
“头碰头”
σ键
x
y
z
x
y
z
N2中共价三键的形成过程
σ键
“头碰头”
“肩并肩”
π键
“肩并肩”
π键
N≡N
z
z
y
y
x
π
π
σ
探究活动
1、观察乙烷、乙烯和乙炔的分子结构,它们的分子中的共价键分别由几个σ键和几个π键构成?
乙烷
乙烯
乙炔
①乙烷中含有1个C-C键和6个C-H键,所以乙烷中含有7个σ键;
②乙烯中含有1个C=C键和4个C-H键,即含有5个σ键和1个π键;
③乙炔中含有1个三键和2个C-H键,即含有3个σ键和2个π键;
乙烯分子:每个碳原子s轨道、2个p轨道(sp2杂化轨道)分别与2个氢原子、另一个碳原子形成3个σ键,共5个σ键;每个碳原子p轨道均有一个未成对电子,两个p轨道以“肩并肩"相互重叠,形成π键。
乙炔分子:每个碳原子s轨道、1个p轨道分别(sp杂化轨道)与1个氢原子、另一个碳原子形成2个σ键,共3个σ键;碳原子中另外两个p轨道与碳原子中的两个p轨道以“肩并肩”相互重叠,形成两个π键。
探究活动
2、解释乙烯分子中π键是如何形成的,预测乙炔分子中π键是如何形成的?
探究活动
3、模仿图2-3所示,绘制乙炔分子中的π键。(提示:两个碳原子各自用2个p轨道形成2个π键。)
共价键
本质:原子之间通过共用电子对(或原子轨道重叠)形成共价键
特征:具有方向性和饱和性
成键方式
σ键
原子轨道“头碰头”重叠,电子云呈轴对称
π键
原子轨道“肩并肩”重叠,电子云呈镜面对称
共价三键——1个σ键、2个π键
共价单键——1个σ键
共价双键——1个σ键、1个π键
一般规律
特征
特征
课堂小结
课堂练习2:共价键具有饱和性和方向性,下列关于共价键这两个特征的叙述中,不正确的是( )
A.共价键的饱和性是由成键原子的未成对电子数决定的
B.共价键的方向性是由成键原子的轨道的方向性决定的
C.共价键的饱和性决定了分子内部的原子的数量关系
D.共价键的饱和性与原子轨道的重叠程度有关
D
课堂练习3:下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是( )
A.CH4与NH3 B.C2H6与C2H4
C.H2与Cl2 D.Cl2与N2
课堂练习4:下列说法不正确的是( )
A.σ键是轴对称的,π键是镜像对称的
B.在气体单质中,一定有σ键,可能有π键
C.两个原子间形成共价键时,最多有一个σ键
D.BF3分子中原子的最外层电子数不全是8
A
B
自我检测
课堂练习5:丁烯二酸(HOOCCH==CHCOOH)分子结构中含有σ键、π键的个数分别是( )
A.4个σ键,1个π键 B.11个σ键,3个π键
C.4个σ键,3个π键 D.9个σ键,5个π键
B
课堂练习6:在下列分子中①HF ②Br2 ③H2O ④N2 ⑤CO2 ⑥H2 ⑦H2O2 ⑧HCN
(1)分子中只有σ 键的是:
(2)分子中含有π键的是:
(3)分子中所有原子均满足最外层8电子结构的是:
(4)分子中含有s-s σ键的是:
(5)分子中含有s-p σ 键的是:
(6)分子中含有p-p σ键的是:
② ④ ⑤ ⑦ ⑧
① ② ③ ⑥ ⑦
④ ⑤ ⑧
② ④ ⑤
⑥
① ③ ⑦ ⑧
(H—C≡N)
